微胶囊造粒仪制备青春双歧杆菌微胶囊
王欢,肖军霞,黄国清,杨剑,*
(1.深圳职业技术学院应用化学与生物技术学院,广东深圳518055;2.青岛农业大学食品科学与工程学院,山东青岛266109)
微胶囊造粒仪制备青春双歧杆菌微胶囊
王欢1,肖军霞2,黄国清2,杨剑2,*
(1.深圳职业技术学院应用化学与生物技术学院,广东深圳518055;2.青岛农业大学食品科学与工程学院,山东青岛266109)
采用微胶囊造粒仪Encapsulator B-395 Pro制备青春双歧杆菌(Bifidobacterium adolescentis)微胶囊,以多孔淀粉、海藻酸钠、壳聚糖为壁材,以青春双歧杆菌的包埋率为检测指标,研究多孔淀粉用量、包埋温度、pH值和振荡时间,以及海藻酸钠浓度、壳聚糖浓度和CaCl2浓度对微胶囊包埋率的影响。结果表明,最佳工艺为:多孔淀粉用量按0.08 g/mL菌悬液和菌悬液混合,调节pH值为6.0,在30℃恒温振荡40min后和1.6%的海藻酸钠混合,在微胶囊造粒仪中将混合液滴加到1.0%的CaCl2溶液中,固化成膜后,在0.75%的壳聚糖溶液中覆膜40min,洗涤,制得湿微胶囊,其包埋率可达到94.62%,活菌数为3.1×108cfu/mL。制得的青春双歧杆菌微胶囊均为白色,粒径分布均匀,粒径为497.8 μm的湿胶囊占56.26%。
青春双歧杆菌;微胶囊;制备
微胶囊造粒仪(Encapsulator B-395 Pro)的功能原理是高频振动技术,振动喷嘴通过叠加振动将层流型流体喷射流分成尺寸相等的液滴,从而制造出极其均匀的圆形微胶囊。其操作简单,可根据需求选择不同尺寸的喷嘴,制备出0.15 mm~2 mm的微胶囊颗粒,尺寸统一、分布较窄(可实现<5%标准偏差)[1]。
微胶囊造粒仪可在温和无菌条件下,利用反应器进行细胞的生物微胶囊化。其与包埋混合物接触的部件均可经高温高压消毒,反应容器可满足无菌样品制备的要求[2]。相比喷雾干燥法和挤压法等传统益生菌微胶囊制备方法,微胶囊造粒仪可在温和条件下将药物、香精香料、酶、颜料、微生物或动植物细胞包埋在聚合物基质中[3-6],形成颗粒均匀、粒径适中的微胶囊,其稳定高效的包埋效果得到了广泛认可。
青春双歧杆菌(Bifidobacterium adolescentis)是双歧杆菌当中很重要的一种,具有多种生理活性,但外界环境中许多不利的因素会导致青春双歧杆菌死亡,降低了其生理活性。微胶囊作为双歧杆菌的包埋技术手段之一,它常被用来提高双歧杆菌在不良环境中的存活率并实现双歧杆菌肠道释放的目的。目前关于青春双歧杆菌微胶囊的研究很少,对青春双歧杆菌的研究主要集中于其耐氧性驯化及生理代谢机理研究。双歧杆菌微胶囊的研究主要集中于两歧双歧杆菌微胶囊。邹强等[7]以海藻酸钠为壁材,采用乳化内源凝胶法制备两歧双歧杆菌微胶囊,包埋效果不明显,在模拟胃肠液中两歧双歧杆菌的活性下降了3个对数值。杨基础等[8]采用挤压法将海藻酸钠与双歧杆菌直接混合后滴入CaCl2中固化,制得双歧杆菌微胶囊。该微胶囊不能很好地阻隔胃液,产品不具有耐胃酸性。
本文以多孔淀粉、海藻酸钠、壳聚糖为壁材,以包埋效率为检测指标,研究了多孔淀粉添加量/mL菌悬液、作用温度、pH值、作用时间以及海藻酸钠浓度、壳聚糖浓度、CaCl2浓度、菌悬液/海藻酸钠质量比对包埋率的影响,筛选出青春双歧杆菌微胶囊最佳的制备条件,以期制备出外观形状和菌株活性良好的青春双歧杆菌微胶囊,扩大其在食品领域内的应用。
1 材料和方法
1.1材料与试剂
海藻酸钠、壳聚糖、TPY培养基、MRS培养基、无水氯化钙、多孔淀粉、氢氧化钠、柠檬酸钠、冰醋酸、盐酸、L-半胱氨酸:均为分析纯;青春双歧杆菌(GIMI. 278):购自广东省微生物研究所微生物菌种保藏中心。
1.2仪器
B-395 Pro微胶囊造粒仪:瑞士步琦有限公司;95-1磁力搅拌器:Barnsteed International;ES-315高压灭菌器:TOMY Corporation;SPX-150细菌恒温培养箱、SHZ-C恒温振荡培养箱:Sheldon Manufacturing,Inc.;PB-10pH计:Sartorius;5810R高速离心机:Eppendorf;XW-80A漩涡混合器:上海医大仪器厂;DHE-9053A电热恒温鼓风干燥箱:上海精宏实验设备有限公司;BS 224S电子天平:Sartorius;BCD-518WSA海尔低温冰柜:海尔集团;激光MICROTRACS3500粒度分析仪:美国Microtrac公司。
1.3方法
1.3.1菌悬液的制备
挑取复苏培养好的双歧杆菌菌落接种于20 mL TPY液体培养基中,并在37℃下厌氧培养24 h,然后按1.0%的接种量转接到100 mL的TPY液体培养基中在厌氧条件下进行增殖培养,12 h后,将菌悬液在4℃、8 000 r/min的条件下离心10 min,去上清,菌泥用无菌的NaCl溶液(8.5 g/L)洗涤两次后,重悬于10 mL的无菌水中得到浓缩菌液,最后利用平板计数法对该浓缩菌液进行精确计数[9-11]。
1.3.2微胶囊的制备
称取一定量的多孔淀粉于微胶囊造粒仪配备的耐压玻璃瓶中,加入50 mL菌悬液(2×109cfu/mL),用0.1 mol/L NaOH、HCl溶液调pH值,在不同水浴作用温度下振荡吸附一定时间后和海藻酸钠溶液混合,搅拌均匀后,用微胶囊造粒仪(300 μm喷嘴)经高频振荡滴加到一定浓度的无菌CaCl2溶液中,固化30 min成膜。用3.5%CaCl2溶液浸泡10 min进行硬化[12-13]。过滤得到样品,用去离子水漂去样品表面的CaCl2残液,再用0.85%的无菌生理盐水洗涤微胶囊表面菌体。将收集到的微胶囊在搅拌速度为600 r/min的情况下加入到壳聚糖溶液中覆膜40 min[14]后洗涤2次,4℃保存。最后,将微胶囊经冷冻干燥后制得微胶囊冻干品。
1.3.3青春双歧杆菌微胶囊包埋产率的测定
将制备得到的湿微胶囊加入到100 mL预热的磷酸盐缓冲液中(37℃,0.1 mol/L NaH2PO4,pH 7.4),通过高速均质机破碎微胶囊(10 000 r/min,20 s),缓慢摇晃此破碎液30 min,使包埋的青春双歧杆菌完全释放出来,取一定量的液体,经稀释后,采用稀释平板计数法,将液体涂布于TPY琼脂培养基上,然后在37℃、厌氧条件下培养48 h后,计算菌落总数[15]。
包埋率(Encapsulation Yield,EY)计算公式如下所示:EY/%=N/N0×100
式中:N是指包埋于微胶囊中的活细胞总数;N0是菌悬液中活细胞总数。
2 结果与分析
海藻酸钠分子中含有的自由羧基和羟基,可以和二价阳离子(Ca2+、Zn2+)结合形成凝胶,4个古洛糖醛酸残基和Ca2+连接形成一种三维结构―“鸡蛋箱”结构。海藻酸钠和二价阳离子形成的这一结构是一种pH敏感型凝胶,在低pH条件下较为稳定,这种特性有利于减少胃酸对菌株活性的损伤,从而增强包埋的双歧杆菌对胃酸的耐受能力。
壳聚糖是一种由葡萄糖胺组成的线性高分子化合物。在阴离子和聚阴离子存在的条件下,葡萄糖胺通过交叉连接的方式聚合。用海藻酸钠和壳聚糖来包埋双歧杆菌可以使双歧杆菌在一定程度上增强抗逆环境的能力。
2.1多孔淀粉用量对微胶囊包埋率的影响
多孔淀粉是指具有生淀粉酶活力的酶在低于淀粉糊化温度下作用于生淀粉后而形成一种蜂窝状多孔性淀粉载体,是一种具有良好安全性的有机吸附剂[16]。在温度25℃、pH值5.5、振荡时间30 min、海藻酸钠浓度1.2%、壳聚糖浓度0.5%、CaCl2浓度1.0%条件下,多孔淀粉用量分别为0.04、0.06、0.08、0.1、0.12 g/mL菌悬液时的微胶囊包埋率如图1所示。

图1 多孔淀粉用量对微胶囊包埋率的影响Fig.1 Effect of porous starch dosage on EY of Bifidobacterium adolescentis microcapsules
由图1可知,包埋率随着多孔淀粉用量的增加呈先升高后降低而逐渐趋于稳定的变化趋势。多孔淀粉用量在0.08 g/mL菌悬液时,包埋率最大达到66.57%,此时湿胶囊中活菌数为2.35×108cfu/mL,与多孔淀粉用量为0.04、0.06、0.1 g/mL菌悬液时呈显著性差异(P<0.05)。这主要是因为多孔淀粉颗粒的孔洞对青春双歧杆菌有一定的容纳数量(饱和度),当多孔淀粉添加量足以将菌悬液内的青春双歧杆菌吸附后,再添加多孔淀粉也不会增加微胶囊的包埋率。此外,增加多孔淀粉用量会造成微胶囊的团聚,使制备的微胶囊样品难以分离。马嫄等[12]的研究结果表明,包埋嗜酸乳杆菌所需要的多孔淀粉用量为0.10 g/mL菌悬液,该结果与本试验基本吻合。
2.2多孔淀粉作用温度对微胶囊包埋率的影响
在淀粉用量0.08 g/mL菌悬液、pH值5.5、振荡时间30 min、海藻酸钠浓度1.2%、壳聚糖浓度0.5%、CaCl2浓度1.0%条件下,多孔淀粉作用温度对微胶囊包埋率的影响见图2。
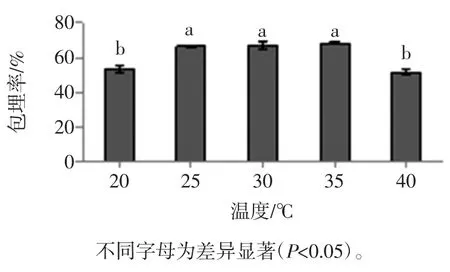
图2 多孔淀粉作用温度对微胶囊包埋率的影响Fig.2 Effect of porous starch temperature on EY of microcapsules
由图2可知,从20℃开始,随着温度的增加,微胶囊的包埋率先增加后减小。在25℃到35℃之间趋于稳定,包埋率分别是67.28%、68.35%、67.80%,此时湿胶囊中的活菌数分别是2.54×108、2.58×108、2.56× 108cfu/mL,相互之间差异不显著(P>0.05)。当温度升高到40℃时,包埋率会降低,这可能是青春双歧杆菌部分失活,从而能导致测定的包埋率下降[17]。
2.3多孔淀粉作用pH值对微胶囊包埋率的影响
在淀粉用量0.08 g/mL菌悬液、温度35℃、振荡时间30 min、海藻酸钠浓度1.2%、壳聚糖浓度0.5%、CaCl2浓度1.0%条件下,pH对微胶囊包埋率的影响见图3。
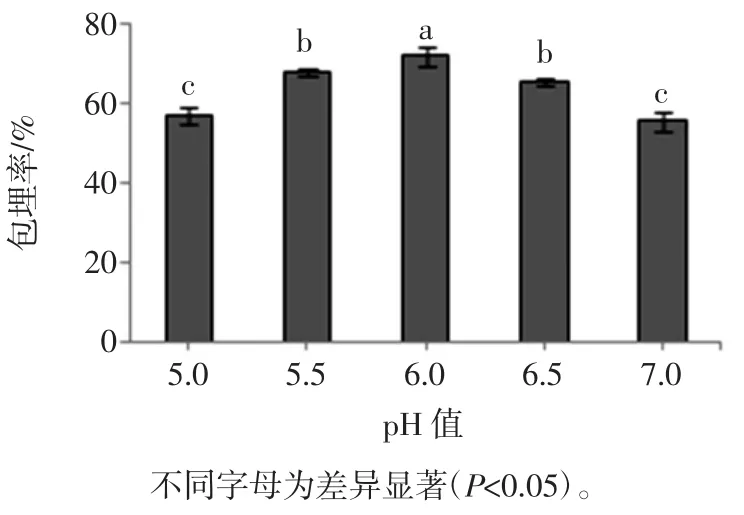
图3 多孔淀粉作用pH值对微胶囊包埋率的影响Fig.3 Effect of porous starch pH on EY of Bifidobacterium adolescentis microcapsules
由图3可知,微胶囊的包埋率随着pH值的增加呈先增加后减小的变化趋势。在pH6.0时包埋率最大达到71.79%,活菌数达到2.55×108cfu/mL,并与其它pH时包埋率均具有显著性差异(P<0.05)。这可能是pH值过低或过高都会使青春双歧杆菌失活,从而导致测定的青春双歧杆菌微胶囊的包埋率下降[18]。
2.4多孔淀粉振荡时间对微胶囊包埋率的影响
在淀粉用量0.08 g/mL菌悬液、温度35℃、pH值6.0、海藻酸钠浓度1.2%、壳聚糖浓度0.5%、CaCl2浓度1.0%条件下,多孔淀粉振荡吸附时间对微胶囊包埋率的影响见图4。
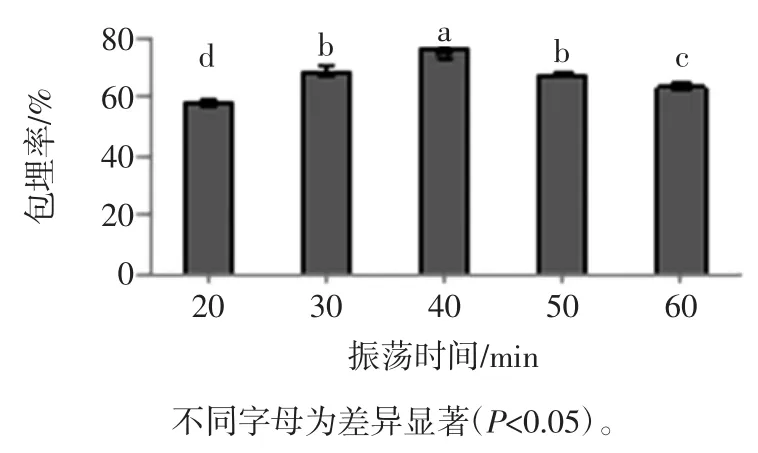
图4 多孔淀粉振荡时间对微胶囊包埋率的影响Fig.4 Effect of porous starch shaking time on EY of Bifidobacterium adolescentis microcapsules
由图4所示,微胶囊包埋率随着振荡时间的延长呈先增加后减小变化趋势。在振荡时间为40 min时,包埋率达到最大75.85%,此时湿胶囊中的活菌数为2.59×108cfu/mL,与其它振荡时间的包埋率具有显著性差异(P<0.05)。主要原因可能是多孔淀粉包埋青春双歧杆菌主要是靠吸附力,适当延长振荡时间增加了菌种与多孔淀粉充分接触的几率[12],从而提高了青春双歧杆菌的包埋率;40 min之后多孔淀粉开始崩解,且青春双歧杆菌逐渐失活,从而导致微胶囊的包埋效率开始减小。
2.5正交试验
多孔淀粉正交试验设计及结果见表1。

表1 多孔淀粉正交试验设计及结果Table 1 Orthogonal array design matrix and results of porous starch
由表1可知,多孔淀粉各因素对微胶囊包埋率影响的主次顺序依次为多孔淀粉用量A>pH值C>振荡时间D>包埋温度B,根据正交试验结果可知,多孔淀粉的最佳包埋条件为:A1B2C2D2,即多孔淀粉用量0.08 g/mL菌悬液,包埋温度为30℃,pH值为6.0,振荡时间40 min,按此工艺测得的微胶囊包埋率为75.31%,菌悬液活菌数1.29×108cfu/mL,经包埋之后的微胶囊内的活菌数为2.45×108cfu/mL。
2.6海藻酸钠浓度对微胶囊包埋率的影响
海藻酸钠浓度对微胶囊包埋率的影响见图5。
由图5可知,随海藻酸钠浓度的增加,微胶囊的包埋率先增加后减小。在海藻酸钠浓度为1.6%时,微胶囊的包埋率最大达到85.96%,并与其它浓度时的包埋率均呈显著性差异(P<0.05)。此时当菌悬液活菌浓度为1.27×109cfu/mL时,湿微胶囊包埋的活菌数为2.84×108cfu/mL。主要的原因是不同浓度的海藻酸钠与Ca2+和壳聚糖的络合程度不一样,形成的微胶囊囊壁紧密程度不同,导致微胶囊的透氧程度也不同,从而使青春双歧杆菌微胶囊的包埋率不同[19]。
2.7壳聚糖浓度对微胶囊包埋率的影响
壳聚糖浓度对微胶囊包埋率的影响见图6。
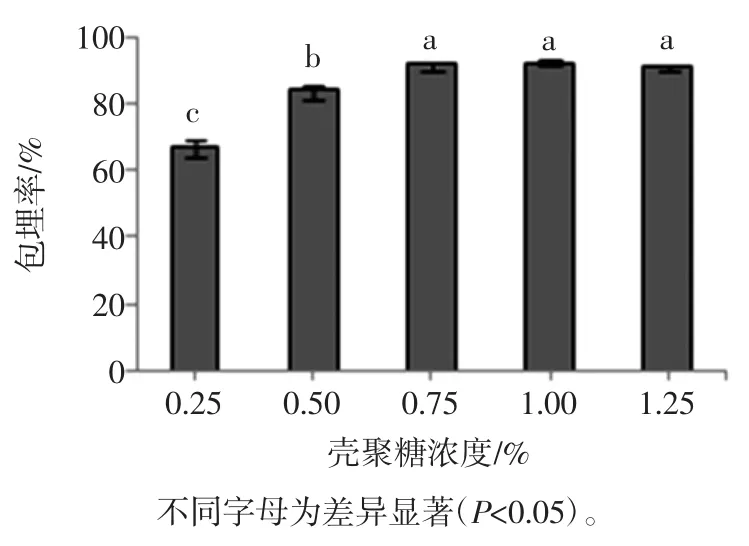
图6 壳聚糖浓度对微胶囊包埋率的影响Fig.6 Effect of chitosan concentration on EY of Bifidobacterium adolescentis microcapsules
由图6可知,在0.25%~1.25%之间,随着壳聚糖浓度的增加,微胶囊的包埋率先增加,在0.75%时达到最大91.48%,此时湿微胶囊中包埋的活菌数为2.87×108cfu/mL;继续增加壳聚糖浓度,包埋率趋于稳定稍有减小,壳聚糖浓度1.25%时,包埋率为91.15%,活菌数2.81×108cfu/mL。主要原因是:壳聚糖溶液浓度会影响到壳聚糖分子扩散的快慢,进而影响成膜效果,对微胶囊的性能产生影响。壳聚糖浓度增加,壳聚糖分子的扩散推动力增大,NH3+的位点数增加,壳聚糖与海藻酸钠的交联程度也越强,微胶囊膜通透性降低,减少了外环境对微胶囊内菌体的伤害[20]。壳聚糖溶液浓度增加其黏度也会变大,当溶液浓度达到一定程度时其流变性能也会发生改变,壳聚糖分子扩散缓慢,壳聚糖与海藻酸钠的交联作用也相应变弱,微胶囊透氧性增加,从而导致包埋效率稍有减小。壳聚糖浓度0.75%、1.0%、1.25%之间的微胶囊包埋率差异不显著(P>0.05),考虑经济节约因素,选择壳聚糖浓度为0.75%。
2.8CaCl2浓度对微胶囊包埋率的影响
CaCl2浓度对微胶囊包埋率的影响见图7。
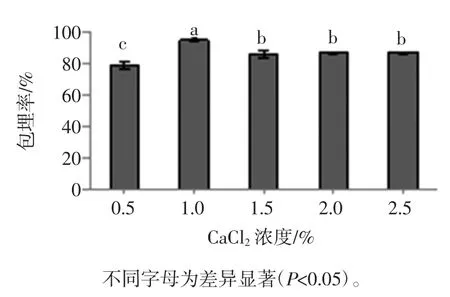
图7 CaCl2浓度对微胶囊包埋率的影响Fig.7 Effect of CaCl2concentration on EY of Bifidobacterium adolescentis microcapsules
由图7可知,在CaCl2浓度为0.5%~2.5%之间,随着CaCl2浓度的增加,微胶囊的包埋率呈现先增加后降低然后趋于稳定的变化趋势。在CaCl2浓度为1.0%时包埋率达到最大值94.62%,此时湿胶囊中的活菌数为3.1×108cfu/mL。CaCl2浓度为1.0%和其它浓度之间的微胶囊包埋效率存在显著性差异(P<0.05)。主要原因是:海藻酸钠中的Na+被适量的Ca2+取代形成“egg-box”结构,但是当CaCl2浓度较低或过高时导致微胶囊内部的网状结构分布不均[21],从而表现为微胶囊中所含菌数的差异,故选择最佳的CaCl2浓度为1.0%。
2.9青春双歧杆菌微胶囊表面特征
青春双歧杆菌微胶囊粒径分布均匀。湿胶囊的粒径分布情况如图8所示。

图8 青春双歧杆菌湿微胶囊粒径分布Fig.8 Size distribution of wet Bifidobacterium adolescentis microcapsules
粒径主要分布在418.6 μm~704.0 μm之间,粒径为497.8 μm的湿胶囊占56.26%,粒径为592.0 μm的湿胶囊则占样品的31.08%,704.0 μm的湿胶囊占样品数的5.86%,出现这种情况的主要原因是:在制备过程中,为了保证液滴的分散性,需要适当调节微胶囊造粒仪的振荡频率及进样口的压力,从而导致了粒径会有所不同。
图9是单反相机拍摄的青春双歧杆菌微胶囊湿胶囊的的形态特征照片,粒径分布均匀,成白色颗粒。
图10是湿微胶囊在普通显微镜下的外部形态,海藻酸钠和壳聚糖在外部形成一层囊壁,将吸附有双歧杆菌的多空淀粉颗粒包埋在微胶囊内部。

图9 青春双歧杆菌微胶囊湿胶囊Fig.9 Wet Bifidobacterium adolescentis microcapsules

图10 普通显微镜下湿青春双歧杆菌微胶囊Fig.10 Optical microphotograph of wet Bifidobacterium adolescentis microcapsules
3 结论
本文研究了利用微胶囊造粒仪制备青春双歧杆菌微胶囊的工艺条件,以青春双歧杆菌微胶囊的包埋效率为研究指标,考察了多孔淀粉用量、作用温度、pH值、振荡时间,海藻酸钠浓度、壳聚糖浓度、CaCl2浓度、菌悬液/海藻酸钠体积比等因素对微胶囊的影响,并对其影响机理做了初步分析,同时观察了微胶囊的外部形态。
用微胶囊造粒仪制备青春双歧杆菌微胶囊的最佳工艺条件为:多孔淀粉用量为0.08 g/mL菌悬液,包埋温度为30℃,pH值为6.0,振荡时间40 min,海藻酸钠浓1.6%,壳聚糖浓度0.75%,CaCl2浓度1.0%,按此工艺参数制备的微胶囊,湿胶囊中青春双歧杆菌的包埋率为94.62%,此时湿胶囊中的活菌数为3.1× 108cfu/mL制备的青春双歧杆菌微胶囊粒径均匀,粒径主要分布在418.6μm~704.0μm之间,粒径为497.8 μm的湿胶囊占56.26%,粒径为592.0 μm的湿胶囊则占样品的31.08%。
[1]Whelehan M,I W Marison.Microencapsulation using vibrating technology[J].Journal of Microencapsulation,2011,28(8):669-688
[2]Heinzen C,A Berger,I Marison.Use of vibration technology for jet break-up for encapsulation of cells and liquids in monodisperse microcapsules[J].Fundamentals of Cell Immobilisation Biotechnology.2004,20(7):257-275
[3]Zhang Y,D Rochefort.Comparison of emulsion and vibration nozzle methods for microencapsulation of laccase and glucose oxidase by interfacial reticulation of poly(ethyleneimine)[J].Journal of Microencapsulation,2010,27(8):703-713
[4]Zvonar A,J Kristl,J Kerc,et al.High celecoxib-loaded nanoparticles prepared by a vibrating nozzle device[J].Journal of Microencapsulation,2009,26(8):748-759
[5]Zvonar A,K Berginc,A Kristl,et al.Microencapsulation of self-microemulsifying system:improving solubility and permeability of furosemide[J].International Journal of Pharmaceutics,2010,388(1):151-158
[6]Homar M,R Dreu,J Kerc,et al.Preparation and evaluation of celecoxib-loaded microcapsules with self-microemulsifying core[J]. Journal of Microencapsulation,2009,26(6):479-484
[7]邹强.双歧杆菌微胶囊的研究[D].无锡:江南大学,2012
[8]杨基础,刘佳.双歧杆菌固定化的研究[J].微生物学通报,1996,23(1):35-36
[9]马洪波,冯子力,谭华.菌(毒)种保存及复苏技术[J].中国国境卫生检疫杂志,2006(4):243-247
[10]Annan N,A Borza,L T Hansen.Encapsulation in alginate-coated gelatin microspheres improves survival of the probiotic Bifidobacterium adolescentis 15703T during exposure to simulated gastro-intestinal conditions[J].Food Research International,2008,41(2):184-193
[11]Nag A,K S Han,H Singh.Microencapsulation of probiotic bacteria using pH-induced gelation of sodium caseinate and gellan gum[J]. International Dairy Journal,2011,21(4):247-253
[12]马嫄,段显萍,刘芸,等.双层包埋制备嗜酸乳杆菌微胶囊及其应用[J].食品科学,2013(4):99-103
[13]陈超.嗜酸乳杆菌微胶囊制备及质量评价的研究[D].南昌:江西农业大学,2012
[14]Zhou Y,E Martins,A Groboillot,et al.Spectrophotometric quantification of lactic bacteria in alginate and control of cell release with chitosan coating[J].Journal of Applied Microbiology,1998,84(3):342-348
[15]徐海燕,张志焱,曹斌,等.青春双歧杆菌培养基的优化及冻干保护剂的筛选[J].畜牧与饲料科学,2013(3):15-18
[16]付陈梅,阚建全,陈宗道,等.微孔淀粉的制备性质及应用[J].食品与机械,2003(3):11-13
[17]姚卫蓉,姚惠源.多孔淀粉包埋益生菌的工艺研究[C].广州:第三届“益生菌、益生元与健康研讨会”,2004
[18]张智,黄放,王闯,等.青春双歧杆菌耐氧驯化及培养条件的响应面法优化[J].食品工业科技,2011(4):208-212
[19]张强,马齐,徐升运,等.海藻酸钠包埋乳酸菌及活性分析[J].陕西农业科学,2009(2):23-25
[20]赵彬然,薛伟明,张宏亮,等.壳聚糖/海藻酸钙微胶囊的通透性能[J].化工进展,2009(10):1803-1807
[21]何荣军,杨爽,孙培龙,等.海藻酸钠/壳聚糖微胶囊的制备及其应用研究进展[J].食品与机械,2010(2):166-169
Studies on Preparation of Bifidobacterium adolescentis Microcapsules Using Encapsulator B-395 Pro
WANG Huan1,XIAO Jun-xia2,HUANG Guo-qing2,YANG Jian2,*
(1.School of Applied Chemistry and Biological Technology,Shenzhen Polytechnic,Shenzhen 518055,Guangdong,China;2.College of Food Science and Engineering,Qingdao Agricultural University,Qingdao 266109,Shandong,China)
In this research,Bifidobacterium adolescentis microcapsules based on porous starch,sodium alginate and chitosan had been prepared by Encapsulator B-395.The microcapsules EY was considered as the standard.The porous starch concentration,temperature,pH,shaking time and the sodium alginate concentration,chitosan concentration,CaCl2concentration,bacterium culture/sodium alginate were searched.The results were:porous starch concentration was 0.08 g/mL bacterium culture,temperature was 30℃,pH was 6.0,shaking time was 40 min,sodium alginate was 1.6%,chitosan concentration was 0.75%,CaCl2concentration was 1.0%.The maximum EY was 94.62%,3.1×108cfu/mL.The color of capsules was white.The rate of 497.8 μm wet microcapsules was 56.26%.
Bifidobacterium adolescentis;microcapsule;preparation
10.3969/j.issn.1005-6521.2016.21.021
深圳市科技研发资金基础研究计划(JCYJ2013033115120 4151)
王欢(1989—),女(汉),硕士研究生,研究方向:功能性食品。
杨剑(1965—),男,教授。
2012--

