木奶果花色苷提取纯化及其抗氧化活性研究
邓浩,张容鹄,*,梁振益,冯建成,窦志浩,晁增燕
(1.海南省农业科学院农产品加工设计研究所,海南海口570100;2.海南大学材料与化工学院,海南海口570100)
木奶果花色苷提取纯化及其抗氧化活性研究
邓浩1,张容鹄1,*,梁振益2,冯建成2,窦志浩1,晁增燕2
(1.海南省农业科学院农产品加工设计研究所,海南海口570100;2.海南大学材料与化工学院,海南海口570100)
采用溶剂提取法提取木奶果果肉中的花色苷,得到最佳提取工艺条件为:提取溶剂为用1%HCl酸化过的乙醇溶液,溶剂浓度为60%,料液比为1∶20(g/mL),提取时间为45 min,提取温度为50℃;采用大孔树脂法分离和纯化提取物中的花色苷,5种大孔树脂静态吸附率大小顺序为:AB-8(92.80%)>D101(91.90%)>NKA-Ⅱ(90.80%)>X-S(90.50%)>D-151(88.20%)>D-280(83.40%);选用D-101和AB-8两种对花色苷吸附率较高的树脂进行解吸率实验,选择乙醇为洗脱液,当乙醇浓度为60%时,D-101和AB-8的洗脱率分别为82.06%和84.32%;采用DPPH自由基法测定木奶果中花色苷的抗氧化活性,当花色苷的浓度为5.70 μg/mL时,自由基清除率最高达到90.00%,IC50为3.35 μg/mL,表现为较强的抗氧化活性。
木奶果;花色苷;提取;抗氧化活性
木奶果(Baccaurea ramiflora Lour),别名也称为水赖、麦穗、蒜瓣果,属大戟科木奶果属植物,为常绿乔木或灌木,生于低海拔至中海拔的山谷、山坡阴湿林中,是热带雨林植物代表种类之一。本属约有80余种,分布于印度、马来西亚、缅甸、泰国、越南、老挝、柬埔寨、中国、印度尼西亚等国[1-2]。我国有3种,主要分布于海南、云南等。其果肉含人体所需的营养成分,根、果皮均可入药[3]。20世纪90年代初,胡建香等[4]对西双版纳地区野生木奶果果实进行了成分分析,其果实可食率为49.2%,含水分84.7%、脂肪为0.06%、淀粉为0.47%、纤维为0.29%、维生素C为1.57 mg/100 g、可滴定酸为1.99%、总糖为11.87%,目前针对木奶果果实的功能成分的研究报道较少。
花青素是一类天然的可食用的水溶性色素[5],属酚类化合物中的类黄酮,其色泽鲜亮自然、无毒、无特殊气味,具有抗炎抗氧化[6]、保肝[7-8]、护肾[9]、控制血糖[10]等功能,在食品、化妆品及医药等行业中有广阔的应用前景。开展木奶果中花青素的提取工艺及其抗氧化活性的研究,对进一步掌握木奶果的功能成分及功效,对食品加工业天然色素的开发与利用都具有重要意义。
1 材料与方法
1.1材料与试剂
木奶果:购于海南省保亭县南林乡,2014年6月15日于海南保亭南林乡采摘后低温运到实验室,果皮、果肉分离后,于-50℃冷冻后经真空冷冻干燥保存备用;甲醇、乙醇、盐酸、氯化钾、醋酸、醋酸钠等试剂:均为国产分析纯;大孔吸附树脂AB-8、D-101、D-151、D-280、NKA-Ⅱ、X-S:阿拉丁试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):美国Sigma公司。
1.2仪器与设备
UV-2450紫外分光光度计:日本岛津公司;HHS-4S水浴锅:上海市南阳仪器有限公司;旋转蒸发仪:上海申生科技有限公司;CPA225D电子分析天平:德国Sartorius公司。
1.3试验方法
1.3.1花色苷的提取
1.3.1.1缓冲溶液的配制、花色苷的测定
参照宋德群等[11]的方法配制缓冲溶液。pH 1.0缓冲液:将0.2 mol/L KCl与0.2 mol/L HCl以25∶67(体积比)的比例配制;pH 4.5缓冲液:将0.1 mol/L NaAc、0.1 mol/L HCl与H2O以100∶60∶90(体积比)的比例配制。
参照戚向阳等[12]的pH示差法检测花色苷。分别取0.025 mol/L氯化钾缓冲液(pH1.0)和0.4 mol/L醋酸钠缓冲液(pH4.5)各9 mL。分别加入待测样品1 mL,混匀,平衡1 h,用蒸馏水作空白,在最大吸收波长处的吸光值Aλvis-max和校正浑浊度处A700nm测定稀释样品的吸光度。A=(Aλvis-max-A700)pH1.0-(Aλvis-max-A700)pH4.5,原始样品中花色苷色素含量:m/(mg/L)=(A×MW×DF×1000)/(ξ× 1),式中:MW为相对分子质量;DF为稀释因子;ξ为摩尔吸光度;1为比色皿直径(1 cm)。本研究中按矢车菊-3-葡萄糖苷计算花色苷浓度,其MW=449.2,DF= 10,ξ=26900。
1.3.1.2提取溶剂种类、浓度的选择
分别称取果肉1.0 g 6份,标记为A1、A2、A3、A4、A5、A6,分别加入蒸馏水、1%HCl酸化过的蒸馏水、乙醇、1%HCl酸化过的乙醇、甲醇、1%HCl酸化过的甲醇6种提取溶剂,料液比1∶20(g/mL),于水浴锅40℃的条件下提取2次,每次30 min,合并2次提取液,定容至50 mL。提取的花色苷按1.3.1.1方法检测。
分别称取果肉1.0 g 5份,标记为B1、B2、B3、B4、B5,按上一步骤实验得出的最佳提取液以浓度分别为40%、50%、60%、70%、80%比例加入,料液比1∶20(g/mL),于水浴锅40℃条件下搅拌提取2次,每次30 min,合并2次提取液,定容至50 mL。提取的花色苷按1.3.1.1方法检测。
1.3.1.3料液比、提取时间、提取温度的选择
分别称取果肉1.0 g 6份,标记为C1、C2、C3、C4、C5、C6,按以上步骤选择出的最适合的溶剂及其最佳浓度,分别按料液比1∶5、1∶10、1∶15、1∶20、1∶25、1∶30(g/mL),于水浴锅40℃条件下提取2次,每次30 min,合并2次提取液,定容至50 mL。提取的花色苷按1.3.1.1方法检测。
分别称取果肉1.0 g 5份,标记为D1、D2、D3、D4、D5,按以上3个步骤得出的最佳溶剂、溶剂浓度、料液比等参数,于水浴锅40℃条件下提取2次,每次的时间分别为15、30、45、60、120 min。合并2次提取液,定容至50 mL。提取的花色苷按1.3.1.1方法检测。
分别称取果肉1.0 g 6份,标记为E1、E2、E3、E4、E5、E6,按以上4个步骤得出的最佳溶剂、溶剂浓度、料液比、提取时间等参数分别于30、40、50、60、70℃的条件下水浴提取2次,合并2次提取液,定容至50 mL。提取的花色苷按1.3.1.1方法检测。
1.3.2花色苷的纯化
1.3.2.1大孔吸附树脂种类的选择
分别称取已处理好的大孔吸附树脂AB-8、D-101、D-151、D-280、NKA-Ⅱ、X-S各5 g于烧杯中,标记为1~6,各加入10 mL样液,放置,静态吸附24 h后测其在最大吸收波长处的吸光值。吸附量Q=(C0-Ce)× V/m。式中:Q为吸附量,mg/g;C0为起始质量浓度,mg/ mL;Ce为平衡质量浓度,mg/mL;V为吸附液体积,mL;m为树脂质量,g。
1.3.2.2洗脱液浓度的选择
选取上一步骤中吸附量较好的2种大孔吸附树脂,分别用0%、20%、40%、60%、80%的乙醇溶液25 mL进行洗脱3次,以解析率为衡量指标,确定最佳洗脱液浓度。解析率测定公式:D/%=Cd×Vd×100/[(C0-Ce)×V]。式中:D为解吸率,%;Cd为解吸液质量浓度,mg/mL,Vd为解吸液体积,mL。
1.3.3花色苷的抗氧化活性的测定
参照Bao J[13]等DPPH自由基法测定花色苷的抗氧化活性。将树脂分离的样品用蒸馏水稀释至不同的浓度,分别取样品2 mL和2×10-4mol/L DPPH乙醇溶液2 mL,混匀后在室温下避光反应30 min,在517 nm下测定吸光值Ai;Aj为2 mL无水乙醇加2 mL样品溶液的吸光度,A0为2 mL DPPH加2 mL蒸馏水的吸光度,并以等体积蒸馏水和无水乙醇混合液空白调零。平行测定3次取平均值,清除率按下式计算:清除率/%=1-[(Ai-Aj)/A0]×100。
2 结果与分析
2.1花色苷的提取
2.1.1提取溶剂种类、浓度的选择
选择不同的溶剂对木奶果中的花色苷进行提取。A1,A2,A3,A4,A5,A6,分别代表的溶剂是蒸馏水、1% HCl酸化过的蒸馏水、乙醇、1%HCl酸化过的乙醇、甲醇和1%HCl酸化过的甲醇。结果如图1所示。

图1 溶剂种类对花色苷质量分数的影响Fig.1 Effect of solvent types on the content of anthocyanin
由图1可知,花色苷通过有机溶剂和水的提取差别不大,酸化过的溶液比没酸化过的提取效果明显要好,这可能是因为花色苷是酚类化合物,在偏酸性有机溶剂中有更大的溶解度。因此选择1%HCl酸化过的乙醇作为提取剂。
选择不同的乙醇浓度对木奶果花色苷进行提取,结果如图2所示。
由图2可知,当乙醇浓度小于60%(体积比)时,随着乙醇浓度增加提取的花色苷质量分数不断增加,当乙醇浓度60%时,提取的花色苷质量分数达到最大值0.135 mg/g。当乙醇浓度大于60%时,随着乙醇浓度增加提取的花色苷质量分数不断减少,可能是因为在乙醇浓度为60%时的极性与花色苷提取物的极性相近,根据相似相溶原理,此时溶解度最大,便于提取。因此选择提取溶剂为1%HCl酸化过浓度为60%的乙醇。

图2 溶剂浓度对花色苷质量分数的影响Fig.2 Effect of solvent concentration on the content of anthocyanin
2.1.2料液比、提取时间、提取温度的选择
选择不同的料液比对木奶果花色苷进行提取,结果如图3所示。

图3 料液比对花色苷质量分数的影响Fig.3 Effect of solid-liquid ratio on the content of anthocyanin
由图3可知,随着料液比的减小,提取的花色苷质量分数呈上升趋势,当料液比达到1∶20(g/mL)时,花色苷质量分数达到最大值0.138 mg/g,继续减少料液比对花色苷提取效果影响不大,因此选择料液比为1∶20(g/mL)。
选择不同的提取时间对木奶果花色苷进行提取,结果如图4所示。
由图4可知,提取时间为45 min时提取的花色苷质量分数达到最大值0.140 mg/g,之后提取时间越长提取量反而越来越少,可能是提取时间过长花色苷被氧化造成的,因此选择提取时间为45 min。
选择不同的提取温度对木奶果花色苷进行提取,结果如图5所示。
由图5可知,提取温度为50℃时提取的花色苷质量分数达到最大值0.182 mg/g,之后随着提取温度的增加花色苷的提取质量分数反而越来越少,可能是花色苷在高温下被氧化分解造成的,因此选择提取温度为50℃。

图4 提取时间对花色苷质量分数的影响Fig.4 Effect of time on the content of anthocyanin

图5 温度对花色苷质量分数的影响Fig.5 Effect of temperature on the content of anthocyanin
2.2花色苷的纯化
2.2.1大孔吸附树脂种类的选择
采用大孔树脂法分离和纯化木奶果提取物中的花色苷,对比了5种大孔树脂静态吸附情况,结果如图6所示。

图6 树脂的种类对花色苷吸附率的影响Fig.6 Effect of macroporous resin types on the adsorption rate of anthocyanin
由图6可知,吸附率大小顺序为:AB-8(92.80%)>D101(91.90%)>NKA-Ⅱ(90.80%)>X-S(90.50%)>D-151(88.20%)>D-280(83.40%)>。因此选择大孔吸附树脂种类为AB-8和D101。
2.2.2洗脱液浓度的选择
选用D101和AB-8两种吸附率较高的大孔吸附树脂进行静态解吸实验,以不同浓度的乙醇溶液为洗脱液,结果如图7所示。

图7 洗脱液浓度对花色苷洗脱率的影响Fig.7 Effect of concentration of elution solution on the elution rate of anthocyanins
由图7可知,随着洗脱液浓度的增加,两种大孔吸附树脂的洗脱率的逐渐增大,当洗脱液浓度达到60%(体积比)以后,洗脱率维持基本不变。因此,选择脱液浓度为60%。
2.3花色苷的抗氧化活性的测定
DPPH分子溶液具有典型紫色,在517 nm处有强吸收,当它与自由基清除剂作用时,生成无色产物,溶液的紫色变浅[14]。结果如图8所示。
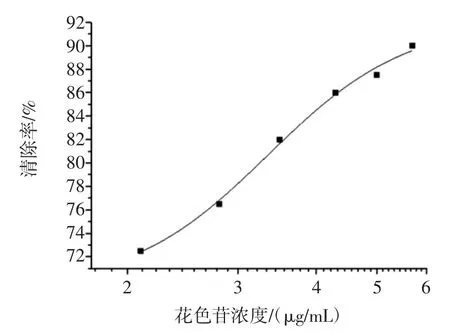
图8 花色苷浓度对DPPH自由基清除率的影响Fig.8 Effect of concentration ofanthocyanin on the rate of scavenging DPPH radical
由图8可知,木奶果的花色苷提取物对DPPH自由基有一定的清除能力,且随质量浓度的增加而增强。当提取物的浓度为5.70 mg/mL时,自由基清除率达到90.00%,IC50为3.35 μg/mL。一般认为某种物质清除自由基的IC50值低于10 mg/mL,表明其具有较好的抗氧化性[15]。可见木奶果中花色苷提取物有较强的抗氧化活性。
3 结论
采用溶剂提取法提取木奶果果肉中的花色苷,研究了提取溶剂、溶剂浓度、料液比、提取时间和提取温度对提取效果的影响,得最佳提取工艺条件为:提取溶剂为用1%HCl酸化过的乙醇溶液、溶剂浓度为60%、料液比为1∶20(g/mL)、提取时间为45 min和提取温度为50℃。
采用大孔树脂法分离和纯化木奶果提取物中的花色苷,对比了5种大孔树脂静态吸附及解吸结果,吸附率大小顺序为:AB-8(92.80%)>D101(91.90%)>NKA-Ⅱ(90.80%)>X-S(90.50%)>D-151(88.20%)>D-280(83.40%);选用D101和AB-8两种吸附率较高的树脂进行解吸率实验,选用乙醇为洗脱液,当乙醇浓度为60%时,D101和AB-8的洗脱率分别为82.06%和84.32%。
采用DPPH自由基法测定木奶果花色苷提取物的抗氧化活性,当提取物的浓度为5.70 μg/mL时,自由基清除率最高达到90.00%,IC50为3.35 μg/mL,表现为较强的抗氧化活性。
[1]Inta A,Trisonthi P,Trisonthi C.Analysis of traditional knowledge in medicinal plants used by Yuan in Thailand[J].Journal of Ethnopharmacology,2013,149(1):344-351
[2]Deb P,Sundriyal R C.Tree regeneration and seedling survival patterns in old-growth lowland tropical rainforest in Namdapha National Park,north-eastIndia[J].Forest Ecology&Management,2008,255(12):3995-4006
[3]徐静,林强,梁振益,等.木奶果根、叶、果实中挥发油化学成分的对比研究[J].食品科学,2007,28(11):439-442
[4]胡建香,肖春芬,郑玲丽.野生果树——木奶果[J].中国南方果树,2003,32(4)
[5]何艾,张容鹄,陈秀琼,等.酶法提取红毛丹果皮花色苷的研究[J].热带生物学报,2011,2(4):355-359
[6]Zi-Feng Z,Shao-Hua F,Yuan-Lin Z,et al.Purple sweet potato color attenuates oxidative stress and inflammatory response induced by D-galactose in mouse liver[J].Food&Chemical Toxicology,2009,47(2):496-501
[7]Yong P H,Choi J H,Yun H J,et al.Anthocyanins from purple sweet potato attenuate dimethylnitrosamine-induced liver injury in rats by inducing Nrf2-mediated antioxidant enzymes and reducing COX-2 and iNOS expression[J].Food&Chemical Toxicology,2011,49(1):93-99
[8]Yong P H,Choi J H,Choi J M,et al.Protective mechanisms of anthocyanins from purple sweet potato against tert-butyl hydroperoxide-induced hepatotoxicity[J].Food&Chemical Toxicology,2011,49(9):2081-2089
[9]Jing L,Soon Sung L,Jae-Yong L,et al.Purple corn anthocyanins dampened high-glucose-induced mesangial fibrosis and inflammation:possible renoprotective role in diabetic nephropathy[J].Journal of Nutritional Biochemistry,2012,23(4):320-331
[10]Zhang Z F,Lu J,Zheng Y L,et al.Purple sweet potato color attenuates hepatic insulin resistance via blocking oxidative stress and endoplasmic reticulum stress in high-fat-diet-treated mice[J].Journal of Nutritional Biochemistry,2013,24(6):1008-1018
[11]宋德群,孟宪军,王晨阳,等.蓝莓花色苷的pH示差法测定[J].沈阳农业大学学报,2013,44(2):231-233
[12]戚向阳,姚叶斌.杨梅花色苷提取工艺条件的响应面分析及其抗氧化活性[J].果树学报,2009,26(2):226-230
[13]Bao J,Cai Y M,Wang G,et al.Anthocyanins,flavonols,and free radical scavenging activity of Chinese bayberry(Myricarubra)extracts and their color properties and stability.[J].Journal of Agricultural&Food Chemistry,2005,53(6):2327-2332
[14]段宙位,窦志浩,何艾,等.青金桔皮中多酚的提取及其抗氧化性研究[J].食品工业科技,2015,36(10):244-248
[15]郑义,邵颖,陈安徽,等.益智仁总黄酮超声辅助提取工艺优化及其抗氧化活性[J].食品科学,2014,35(6):44-49
Study on the Extraction and Purification of Anthocyanins from Baccaurea ramiflora Lour and Its Antioxidant Activity
DENG Hao1,ZHANG Rong-hu1,*,LIANG Zhen-yi2,FENG Jian-cheng2,DOU Zhi-hao1,CHAO Zeng-yan2
(1.Institute of Processing&Design of Agroproducts,Hainan Academy of Agricultural Science,Haikou 570100,Hainan,China;2.College of Materials and Chemical Engineering,Hainan University,Haikou 570100,Hainan,China)
The anthocyanins from Baccaurea ramiflora Lour fruit flesh were extracted by solvent method,the optimal extraction conditions were:extraction solvent was ethanol solution with 1%HCl,solvent concentration was 60%,solid-liquid ratio was 1∶20(g/mL),extraction time was 45 min,extraction temperature was 50℃;five different macroporous resins were used to separate and purify the anthocyanins in the extract,and the static adsorption rates order was:AB-8(92.80%)>D101(91.90%)>NKA-Ⅱ(90.80%)>X-S(90.50%)>D-151(88.20%)>D-280(83.40%).The elution rates of AB-8 and D-101 were 82.06%and 84.32%when the concentration of ethanol was 60%.The antioxidant activity of anthocyanins from Baccaurea ramiflora Lour was determined by DPPH radical scavenging method,when the anthocyanin concentration was 5.70 μg/mL,the free radical scavenging rate was 90%,IC50was 3.35 μg/mL,showed strong antioxidant activity.
Baccaurea ramiflora Lour;anthocyanin;extraction;antioxidant activity
10.3969/j.issn.1005-6521.2016.21.008
海南省自然科学基金项目(314156)
邓浩(1987—),男(汉),讲师,硕士研究生,研究方向:农产品加工。
2015-12-22

