体外开窗EVAR技术治疗短瘤颈腹主动脉瘤的初步经验
罗宇东 朱杰昌 张益伟 冯 舟 范海伦 戴向晨
天津医科大学总医院血管外科,天津 300052
体外开窗EVAR技术治疗短瘤颈腹主动脉瘤的初步经验
罗宇东 朱杰昌 张益伟 冯 舟 范海伦 戴向晨*
天津医科大学总医院血管外科,天津 300052
目的 初步探讨体外开窗EVAR技术治疗短瘤颈腹主动脉瘤(abdominal aortic aneurysm,AAA)的可行性。方法 回顾性分析2013年8月至2016年8月天津医科大学总医院血管外科收治的6例应用体外开窗技术治疗的短瘤颈AAA患者的临床资料。所有患者均根据术前计算机体层摄影血管造影(computed tomography angiography,CTA)数据预定或者自制体外开窗支架,行AAA腔内修复术(endovascular aortic repair,EVAR)和内脏动脉分支支架植入术。结果 6例均顺利完成手术。2例患者术后1周内出现一过性肾功能损伤,经内科治疗后改善。6例患者平均随访时间为8.6个月(范围为1~24个月)。1例左侧肾切除患者术后3个月复查彩色超声多普勒,显示右侧肾动脉通畅,腹主动脉支架通畅,无内漏。其余5例患者术后复查CTA,均显示主体开窗支架和内脏分支支架通畅,无内漏。结论 体外开窗EVAR技术是一项治疗短瘤颈AAA的可行方法。
腔内修复术;腹主动脉瘤;开窗支架
AAA的治疗包括传统的开放手术和腔内治疗。文献[1,2]报道,与开放手术相比,EVAR可以缩短手术时间、手术出血量比较少、减少住院时间、减少临床并发症和死亡的发生率。因此,目前EVAR已经成为治疗AAA的首选的手术方式,广泛应用于临床。但是由于近端瘤颈锚定区解剖学的局限性而导致约40%的AAA不适用EVAR,包括短瘤颈、扭曲瘤颈和瘤体累及内脏动脉等[3]。开窗支架的应用可以将锚定区定位在肾动脉,甚至肠系膜上动脉和腹腔干以上,治疗肾上AAA、平肾AAA和近肾AAA[4]。目前,开窗支架主要应用定制混合型支架,天津医科大学总医院血管外科采用此支架完成1例。由于定制时间比较长,费用相对比较高并且注册证等问题,无法广泛应用于临床。天津医科大学总医院血管外科应用体外台上开窗技术,解决定制支架的局限性,共完成5例,现报告如下。
1 材料与方法
1.1临床资料
6例患者入院时临床资料见表1。
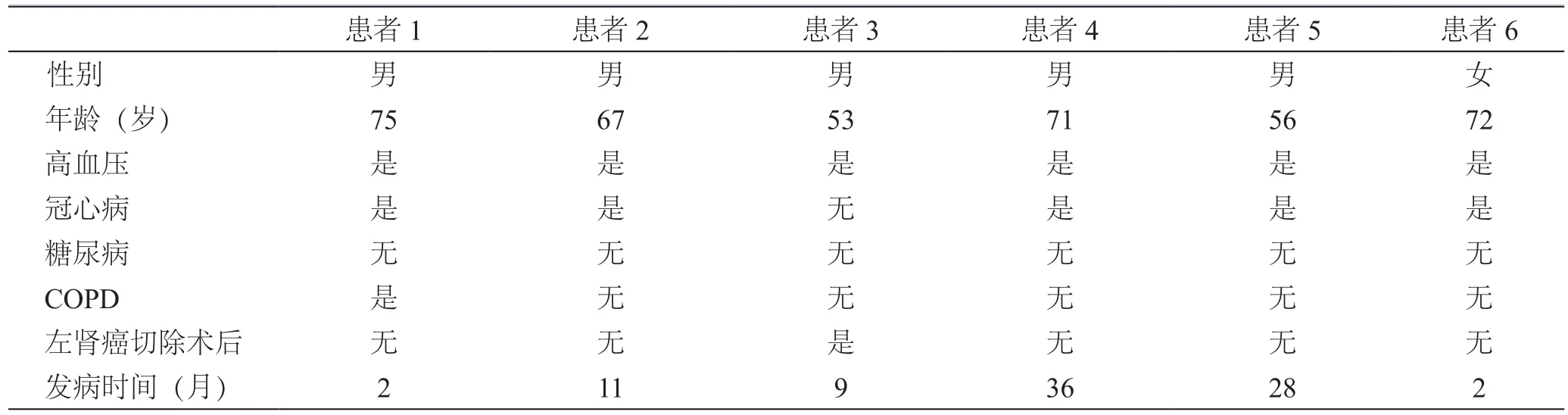
表1 6例患者临床病史资料
1.2术前CT检查
全部患者均于术前行主动脉弓至双侧股浅动脉起始部CTA。CTA均诊断为AAA。CT检查数据见表2。
1.3开窗方案
根据术前CT检查,拟定体外大支架的开窗方案,具体数据见表3。
1.4手术方法
1.4.1支架体外开窗制作方法
Zenith体外主体覆膜支架开窗的方法:⑴ 将支架输送系统的外鞘向后撤,将覆膜支架完全释放;⑵ 依术前测量数据用Marker笔定位开窗和开槽的位置及其相应直径,用电刀烧灼开窗开槽;⑶ 将圈套器用作定位Marker,分别缝在窗和槽的边缘;⑷ 在支架背侧用1根0.036 cm(即0.014英寸)导丝做支架的缩窄,前端插入输送器内芯,尾端备用;⑸ 肾动脉预置1根0.036 cm导丝,前端插入输送器内芯,尾端备用;⑹ 将改装后支架送回原输送系统内。
C3支架体外开窗的方法类似于Zenith支架,不同之处包括:⑴ SMA的开槽需要去掉C3支架前端M型金属丝后,开“V”型槽;⑵ 不需要在支架背侧预置缩窄导丝;⑶ 改装后支架回收入1个20 F导鞘内。
1.4.2开窗支架手术方法
Zenith腹主动脉开窗支架手术方法:全麻下穿刺双侧股总动脉,预置Proglide双缝线。切开暴露左侧腋动脉,置入12 F动脉鞘于降主动脉。在全身肝素化(100 u/kg)后,自股动脉将黄金标记猪尾导管置于胸12水平,造影确认腹腔干动脉、肠系膜上动脉、双侧肾动脉开口位置和明确AAA形态。自左侧腋动脉入路,将2根造影导管选入股总动脉,引出备用。将自制的开窗支架主体、预置导丝沿超硬导丝和2根造影导管送入腹主动脉,2根0.036 cm导丝均由左侧腋动脉鞘内引出和固定。依据开窗标记Marker定位,部分释放支架前端,露出SMA槽和肾动脉开窗,自左侧腋动脉入路,导丝导管配合分别选入SMA和肾动脉,保留Supercore导丝。重复腹主动脉造影,确定腹腔干动脉、肠系膜上动脉和肾动脉血流通畅,释放开窗主体支架直至释放出支架短腿,释放主体前端裸支架,拔出缩窄导丝。对侧选腿成功后,球囊扩张瘤颈,再接腿至髂总动脉末端。将主体完全释放,退出输送系统,长腿侧接腿置于髂总动脉远端。将7 F长鞘选入SMA和肾动脉,经长鞘送入分支覆膜(Viabahn)或者裸支架,腹主动脉内探出约3~5 mm,并且用球囊将腹主动脉内支架扩张成喇叭口。最后,复查腹主动脉造影,确认腹主动脉各分支通畅,AAA隔绝满意,无内漏,双侧髂动脉血流良好。双侧缝合股总动脉,确认足背动脉搏动正常。左侧腋动脉缝合,逐层关闭切口,患者送回ICU监护。

表2 6例患者CT重建测量结果

表3 6例患者拟定支架开窗数据表
C3腹主动脉开窗支架的手术方法,基本步骤与Zenith腹主动脉开窗支架的手术方法相同,不同之处包括:⑴ 主体支架定位调节是通过后释放的反复回收实现;⑵ 在主体支架定位释放后,SMA和肾动脉分支血管的选取入路是同侧或者对侧股总动脉,不需要常规建立腋动脉入路。
2 结果
6例患者均顺利完成手术,均住院1周,顺利出院。具体应用支架情况见表4。
2例患者术后1周内出现一过性肾功能损伤,经内科治疗后1例患者血肌酐由最高211μmol/L恢复正常;另一例左侧肾切除患者血肌酐由335μmol/L下降并且维持在220μmol/L左右。
6例患者平均随访时间为8.6个月(范围为1~24个月)。1例左侧肾切除患者术后3个月复查彩色超声多普勒显示,右侧肾动脉通畅,腹主动脉支架通畅,无内漏。其余5例患者术后复查CTA,均显示腹腔分支血管通畅,无内漏和支架移位,AAA隔绝满意,双侧下肢血流通畅。

表4 主体支架及分支支架选择
3 讨论
传统的EVAR适用于肾下AAA,而肾上AAA、平肾AAA和近肾AAA不属于EVAR的适应证。在开窗技术应用于肾上AAA、平肾AAA和近肾AAA后逐渐扩大EVAR的适应证。多中心的报道[5,6]证实了开窗支架技术具有可重复性、比较高的技术操作成功率、比较低的并发症发生率和死亡率。研究[7]报道,对平肾的AAA,开窗技术与开放手术相比,肾功能损害的发生率和手术的死亡率明显减少。目前,估计世界约有6 500例患者接受了AAA开窗手术[8]。
Zenith腹主动脉开窗支架是由3个部分组成,包括近端开窗主体、远端分叉型主体和对侧接腿。目前,FDA批准的支架可以设计3个开窗,开窗类型包括小窗(6 mm×6 mm或者6 mm×8 mm,中央无金属梁)、大窗(直径8~12 mm,中央有金属梁)和槽〔10×(6~12)mm〕。适用于近肾AAA,并且要求肾下瘤颈在4~15 mm之间。当需要3个窗以上的AAA、内脏动脉扭曲严重和肾动脉的解剖(包括多根细小副肾动脉和肾动脉分叉贴近主干开口)不适合分支覆膜支架植入时,这款定制支架不适用。南美和欧洲一些国家可以将Zenith腹主动脉开窗支架的开槽定制为20~30 mm。理论上开槽靶血管不需要植入支架。但是,有报道[8]显示,10 mm的开槽没有支架植入,可能导致致命性内脏血管血栓形成。这也是除美国以外国家将开槽扩大的原因。在本研究中1例患者为了防止支架开槽相关并发症,在SMA植入1枚裸支架。
定制支架需要1~2个月的定制时间,不适用于巨大AAA、有症状的AAA和包裹性破裂的患者。为了解决长时间等待的问题,国外p-Branch支架和Ventana支架已经在临床应用[9,10]。但是,Mendes等[11]一项关于390例研究显示,这2款支架分别只适用于49%和42%的AAA患者,仍然具有局限性。因此,对部分濒临破裂的近肾或者平肾AAA患者自行体外开窗,具有临床应用价值。
结合本研究的病例,将自行体外开窗的初步经验总结如下:⑴ 可以选择的主体开窗支架包括胸主动脉和腹主动脉CUFF(主要是根据瘤颈的直径和长度选择)、Zenith腹主分叉型、单边支架和C3支架。⑵ 如果近端开窗主体支架选择直筒型支架,远端支架需要选择无前端锚定裸支架的覆膜支架,目前常用的是腹主动脉覆膜支架,目的在于防止裸支架对内脏动脉分支支架的干扰。在本研究中第2例患者为保留右侧粗大的副肾动脉而选择了腹主动脉CUFF作为近端开窗支架;第3例患者为右侧肾动脉开窗,选择了C3支架;第4例患者为左侧肾动脉开窗,选择了Zenith腹主分叉型支架;第5、6例患者为双侧肾动脉和SMA开窗,选择了Zenith腹主分叉型支架。⑶ 开窗支架的释放需要精确的定位,因此术前应该做好每一个内脏分支血管的最佳切线投射角度的测量,减少术中放射线和造影剂的剂量。⑷ 当应用Zenith腹主分叉型支架时,采用左侧腋动脉入路行内脏动脉分支支架植入。无法通过左侧腋动脉12 F导鞘同时在双侧肾动脉开窗处保留7 F导鞘,所以在主体支架前端裸支架打开前,需要先将一侧的肾动脉植入分支支架。这时应该选择主体同侧的肾动脉,原因是在回撤输送器的过程中对侧肾动脉更容易受到干扰。另外,在远端对侧接腿的过程中,输送器的输入可能干扰已经植入支架的肾动脉。为避免这个问题,可以预先在肾动脉支架内植入8~20 mm球囊作为保护。本组1例双侧肾动脉开窗的患者,由于预先考虑到以上问题,术中肾动脉支架未受到干扰。
综上所述,应用开窗技术处理复杂瘤颈肾下AAA、近肾AAA、平肾AAA和肾上AAA是一项崭新的技术,它扩大了腔内治疗AAA的适应证,是腔内技术的2次革命。鉴于国内外临床应用经验和报道相对比较少,故需要大量的临床数据以获得安全性和有效性的循证支持。
[1]De Bruin JL, Baas AF, Buth J, et al. Long-term outcome of open or endovascular repair of abdominal aortic aneurysm[J]. N Engl J Med, 2010, 362: 1881-1889.
[2]Greenhalgh RM, Brown LC, Powell JT, et al. Endovascular versus open repair of abdominal aortic aneurysm[J]. N Engl J Med, 2010, 362 (20): 1863-1871.
[3]Carpenter JP, Baum RA, Barker CF, et al. Impact of exclusion criteria on patient selection for endovascular abdominal aortic aneurysm repair[J]. J Vasc Surg, 2001, 34 (6): 1050-1054.
[4]Greenberg R, Eagleton M, Mastracci T. Branched endografts for thoracoabdominal aneurysms[J]. J Thorac Cardiovasc Surg, 2010, 140 (6 Suppl): S171-178.
[5]GLOBALSTAR Collaborators. Early results of fenestrated endovascular repair of juxtarenal aortic aneurysms in the United Kingdom[J]. Circulation, 2012, 125 (22): 2707-2715.
[6]Cross J, Gurusamy K, Gadhvi V, et al. Fenestrated endovascular aneurysm repair[J]. Br J Surg, 2012, 99 (2): 152-159.
[7]Nordon IM, Hinchliffe RJ, Holt PJ, et al. Modern treatment of juxtarenal abdominal aortic aneurysms with fenestrated endografting and open repairda systematic review[J]. Eur J Vasc Endovasc Surg, 2009, 38 (1): 35-41.
[8]Oderich GS, Correa MP, Mendes BC. Technical aspects of repair of juxtarenal abdominal aortic aneurysms using the Zenith fenestrated endovascular stent graft[J]. J Vasc Surg, 2014, 59 (5): 1456-1461.
[9]Resch TA, Dias NV, Sobocinski J, et al. Development of off-theshelf stent grafts for juxtarenal abdominal aortic aneurysms[J]. Eur J Vasc Endovasc Surg, 2012, 43 (6): 655-660.
[10]Holden A, Mertens R, Hill A, et al. Initial experience with the Ventana fenestrated system for endovascular repair of juxtarenal andpararenal aortic aneurysms[J]. J Vasc Surg, 2013,57 (5): 1235-1245.
[11]Mendes BC, Oderich GS, Cha S, et al. Anatomical feasibility of offthe-shelf fenestrated stent-grafts to treat juxtarenal and pararenal abdominal aortic aneurysms[J]. J Vasc Surg, 2014, 60 (4): 847-848.
Primary study of Fenestrated EVAR for treating abdominal aortic aneurysm with short proximal neck
LUO Yu-dong ZHU Jie-chang ZHANG Yi-wei FENG Zhou FAN Hai-lun DAI Xiang-chen*
Department of Vascular Surgery, Tianjin Medical University General Hospital, Tianjin 300052, China
Objective To investigate the clinical value of Fenestrated EVAR for treating abdominal aortic aneurysm with short proximal neck. Methods A retrospective analysis of the result 6 cases from August 2013 to August 2016 was performed. Fenestrated stent-grafts were designed according to the preoperative CTA data. All cases underwent EVAR with the fenestrated stent-grafts to revascularize visceral branches. Results Fenestrated EVAR was performed in all of the 6 cases successfully. Renal dysfunction occurred in two cases during 7 post-operative days and improved with the medical treatment. Mean follow-up period was 8.6 months (range, 1-24 months). The Doppler of one case with nephrectomy on the left side at 3 months follow-up showed patency and no endoleak of both fenestrated stent graft and right renal stent graft. CTA was performed among other 3 cases postoperatively. Patency and no endoleak of fenestratedstent graft and visceral stent grafts were found from the images. Conclusion Fenestrated EVAR is a viable and safe alternative to treat AAA with short proximal neck.
endovascular aortic repair; abdominal aortic aneurysm; fenestrated stent-graft
R543.1
A
10.19418/j.cnki.issn2096-0646.2016.05.01
戴向晨,E-mail:13302165917@163.com

