犊牛腹泻肠球菌分离鉴定及生物膜筛选条件分析
黄昌谋
(新疆阿瓦提县拜什艾日克镇畜牧兽医站,新疆阿瓦提 843200)
犊牛腹泻肠球菌分离鉴定及生物膜筛选条件分析
黄昌谋
(新疆阿瓦提县拜什艾日克镇畜牧兽医站,新疆阿瓦提 843200)
基于临床上犊牛腹泻的高发病率,致使犊牛死亡严重,给养牛业造成重大经济损失。本实验采用细菌常规分离鉴定方法和96孔板微量滴定法。筛选出肠球菌及其生物膜;研究生物膜的生长特性。共筛得细菌214株,其中,肠球菌24株;肠球菌所占的比例为11.21%。利用96孔微量板测定,得到生物膜阳性菌1株。生物膜阳性率为4.17%。为临床上犊牛腹泻的诊断和治疗提供依据。
犊牛腹泻生物膜肠球菌
犊牛腹泻是犊牛常发的一种胃肠疾病。犊牛常在出生后2~3d开始发病,对犊牛的发育、生长、成活等有很大影响。在大群饲养时,犊牛腹泻发生率常达90%~100%,死亡率最高可达50 %以上,对奶业的发展威胁很大。本实验采取在肠球菌培养基中添加奶粉,以期促进其生物膜生长,并且寻找到最适宜生物膜生长的脱脂奶粉梯度和培养时间梯度,为犊牛腹泻的诊断和治疗提供依据。
1 实验材料
1.1 实验样品
本试验样品全部为犊牛腹泻的粪样,采自新疆生产建设兵团农一师某团牛场的犊牛样品共计16份。其中所有犊牛年龄均在15日以下。
1.2 实验试剂
脑心浸液琼脂培养基[BHI](BD生产);脱脂奶粉(BD生产);普通琼脂;过氧化氢;革兰氏染色所需试剂(结晶紫,酒精,沙黄,碘液);肠球菌琼脂即胆汁七叶苷叠氮钠(BD生产);pH试纸;生理盐水。
1.3 试验仪器
全波长酶标仪(Power Wave XS美国产);隔水式恒温培养箱(GHP-9080上海一恒科学仪器有限公司);无菌操作台(SWCJ-2F上海博讯实业有限公司医疗设备厂);进口U型96孔板(3599)购自Corning Costar产品;立式压力蒸汽灭菌器(LZDX-50KB上海申安医疗器械厂);电子天平(XM4039SHMAD-ZU Corporation);显微镜;烧杯;量筒;锥形瓶;注射器;载玻片;移液器;平皿。
2 实验方法
2.1 样品采集及处理
样品接种于LB液体培养基中,振摇24h,再于LB固体平板上划线培养。37℃24h培养,挑取单菌落,接种于另一LB平板上,继续37℃24h培养。挑取每一菌落的部分做革兰氏染色,进行镜检。
2.2 生化实验鉴定
进一步确定具体菌种,接种单菌落于胆汁七叶苷叠氮钠培养基(肠球菌鉴别培养基),肠球菌在此培养基上变黑,故可分离出肠球菌。
2.3 溶血试验
根据肠球菌溶血现象的不同,可分αβγ型血平板:普通琼脂加热待其冷却至50℃+5%的家兔鲜血,即每100m1普通琼脂加入5m1兔血。
2.4 保菌
细菌悬浮液取1m1在离心机转速为13000rpm/min离心3min,弃上清液取1m1继续离心(13000rpm/min,3min),弃上清液,加等量80%的甘油混合,-70℃保存备用。
2.5 菌株活化
移液器吸取离心管中50µ1菌液入LB液体培养基,静置过夜培养;
2.6 菌株固化
接种环勾取活化了的菌株在BHI固体培养基上,37℃静置过夜培养;
2.7 混菌
接种环勾取固化了的菌落,入BHI液体培养基;36℃静置过夜培养;
用移液枪分别吸取菌液和BHI培养基以1/100的比例混匀加至U型96孔板中。A~F孔加入混液,而GH两排空加入200µ1空白BHI培养基,作为对照。36℃36h培养,后将液体轻轻拍下,用PBS液体冲洗96孔板3次,60℃ 1h烘干固定;加入0.4%草酸铵结晶紫,覆盖孔底即可,染色5min,流水冲洗无紫色流下,晾干后在酶标仪读取数值。
判定标准:空白平均值
临界值=空白平均值+3*标准差
生物膜生长=菌的平均值—临界值
0.14>生物膜生长,判定为阴性,符号表示“—”
0.14≤生物膜生长<0.28,判定为阳性,符号表示为“+”
0.28≤生物膜生长<0.56,判定为中等阳性,符号表示为“++”
0.56≤生物膜生长,判定为强阳性,符号表示为“+++”
2.8 脱脂奶粉梯度探索实验
对冻菌进行活化固化后,配制不同奶粉浓度的BH I培养基(奶粉浓度分别设置为0,0.25%,0.5%,0.75%),115℃高压灭菌15min(此条件既可以达到灭菌效果又不致使蛋白质变质);然后吸取菌液和BHI培养基以1/100的比例混匀,A~F孔每孔加入200µL混液,而G,H两排空加入与上6孔相对应奶粉浓度的BHI培养基200µL作为对照;36℃36h培养。后将液体轻轻拍下,用PBS液体冲洗96孔板3次,60℃ 1h烘干固定;加入0.4%草酸铵结晶紫,覆盖孔底即可,染色5min,流水冲洗无紫色流下,晾干后在酶标仪读取数值。
2.9 培养时间梯度实验
对冻菌进行活化固化后,配制0.5%奶粉浓度的BHI培养基,115℃高压灭菌15min,吸取菌液和BHI培养基以1/100的比例混匀上96孔板,37℃36h培养;后将液体轻轻拍下,用PBS液体冲洗96孔板3次,60℃ 1h烘干固定;加入0.4%草酸铵结晶紫,覆盖孔底即可,染色5min,流水冲洗无紫色流下,晾干后在酶标仪读取数值。
3 实验结果
3.1 肠球菌筛选结果
16份样品共筛选出214株菌,其中肠球菌24株(显微镜视野下肠球菌呈圆形或椭圆形的革兰氏阳性球菌),肠球菌比例11.21%。
3.2 肠球菌溶血实验结果
24株肠球菌中9株菌呈β溶血现象:(S16-1,S14-1,S16-11,S16-6,S16-13,S9-1,S13-13,S8-23,S14-1)。余下15株菌呈γ溶血。
3.3 肠球菌的生长曲线实验
肠球菌菌数0~36h呈现递增趋势,在36h达到峰值;36h后逐渐减少,到48h几乎全部死亡见图1

图表 1 肠球菌生长曲线结果
3.4 生物膜筛选结果
24株菌肠球菌筛出一株阳性菌(菌名为S9-2)。肠球菌阳性比例4.17%。结果见图2
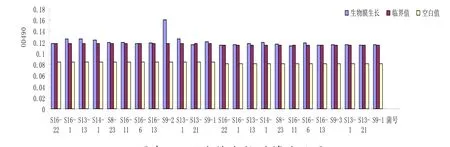
图表 2 肠球菌生物膜筛选结果
3.5 脱脂奶粉对生物膜生长的促进结果
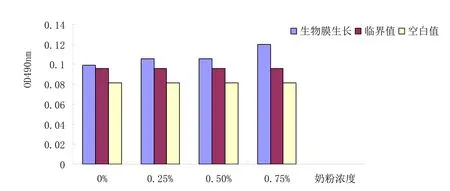
奶粉对肠球菌生物膜生长具有明显的促进作用。研究结果表明添加牛奶能够产生生物膜,不同牛由于基因型变异使酪蛋白的浓度、b和k-casein不同。因此,不同的效率酪蛋白变成提高生物膜的形成表明牛奶主体也可能影响到蛋白质的增长uberis和感染的发展模式。我们曾表明,在美国抗生素耐药性主要由压力UV-1ight等因素诱导诱变。物种的快速适应能力导致DNA损伤。生物膜会造成广泛的遗传多样性被认为是细菌的生存策略,确保各种各样的环境条件。生物膜种群包括与不同的细胞基因型和表型可能。这至少可以部分解释为什么根除环境病原体经常失败。结果见图3

图表 3 加奶粉对肠球菌生物膜影响结果图
3.6 奶粉梯度与时间梯度的探索结果
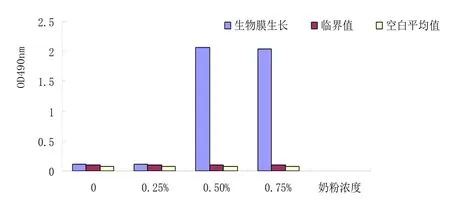
图表 4 肠球菌生物膜在24h生长结果
图表 5 肠球菌生物膜在36h生长结果

图表 6 肠球菌生物膜在48h生长结果
4 结论
依据实验数据分析,可得出如下次结论。
(1)加入奶粉对肠球菌生物膜阳性的细菌具有非常明显的促进作用,但对本身生物膜阴性菌无作用。
(2)肠球菌的最适宜生长条件是:恒温箱37℃培养,培养时间为36h,BHI培养基加入0.5%的奶粉。奶粉浓度继续提高,对结果影响不大,故为了经济原则,培养的最适宜奶粉浓度控制在0.5%,即100mLBHI培养基中加入0.5g奶粉。
(3)肠球菌的生长最好的时间 为36h,此时活菌数最多。在0~36h呈现递增趋势,在36h达到峰值,而在36h以后活菌数递减。至48h肠球菌已近乎全部死亡。
5 讨论
(1)脱脂奶粉中的蛋白质,碳水化合物较全脂奶粉高1/3,钙磷维生素也较全脂奶粉高。故本实验选用脱脂奶粉研究对肠球菌生物膜影响。奶粉中的成分(酪蛋白)对肠球菌生物膜生长具有不同程度促进作用。
(2)根据图5可以得出脱脂奶粉促进肠球菌生物膜生长的最适浓度为0.5%,符合研究。
(3)根据图4,5,6比较可以得出生物膜生长的最适培养时间为36h,符合研究。
[1] 宋恩亮,吴乃科.犊牛腹泻的致病因素及临床治疗[J].动物科学与动物医学,2001,(3):45-46.
[2] 李仲兴.肠球菌感染的研究进展[J].医学综述,2005,(10):938-943.
[3] 李光辉,张婴元.肠球菌感染研究进展[J].国外医学(内科学分册),1999,(11):471.
[4] 陆承平.兽医微生物学[M].北京:中国农业出版社,2007:94-95.

