运动预处理对脑缺血再灌注大鼠缺血半暗区细胞凋亡及相关蛋白P53表达的影响①
吴孝军,叶涛,李宏玉,姜云飞,张中伟,朱路文
运动预处理对脑缺血再灌注大鼠缺血半暗区细胞凋亡及相关蛋白P53表达的影响①
吴孝军1,叶涛1,李宏玉1,姜云飞1,张中伟1,朱路文2
目的探讨运动预处理对脑缺血再灌注大鼠脑组织缺血半暗区细胞凋亡程度及P53蛋白表达的影响。方法36只雄性Sprague-Daw ley大鼠随机分为假手术组、模型组、运动预处理组,每组各12只。采用改良Longa线栓法制备大鼠大脑中动脉阻塞模型(MCAO)。TUNEL法观察缺血半暗区细胞凋亡情况;Western blotting检测缺血半暗区P53蛋白的表达。结果脑缺血再灌注24 h后,模型组TUNEL阳性细胞数较假手术组明显增加(P<0.01),运动预处理组较模型组明显降低(P<0.01);模型组P53蛋白表达明显高于假手术组(P<0.01),运动预处理组明显低于模型组(P<0.01)。结论运动预处理可下调脑缺血再灌注大鼠缺血半暗区P53蛋白的表达,有效抑制缺血半暗区皮层细胞凋亡,发挥脑保护作用。
脑缺血再灌注;运动预处理;细胞凋亡;P53;大鼠
[本文著录格式]吴孝军,叶涛,李宏玉,等.运动预处理对脑缺血再灌注大鼠缺血半暗区细胞凋亡及相关蛋白P53表达的影响[J].中国康复理论与实践,2016,22(10):1117-1120.
CITED AS:Wu XJ,Ye T,LiHY,etal.Effectof exercise preconditioning on apoptosisand expression of P53 in ischemic penumbra in ratsafter cerebral ischem ia-reperfusion[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(10):1117-1120.
缺血性脑卒中(ischem ic stroke)是由于大脑血液供应出现障碍导致局部脑组织缺血、缺氧,进而引起缺血性坏死以及脑软化的一种疾病。通常脑缺血再灌注损伤后神经细胞损伤表现为病理性死亡和生理性死亡两种形式。前者是因为严重的脑组织损伤而导致相对直接的细胞死亡;后者则更多表现为迟发性的神经细胞凋亡,这一过程是由于脑组织损伤激活细胞本身的自杀性程序而产生,且常发生于脑损伤后的缺血半暗区。神经细胞凋亡在脑缺血再灌注引起的脑组织损伤中发挥着重要作用[1-3],如果能有效抑制这一过程的发生将有效降低脑缺血再灌注损伤,因此寻找有效的干预手段成为当今的研究热门方向。运动预处理[4]即在缺血性脑损伤发生之前给予重复多次的运动训练,这一过程可诱导脑缺血耐受,产生脑保护作用。
1 材料与方法
1.1实验动物及分组
清洁级Sprague-Daw ley雄性大鼠36只,鼠龄8~10周,体质量(220±30)g,采购于黑龙江中医药大学动物实验中心,实验动物质量合格证号SYXK(黑)2010007。对所有大鼠称重并进行编号,随机分为假手术组、模型组和运动预处理组,每组各12只。
1.2主要设备与试剂
RM 2265型切片机:德国LEICA。-80℃冰箱:美国。超纯水系统:NW IOLVF,香港。DH36001B电热恒温培养箱:天津市泰斯特仪器有限公司。ZH-PT型动物实验跑台:徐州利华电子科技发展有限公司。WD-9413B凝胶成像分析系统:北京。HPLAS-1000图像分析系统:德国。TUNEL检测试剂盒:罗氏公司。内参抗体β-actin:万类生物科技。P53抗体:武汉博士德生物工程有限公司。羊抗兔IgG-HRP:碧云天公司。
1.3实验方法
1.3.1模型制备与干预
模型组自由活动3周后,参照改良Longa线栓法[5],对大鼠进行大脑中动脉阻塞(m iddle cerebralartery occlusion,MCAO),制备局灶性脑缺血大鼠实验动物模型。造模手术所需的全部器具必须进行严格的无菌消毒。大鼠使用10%水合氯醛300mg/kg腹腔注射麻醉。手术切口位于大鼠颈部正中偏右位置,以便更好暴露颈总动脉(arteria carotis communis,CCA)、颈外动脉(external carotid artery,ECA)以及颈内动脉(internal carotid artery,ICA),而后对CCA及ECA分别进行结扎,还需在CCA主干远端打一活结,在这一活结之后和CCA分叉处以前用动脉夹将CCA主干夹闭,用静脉注射器针头在CCA主干上纵向刺一小口,将浸过蜡的鱼线缓慢经CCA主干插入ICA。以颈内动脉和颈外动脉分叉处作为起点,线栓插入深度为(11±0.5)mm时,如果再进线时感到手下有轻微阻力应马上停止,此时表明线栓已成功经ICA入颅,栓线另一端留在切口之外,切口严格消毒后进行缝合处理。大鼠脑缺血2 h后,缓慢且轻柔地拔出栓线约10 mm进行再灌注。
运动预处理组运动预处理方案与Ding等的研究基本[6-7]一致。实验正式开始前,对所有大鼠进行为期3 d的适应性跑台训练,电动跑台坡度为0°,速度8~10 m/m in,每天持续时间为20m in,如果出现不积极参与训练的大鼠,应该及时剔除,并不断补充符合实验要求的大鼠。正式实验时,运动预处理组大鼠在造模前进行3周的电动跑台训练,每周连续训练6 d,休息1 d。电动跑台坡度为0°,速度12m/m in,每天持续时间30m in,造模方法同模型组。
假手术组造模过程同上,线栓插入深度10mm以内,并且不需要进行拔线处理。
1.3.2取材及标本处理
缺血再灌注24 h后,每组取6只大鼠,4%多聚甲醛PBS缓冲液(pH=7.4,4℃)进行缓慢灌注后快速断头取脑,将完整的大脑浸泡在4%多聚甲醛溶液中固定一夜。第2天将脑组织从视交叉之后1mm继续向后取厚度约为3mm大脑切片,对其进行石蜡包埋等常规处理后备用,主要是用于TUNEL法观察缺血半暗区细胞凋亡情况。对各组其余的6只大鼠迅速断头,在冰板上取鲜脑,分离出右侧大脑皮层,迅速放入-80℃冰箱中冻存备用。
1.4指标检测
1.4.1TUNEL检测缺血半暗区神经细胞凋亡情况
石蜡切片,二甲苯脱蜡,梯度酒精脱水,Proteinase K工作液21~37℃处理15~30m in;制备TUNEL反应混合液;标本与TUNEL反应混合液在暗湿盒中反应,37℃;与converter-POD在暗湿盒中反应,37℃30m in;与DAB底物反应,15~25℃10m in;拍照后苏木素复染,梯度酒精脱水、二甲苯透明、中性树胶封片。光学显微镜观察凋亡细胞数目(/100µm2)。
1.4.2Western blottinng检测缺血半暗区P53蛋白表达
提取蛋白质样品,检测样品蛋白质含量。制备蛋白上样液,组织变性,SDS-PAGE凝胶电泳,凝胶转膜。将一抗(P53抗体,1∶1000),放入一抗工作液中,4℃孵育一夜,TBST清洗3次,每次10min;加二抗(羊抗兔IgG-HRP,1∶3000),将洗净后的一抗反应膜置于二抗工作液中60m in;洗膜除去残留的二抗;曝光和洗片。对胶片进行扫描,然后用凝胶图像处理系统进行分析,计算灰度值。
1.5统计学分析
采用SPSS 22.0软件进行统计处理。所有数据均采用(xˉ±s)表示,组间比较采用ANOVA方差分析、LSD-t两两检验。显著性水平ɑ=0.05。
2 结果
2.1TUNEL染色
实验视野中TUNEL阳性细胞以神经细胞为主,其细胞核着色非常明显,大多呈现为棕黄色。假手术组中,视野下TUNEL检测阳性细胞数可见少许,为正常生理表达。模型组TUNEL阳性细胞数较假手术组明显增加(P<0.01)。与模型组相比,运动预处理组TUNEL阳性细胞数明显减少(P<0.01)。见表1、图1。
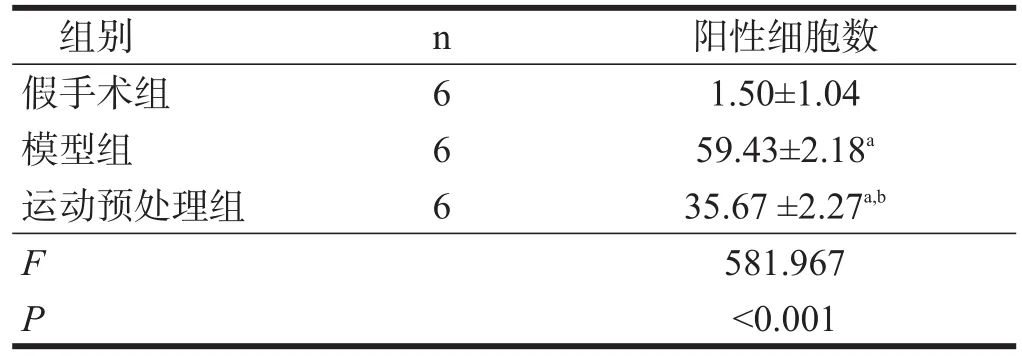
表1 各组缺血半暗带神经元TUNEL阳性细胞计数(/100µm2)
2.2Western blotting
假手术组中大鼠大脑皮层P53蛋白有基础性表达,模型组缺血再灌注24 h后缺血半暗区P53蛋白表达较假手术组明显增高(P<0.01);与模型组相比,运动预处理组缺血半暗区P53蛋白表达明显降低。见表2、图2。

表2 各组大鼠脑组织缺血半暗区P53蛋白的表达
3 讨论
细胞凋亡是细胞的正常生理性活动程序[8]。细胞凋亡的发生与多基因的表达和调控密切相关。研究表明,在脑缺血再灌注损伤过程中,神经元死亡多数为细胞凋亡[9]。通常脑缺血中心区域由于损伤相对较重,因此神经细胞以坏死为主,而细胞凋亡这一过程多发生在缺血中心周围的半暗区。缺血性脑损伤严重程度与细胞凋亡关系非常密切,特别是迟发性神经细胞死亡[10]。既然细胞凋亡在局灶性脑缺血损伤后所引发的迟发性神经细胞死亡过程发挥重要作用,因此如果针对缺血半暗带区采用更多有效的干预方法,充分利用细胞凋亡过程中的可控因素,可以有效减轻细胞凋亡的程度[11]。Mahshid等在大鼠的运动预处理实验中研究发现,运动预处理使缺血性损伤后脑组织海马区残存更多鲜活的神经细胞,缺血性脑损伤后细胞凋亡明显减轻[12]。Zhang等研究发现运动预处理组大鼠脑卒中后的自噬现象明显受到抑制,这一过程有效减轻神经细胞凋亡[13]。综上所述,运动预处理可以作为一种有效的干预手段,发挥其在抑制脑缺血再灌注损伤后的细胞凋亡方面的重要作用。
本实验选用TUNEL法对大鼠的缺血半暗区神经细胞凋亡情况进行检测,在缺血再灌注24 h后,检测发现大鼠脑组织缺血半暗区均存在较为明显的细胞凋亡现象,这与先前相关研究发现的脑缺血再灌注和细胞凋亡具有相关性的结论基本符合。本实验发现,假手术组大鼠仅存在非常少量的细胞凋亡,一般为生理性细胞凋亡现象,在缺血再灌注24 h后模型组大鼠的细胞凋亡程度与假手术组相比较出现明显增加(P<0.01)。与模型组相比,运动预处理组细胞凋亡程度明显减弱(P<0.01)。这说明运动预处理可有效减轻大鼠脑缺血再灌注后的细胞凋亡现象,从而发挥其脑保护作用。

图1 各组缺血半暗带神经元TUNEL阳性细胞表达结果(TUNEL染色,400×)
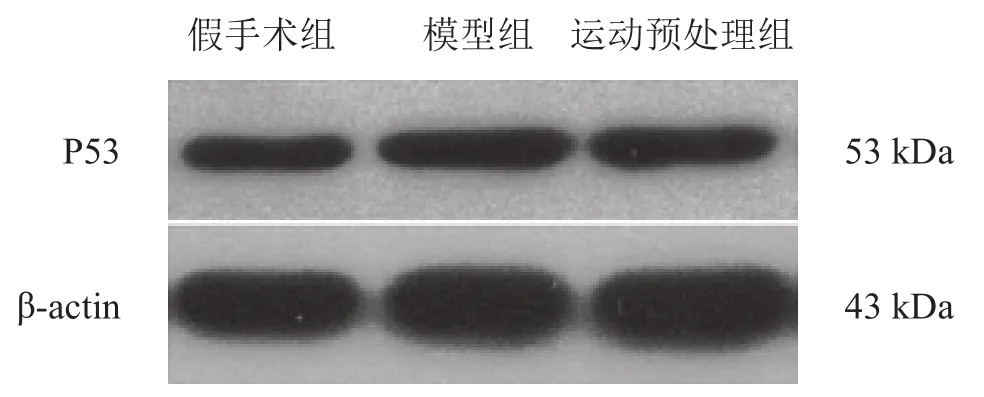
图2 各组大鼠脑组织缺血半暗区P53蛋白Western blotting的表达结果
P53蛋白是调控神经细胞凋亡的重要蛋白,在脑缺血事件发生之初给神经细胞一定的修复时间,但如果修复失败则进入促凋亡程序[14-15]。P53主要以调控其下游相关通路靶蛋白的方式发挥促凋亡作用[16-17]。野生型P53蛋白在脑缺血事件中通常被看作是一种重要的转录因子,其主要作用是调节其他细胞周期中的一些重要的关联蛋白,如增加P21蛋白、Bax蛋白的表达,同时抑制Bcl-2蛋白、Bcl-xl蛋白的表达,以此来加快神经细胞凋亡[18-20]。本实验发现,P53蛋白在脑缺血再灌注发生后开始发挥其转录因子的作用,引起缺血半暗区内细胞凋亡明显增加。运动预处理在脑缺血再灌注24 h后明显抑制P53蛋白的表达,发挥其脑神经保护作用。
运动预处理具体调控脑缺血再灌注损伤后细胞凋亡过程的分子机制还不是十分明确。本实验发现运动预处理可有效抑制脑缺血再灌注损伤后细胞凋亡现象,这一机制的产生可能与抑制P53蛋白的表达密切相关。今后我们将在之前的研究基础上,引入相关蛋白抑制剂,同时检测P53下游通路的靶蛋白的具体表达,对运动预处理产生的脑神经保护作用展开更加广泛而透彻的分析,为运动预处理全面应用于临床创造更多的理论支持,使其更好地应用于脑缺血再灌注后脑组织损伤的防治,造福更多患者。
[1]Broughton BRS,Reutens DC,Sobey CG.Apoptotic mechanisms after cerebral ischem ia[J].Stroke,2009,40(5):e331-e339.
[2]Niizuma K,Yoshioka H,Chen H,et al.Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischem ia[J].Biochim BiophysActa,2010,1802(1):92-99.
[3]Zhang F,YinW,Chen J.Apoptosis in cerebral ischemia:executional and regulatory signaling mechanisms[J].Neurol Res,2004,26(8):835-845.
[4]Zhang F,Wu Y,Jia J.Exercise preconditioning and brain ischem ic tolerance[J].Neuroscience,2011,177(177):170-176.
[5]Longa EZ,Weinstein PR,Carlson S,et al.Reversiblemiddle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(20):84-91.
[6]Ding Y,Li J,Luan X,et al.Exercise pre-conditioning reduces brain damage in ischemic rats thatmay be associated with regional angiogenesis and cellular overexpression of neurotrophin[J].Neuroscience,2004,124(3):583-591.
[7]Ding YH,Li J,YaoWX,etal.Exercise preconditioning upregulates cerebral integrins and enhances cerebrovascular integrity in ischemic rats[J].Acta Neuropathol,2006,112(1):74-84.
[8]张雅丽,高维娟,闫凤霞,等.黄芪注射液抑制缺氧缺糖后复氧复糖大鼠海马神经细胞凋亡的研究[J].中国老年学杂志,2009,29(7):793-796.
[9]Segura T,Calleja S,Jordan J.Recommendations and treatment strategies for themanagementof acute ischemic stroke[J].ExpertOpin Pharmacother,2008,9(7):1071-1085.
[10]吴伟,史继新.脑缺血再灌注损伤后神经元损伤机制及治疗研究进展[J].中国微循环,2003,7(6):391-394.
[11]富苏,韩经丹,周杰,等.通络化痰胶囊对脑缺血损伤大鼠神经细胞凋亡及Bcl-2,Bax的影响[J].中国实验方剂学杂志,2013,19(8):242-246.
[12]Mahshid T,Mohammad A,MehdiA,etal.Exercise preconditioning improves behavioral functions follow ing transient cerebral ischemia induced by 4-vessel occlusion(4-VO)in rats[J]. Arch Iran Med,2013,16(12):697-704.
[13]Zhang L,Hu X,Jing L,etal.Physicalexercise improves functional recovery throughmitigation of autophagy,attenuation of apoptosis and enhancement of neurogenesis after MCAO in rats[J].BMCNeurosci,2013,14(1):1-8.
[14]Leker RR,Aharonow izM,Greig NH,etal.The roleof p53-induced apoptosis in cerebral ischemia:effects of the p53 inhibitor pifithrin alpha[J].Exp Neurol,2004,187(2):478-486.
[15]Culmsee C,Siewe J,Junker V,et al.Reciprocal inhibition of p53 and nuclear factor-kB transcriptional activities determines cell survival or death in neurons[J].JNeurosci,2003,23(24):8586-8595.
[16]LiT,Liu X,Jiang L,etal.Lossof p53-mediated cell-cycle arrest,senescence and apoptosis promotes genomic instability and prematureaging[J].Oncotarget,2016,7(11):11838-11849.
[17]Cregan SP,Maclaurin JG,Craig CG,etal.Bax-dependentcaspase-3 activation is a key determinant in p53-induced apoptosis in neurons[J].JNeurosci,1999,19(18):7860-7869.
[18]Humpton TJ,Vousden KH.Regulation of Cellular Metabolism and Hypoxia by p53[J].Cold Spring Harb PerspectMed,2016,6(7):a026146.
[19]Temiz P,AkkaşG,Neşe N,et al.Determination of apoptosis and cell cyclemodulators(p16,p21,p27,p53,BCL-2,Bax,BCL-xL,and cyclin D1)in thyroid follicular carcinoma,follicular adenoma,and adenomatous nodules via a tissuem icroarraymethod[J].Turk JMed Sci,2015,45(4):865-871.
[20]Ou X,Lu Y,Liao L,etal.Nitidine chloride induces apoptosis in human hepatocellular carcinoma cells through a pathway involving p53,p21,Bax and Bcl-2[J].Oncol Rep,2015,33(3):1264-1274.
Effect of Exercise Preconditioning on Apop tosis and Expression of P53 in Ischem ic Penumbra in Rats after Cerebral Ischem ia-Reperfusion
WU Xiɑo-jun1,YETɑo1,LIHong-yu1,JIANG Yun-fei1,ZHANG Zhong-wei1,ZHU Lu-wen2
1.Heilongjiang University of ChineseMedicine,Heilongjiang,Harbin 150040,China;2.The Second HospitalAffiliated to Heilongjiang University of ChineseMedicine,Heilongjiang,Harbin 150001,China
Correspondence to ZHU Lu-wen.E-mail:zhuluwen1983@126.com
Objective To explore the effectof exercise preconditioning on apoptosis and expression of P53 protein in ischem ic penumbra in rats after cerebral ischem ia-reperfusion.Methods Thirty-six Sprague-Daw ley ratswere random ly divided into sham group,model group and exercise preconditioning group,with twelve rats in each group.Themiddle cerebral artery occlusion(MCAO)modelwas established withmodified Longa'smethod.TUNELmethod was used to observe the apoptosisof neural cells in the ischemic penumbra.Western blottingwasused to detect theexpression of P53 protein in the ischem ic penumbra.Results Twenty-fourhoursafter cerebral ischemia-reperfusion,the number of TUNEL positive cellswasmore in themodelgroup than in the sham group(P<0.01),and was less in the exercise preconditioning group than in themodelgroup(P<0.01).The expression of P53 protein was higher in themodel group than in the sham group (P<0.01),and was lower in the exercise preconditioning group than in themodel group(P<0.01).Conclusion Exercise preconditioning coud down-regulate theexpression of P53 protein in the ischem ic penumbra,and inhibit theapoptosisof cortical cells.
cerebral ischem ia-reperfusion;exercise preconditioning;apoptosis;P53;rats
10.3969/j.issn.1006-9771.2016.10.001
R743.3
A
1006-9771(2016)10-1117-04
1.国家自然科学基金项目(No.81503666);2.黑龙江省自然科学基金项目(No.QC2015103);3.哈尔滨市科技创新人才专项基金项目(青年后备人)(No.2014RFQGJ150);4.黑龙江中医药大学研究生科研创新项目(No.2015-33)。
1.黑龙江中医药大学,黑龙江哈尔滨市150040;2.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市150001。作者简介:吴孝军(1990-),男,汉族,辽宁辽阳市人,硕士研究生,主要研究方向:脑卒中中医康复的基础研究。通讯作者:朱路文(1983-),男,汉族,山东邹城市人,博士,主治医师,主要研究方向:神经系统疾病中医康复基础与临床。E-mail:zhuluwen1983@126.com。
为了研究运动预处理保护作用与半暗区的关系,本实验以神经细胞凋亡及凋亡相关蛋白表达为指标,观察运动预处理对局灶性脑缺血再灌注半暗区的影响,深入探讨运动预处理作用机制,为临床提供有意义的实验依据。
(2016-05-16
2016-07-22)

