液相芯片技术同时检测莱克多巴胺、盐酸克伦特罗和沙丁胺醇
梁世正 潘家荣


摘 要 建立了一种同时检测兽药莱克多巴胺(RAC)、克伦特罗(CL)、沙丁胺醇(SAL)的多残留的新方法。采用液相悬浮芯片技术,基于间接竞争法的原理,将3种兽药抗原分别偶联到不同的荧光微球上作为探针,以藻红蛋白(PE)荧光标记二抗为信号,通过优化实验条件,分别建立3种兽药的标准曲线。基于特异性识别实验,建立3种兽药同时检测的标准曲线。结果表明,同时检测的3条曲线均呈现良好的线性相关,线性相关系数(R2)均大于0.99,RAC, CL和SAL的检测范围分别为1~500 μg/L, 0.1~500 μg/L, 1~100 μg/L,检出限分别为0.68, 0.095和0.88 μg/L。与其它结构类似物的交叉反应率均低于1.5%,实际样品中的加标回收率令人满意。
关键词 液相芯片技术;多残留分析;莱克多巴胺;克伦特罗;沙丁胺醇
1 引 言
由于“瘦肉精”具有明显的促生长、提高瘦肉率及减少脂肪的效果,近年来常发生违法使用“瘦肉精”事件[1]。非法添加的“瘦肉精”以莱克多巴胺(RAC)、克伦特罗(CL)、沙丁胺醇(SAL)较为常见,2012年中华人民共和国农业部1682号公告将其均列为“瘦肉精”,以加强监测。“瘦肉精”不仅危害消费者身体健康,可引起中毒,严重者甚至可引起死亡,同时也被世界反兴奋剂机构列为运动员禁用的兴奋剂[2,3]。因此大力研发“瘦肉精”残留检测技术具有非常重要的现实意义。
现有RAC、CL和SAL等“瘦肉精”的快速检测方法主要有酶联免疫法[4,5]、胶体金法[6]、化学发光酶免疫法[7]、传感器技术[8]、表面增强拉曼光谱技术[9]等,但上述方法通常只能针对一种物质检测。文献报道的多残留检测技术,也只针对这3种物质的总量测定[10,11]。在多残留同时分析中,更多采用的是液相色谱法[ 12,13]、气相色谱质谱联用法[ 14]和液相色谱质谱联用法[ 15,16]、毛细管电泳法[17]等,这些方法虽然灵敏度较高,但普遍存在样品前处理复杂、耗时长的不足,在检测样品量较大时尤为突出。
液相芯片技术(Suspension array technology,SAT)是20世纪末开发的基于荧光微球的多功能分析平台,也是唯一经美国食品与药品管理局批准应用于临床诊断的新型生物芯片产品[18]。它具有灵敏度高、检测速度快、灵活性强的优点,可在2~3 h内对大量样品的多种成分进行筛选分析,主要用于核酸和蛋白质检测,如病原体检测、核酸测定、细胞因子测定、肿瘤标记物测定等[19~22]。基于农兽药的抗原及抗体,也已经建立了农兽药残留液相芯片技术检测方法[23~26]。然而,同时检测这3种瘦肉精的研究尚未见报道。本研究结合液相芯片技术的优点,借鉴间接竞争酶联免疫吸附分析法的原理,以藻红蛋白标记二抗为报告分子,实现对RAC、CL和SAL同时快速检测, 也为其它兽药残留的检测提供了新思路。
2 实验部分
2.1 仪器与试剂
Luminex 200液相悬浮芯片系统(美国Luminex公司);4625型孔板振荡器;ST16R冷冻离心机(美国Thermo公司);WP6122050抽滤装置(美国Millipore公司)。
编号No.18、No.20和No.29的微球(美国Luminex公司);盐酸莱克多巴胺、盐酸克伦特罗、硫酸沙丁胺醇、西马特罗、马布特罗、盐酸齐帕特罗等标准品购自德国Dr. Ehrenstofer公司;牛血清蛋白BSA(美国Sigma公司);1.2 μm 96孔过滤板(美国Millipore公司);RAC、CL和SAL的抗原及其单克隆抗体购自中检维康公司; PE标记二抗购自上海绘辛公司。其余试剂均为国产分析纯;猪肉购自当地超市。
活化缓冲液:0.1 mol/L NaH2PO4Na2HPO4,pH 6.2。磷酸盐缓冲液(PBS,pH 7.4):138 mmol/L NaCl,2.7 mmol/L KCl,8 mmol/L Na2HPO4, 1.5 mmol/L KH2PO4。洗涤缓冲液:PBS,0.05% Tween20,pH 7.4。分析缓冲液:PBS,1% BSA,pH 7.4。储存缓冲液:PBS,0.1% BSA,0.02% Tween20,0.05%叠氮化钠,pH 7.4。
2.2 实验方法
2.2.1 实验原理 Luminex微球用荧光染料进行编码,通过调节两种荧光染料的配比获得100种不同特征光谱的微球[27]。首先将3种瘦肉精抗原分别共价交联到3种微球表面。类似间接竞争法原理,以微球为固相载体,样品中的兽药分子、微球上的兽药抗原竞争结合兽药抗体,再用抽滤方式除去未结合物质,结合上报告分子(PE荧光标记二抗)。悬浮芯片系统中有两个激光发射器,红色激光可以一次性激发荧光微球上的两种荧光染料,荧光信号被两个光电二极管所识别,根据荧光图谱不同确定微球编号,进而确定微球上偶联的探针,达到定性分析的目的;另一个激发报告分子,该荧光信号被光电倍增管识别,通过量化微球上结合的报告信号,即中位荧光强度值(Mean fluorescent intensity, MFI),实现定量分析,如图1所示。
2.2.2 实验步骤 (1)取出偶联微球,恢复至室温后漩涡30 s,超声处理10 s。 (2)1.2 μm的96孔过滤板中加入100 μL PBS预湿实验孔。抽去孔内液体,每孔中加入适量预混好的偶联微球(每种约2000个),用150 μL PBS洗涤两次后。将适量标准品或样品分别加入合适的孔中,空白孔加入等量PBS,再加入适量的各种抗体,用PBS补齐各孔至100 μL。 (3)用移液器反复抽吸混匀孔内溶液,避光条件下37℃振荡60 min。 (4)反应完毕后,抽去孔内液体,用150 μL PBS洗涤两次。 (5)每孔中加入100 μL经适当稀释的PE标记二抗,移液器反复抽吸混匀。 (6)避光条件下, 37℃振荡45 min后,抽去孔内液体,用150 μL PBS洗涤两次。 (7)加入100 μL PBS,重悬浮微球并混匀,置于液相芯片系统进行测试,每种微球读取100个。
2.3 实验条件优化以及标准曲线的建立
2.3.1 最佳抗原加入量 参照Luminex公司提供的蛋白质偶联方法[23]并优化: 取微球100 μL(1.25×106个/mL)置于EP管,14000 g离心5 min,弃上清液。加入活化缓冲液,振荡和超声各30 s, 重悬,再加入50 mg/mL NHS和EDC各50 μL, 混匀, 37℃振荡20 min。离心弃上清液, 用PBS洗涤3次,加入150 μL PBS重悬,再加入抗原,用PBS补齐至500 μL,37℃振荡6 h。离心弃上清液后,用1% BSA封闭,储存缓冲液保存。抗原加入量分别为1, 2, 4, 8和10 ng。其中,微球No.18, No.20, No.29分别偶联RAC抗原、CL抗原和SAL抗原。
2.3.2 最佳抗体加入量 按照2.2.2节方法,在不加样品和标准品情况下,分别加入对应抗体1, 5, 10, 20和40 ng,加入过量的PE标记二抗,采用液相芯片系统测试。
2.3.3 单一标准曲线建立 3种标准品按照一定比例稀释成梯度液,采用液相芯片系统测试。按照ELISA所采用的抑制率计算方式(抑制率B =(A1-An)/A1,其中, A1为不加样品孔MFI值; An为加标准品或者样品孔MFI值),将各孔MFI值换算成抑制率,以抑制率为纵坐标,浓度的对数值为横坐标,建立RAC, CL, SAL的单一标准曲线。
2.3.4 特异性识别实验 参照文献[28]的高通量检测的特异性识别实验方法,测试所制备的荧光微球表面的抗原是否能被各自的抗体特异性识别。按照2.2.2节实验步骤,其中,1, 2, 3号孔分别加入偶联抗原的微球No.18, No.20, No.29和对应的最佳抗体加入量,4号孔加入3种偶联抗原的微球和对应的最佳抗体加入量。5, 6, 7号孔仅分别比1, 2, 3号孔多加入对应的过量标准品,8号则比4号多加入过量的3种标准品。8个孔均加入适当PE标记二抗反应后,采用液相芯片系统测试。
2.3.5 多元标准曲线建立 将3种偶联微球等数量混合后,按照2.2.2节,每孔加入偶联好微球混合液(每种微球约2000个),再加入按照一定比例稀释的3种标准品,采用液相芯片系统测试。
2.4 交叉反应性
分别对RAC、CL、SAL、西马特罗、马布特罗和盐酸齐帕特罗进行交叉反应性测试,以结构类似物浓度对数值为横坐标,抑制率为纵坐标,建立标准曲线,计算IC50,按照交叉反应率公式[29](交叉反应率为目标物IC50与结构类似物IC50的百分比)计算结果。
2.5 加标回收实验
参照文献[30]的样品前处理方法,在已知量的猪肉组织样品中,加入标准品后充分绞碎;准确称取2.0 g,加入6 mL乙腈0.1 mol/L HCl(84∶16, V/V), 振荡离心;用正己烷萃取3次后旋蒸至近干,用纯水定容至1 mL。分别测试添加浓度为1, 5, 10和50 ng/g的RAC, CL和SAL单标和混标时的回收率。
3 结果与讨论
3.1 抗原加入量优化
如图2所示,起初随着抗原加入量增加,MFI值逐渐升高,这是因为微球表面上的位点越来越多地被抗原占据。随后,随着抗原加入量增加时,MFI值反而降低,这可能是由于微球表面结合过多抗原,形成空间位阻,不利于抗体的结合[23]。以MFI最高时的抗原量为最佳加入量,即SAL, CL, RAC分别为2, 4和4 μg。
3.2 抗体加入量优化
如图3所示,低浓度时,随着抗体加入量增加,MFI值迅速升高。抗体量增大一定值后, 3种抗体的
MFI值均趋于平稳,此时兽药抗原的位点已被全部占据[23]。选择MFI的拐点为最佳抗体加入量,因为
此时靶标物和探针竞争结合兽药抗体的竞争结果变化最显著,同时考虑节省抗体,SAL, CL和RAC的
抗体加入量分别为10, 20和5 ng。
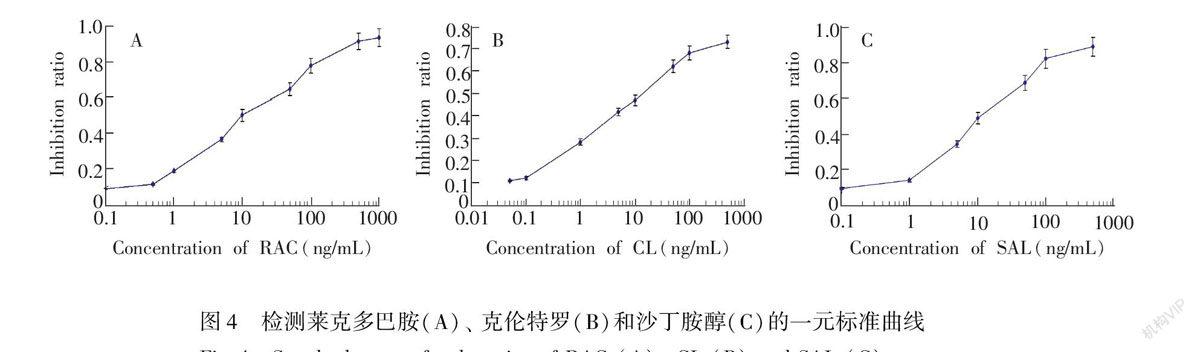
3.3 一元标准曲线建立
在最佳实验条件下,建立了3种瘦肉精的一元标准曲线。在一定浓度范围内,抑制率与3种瘦肉精浓度呈现良好的线性关系。 RAC(图4A)的线性方程为y=0.2733x+0.1933,R2=0.9933,线性范围0.5~500 ng/mL,IC10=0.456 ng/mL。CL(图4B)的线性方程为y=0.1881x+0.2929,R2=0.9961,线性范围0.1~100 ng/mL,IC10=0.094 ng/mL。SAL(图4C)的线性方程为y=0.3376x+0.1302,R2=0.9943,线性范围为1~500 ng/mL,IC10=0.814 ng/mL。3种兽药的检出限均低于1 ng/mL,表现出较高的灵敏度。
图4 检测莱克多巴胺(A)、 克伦特罗(B)和沙丁胺醇(C)的一元标准曲线
Fig.4 Standard curves for detection of RAC (A), CL (B) and SAL (C)
3.4 特异性识别实验
特异性识别实验结果如图5所示,利用软件SPSS19的单样本t检验方法对数据进行分析。4号孔的No.18, No.20, No.29的MFI分别与1, 2, 3号孔的MFI对比,p>0.05,无显著性差异,说明各兽药抗体均能特异性识别其对应微球上的兽药抗原,而与其它兽药抗原无明显交叉反应。同样, 8号孔与5, 6, 7号孔对比,p>0.05,无显著性差异,说明在竞争条件下,兽药仍能特异性识别对应微球上的兽药抗原,而不会干扰其它兽药抗体与对应微球上的兽药微球结合。而4号孔与8号孔对比,p<0.05,差异性显著,说明加入标准品后,标准品能与微球上的兽药抗原显著竞争兽药抗体。以上结果表明,在混合体系中,3种抗体均能准确特异性识别各自的探针,各抗体与其它探针和标准品几乎不结合,无明显干扰,因此,可以实现RAC, CL和SAL的多元分析。
3.5 多元标准曲线建立
以抑制率为纵坐标,标准物浓度对数值为横坐标,建立多元标准曲线,如图6所示。3条曲线的参数如表1所示,R2﹥0.99,但略小于单一标准曲线,检测范围及检出限均也均有细小差别。一方面,目
标物增加后,反应体系变得更复杂,虽然3种目标物同时检测时无明显干扰,但微小的干扰仍难以避免。此外,3种物质均为β2受体激动剂,结构相似,存在极低的交叉反应率,会影响检测范围及检出限。与进出口标准中RAC, CL, SAL的检出限(分别为0.5, 0.05和0.5μg/kg)相比[31],本分析方法灵敏度高,检测范围更宽。
3.6 回收率
RAC, CL和SAL的添加浓度均为1, 5, 10和50 ng/g时,分别测试猪肉样品中3种物质的回收率,结果见表2和表3。可见对于单标和混标样品,添加回收率均在80%~115%之间。
3.7 交叉反应测试
分别对RAC、CL、SAL、西马特罗、马布特罗和盐酸齐帕特罗进行测试,结果如表4所示,对所测的几种结构类似物的交叉反应率均低于1.5%,表明本方法交叉反应率低,特异性强,可用于RAC, CL, SAL多残留检测。
4 结 论
研究结果表明,本方法具有通量高、灵敏度高、特异性强、检测速度快的优点,实现了RAC, CL和SAL的多残留分析,为研制多残留检测的商业化试剂盒奠定了基础。
References
1 ZHOU JingBo, ZHANG YuGuang, ZHANG JianXun. Modern Journal of Animal Husbandry and Veterinary Medicine, 2013, (8): 1-4
周景博, 张宇光, 张建勋. 现代畜牧兽医, 2013, (8): 1-4
2 HU Ping, YU ShaoWen, LI Hong, CHENG Bin, LIU SiLe. Journal of Shenzhen University Science and Engineering, 2008, 25(1): 1-8
胡 萍, 余少文, 李 红, 成 斌, 刘思乐. 深圳大学学报(理工版), 2008, 25(1): 1-8
3 LUAN ZhaoQian, ZHANG YiNong, WANG XinZhai. China Sports Coaches, 2012, (2): 38-39
栾兆倩, 张亦农, 王新宅. 中国体育教练员, 2012, (2): 38-39
4 Li X, Zhang G, Deng R, Yang Y, Liu Q, Xiao Z, Yang J, Xing G, Zhao D, Cai S. Food Addit. Contam., 2010, 27(8): 1096-1103
5 Ren X, Zhang F, Chen F, Yang T. Food Agr. Immunol., 2009, 20(4): 333-344
6 LI JunHua, LI ChunSheng, ZHANG XingWei, FANG BaoLing, CHENG Hua, WU Meng. Animal Husbandry & Veterinary Medicine, 2013, 45(4): 71-73
李君华, 李春生, 张星炜, 房宝玲, 程 华, 吴 萌. 畜牧与兽医, 2013, 45(4): 71-73
7 XU ChuanLai, PENG ChiFang, HAO Kai, JIN ZhengYu, WANG WuKang. Chinese J. Anal. Chem., 2005, 33(5): 699-702
胥传来, 彭池方, 郝 凯, 金征宇 王武康. 分析化学, 2005, 33(5): 699-702
8 QI YuBing, LIU Ying, SONGQiJun. Chinese J. Anal. Chem., 2005, 33(5): 1053-1057
齐玉冰, 刘 瑛, 宋启军. 分析化学, 2005, 33(5): 1053-1057
9 ZHAI FuLi, HUANG YiQun, WANG XiChang, LAI KeQiang. Chinese J. Anal. Chem., 2012, 40(5): 718-723
翟福丽, 黄轶群, 王锡昌, 赖克强. 分析化学, 2012, 40(5): 718-723
10 Wang H, Zhang Y, Li H, Du B, Ma H, Wu D, Wei Q. Biosens. Bioelectron., 2013, (49): 14-19
11 WANG WeiYu, ZHANG YuLian, XING XiaoPing, WANG JinYan, SHI Xue, YE JianNong. Chinese Journal of Chromatography, 2008, 26(2): 228-231
王伟宇, 张玉莲, 邢晓平, 王金妍, 石 雪, 叶建农. 色谱, 2008, 26(2): 228-231
12 AN HongZhe, ZHANG SuXia, SHEN JianZhong, CHENG LinLi, LIU JinFeng. Feed Industry, 2008, 29(6): 54-56
安洪泽, 张素霞, 沈建忠, 程林丽, 刘金凤. 饲料工业, 2008, 29(6): 54-56
13 Du W, Zhang S, Fu Q, Zhao G, Chang C. Biomed. Chromatogr., 2013, 27(12): 1775-1781
14 Wang L, Li Y, Zhou Y, Yang Y. Chromatographia, 2010, 71(78): 737-739
15 WANG Hui, PENG XinKai, WANG YuZhi, XIA LiXin, ZENG Huan. Journal of Analytical Science, 2012, 31(5): 509-516
汪 辉, 彭新凯, 王玉枝, 夏立新, 曾 欢. 分析测试学报, 2012, 31(5): 509-516
16 WANG FengMei, ZHANG HongWei, PANG ShiPing, TANG ZhiXu, NIU ZengYuan, LUO Xin. Chinese J. Anal. Chem., 2008, 36(12): 1629-1635
王凤美, 张鸿伟, 庞士平, 汤志旭, 牛增元, 罗 忻. 分析化学, 2008, 36(12): 1629-1635
17 Somsak S, Proespichaya K. Talanta, 2008, 76(5): 1194-1198
18 Brett H. Arch. Physiol. Biochem., 2012, 118(4): 192-196
19 vander Wal F J, Achterberg R P, Kant A, Maassen C B M. Vet. J., 2013, 196(3): 439-444
20 Dunbar S A. Clinica Chim. Acta, 2006, 363(12): 71-82
21 Ibrahim J N, Jounblat R, Delwail A, AbouGhoch J, Salem N, Chouery E, Megarbane A, MedlejHashim M, Lecron J C. Cytokine, 2014, 69(2): 248-254
22 Miriam R, Jonathan D, Tim W,Jürgen K, Martin S, Nicoline H, Elke J, Matthias K, Magnus von K D. Cancer Immunol. Immun., 2014, 63(12): 1251-1259
23 Liu N, Su P, Gao Z, Zhu M, Yang Z, Pan X, Fang Y, Chao F. Anal. Chim. Acta, 2009, 632(1): 128-134
24 Su P, Liu N, Zhu M X, Ning B A, Liu M, Yang Z H, Pan X J, Gao Z X. Talanta, 2011, 85(2): 1160-1165
25 Wang Y F, Wang D N, Zou M Q, Jin Y, Yun C L, Gao X W. Anal. Lett., 2012, 44(16): 2711-2720
26 Guo Y R, Jie T, Liang C Z, Zhu G N, Gui W J. Microchim. Acta, 2013, 180(56): 387-395
27 CHENG Tao, WANG HuiYu, MEI Lin, HAN XueQing. Biotechnology Bulletin, 2011, (9): 48-51
程 涛, 王慧煜, 梅 琳, 韩雪清. 生物技术通报, 2011, (9): 48-51
28 Liu N, Gao Z, Ma H, Su P, Ma X, Li X, Ou G. Biosens. Bioelectron., 2013, 41: 710-716
29 CAI QinRen, ZENG ZhenLing, YANG GuiXiang, CHEN ZhangLiu, FANG BingHu. Scientia Agricultura Sinica, 2004, 37(7): 1060-1064
蔡勤仁, 曾振灵, 杨桂香, 陈杖榴, 方炳虎. 中国农业科学, 2004, 37(7): 1060-1064
30 XIAO XiaoHua, ZHOU Si, LI GongKe. Journal of Food Safety and Quality, 2012, 3(5): 485-489
肖小华, 周 思, 李攻科. 食品安全质量检测学报, 2012, 3(5): 485-489
31 SN/T 19242011, Determination of Clenbuterol, Ractopamine, Salbutemol, and Terbutalin Residues in Foodstuffs of Animal Origin for Import and Export HPLCMS/MS. Industry Standard of Entryexit Inspection and Quarantine of the People′s Republic of China
进出口动物源食品中克伦特罗、莱克多巴胺、沙丁胺醇和特布他林残留量的测定液相色谱质谱/质谱法. 中华人民共和国出入境检验检疫行业标准. SN/T 19242011

