关于化学反应限度演示实验的进一步探究
李军
关于化学反应限度演示实验的进一步探究
李军
(如皋市搬经中学江苏如皋226511)
苏教版《化学2》“探究化学反应限度”的实验,最后向上层清液试样中滴入3滴KSCN溶液,溶液略显红色,明显弱于预期。怎样才能避免这种现象的产生?作者通过理论探究和实验探究得知:随着加入的FeCl3溶液用量的逐渐增大,最终所得上层清液中Fe3+的浓度也逐渐增大,实验的现象也随之越来越符合预期。随后提出对本实验的改进意见。
高中化学;教材;化学反应限度;实验探究
一、问题的发现
在进行人教版《化学2》“化学反应限度”教学时,为了帮助学生更好地建构可逆反应、化学反应限度概念,笔者借用了苏教版《化学2》“探究化学反应限度”的实验,组织学生进行了分组实验,学生兴趣盎然,课堂评价和课后反馈也显示出宏观表征的强化确实收到了较好的教学效果。但也有美中不足之处,不少学生在向经过萃取后的上层清液试样中加入硫氰化钾溶液后,并没有明显的血红色产生,部分学生出于对硫氰化钾试剂的条件反射,勉强给出了溶液中含有铁离子的结论,也有学生认为试剂可能因放置较久而失效,从而使得实验现象不够明显。事实上,将实验中使用的硫氰化钾溶液滴加到少量氯化铁试剂中,立即有明显的血红色产生,说明试剂并未变质。那么出现这种现象的原因到底是什么?怎样才能避免这种现象的产生?为此,笔者对该实验进行了一次深入探究。
二、科学探究
1.猜想与假设
首先将该实验过程全景还原,先向5mL0.1mol/L KI溶液中滴加6滴0.1mol/LFeCl3溶液,充分振荡后静置片刻,溶液变为棕黄色,实验现象符合预期,说明有I2生成,此时发生反应2Fe3++2I-⇌2Fe2++I2。再向反应体系中加入2mL四氯化碳萃取I2以免对后继步骤产生颜色干扰,充分振荡静置后,下层液体呈紫红色,上层液体呈浅棕色,也达到了实验预期。
最后向上层清液试样中滴入3滴KSCN溶液,溶液略显红色,明显弱于预期。主要问题出在第三步,对照原理Fe3++nSCN-⇌[Fe(SCN)n]3-n,引出猜想:Fe3+浓度太低,导致现象与预期不符。
2.理论探究
为了避免实验的盲目性,同时发挥理论对实践的指导作用,接下来笔者认真查阅了相关的书籍资料,得到一些重要的数据和信息。查阅分析化学相关内容可得:当溶液中Fe3+浓度低于5ppm时,SCN-不再能检验出Fe3+。查阅普通无机化学可得:Eθ(Fe3+/Fe2+)=0.7710V,Eθ(I2/I-)=0.5355V,利用△Gθ=-RTlnKθ=-2.303RTlgKθ=-nFEθ,代入相关数据计算,具体过程如下:
Eθ=Eθ(Fe3+/Fe2+)-Eθ(I2/I-)=0.7710V-0.5355V=0.2355V,
lgKθ=nFEθ/(2.303RT)=96500×0.2355/(2.303× 8.314×298),
可得Kθ=9819
c(Fe3+)=c(Fe2+)/(c(I-)Kθ),
若反应完全,易知c(Fe2+)=5.6603×10-3mol/L,c(I-)=8.8679×10-2mol/L,
c(Fe2+)/(c(I-)Kθ)=6.5006×10-6
故可得c(Fe3+)<6.5006×10-6mol/L≈0.364ppm<5ppm
通过周密细致的理论分析,原先的猜想“实验现象与预期不符是因为Fe3+浓度过低”从理论上成立,但实践是检验真理的唯一标准,所以猜想是否真正成立,还需接受实践的检验。
3.实验探究
为此,围绕猜想,笔者考虑通过在合理范围内改变Fe3+用量的方法来改变最终所得的上层清液中Fe3+浓度,设计三个对比组的实验来进行实践。
第一组向5mL0.1mol/LKI溶液中滴加1mL 0.1mol/LFeCl3溶液,充分振荡后静置片刻,溶液变为棕黄色,再向反应体系中加入2mL四氯化碳萃取I2,充分振荡静置后,下层液体呈紫红色,上层液体呈浅棕色,最后向上层清液试样中滴入3滴KSCN溶液,溶液略显红色,依然弱于预期。
第二组向5mL0.1mol/LKI溶液中滴加2mL 0.1mol/LFeCl3溶液,充分振荡后静置片刻,溶液变为棕黄色,再向反应体系中加入2mL四氯化碳萃取I2,充分振荡静置后,下层液体呈紫红色,上层液体呈浅棕色,最后向上层清液试样中滴入3滴KSCN溶液,溶液略浅于血红色,基本符合预期。
第三组向5mL0.1mol/LKI溶液中滴加3mL 0.1mol/LFeCl3溶液,充分振荡后静置片刻,溶液变为棕黄色,再向反应体系中加入2mL四氯化碳萃取I2,充分振荡静置后,下层液体呈紫红色,上层液体呈棕红色,最后向上层清液试样中滴入3滴KSCN溶液,溶液呈血红色,符合预期。
将上述三组实验数据对比可知,确实随着加入的FeCl3溶液用量的逐渐增大,最终所得上层清液中Fe3+的浓度也逐渐增大,实验的现象也随之越来越符合预期。不仅如此,实践过程还使我们获得了一些第一手的数据材料:当加入的FeCl3溶液体积达到2mL及以上时,加入KSCN溶液就会有血红色产生。
三、实验改进
探究实践中获得的数据虽然还略显粗糙,但也使我们对于本实验的认识从定性上升到定量,为我们对实验最佳条件的选择提供了依据和可能,对于本实验在滴加FeCl3溶液体积量度上略加改变,即增加到2mL及以上,就可以取得较好的实验效果。那么还有没有其他方法呢?
回到理论分析的过程中,因为Fe3+浓度过低,导致KSCN溶液检验失败,如果能找到合适试剂,使其遇到该浓度下的Fe3+,依然有明显的现象,如沉淀、特征颜色等,不也同样可以起到检验Fe3+的目的吗?亚铁氰化钾[化学式为K4Fe(CN)6,俗称黄血盐,常用作除铁剂]就不失为一种较为理想的试剂,其原理如下:
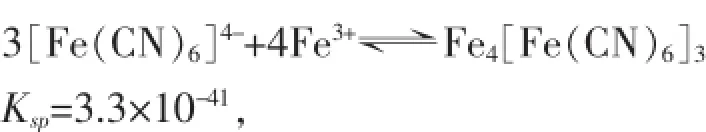
由此可知,Ksp=(c([Fe(CN)6]4-))3×(c(Fe3+))4=3.3×10-41
c([Fe(CN)6]4-)=3.3×10-41/(c(Fe3+))4>3.3×10-41/(6.5006×10-6)4=1.1660×10-10mol/L
进一步的理论分析表明,只要将“滴加3滴KSCN溶液”改进为“滴加3滴K4Fe(CN)6溶液”,上层清液中应该就会有蓝色沉淀普鲁士蓝产生。随后的实验验证也证实了这一点,该反应现象明显、灵敏度高,CN-与Fe2+结合稳固,试剂毒性极低,安全性上佳,确实也非常适合改进本实验。
四、结语
教材是教学的重要资源,但教材并不是教学的唯一资源,高中化学现行教材体系有三个现行版本,在设计思路、设计风格上各有所长、各具特色,教师完全可以在深入研究三套教材的基础上取长补短、优化组合,真正做到变“教好教材”为“用好教材”。对于教材上所述内容,也不能盲目迷信,正所谓“尽信书不如无书”,对于实践活动中遇到的一些不合教材预期的反常现象,应敢于质疑,大胆假设,小心求证,努力探索,获取反常背后隐藏的“不反常”,真正为学生做好“传道、授业、解惑”。
1008-0546(2016)11-0094-02
G633.8
B
10.3969/j.issn.1008-0546.2016.11.033

