姜黄素固体脂质纳米粒干粉吸入剂的制备工艺研究Δ
李 楠,于美丽(1.天津医科大学研究生院,天津 300170;2.天津市医药科学研究所,天津 300020;3.天津市第三中心医院人工细胞重点实验室,天津 300170)
姜黄素固体脂质纳米粒干粉吸入剂的制备工艺研究Δ
李楠1,2*,于美丽3#(1.天津医科大学研究生院,天津300170;2.天津市医药科学研究所,天津300020;3.天津市第三中心医院人工细胞重点实验室,天津300170)
目的:制备姜黄素(Cur)固体脂质纳米粒(SLN)干粉吸入剂(DPI)。方法:以粒径、多分散系数、包封率和药物沉积率等为指标筛选Cur-SLN的干燥方法(喷雾干燥和冷冻干燥);基于优化后干燥方法,以药物沉积率、排空率、休止角、吸湿增重率、含量均匀度等指标对Cur-SLN-DPI处方(乳糖-干粉比例、单剂量每粒胶囊装量)进行单因素考察并进行验证试验。结果:喷雾、冷冻干燥法所得Cur-SLN的体外有效部位沉积率分别为29.98%和15.69%,以前者为优;优化后的单剂量处方为乳糖-干粉(1∶1)混合物50 mg、第3组分乳糖10 mg,填充于4号胶囊中;所制3批干粉各指标平均值为粒径3.35 μm、水分4.57%、含量均匀度3.65、体外有效部位沉积率28.73%、排空率95.17%、休止角24.03°、吸湿增重率2.2%(RSD均小于2%,n=3)。结论:建议选用喷雾干燥法制备Cur-SLN;优化处方后所制Cur-SLN-DPI质量符合要求。
姜黄素;固体脂质纳米粒;干粉吸入剂;制备工艺;干燥方法;体外有效部位沉积率
姜黄素(Curcumin,Cur)是姜科姜黄属植物姜黄中的主要活性成分,为一类毒副作用小、安全多效的天然活性物质,具有良好的抑制肿瘤细胞生长和治疗肺部炎症等作用[1-2],是一种具有应用前景的药物。但因其水溶性极差、口服生物利用度低、光敏性很强、需避光保存,从而限制了其在临床上的应用[3-5]。
干粉吸入剂(Dry powder inhaler,DPI)又称粉雾剂,是将微粉化药物单独或与载体混合后以胶囊、泡囊或多剂量储库形式,采用特制的干粉吸入装置,使药物分散成雾状进入呼吸道,发挥局部或全身作用的一种给药体系[6-7]。以DPI形式给药,可克服定量吸入气雾剂(MDI)的缺点,如氟利昂的大气污染,递送药物量小,自主呼吸与给药器释药难以协调、吸入效率不高等。
笔者将固体脂质纳米粒(Solid lipid nanoparticles,SLN)作为载体材料引入DPI,可实现药物在肺部的缓释和靶向性。通过缓释可降低用药频率、提高疗效、降低毒副反应;而通过靶向递送可实现对癌症的靶向治疗。特别是对Cur等水溶性较差、口服吸收差的中药用于肺内给药具有良好的应用前景[8]。本课题制备的单剂量胶囊型Cur-SLN-DPI,系将制备好的混合干粉用填充方式灌入4号胶囊中,置于干粉吸入器内使用。笔者在优化Cur纳米粒混悬液干燥工艺的基础上,采用喷雾干燥法制备Cur-SLN-DPI,并对其平均粒径、排空率和体外有效部位沉积性质等进行考察。
1 材料
1.1仪器
Spectrum-754紫外-可见分光光度计(上海光谱仪器有限公司);UV-2450紫外扫描检测仪(日本岛津公司);Zetasize粒度及Zeta电位分析仪(英国Malvern公司);2Z-4旋片真空泵(浙江黄岩求精真空泵厂);冷冻干燥机(北京四环科学仪器厂);YC-015实验型喷雾干燥机(上海雅程仪器设备有限公司);胶囊型干粉吸入器(上海信谊天平药业有限公司);双冲程碰撞取样器(天津市药物研究院自制)。
1.2药品、对照品与试剂
Cur对照品(南京泽朗医药科技有限公司,批号:20140226,纯度:99.0%);Cur原料药(天津一方科技有限公司,批号:20130312,纯度:98.5%);硬脂酸(天津市化学试剂批发公司,批号:20121211);聚山梨酯80(天津市光复精细化工研究所,批号:201203 17);葡聚糖凝胶G-50(上海蓝季科技有限公司,批号:131118);乳糖(山西百威昂药业有限公司,批号:10564845);海藻糖(南宁中诺生物工程有限公司,批号:20110812);其他试剂均为分析纯。
2 方法与结果
2.1微乳法制备Cur-SLN混悬液[9]
称取处方量的Cur原料药、硬脂酸,65熔化,加适量相同温度的质量比为1∶4的聚山梨酯80/乙醇溶液及适量蒸馏水,涡旋1 min形成O/W型微乳。使用自行设计的微乳注入装置距离冷却水相表面约6 cm,在电磁搅拌(1 000 r/min)下将热微乳以1滴/5 s的速度滴入2的水分散介质中,当微乳全部加入后继续以2保温搅拌15min,即得Cur-SLN混悬液。
2.2Cur-SLN混悬液干燥工艺的研究
选取2种干燥工艺即冷冻干燥和喷雾干燥进行比较研究。
2.2.1冷冻干燥工艺精密量取Cur-SLN混悬液2 ml,加入4%海藻糖为冻干保护剂,电磁搅拌下使其混合均匀后,分装于洗净灭菌后的玻璃具塞小瓶中,放入-75超低温冰箱预冻12 h。充分冰冻后转入冷冻干燥机干燥24 h,温度为-50,压力为98×10-3Mbar,得到Cur-SLN冻干粉。干粉外观形态维持原液体积,不塌陷,不皱缩,表面光洁;色泽均匀,无花斑,质地细腻。
2.2.2喷雾干燥工艺预试验初步确定喷雾干燥工艺参数如下:进口温度105,出风温度50,风机功率55 Hz,供液速度1.8 ml/min,雾化压力170 kPa,气流量0.60 m3/min,蠕动泵转速280 ml/h,撞针间隔2 s。试验中,当混悬液一旦喷完,需通过调节进口温度使出口温度保持在50~60并持续20 min左右,使得干粉通过二次干燥进一步降低残留水分。所得干粉过200目筛后置于干燥器中保存备用。
2.2.32种干燥工艺样品干粉复溶后Cur-SLN理化性质的评价取上述2种Cur-SLN样品,观察其再分散性。向2种样品中加入蒸馏水适量,超声30 s后分散为均匀的淡黄色乳状溶液,表明2种样品的再分散性均良好。测定样品再分散后的粒径、多分散系数和包封率[EE=(m总药物-m游离药物)/m总药物×100%[9],m即药物含量,其测定方法另文发表],评价2种Cur-SLN冷冻干燥和喷雾干燥干粉的性质,结果见表1。

表1 2种样品的粒径、多分散系数及包封率测定结果(x ±s,n=3)Tab 1 The particle sizes,polydispersity coefficients and encapsulation efficiencies of two kinds of samples(x ±s,n=3)
由表1可见,2种干粉再分散前后的粒径、多分散系数及包封率均稍有变化。另外,冻干样品肉眼观察外观饱满、表面细腻光洁,喷雾干燥后样品肉眼观察为淡黄色粉末。
2.2.42种干燥工艺样品体外各部位沉积率比较分别精密称取2种样品的干粉适量,与乳糖以适宜的比例混合均匀,按2015年版《中国药典》(四部)通则0951中干粉吸入剂微细粒子分布测定方法[10],采用自制液体双级碰撞器测定并计算2种样品体外各部位药物沉积率(各级分布瓶的药量/胶囊中的总药量×100%,其值应不小于标示量的10%),结果见表2。
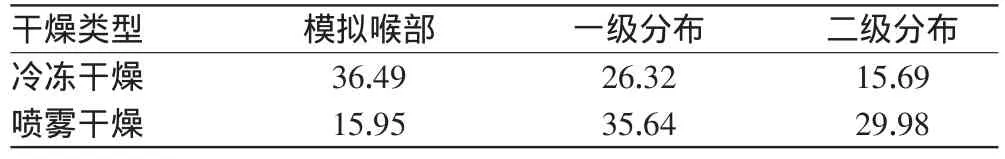
表2 2种样品的体外各部位药物沉积率(%%)Tab 2 The rates of drug deposition on different sites in vitro of two kinds of samples(%%)
由表2可知,喷雾干燥法较冷冻干燥法所得SLN干粉具有较高的二级分布率即有效部位沉积率,这主要与粉末的粒径有关。前者所得干粉粒径易沉积到肺部,而后者粒径较大,易沉积在咽喉部位。由此结果确定后续试验采用喷雾干燥法制备Cur-SLN-DPI。
2.3Cur-SLN-DPI制备工艺的单因素考察
2.3.1乳糖-干粉比例对体外各部位沉积率的影响分别精密称量200目乳糖及喷雾干燥法制备的Cur-SLN干粉适量,按照乳糖-干粉1∶1、1∶2、1∶3的质量比过200目筛混合均匀后,测定并计算体外各部位药物沉积率,结果见表3。
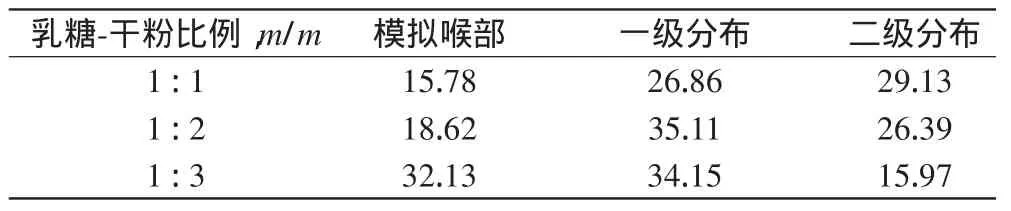
表3 乳糖-干粉不同比例时样品体外各部位药物沉积率(%%)Tab 3 The rates of drug deposition on different sites in vitro of samples in case of different lactose-dry powder ratios(%%)
由表3可见,当乳糖与干粉质量比为1∶1时具有较好的二级分布率。
2.3.2单剂量每粒胶囊装量的初步筛选根据干粉吸入给药装置的结构特征、患者的吸入方式和胶囊灌装时剂量的准确性要求,设计了在4号胶囊中装入不同量(50、60、70、80、90 mg)的乳糖-干粉混合物。采用排空率为检测指标(检测方法及计算方法见文献[11],值高者为佳)筛选单剂量每粒胶囊的装量。精密称取适量乳糖和Cur-SLN干粉,以1∶1的比例混合均匀后,填充于4号胶囊中,置于吸入装置内。以(60±5)L/ min的气流抽吸4次,每次1.5 s,称定质量,用小刷擦拭干净残留内容物,再分别称定囊壳质量。求出每粒胶囊的排空率,确定每粒胶囊的装量,结果见表4。

表4 不同装量下排空率的测定结果(n=3)Tab 4 The emptying rates in case of different filling amounts(n=3)
由表4可见,每粒胶囊装量小于90 mg时的排空率均大于90%,符合《中国药典》中关于排空率的要求[11]。
2.3.3单剂量每粒胶囊填装量的最终筛选进行乳糖-干粉(200目)和稀释剂填装量试验,以进一步确定胶囊填充量。通过加入不同量的第3组分稀释剂(过600目筛的乳糖)来调节胶囊填充量。样品1:取乳糖与干粉以1∶1的比例用等量递增法充分混合均匀,每粒胶囊中含乳糖-干粉总量约50 mg,填充于4号胶囊,填充量为50 mg;样品2、3、4:分别在样品1基础上再加入10、20、30 mg乳糖混匀,填充量分别为60、70、80 mg。取各样品分别进行以下检测:
(1)粉体流动性测定。流动性的好坏会直接关系到分剂量的准确性。本研究选用休止角为流动性衡量指标,测定方法采用固定漏斗法:将3只漏斗串联并固定于水平放置的坐标纸上1 cm的高度(H)处,将粉末沿漏斗壁倒入最上面的漏斗中,直到坐标纸上形成的颗粒圆锥体尖端接触到漏斗口为止,由坐标纸测出圆锥底部的直径(2 R),计算出休止角(tanA=H/R)。结果,样品1、2、3、4的休止角分别为34.6°、32.7°、30.5°、28.7°。
(2)体外有效部位药物沉积率测定。样品1、2、3、4的有效部位药物沉积率(二级分布)测定结果分别为29.1%、30.4%、23.2%、18.3%,均在10%以上。
(3)吸湿速率(吸湿增重率)测定。取干燥后的微粉(约1 g)精密称质量(m1),将其放入25室温下、相对湿度92.5%的干燥器(氯化钠饱和溶液)中不同时间(2、8、16、24 h)后,取出称质量(m2),以(m2-m1)/m1×100%计算吸湿增重率(%)。结果,各样品放置不同时间后吸湿增重率(%)结果见表5。

表5 各样品放置不同时间后吸湿增重率测定结果(%%)Tab 5 The moisture-absorption weight gain rates of the samples placed for different durations(%%)
由表5结果表明,4份样品随稀释剂比例的增加和放置时间的延长,吸湿速率加快,但总体差异不大。
(4)含量均匀度测定。按照2015年版《中国药典》(四部)通则0941[10]中规定,胶囊型干粉吸入剂含量均匀度应≤20。取样品1、2、3、4依法进行检测,结果含量均匀度分别为3.86、4.21、4.83、3.77,均符合规定。
2.3.4单剂量胶囊处方装量的确定综合上述各结果可知,4种样品流动性和吸湿性基本一致无大差异,含量均匀度均符合规定,而有效部位沉积率以样品2最优。因此确定稀释剂的用量为10 mg,其单剂量处方确定为Cur-SLN干粉-乳糖(1∶1)混合物50mg、第3组分稀释剂10mg,填充于4号胶囊中。
2.4优化处方的工艺验证
按上述各处方及工艺制备3批Cur-SLN-DPI,测定其平均粒径、水分、含量均匀度、体外有效部位沉积率、排空率、休止角和吸湿增重率。结果3批样品上述指标平均值分别为3.35 μm、4.57%、3.65、28.73%、95.17%、24.03°和2.2%,各指标RSD均小于2%(n=3),重现性良好。因此本试验制备的Cur-SLN-DPI符合《中国药典》干粉吸入剂项下的质量要求。
3 讨论
肺部的生理结构要求DPI的药物粒子非常小,一般认为理想的药物粒径为1~7µm;大于此范围的粒子不能进入细支气管内,比如粒径大于8μm的粒子,50%以上会沉积于口咽部和上呼吸道的分支处;而太小的粒子比如粒径小于3 μm的可沉积于细支气管和肺泡,更小的粒子则不能停留在呼吸道,容易随呼气排出。故干粉的粒径是决定DPI有效给药的关键因素之一。
本试验采用自制的双层液体碰撞器,可通过模拟人体肺部环境检测药物微粒沉积情况。模拟咽喉部即模仿人口腔-喉的生物结构,一级分布相当于主支气管,二级分布相当于肺细支气管以下部位,即有效部位。
药物微粉化后,粉体极易聚集成团,降低了其流动性,并且在吸入过程中难以解吸,从而降低了药物的疗效。因此在DPI的处方设计中,为了改善药物粒子间聚集的现象,通过将一些无药理活性的物质作为载体或采用润滑剂吸附药物微粉的方法来改变干粉的形状。如本试验加入的微粉化乳糖可以降低药物粒子之间的吸附,因此可以提高药物的流动性和分散性。对于给药剂量小的药物,载体也可作为稀释剂使用。目前乳糖是市场上唯一一个被美国FDA批准的可用于吸入给药的辅料产品[12-13],故本试验选用乳糖为润滑剂、稀释剂和载体,安全性好且制剂符合要求。
[1]Shehzad A,Rehman G,Lee YS.Curcumin in inflammatory diseases[J].Biofactors,2013,39(1):69.
[2]王彬辉,章文红,张晓芬,等.姜黄素的药理及剂型研究进展[J].中华中医药学刊,2013,31(5):1102.
[3]张晶,李杨,向美玲,等.姜黄素脂质体粉雾剂的研制和药效学评价[J].军事医学,2013,37(9):692.
[4]余美荣,蒋福升,丁志山.姜黄素的研究进展[J].中草药,2009,40(5):828.
[5]Shaikh J,Ankola DD,Beniwal V,et al.Nanoparticle encapsulation improves oral bioavailability of curcumin by at least 9-fold when compared to curcumin administered with piperine as absorption enhancer[J].Eur J Pharmaceut Sci,2009,37(3/4):223.
[6]Bosquillon C,Preat V,Vanbever R.Pulmonary delivery of growth hormone using dry powders and visualization of its local fate in rats[J].J Control Release,2004,28(96):233.
[7]Duret C,Wauthoz N,Sebti T,et al.Solid dispersions of itraconazole for inhalation with enhanced dissolution,solubility and dispersion properties[J].Int J Pharm,2012,428(1/2):103.
[8]Li R,Jiang S,Liu D,et al.A potential new therapeutic system for glaucoma:solid lipid nanoparticles containing methazolamide[J].J Microencapsul,2011,28(2):134.
[9]李楠,李锡晶,王倩.微乳法制备姜黄素固体脂质纳米粒[J].中国药房,2015,26(19):2698.
[10] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:124-130.
[11]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录12-13.
[12]Young PM,Chan HK,Chiou H,et al.The influence of mechanical processing of dry power inhaler carriers on drug aerosolization performance[J].J Pharm Sci,2007,96(5):1331.
[13]Bridson RH,Robbins PT,Chen Y,et al.The effects of high shear blending on alpha-lactose monohydrate[J].Int J Pharm,2007,339(1/2):84.
(编辑:刘萍)
Study on Preparation Technology of Dry Powder Inhaler of Curcumin-loaded Solid Lipid Nanoparticles
LI Nan1,2,YU Meili3(1.The Graduate School of Tianjin Medical University,Tianjin 300170,China;2.Tianjin Institute of Pharmaceutical Science,Tianjin 300020,China;3.The Key Laboratory of Artificial Cells,Tianjin Third Central Hospital,Tianjin 300170,China)
OBJECTIVE:To prepare Dry powder inhaler of curcumin-loaded solid lipid nanoparticles(Cur-SLN-DPI).METHODS:With the particle size,polydispersity coefficient,encapsulation efficiency and drug deposition rate as the indexes,the Cur-SLN drying methods(spray drying and freeze drying)were screened.Based on the optimized drying method,with the drug deposition rate,emptying rate,the angle of repose,moisture-absorption weight gain rate and content uniformity as the indexes,single factor observation was made on the formulation of Cur-SLN-DPI(lactose-dry powder ratio,the filling amount of each single-dose capsule),and verification tests were carried out.RESULTS:The rates of effective in vitro deposition of Cur-SLN obtained by spray and freeze drying were 29.98%and 15.69%respectively,and the former was better.The optimized single-dose formulation was as follows as lactose-dry powder(1∶1)mixture of 50 mg,lactose of 10 mg as the third component,in a No.4 capsule.The average values of all indexes of 3 lots of the prepared dry powder were as follows as particle size of 3.35 μm,4.57%of moisture,content uniformity represented as 3.65,effective in vitro deposition rate of 28.73%,emptying rate of 95.17%,the angle of repose of 24.03°and moisture-absorption weight gain rate of 2.2%(RSD lower than 2%,n=3).CONCLUSIONS:It is suggested that Cur-SLN should be prepared by spray drying.The Cur-SLN-DPI prepared according to the optimized formulation conforms to quality standards.
Curcumin;Solid lipid nanoparticles;Dry powder inhaler;Preparation technology;Drying method;Effective in vitro deposition rate
R943
A
1001-0408(2016)28-3979-03
10.6039/j.issn.1001-0408.2016.28.28
天津市卫生行业重点攻关项目(No.13KG110);天津市卫生局科技基金项目(No.2012KY32)
*助理实习员,硕士研究生。研究方向:生物医学工程。电话:022-27236127。E-mail:coco10190286@sina.com
研究员,硕士生导师。研究方向:生物医用材料及三维细胞支架研究和应用。E-mail:yumeili8@163.com
(2016-01-25
2016-03-16)

