绿豆叶斑病菌分生孢子的产生和萌发条件研究
张海涛,殷丽华,柯希望,台莲梅,左豫虎
(黑龙江八一农垦大学农学院,黑龙江大庆163319)
绿豆叶斑病菌分生孢子的产生和萌发条件研究
张海涛,殷丽华,柯希望,台莲梅,左豫虎
(黑龙江八一农垦大学农学院,黑龙江大庆163319)
为了明确绿豆叶斑病病原菌变灰尾孢菌(Cercospora canescens)分生孢子形成及萌发的最适条件,研究了变灰尾孢菌在9种供试培养基上,在不同培养条件下分生孢子的产生及分生孢子的萌发情况。结果表明,在高粱粒培养基上25℃,光暗交替条件下培养10天后即可产孢,培养14天后产孢量可达9×105个/mL,玉米粉培养基和小麦粒培养基产孢较少,其他培养基不产孢。分生孢子在25℃、pH 6~7、连续黑暗条件下无菌水中培养20 h后萌发率可达76.0%,不同温度、不同光照处理间萌发率差异显著。在蔗糖溶液和蛋白胨溶液中培养20 h后萌发率分别达87.0%和86.3%。变灰尾孢菌的最适产孢条件为高粱粒培养基上25℃光暗交替培养;分生孢子最适萌发条件为25℃、pH 6~7、连续黑暗培养,蔗糖和蛋白胨可适当提高分生孢子的萌发率。
绿豆叶斑病;变灰尾孢菌;产孢量;产孢条件;萌发条件
0 引言
绿豆作为中国主要的杂豆作物,近年来在黑龙江省的种植面积逐年增加,但因相对落后的生产技术及较为粗放的管理方式,近年来绿豆病害问题呈逐年加重的趋势。由变灰尾孢菌(Cercospora canescens)引起的绿豆叶斑病,又称红斑病,是中国及亚洲绿豆生产上危害最为严重的病害之一[1]。在中国安徽、河南、河北、陕西等省发病较重[2]。绿豆叶斑病以开花结荚期危害最重,病情严重时,病斑融合成片,造成叶片干枯,严重影响绿豆的产量,轻者减产20%~50%,严重的可减产90%以上。
尾孢菌属的绝大多数种在正常培养时不产生分生孢子,例如,要获得引起大豆紫斑病的菊池尾孢(Cercospora kikuchii Mats.&Tomoy)的大量分生孢子,需用高粱米做培养基,在温箱内黑白灯照射处理才能获得[3]。薛其勤等[4]发现花生褐斑病菌也较难产孢,病菌被黑光灯照射培养20天后的产孢量仅能达到1.80× 103个/mL。杨建清等[5]测定烟草疫霉4天就可产生大量游动孢子,庒义庆等[6]研究发现蕉斑镰刀菌3天后就有大量的分生孢子产生。但尾孢菌与其他真菌不同,其产孢时间较长,而长时间的培养容易造成污染,影响后续试验的顺利进行。因此,对绿豆叶斑病菌的最适产孢培养基、产孢条件及分生孢子萌发条件的研究,是快速获得大量病菌分生孢子的重要前期基础,对深入开展绿豆-变灰尾孢菌互作的相关研究有非常重要的科学意义。
国内外对该病的研究报道较少,多数报道与该病害的田间防治有关,1989年郭继红等[7]的研究表明,灭病威对绿豆叶斑病的防治效果显著。2012年邢宝龙[8]认为药剂防治应选用25%嘧菌酯悬浮剂500倍液浸种2 h+25%嘧菌酯悬浮剂600倍液喷雾进行防治。在病原菌分离与鉴定方面也有相关的研究报道,1987年李怡琳等[2]对绿豆叶斑病的病原菌进行了分离和鉴定,从形态学上确定了其病原菌为变灰尾孢菌(Cercospora canescens)。2015年刘昌艳等[9]对绿豆叶斑病菌进行形态学和分子特征鉴定,从分子角度确定绿豆叶斑病的病原为变灰尾孢菌。2014年金玉晓等[10]对采集的绿豆叶斑病病叶进行了病原菌分离、鉴定及其菌丝生长特性的研究,发现变灰尾孢菌在PDA、PSA上生长较快,但未就分生孢子的形成开展相关实验。李怡琳等[2]对病原菌的产孢方法进行了研究,认为变灰尾孢菌接种在高粱粒培养基上后,放入搪瓷盘中其上覆盖双层消毒纱布防止污染,光暗交替培养2周,然后自然干燥,装入双层塑料袋中用硅胶除湿的方法可以使其大量产孢。但其操作方法步骤较多,过程中容易造成污染,不利于孢子的获得。且对于该病菌分生孢子萌发条件研究至今仍未见报道。孢子的获得是研究病菌侵染特性、致病机制乃至发生流行规律的重要前提,而在常规的马铃薯葡萄糖琼脂培养基(PDA)上培养变灰尾孢菌并不能很好的诱导其产孢,因此,为深入研究绿豆-变灰尾孢菌的互作机制,本研究对变灰尾孢菌的最适产孢培养基、最适产孢条件以及最适的孢子萌发条件进行了系统探讨,为绿豆资源的抗病性鉴定,明确病菌侵染过程等奠定基础。
1 材料和方法
1.1供试菌株
供试菌株为金玉晓等[3]从采自大庆市林甸县的绿豆叶斑病标样上分离得到的纯培养LD 14-08,由黑龙江八一农垦大学植物免疫研究室提供。
1.2供试培养基
①马铃薯葡萄糖琼脂培养基(PDA);②马铃薯蔗糖琼脂培养基(PSA)[11];③燕麦片培养基(OMA)[12];④玉米粉培养基(CMA)[12];⑤察氏培养基(Czapek)[12];⑥花生叶斑病尾孢菌培养基(Landers)[13];⑦马铃薯葡萄糖酵母浸膏琼脂培养基(PDAY)[14];⑧高粱粒培养基(SG)[15];⑨小麦粒培养基(WG)[15]。
1.3产孢培养基的筛选
取在PDA上培养的变灰尾孢菌的菌饼(d=5 mm)分别接种到PDA,PSA,OMA,CMA,Czapek,Landers,PDAY平板上,置于25℃,12 h光暗交替培养,每处理重复4次。培养10天后开始检查不同培养基上的产孢情况,观察到产孢后,用血球计数板每3天统计一次产孢量。
平板培养基上产孢量测量方法:在每皿中间打5个直径5 mm的菌饼,置于0.5 mL无菌水中,充分振荡5 min后,用血球计数板计数,并计算产孢量[16]。
高粱粒培养基和小麦粒培养基接菌后,置于恒温25℃培养箱12 h光暗交替培养,待菌丝扩展到四周的高粱或麦粒上后,充分振动使高粱或麦粒散开,继续培养7天后,菌丝体充满整个三角瓶,每瓶加无菌水10 mL,洗脱孢子镜检[15]。
1.4产孢条件的筛选
1.4.1温度对分生孢子形成的影响将菌饼接在1.3中最适于病菌产孢的培养基上,分别置于20、25、30℃的培养箱中12 h光暗交替培养。每处理重复4次。培养16天后测量产孢量。
1.4.2光照对分生孢子形成的影响将菌饼接在1.3中最适于病菌产孢的培养基上,置于30℃的培养箱中分别进行连续光照、12 h光暗交替、连续黑暗培养。每处理重复4次。培养16天后测量产孢量。
1.5分生孢子的萌发条件
1.5.1温度对病原菌分生孢子萌发的影响用无菌水配置浓度为10×10倍视野下20个分生孢子的孢子悬浮液,吸取孢子悬浮液滴于载玻片上,每个载玻片上分开滴2滴,每滴20µL。将载玻片放在铺好已润湿滤纸的培养皿里,置于20、25、30℃温度下培养。分别于4、8、12、16、20、24 h在显微镜下镜检400个分生孢子,每处理观察6个载玻片,记载孢子开始萌发时间,计算孢子萌发率。
1.5.2光照对病原菌分生孢子萌发的影响孢子悬浮液配制和处理同1.5.1,置于连续光照,10 h光暗交替,连续黑暗3种光照条件下培养20 h后,每处理镜检400个分生孢子,计算孢子萌发率。
1.5.3pH对病原菌分生孢子萌发的影响用pH为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0共10个梯度的磷酸缓冲液配置浓度为10×10倍视野下20个分生孢子的孢子悬浮液,其他处理同1.5.1,置于25℃恒温培养箱中连续黑暗培养20 h后,每处理镜检400个分生孢子,计算孢子萌发率。
1.5.4碳源对病原菌分生孢子萌发的影响用含有淀粉、葡萄糖、蔗糖、果糖、麦芽糖、半乳糖和甘露醇浓度分别为10 g/L水溶液配置浓度为10×10倍视野下20个分生孢子的孢子悬浮液,以用无菌水配置的相同浓度的孢子悬浮液为对照。其他处理同1.5.1,置于25℃恒温培养箱中连续黑暗培养20 h后,每处理镜检400个分生孢子,计算孢子萌发率。
1.5.5氮源对病原菌分生孢子萌发的影响用含有硝酸钾、硫酸铵、氯化铵、蛋白胨、牛肉膏、酵母膏、尿素的浓度分别为10 g/L的水溶液配置浓度为10×10倍视野下20个分生孢子的孢子悬浮液,吸取20µL滴于载玻片上培养,以用无菌水配置的相同浓度的孢子悬浮液为对照。其他处理同1.5.1,置于25℃恒温培养箱中连续黑暗培养20 h后,每处理镜检400个分生孢子,计算孢子萌发率。
2 结果与分析
2.1产孢培养基的筛选
变灰尾孢菌在9种供试培养基上25℃、光暗交替条件下培养的产孢时间和产孢量明显不同(见表1)。在高粱粒培养基上培养第10天开始产孢,在马铃薯蔗糖琼脂培养基和小麦粒培养基上培养12天开始产孢,在玉米粉培养基和马铃薯葡萄糖酵母浸膏琼脂培养基上培养14天开始产孢。其余4种培养基上不产孢。变灰尾孢菌在产孢培养基上产孢量存在显著差异,其中在马铃薯蔗糖琼脂培养基,马铃薯葡萄糖酵母浸膏琼脂培养基,玉米粉培养基和小麦粒培养基上虽然能产生分生孢子,但产孢量较少,且开始产孢时间较长。在高粱粒培养基上产孢量较大,且产孢较早,宜用于分生孢子培养。
2.2培养温度和光照条件对分生孢子形成的影响
从表2中可以看出,在高粱粒培养基上光暗交替条件下培养,各温度处理的产孢量存在显著差异,25℃的产孢量最大。在25℃几种光照条件变灰尾孢菌产孢量差异不显著。各培养光照条件下变灰尾孢菌在高粱粒培养基上产孢量的差异不显著。
2.3温度和光照对分生孢子萌发的影响
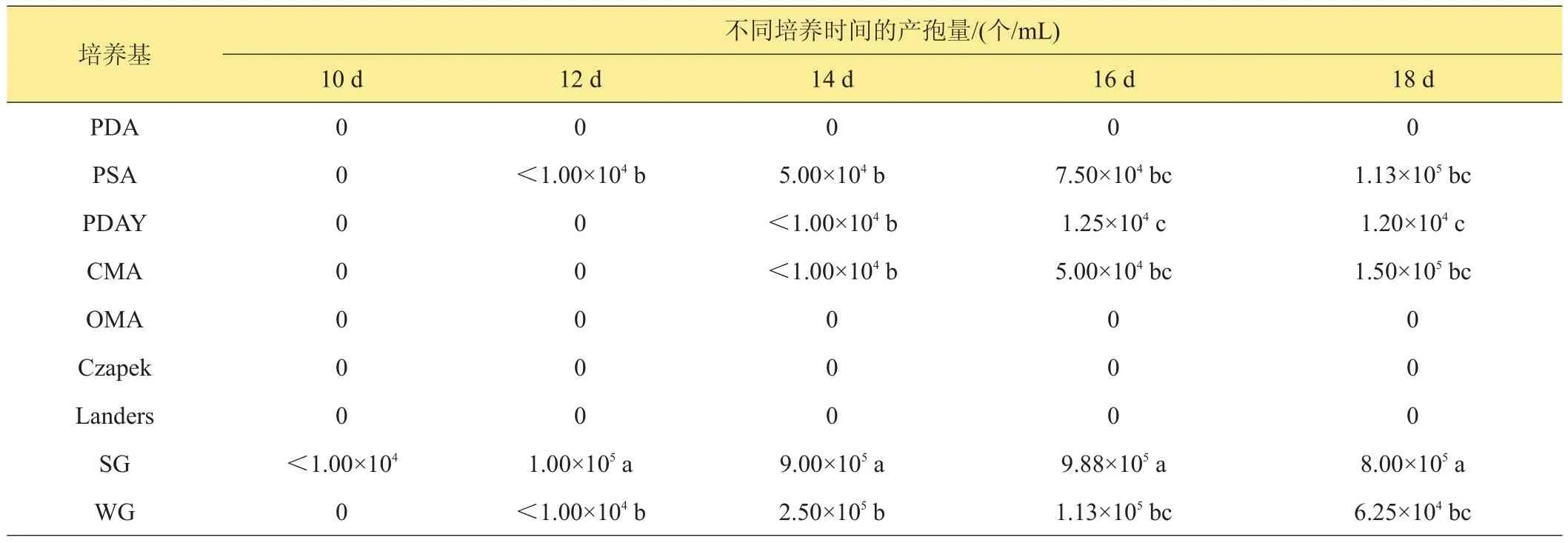
表1 变灰尾孢菌在不同培养基上的产孢情况
从表3中可以看出变灰尾孢菌分生孢子的最适萌发温度为25℃,培养24 h后分生孢子萌发率达到88.5%。连续黑暗有利于变灰尾孢菌分生孢子的萌发,萌发率达到76%。

表2 温度、光照对变灰尾孢菌产孢量的影响

表3 温度、光照对孢子萌发的影响
2.4pH对分生孢子萌发的影响
变灰尾孢菌分生孢子在pH 4~11的范围内均可萌发(见表4),pH为6~7时萌发率最高,达到85.42%。
2.5碳源对变灰尾孢菌分生孢子萌发的影响
不同碳源对变灰尾孢菌分生孢子萌发的影响见表4。分生孢子在无菌水中就可以较好的萌发,萌发率达到72.33%,说明其萌发对碳源没有特殊要求。在蔗糖溶液中萌发率可达到87%,说明蔗糖能促进分生孢子萌发,是分生孢子萌发的最适碳源。果糖对分生孢子萌发也有一定的促进作用。分生孢子在淀粉、葡萄糖、麦芽糖和甘露醇中萌发均较差。
2.6氮源对变灰尾孢菌分生孢子萌发的影响
氮源对变灰尾孢菌分生孢子萌发的影响试验结果见表4。分生孢子在无菌水中的萌发率可以达到74.42%,说明其萌发对氮源没有特殊要求。在供试氮源培养液中,变灰尾孢菌分生孢子均可萌发,在蛋白胨溶液中萌发率最高,萌发率可以达到86.33%,在尿素溶液中分生孢子的萌发率最低,但也达到59.67%。说明蛋白胨是分生孢子萌发的最适氮源。
3 讨论与结论
2003年徐秀德等[17]的研究表明,最适宜玉米灰斑病菌产生分生孢子的为玉米碳粉碳酸钙琼脂培养基和玉米叶粉琼脂培养基。但金玉晓等的研究发现,变灰尾孢菌在玉米叶粉琼脂培养基上的生长情况并不理想。James[18]认为大豆灰斑病菌在利马豆(Lima bean)琼脂培养基上产孢丰富。本研究发现,高粱粒培养基为变灰尾孢菌产孢的最适培养基。变灰尾孢菌在高粱粒培养基上,10天就可产生分生孢子,12天产孢量达到1×105个/mL,可以满足接种,侵染过程等方面的研究需要,而操作方法较1987年李怡琳等[2]的方法更简便。
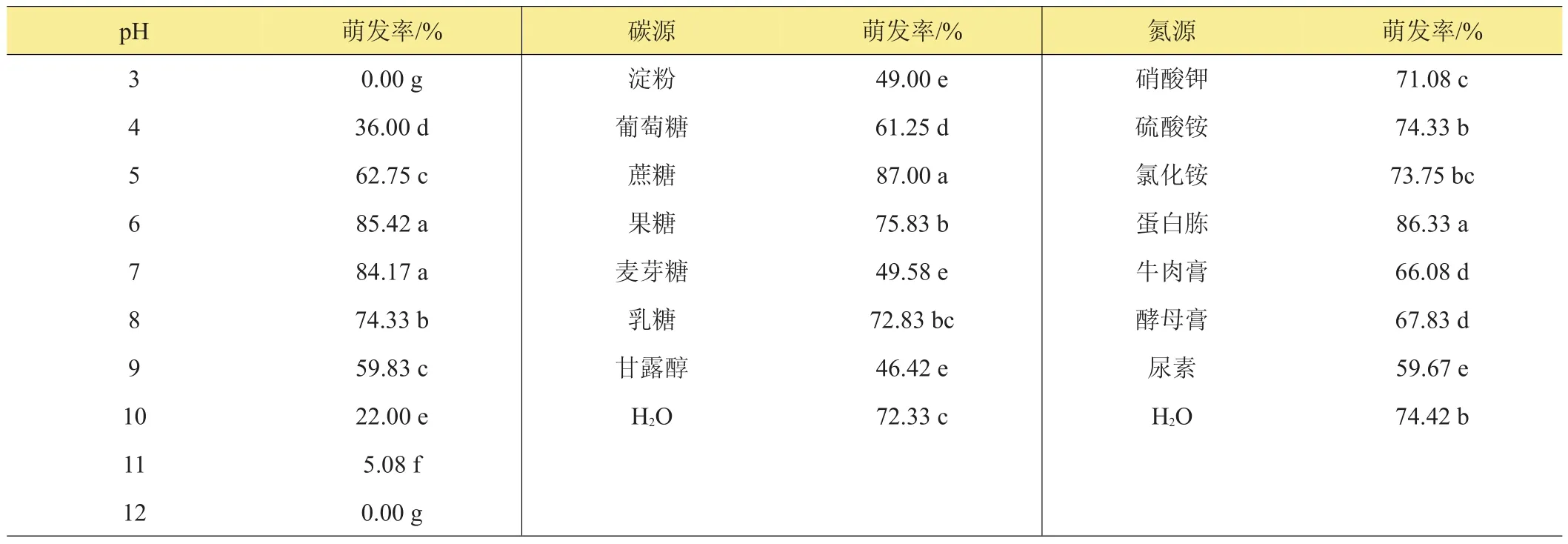
表4 pH、碳源和氮源对孢子萌发的影响
2014年金玉晓等[10]对该病菌的生物学特性进行了研究,但对其产孢条件没有进行系统的研究。本文对该病菌的产孢条件进行了研究,得出了25℃是变灰尾孢菌产孢的最适温度,光照条件对变灰尾孢菌产孢影响不大的结论。这与钟兆西等[19]报道的黑暗有利于大豆灰斑病菌(Cercospora sojina)产孢的观点不同。
绿豆尾孢菌叶斑病的发生发展和危害程度与变灰尾孢菌分生孢子的萌发特性密切相关。但中国尚缺乏对该病害的深入系统研究。张益先等和王桂清[20-21]报道玉米灰斑病菌(Cercospora zeae-maydis Tehon and Doniels)分生孢子的最适萌发温度为25℃。笔者对同属的变灰尾孢菌的分生孢子进行了研究,发现分生孢子在水滴中,3 h即可萌发,最适萌发温度为25℃,此结果也与陈敏等[16]对赶黄草褐斑病菌(Cercospora sedoides Ell.et.Evht)的研究结果一致。黑暗有利于分生孢子的萌发,这与王伟等[22]对大豆紫斑病菌(Cercospora kikuchii Matsumoto and Toloysau)的研究结果相同。变灰尾孢菌与其他尾孢菌属真菌一样,其分生孢子可在较宽的pH范围内萌发[21-23],其萌发的最适pH为6~7。分生孢子在无菌水中就可以较好地萌发,其萌发对碳源、氮源没有特殊要求,蔗糖、果糖、蛋白胨有助于孢子萌发,这与王伟等[22]报道的大豆紫斑病菌的研究结果相似。但变灰尾孢菌分生孢子在无菌水中培养20 h后,其萌发率可达到72.33%,因此,可以看出变灰尾孢菌分生孢子萌发对碳源、氮源无特殊要求。
通过筛选变灰尾孢菌产孢的最适培养基,发现高粱粒培养基与供试的其他培养基比较具有产孢早,产孢量大的优点。明确了变灰尾孢菌分生孢子在25℃下高粱粒培养基中培养的较李怡琳等[2]更简便的培养方法。并且确定了25℃、pH 6~7,连续黑暗条件下培养的最适孢子萌发条件,为深入研究绿豆与变灰尾孢菌的互作奠定基础。
[1]赖传雅,袁高庆.农业植物病理学(华南本)[M].北京:科学出版社,2003:157-161.
[2]李怡琳,李淑英.绿豆品种抗叶斑病鉴定研究[J].作物品种资源,1987(3):11-14.
[3]郭英兰,刘锡琏.中国真菌志(第二十四卷,尾孢菌属)[M].北京:科学出版社,2005:16.
[4]薛其勤,万勇善,刘风珍.花生褐斑病病菌的分离培养及致病性研究[J].中国农学通报,2007,23(3):343-346.
[5]杨建卿,江彤,陈学平.烟草疫霉菌的培养及大量产生游动孢子方法的研究[J].植物保护,2001,27(4):12-14.
[6]庒义庆,乔广行,王源超,等.蕉斑镰刀菌32-6菌株产孢条件研究[J].南京农业大学学报,2008,31(4):77-81.
[7]邢宝龙,冯高,郭新文,等.绿豆尾孢菌叶斑病田间药剂防治试验[J].山西农业科学,2012,40(3):264-266,279.
[8]郭继红,刘钦兰,郑现敏.灭病威防治绿豆叶斑病初报[J].农药,1989,28(6):50.
[9]刘昌艳,肖炎农,吴小微,等.绿豆叶斑病病原鉴定及生物学特性研究[J].植物保护,2015,41(6):83-87.
[10]金玉晓,李薇,台莲梅,等.绿豆叶斑病病菌生长特性研究[J].中国植保导刊,2014,34(10):16-19.
[11]孙俊,刘志恒,黄欣阳,等.辣椒褐斑病菌分生孢子产生条件初探[J].植物病理学报,2010,40(3):322-324.
[12]方中达.植病研究方法[M].3版.北京:中国农业出版社,1998:64.
[13]黎穗临,叶维霖.花生褐斑病菌培养基筛选及生理性状和致病性研究[J].植物病理学报,1991,21(1):31-35.
[14]张靖宜,张倩茹,项文化,等.一株拮抗立枯丝核菌的放线菌筛选、鉴定及生理特性[J].生态学杂志,2014,33(2):394-399.
[15]霍秀娟,李朝生,韩美丽,等.灰梨孢菌产孢培养基筛选[J].南方农业学报,2012,43(5):605-608.
[16]陈敏.赶黄草褐斑病的病原鉴定、病原菌生物学特性及侵染研究[D].雅安:四川农业大学,2011.
[17]徐秀德,董怀玉,姜钰,等.玉米灰斑病抗性鉴定技术[J].植物保护学报,2003,30(2):129-132.
[18]James B S.Compendium of soybean disease.(2nd ed.)[M]. Minnesola:TheAmerican Phytopathological Society,1982:17-20.
[19]钟兆西,王伟.大豆灰斑病菌生物学特性的研究[J].大豆科学,1989,8(3):288-294.
[20]张益先,吕国忠,梁景颐,等.玉米灰斑病菌生物学特性研究[J].植物病理学报,2003,33(4):292-295.
[21]王桂清.玉米灰斑病菌(Cercospora zeae-maydis)生物学多态性与生理分化机理研究[D].沈阳:沈阳农业大学,2003.
[22]王伟,衣春生,赵谦,等.大豆紫斑病菌生物学特性研究[J].大豆科学,1998,17(3):280-285.
[23]曹越平,李海英,刘学敏,等.大豆灰斑病菌(Cercospora sojina Hara)及其对寄主作用的研究[J].植物病理学报,2003,33(2):116-120.
Conidia Production and Germination Conditions of Mung Bean Leaf Spot Pathogen
Zhang Haitao,Yin Lihua,Ke Xiwang,Tai Lianmei,Zuo Yuhu
(College of Agronomy,Heilongjiang Bayi Agricultural University,Daqing 163319,Heilongjiang,China)
To understand the optimal condition for the development and germination of conidium in mung bean leaf spot caused by the Cercospora canescens,nine culture media and different culture conditions were studied. The results showed that Cercospora canescens could be sporulated in sorghum grain culture medium at 25℃with 10 days post incubation(dpi).The amount of conidium sporulated could reach 9×105conidium/mL at 14 dpi.There was less production of conidia with corn meal and wheat grain media,whereas no sporulation with other media.Additionally,a suitable condition for conidia germination was 25℃,pH 6-7 under dark condition,where germination rate could reach 76.0%after 20 h incubation,and there were significant differences in germination rates among different light and temperature conditions.In sucrose and peptone media,the conidia germination ratio was 87.0%and 86.3%,respectively.The optimal condition for sporulation of Cercospora canescens was at 25℃on sorghum grain culture medium,and the optimal condition for spore germination was 25℃,pH 6-7 in darkness.Conidia germination radio could be mildly improved with the addition of sucrose and peptone.
Mung Bean Leaf Spot;Crcospora canescens;Sporulation Quantity;Conidia Production Conditions;Germination Conditions
S432.4+4,S435.22
A论文编号:cjas16030016
国家科技支撑计划项目子课题(2014BAD07B05-06/H08);中国博士后科学基金第56批面上资助项目(2014M561378);国家杂粮工程技术研究中心组建项目(2011FU125X07);黑龙江八一农垦大学学成、引进人才科研启动基金(2030010000)。
张海涛,男,1990年出生,黑龙江五常人,硕士研究生,研究方向为真菌与作物真菌病害。通信地址:163319黑龙江省大庆市高新区黑龙江八一农垦大学农学院植物病理与应用微生物研究所,Tel:0459-6819133,E-mail:18245079648@163.com。
左豫虎,男,1965年出生,河南新郑人,教授,博士研究生导师,博士,主要从事植物病理学研究与教学。通信地址:163319黑龙江省大庆市高新区黑龙江八一农垦大学农学院植物病理与应用微生物研究所,Tel:0459-6819133,E-mail:zuoyuhu@hlau.edu.cn
2016-03-17,
2016-07-28。

