急性高温胁迫对雄性许氏平鲉血液生理生化及相关基因表达的影响*
温海深, 吕里康, 李兰敏, 赵 吉, 张思敏
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
急性高温胁迫对雄性许氏平鲉血液生理生化及相关基因表达的影响*
温海深, 吕里康, 李兰敏, 赵 吉, 张思敏
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
本文以雄性许氏平鲉(Sebastesschlegelii)为研究对象,对急性高温处理下雄性许氏平鲉的血液生理指标及肝脏相关基因的表达水平进行研究。研究显示,红细胞(RBC)和血红蛋白(HGB)均呈先增加后减少的趋势,白细胞(WBC)在实验中增加显著(P<0.05);同时急性高温处理后,血清皮质醇(COR)、血清葡萄糖(GLU)和蛋白水平发生显著变化(P<0.05),GLU出现与血细胞相似的变化规律,COR在整个处理过程中均显著增加(P<0.05);血清蛋白水平整体显著下降(P<0.05);丙氨酸氨基转移酶(GPT)和天门冬氨酸氨基转移酶(GOT)在处理2、6 h后显著升高(P<0.05);HSP70 mRNA表达水平在2和6 h后显著升高(P<0.05);甲状腺激素水平在高温处理下显著下降(P<0.05);TRα和TRβmRNA表达水平显著下降(P<0.05)。研究结果表明,在急性高温处理下雄性许氏平鲉处于胁迫状态,其血液生理生化指标和肝脏相关基因表达受高温影响显著。
许氏平鲉;血液生理生化;HSP70;甲状腺激素;甲状腺激素受体;高温胁迫
鱼类属变温动物,它的生长繁衍与温度、光照、紫外、气压等气候因子有密切关系,其中温度是鱼类生长发育最重要的气候因子。水温影响着鱼类的摄食、生长、免疫和生殖等活动,具有多方面生态作用[1]。不同温度下,鱼类的各项生理指标具有显著差异,而血液与鱼类机体代谢、生殖繁育等密切相关,可作为反映鱼体生理和健康状况的重要指标。徐革峰[2]等对不同温度条件下运动和摄食对细鳞鲑(Brachymystaxlenok)幼鱼代谢模式的研究结果表明,在一定温度范围条件下,细鳞鲑幼鱼的最大代谢率是由运动与摄食共同诱导产生的。此外,温度对鱼类的繁殖进程也是息息相关的,刘永新等[3]对红鳍东方鲀(Takifugurubripes)的研究发现低温能够有效提高红鳍东方鲀家系雄性个体的比例。
许多研究表明,温度对鱼类免疫机能也有显著影响。对罗非鱼(Oreochromisaureus),鳕鱼(GadusmorhuaL.)和黑鲈(Dicenttrarchuslabrax)的研究发现,适宜的温度范围,血清中免疫球蛋白的活性随温度的升高而增强[4-5]。低温能够使罗非鱼白细胞的吞噬活性显著降低,并且会抑制虹鳟(Oncorhynchusmykiss)的噬菌活化因子的分泌[6]。高温胁迫使尼罗罗非鱼血液和肝脏生化指标及肝脏热休克蛋白(Heat shock protein 70,HSP70)基因mRNA转录水平发生了显著变化,这表明,温度胁迫显著影响了鱼体的免疫机能[7]。
许氏平鲉(Sebastesschlegelii)隶属于硬骨鱼纲(Osteichthyes)鲉形目(Scorpaeniformes)鲉科(Scorpaenidae)平鲉属(Sebastes),原名黑鮶,俗称“黑头”、“黑寨鱼”、“黑石鲈”等,是一种广泛分布于西北太平洋近海暖温性鱼类。由于其肉质鲜美,营养丰富,生长快速且抗病能力强,成为北方沿海人工养殖的重要品种之一。其生存温度范围较广(5~28 ℃),生长适宜温度18~24 ℃。目前在全球变暖的大背景下,黄海北部的海域水温波动剧烈且昼夜温差急剧扩大,对网箱养殖许氏平鲉造成严重的影响。本研究旨从生理水平和代谢水平探究许氏平鲉对高温胁迫的免疫反应和应激效应,为许氏平鲉的人工养殖提供参考。
1 材料和方法
1.1 试验鱼类
实验雄鱼于2014年11月购买自山东省海阳市沿海网箱养殖群体。挑选30尾健康无病,发育良好的雄性许氏平鲉(体质量:(406.9±41.5) g,体长:(24.3±1.3) cm),实验前于5个0.5 m3圆柱形塑料桶(直径80 cm,深100 cm)中暂养2天。暂养期间每天换水2次,停止投喂;连续充气,温度为(17±1) ℃;pH 7.8~8.1;溶氧(7.22±0.59) mg/L;模拟自然光周期14L∶10D光照。
1.2 试验设计
实验开始前随机取6尾鱼作为0 h组。设置17 ℃(室温对照)、27 ℃ 2个温度梯度,每个温度梯度设置2个重复,每个重复3尾鱼。将暂养后的实验鱼随机放入设置好温度的实验水体中进行急性高温胁迫,持续进行6 h。
1.3 样品采集和处理
分别在急性高温胁迫0 h和胁迫2、6 h后对实验鱼进行取样,0 h一次性取6尾鱼,2、6 h时每组每次分别随机取6尾鱼。将随机选取的实验鱼放入加有MS-222(200 mg/L)的海水中进行麻醉,尾静脉取血部分制成抗凝血,4 ℃保存,待测血液生理指标;部分制取血清,保存于-80 ℃备用,用来测定血液生化指标及激素水平。另采集肝脏组织,置于-80 ℃超低温冰箱内保存备用。
1.4 血液样本分析
血液生理指标采用BS-1800全自动血液细胞分析仪(迈瑞,深圳)进行分析,包括红细胞(Red blood cell,RBC)、白细胞(White blood cell,WBC)、血红蛋白(Hemoglobin,HGB)。
采用BS-180全自动生化分析仪(迈瑞,深圳)及相配套的试剂盒,对血清中血糖(Glucose,GLU),总蛋白(Total protein,TP),白蛋白(Albumin,ALB),丙氨酸氨基转移酶(Glutamate pyruvic transaminase,GPT)和天门冬氨酸氨基转移酶(Glutamic oxaloacetic transaminase,GOT)的活力测定和分析。
使用碘125皮质醇放射免疫分析试剂盒(九鼎,天津),采用RIA液相平衡竞争放射性免疫分析法进行血清皮质醇(Cortisol,COR)、游离三碘甲腺原氨酸(Free thyroxine 3,FT3)和游离甲状腺素(Free thyroxine 4,FT4)水平的测定。
1.5 肝脏中HSP70表达水平分析
1.5.1 特异性表达引物的设计与合成 根据Mu等[8]的研究成果在NCBI中获得许氏平鲉HSP70mRNA(KC172645.1)的序列,使用Primer5.0、Oligo6.69和DNAMAN6.0等软件设计HSP70的特异性表达引物(见表1)。引物由华大基因Oligo合成进行合成。
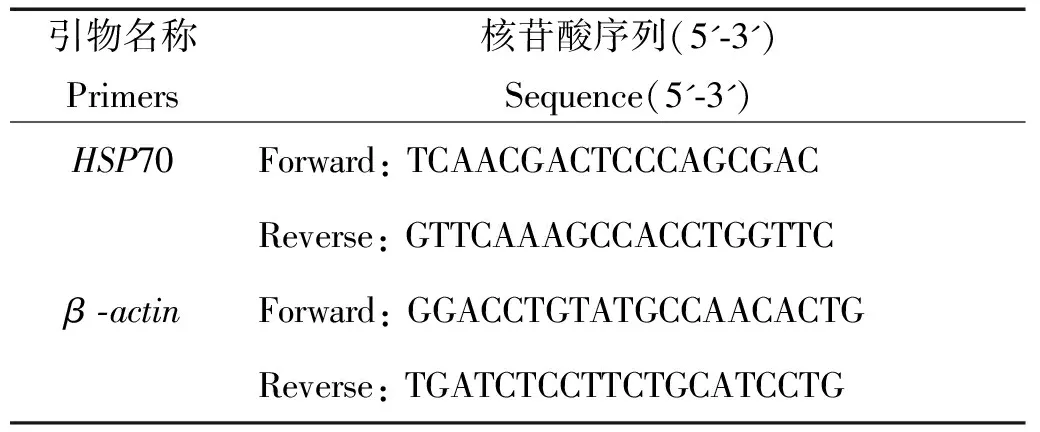
表1 基因表达分析的特异性引物
1.5.2 总RNA的提取 总RNA提取按照Trizol试剂盒说明书相应的步骤进行提取,将提取后的总RNA用核酸测定仪测定每个样品的浓度,以备反转录。同时进行琼脂糖凝胶电泳检测RNA的完整性。
1.5.3 去除基因组DNA和反转录 去除基因组DNA并将RNA反转录成cDNA,实验使用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TAKARA,日本)。
1.5.4HSP70 mRNA相对表达量的检测 检测过程在StepOnePlusTMReal-Time PCR系统(Applied Biosystems,美国)上进行,检测过程中使用SYBR® Premix Ex TaqTM(TliRNaseH Plus)试剂盒(TAKARA,日本)。实验的反应体系如表2所示。

表2 PCR反应体系
实时定量PCR的上机程序为:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环;溶解曲线生成:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,一个循环。以β-actin为内参基因,根据2-△△CT方法计算得到HSP70mRNA的相对表达量。
1.6 肝脏中TRα和TRβmRNA表达的水平的分析测定方法
总RNA的提取、纯化、反转录和表达水平的检测同1.5。
特异性引物的设计根据NCBI中获得许氏平鲉TRαmRNA(JQ409563.1)和TRβmRNA(JQ409564.1)的序列,使用Primer5.0、Oligo6.69和DNAMAN6.0等软件设计HSP70的特异性表达引物如表3。引物由华大基因Oligo合成进行合成。
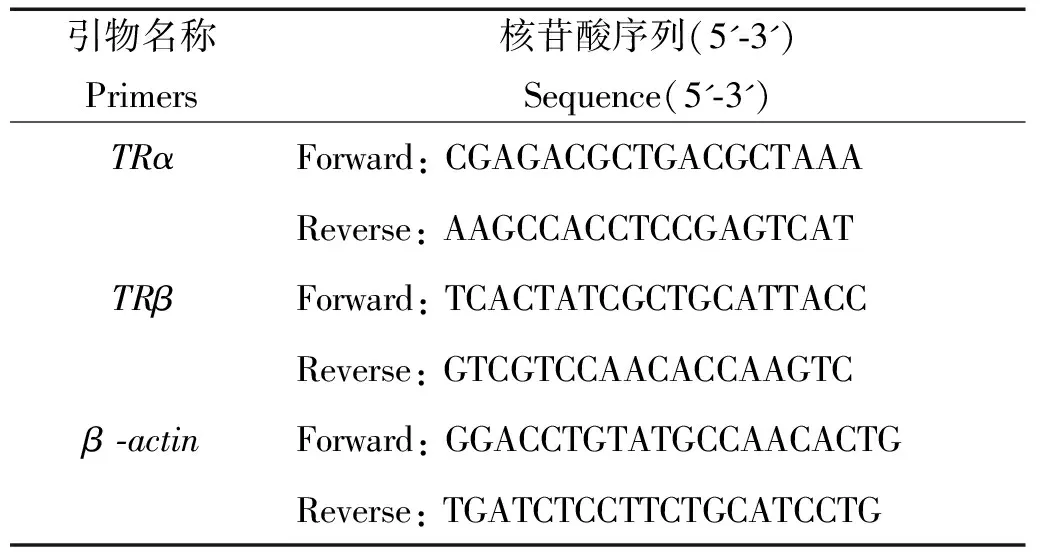
表3 基因表达分析的特异性引物
1.7 数据统计分析
采用SPSS19.0统计软件进行单因素方差分析(ANOVA),在假定方差齐性的条件下,作Turkey-HSD多重比较分析,探究同温度间或不同时间点间各指标数据的差异显著性(若不满足方差齐性,采用Games-Howell法);在P<0.05时为差异显著,所得数据均用平均值±标准误(Mean±SE)表示。
2 结果
2.1 急性高温胁迫对雄性许氏平鲉血液生理指标的影响
急性高温胁迫后,雄性许氏平鲉血液生理指标红细胞(RBC)、血红蛋白(HGB)和白细胞(WBC)的变化水平如图1所示。由图1可知,在胁迫2 h后,RBC数量与对照组相比有显著性升高(P<0.05);6 h后,鱼体内RBC数量与2 h相比呈显著下降趋势(P<0.05)(见图1A)。雄鱼体内HGB的变化情况与RBC相似,2 h后,高温胁迫鱼体内的HGB显著高于对照组(P<0.05),并在6 h后显著下降(P<0.05)(见图1B)。此外,雄性许氏平鲉血液中WBC的数量也随时间呈显著性变化,其中,2 h实验组较对照组显著增加(P<0.05)(见图1C)。
2.2急性高温胁迫对雄性许氏平鲉血液生化指标的影响
2.2.1急性高温胁迫对雄性许氏平鲉血清葡萄糖和皮质醇水平的影响 急性高温胁迫后,雄性许氏平鲉血清葡萄糖(GLU)和皮质醇(COR)变化水平如图2所示。由图2可知,胁迫2 h后血清GLU实验组较对照组有增加趋势,而在6 h后,实验组较对照组显著降低(P<0.05),并且实验组在6 h时,GLU水平只有2 h的1/4。与此同时,在6 h后对照组雄鱼的血清GLU水平较0和2 h显著下降(P<0.05)(见图2A)。血清COR在急性高温胁迫后显著增加(P<0.05),在2h时增至对照组的1.78倍,6 h时增至对照组的2.2倍。但在同一温度不同时间点之间没有显著性的变化(P>0.05)(见图2B)。

(图中标注的大写字母表示同一时间点不同温度间存在显著性差异(P<0.05),小写字母表示同一温度不同时间点间存在显著性差异(P<0.05)。Different capital letters indicate significant differences(P<0.05)at different temperatures of the same time point and different small letters indicate significant differences (P<0.05) in different time points of the same temperature in Tukey-HSD multiple range test.)
图1 急性高温胁迫对雄性许氏平鲉RBC(A)、HGB(B)和WBC(C)水平的影响
Fig.1 Effect of acute high temperature stress on red blood cell(A),hemoglobin(B) and white blood cell(C) levels in maleSebastesschlegelii

(图中标注的大写字母表示同一时间点不同温度间存在显著性差异(P<0.05),小写字母表示同一温度不同时间点间存在显著性差异(P<0.05)。Different capital letters indicate significant differences(P<0.05)at different temperatures of the same time point and different small letters indicate significant differences (P<0.05) in different time points of the same temperature in Tukey-HSD multiple range test.)
图2 急性温度胁迫对雄性许氏平鲉GLU(A)和COR(B)水平的影响
Fig.2 Effect of acute high temperature stress on serum glucose(A) and cortisol(B) levels in maleSebastesschlegelii
2.2.2 急性高温胁迫对雄性许氏平鲉血清蛋白水平的影响 急性高温胁迫对雄性许氏平鲉总蛋白(TP)和白蛋白(ALB)水平的影响如图3所示。由图3可知,TP在6 h时对照组与实验组存在显著性差异(P<0.05)(见图3A),而ALB在2和6 h时实验组与对照组相比都显著性下降(P<0.05)(见图3B)。
2.2.3 急性高温胁迫对雄性许氏平鲉血清转氨酶活性的影响 急性高温胁迫对雄性许氏平鲉血清转氨酶水平的影响如图4所示。由图4可知,丙氨酸氨基转移酶(GPT)和天门冬氨酸氨基转移酶(GOT)在胁迫2、6 h后,实验组与对照组相比显著性升高(P<0.05),但同一温度不同时间点之间各组没有出现显著性的变化。
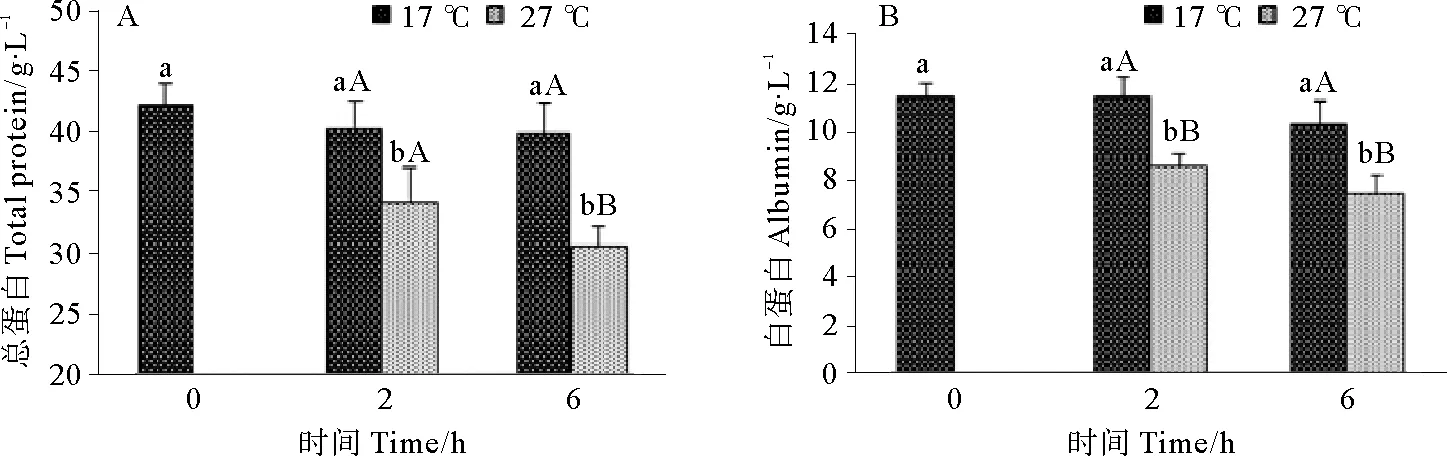
(图中标注的大写字母表示同一时间点不同温度间存在显著性差异(P<0.05),小写字母表示同一温度不同时间点间存在20显著性差异(P<0.05)。Different capital letters indicate significant differences (P<0.05) at different temperatures of the same time point and different small letters indicate significant differences (P<0.05) in different time points of the same temperature in Tukey-HSD multiple range test.)
图3 急性高温胁迫对雄性许氏平鲉血清TP(A)和ALB(B)水平的影响
Fig.3 Effect of acute high temperature stress on serum total protein(A) and albumin(B) levels in maleSebastesschlegelii
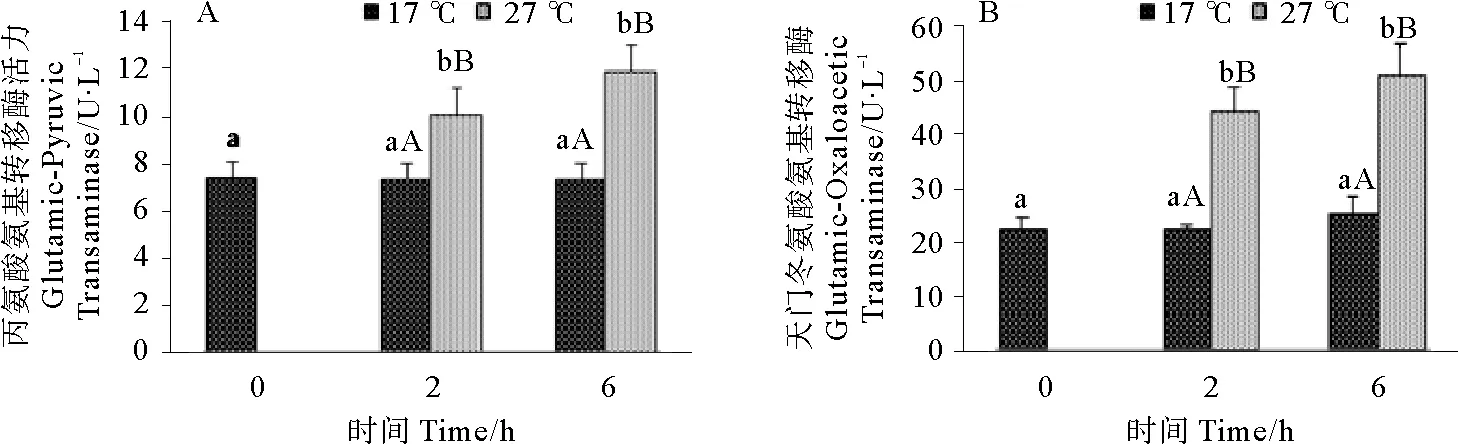
(图中标注的大写字母表示同一时间点不同温度间存在显著性差异(P<0.05),小写字母表示同一温度不同时间点间存在显著性差异(P<0.05)。Different capital letters indicate significant differences (P<0.05) at different temperatures of the same time point and different small letters indicate significant differences (P<0.05) in different time points of the same temperature in Tukey-HSD multiple range test.)
图4 急性高温胁迫对雄性许氏平鲉血清GPT(A)和GOT(B)活力的影响
Fig.4 Effect of acute high temperature stress on serumglutamic-pyruvic transaminase (A) and glutamic-oxaloacetic transaminase (B) activities in maleSebastesschlegelii
2.3 急性高温胁迫对雄性许氏平鲉肝脏HSP70 mRNA的影响
急性高温胁迫对雄性许氏平鲉肝脏HSP70 mRNA的影响如图5所示。由图5可知,雄性许氏平鲉肝脏中HSP70 mRNA的表达水平在2和6 h较对照组都出现了显著性升高(P<0.05),并且在胁迫2 h时升高幅度最为显著,为对照组的5.08倍。但经过4 h后出现显著下降变化(P<0.05)。
2.4 高温胁迫对雄性许氏平鲉甲状腺激素水平的影响
急性高温胁迫对雄性许氏平鲉甲状腺激素水平的影响如图6所示。由图6可知,胁迫后雄性许氏平鲉的甲状腺激素水平随温度和时间均出现了显著性变化。FT3在胁迫6h后迅速降低,并与对照组出现了显著性差异(P<0.05),同时实验组在胁迫2~6 h的过程中,FT3水平也显著下降(P<0.05)(见图6A);雄鱼FT4水平在胁迫下出现下降趋势,并在2 h时较对照组显著下降(P<0.05)(见图6B)。
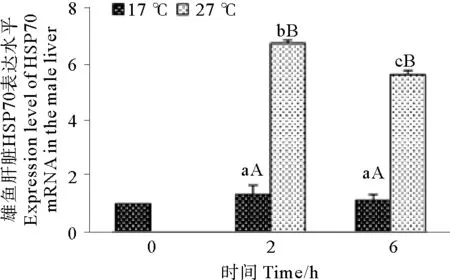
(图中标注的大写字母表示同一时间点不同温度间存在显著性差异(P<0.05),小写字母表示同一温度不同时间点间存在显著性差异(P<0.05)。Different capital letters indicate significant differences (P<0.05) at different temperatures of the same time point and different small letters indicate significant differences (P<0.05) in different time points of the same temperature in Tukey-HSD multiple range test.)
图5 急性高温胁迫对雄性许氏平鲉肝脏HSP70 mRNA表达水平的影响
Fig.5 Effect of acute high temperature stress on expression levels ofHSP70 mRNAs in liver of maleSebastesschlegelii
急性高温胁迫对雄性许氏平鲉肝脏中TRα和TRβmRNA表达水平的影响如图7所示。由图7可知,急性高温胁迫后雄性许氏平鲉TRα和TRβmRNA的表达水平都呈下降趋势。雄鱼TRαmRNA的表达量只在2 h实验组较对照组显著下降(P<0.05)(见图7A),而TRβmRNA的表达量在2和6 h实验组较对照组都显著下降(P<0.05)(见图7B)。
3 讨论
3.1 急性高温胁迫对雄性许氏平鲉血液生理生化指标的影响
红细胞(RBC)是血液中最主要的成分,主要功能是携带和运输氧气,以满足机体生理活动和运动的需要。血红蛋白(HGB)是血液中承担运输氧气的直接载体。RBC和HGB的数量与鱼类的呼吸、运动、代谢和生态等都有着密切的关系。在14、19和23 ℃ 3个梯度下,虹鳟红细胞数量随水温上升而减少,鳙鱼(Aristichlhysnobilis)红细胞数量却是随水温上升而增加[9]。本实验中,雄性许氏平鲉在急性高温胁迫后,RBC和HGB呈先上升后下降的趋势,说明水温升高,机体需要增加呼吸量和代谢率维持新陈代谢和稳态,从而增加红细胞数量以增强携氧能力。白细胞(WBC)作为鱼类机体细胞免疫和体液免疫的重要成分,主要作用是保护机体抵御外部和内部的伤害。本实验中雄鱼在2 h时WBC数量显著增加是机体免疫系统对高温胁迫应答的结果。
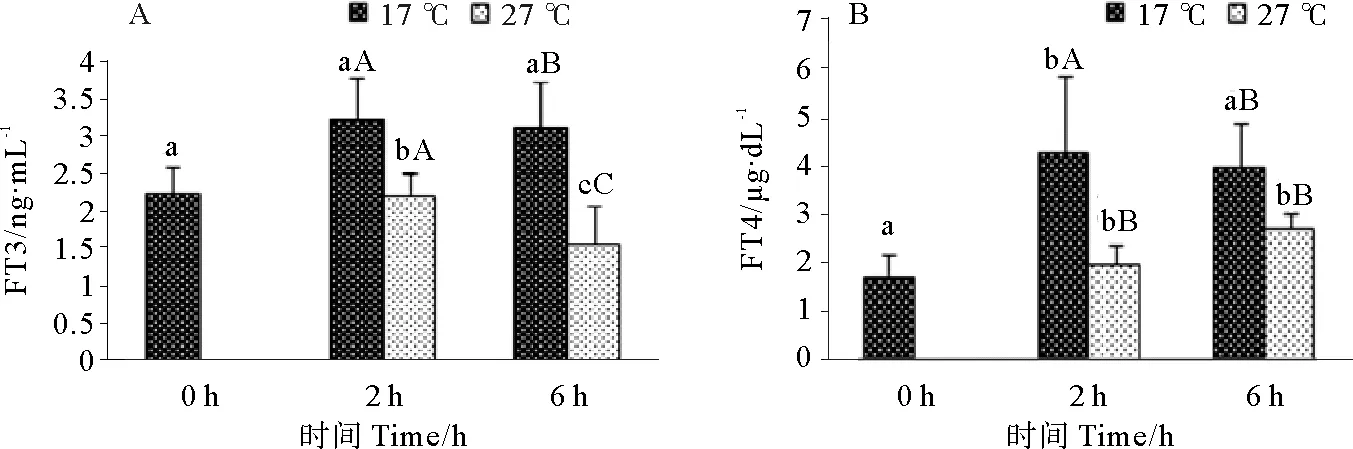
(图中标注的大写字母表示同一时间点不同温度间存在显著性差异(P<0.05),小写字母表示同一温度不同时间点间存在显著性差异(P<0.05)。Different capital letters indicate significant differences (P<0.05) at different temperatures of the same time point and different small letters indicate significant differences (P<0.05) in different time points of the same temperature in Tukey-HSD multiple range test.)
图6 急性高温胁迫对雄性许氏平鲉血清FT3(A)和FT4(B)水平的影响
Fig.6 Effect of acute high temperature stress on serumfreetriiodothyronine(A)and free thyroxine (B)of maleSebastesschlegelii
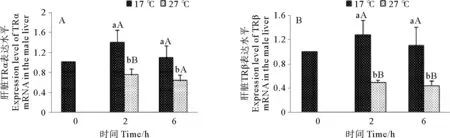
(图中标注的大写字母表示同一时间点不同温度间存在显著性差异(P<0.05),小写字母表示同一温度不同时间点间存在显著性差异(P<0.05)。Different capital letters indicate significant differences(P<0.05)at different temperatures of the same time point and different small letters indicate significant differences (P<0.05) in different time points of the same temperature in Tukey-HSD multiple range test.)
图7 急性高温胁迫对雄性许氏平鲉肝脏TRα(A)和TRβ(B)mRNA表达水平的影响
Fig.7 Effect of acute high temperature stress on expression levels ofTRα(A)andTRβ(B)mRNAs in liver of maleSebastesschlegelii
血清葡萄糖(GLU)作为直接能源物质可以为机体的各项生命活动提供能量。血清皮质醇(COR)浓度的升高可被看作是鱼类应激的灵敏信号。研究发现,当鱼类处于温度胁迫状态时,血清GLU和COR有上升趋势[10];对罗非鱼进行高温处理,结果显示血糖含量显著上升[11];对吉富品系尼罗罗非鱼和斑点叉尾鮰(Ictaluruspunctatus)的研究发现,低温有助于皮质醇的增加[7]。本实验中COR水平在受到胁迫时迅速增加,这是温度急剧变化刺激鱼类下丘脑-垂体-肾间组织轴作用的结果。COR还可加强肝脏中糖异生作用,维持血糖水平稳定[12]。因此GLU的增加既是能量代谢加快的需要也是机体对外界刺激的响应。在本实验中GLU在2 h显著高于0和6 h,是高温条件下鱼体能量消耗增加和COR对其调节的结果。
蛋白质是血清的主要组成部分。总蛋白(TP)具有维持血液正常胶体渗透压,维持pH值恒定的作用,参与脂肪酸、固醇等物质运输并与免疫功能相关;血清白蛋白(ALB)是机体重要的免疫蛋白,与鱼体的抗病及环境适应能力有着密切的关系。鲫(Carassiusauratus)在9~25 ℃水温范围内,TP、ALB随水温上升而上升,并在25 ℃时达到最大值,而超过25 ℃后,TP、ALB含量均随水温升高而下降[13]。对团头鲂高温应激的实验也发现TP和ALB出现显著下降[10]。本研究中,TP和ALB均出现显著下降,这是因为在高温胁迫下,神经内分泌系统产生大量皮质醇影响机体的物质代谢和免疫系统,加速蛋白的分解。研究表明,动物应激过程中神经内分泌系统功能的变化对免疫机制有抑制作用[14],而ALB与机体的免疫功能密切相关,在胁迫2h时显著下降,这可能是鱼类神经内分泌系统调节造成的。
3.2 急性高温胁迫对雄性许氏平鲉肝脏代谢和HSP70mRNA的影响
转氨酶在氨基酸代谢及蛋白质、脂肪和糖类相互转化的进程中意义重大[15],其中谷氨酸氨基转移酶(GPT)和天门冬氨酸氨基转移酶(GOT)是很重要的两种转氨酶。研究显示,虹鳟GPT活性随水温上升而升高,GOT活性随水温上升先上升后下降;鳙鱼GPT酶活性随水温上升先略有升高后快速下降,GOT活性随水温上升略有下降[9]。血清GOT和GPT活力的变化被认为是心脏和肝脏受损的重要标志[16]。本研究中,雄性许氏平鲉转氨酶活力在胁迫后迅速升高,并持续到胁迫6 h,这与何福林[17]等对虹鳟的研究结果类似。对虹鳟和鳙鱼的研究还发现,GOT和GPT在达到峰值后出现了下降,但是本实验没有得出这一结果,这可能与实验胁迫时间较短,GOT和GPT在肝脏中的合成还未受到影响有关。
HSP70是HSPs家族重要成员之一,作为分子伴侣在调节、修复和降解变性蛋白质方面起重要作用,可以清除应激所造成细胞内异常或蛋白质变性[18]。研究表明,温度胁迫可以诱导HSP70在转录水平表达,降低温度胁迫对机体的伤害。对团头鲂进行高温(34 ℃)胁迫发现,胁迫过程中肝脏HSP70 mRNA水平先升高后下降,说明该基因的表达受热应激的调控[19];强俊等[7]研究了急性温度胁迫下尼罗罗非鱼肝脏HSP70 mRNA表达的变化,结果表明21和31 ℃应激组在6h时,HSP70 mRNA表达量达到对照组的1.7和1.6倍。本实验中HSP70 mRNA表达水平在受到高温胁迫后急速增加,并在2 h达到对照组的5.08倍。这是许氏平鲉通过增加HSP70表达量以适应高温的结果,进一步说明了HSP70 mRNA的表达受到温度调控。经过6 h,HSP70 mRNA表达水平始终显著高于对照组,没有出现上述实验中的下降变化,这是因为胁迫时间较短,HSP70对细胞的保护作用还在其阈值范围内,或者HSP70还未从细胞中流失。对此需要做进一步实验进行探究。
3.3 高温胁迫对雄性许氏平鲉甲状腺激素水平的影响
面对环境胁迫,鱼类的神经-内分泌-免疫系统会做出应激反应,达到防御、自身稳定与免疫监督的作用,从而稳定机体内环境。其中下丘脑-垂体-甲状腺(HPT)轴在整个应激过程中起到了重要的作用[20]。
甲状腺激素(FTH)是维持血脂正常代谢的重要激素之一[21],主要为三碘甲状腺原氨酸(FT3)和甲状腺素(FT4)。甲状腺激素中FT3在鱼体内代谢比FT4要快许多,所以FT3在一定程度上更能代表甲状腺的功能。已有研究报道,低温可以使罗非鱼的血清FT3水平升高[22];刘群等[23]研究发现随着养殖密度增加,FT3和FT4的含量逐渐降低。本研究中,T3和T4水平在27 ℃下都显著下降,说明此温度已经超过许氏平鲉的适温范围。总的来看,甲状腺激素水平的降低,是鱼类降低机体基础代谢,减少产热和散热,减少能量损耗的结果。这对鱼体面对高温胁迫提高其免疫力具有重要意义,是鱼类对水温升高的适应性变化。
甲状腺激素受体(TRs)是一类受体激活型转录因子[24]。研究表明,甲状腺激素产生的生物学效应都是通过甲状腺激素受体介导的[25],通过与其受体进行结合,调节相关基因的表达,以此发挥其生物学作用。许多研究表明,THs在鱼类早期生长发育及繁殖过程中起到重要的调控作用[26],并且在免疫应答方面也具有重要的作用。本研究中,雄性许氏平鲉的TRα和TRβmRNA经过高温胁迫后表达水平均显著下降。TRα和TRβmRNA表达水平的下降与T3和T4含量的相一致,可以看出这两者之间是呈正相关的。急性高温胁迫使许氏平鲉TRα和TRβmRNA的表达水平降低,影响了甲状腺轴的内分泌调节。
急性高温胁迫影响了许氏平鲉HPT轴的神经内分泌调节功能,使TRα和TRβmRNA的表达水平下降,因此导致血清FT3和FT4含量也出现下降,而甲状腺激素对血清脂类的代谢调节及鱼类本身对能量需求的调节使TG和TC最终也表现为显著下降。
4 结论
根据本实验的结果,全球变暖的大背景下,海水水温的异常升高将导致许氏平鲉机体出现应激。应激状态下,鱼体代谢水平上升,原本用于生长的能量被大量消耗[27]。因此,养殖实践中应选择合适的养殖区域(水温:18~24 ℃),避免许氏平鲉在高温海水中因应激而出现的机体损伤或免疫水平下降。
[1] 许友卿, 曹占旺, 丁兆坤, 等. 高温对鱼类的影响及其预防研究 [J]. 水产科学, 2010, 29: 235-242.
XU You-qing, CAO Zhan-wang, DING Zhao-kun, et al. Effects and prevention of high temperature on fishes[J]. Fisheries Science, 2010, 29: 235-242.
[2] 徐革锋, 王裕玉, 韩英, 等. 不同温度条件下运动和摄食对细鳞鲑幼鱼代谢模式的影响 [J]. 应用生态学报, 2014, 25: 1156-1162.
XU Ge-feng, WANG Yu-yu, HAN Ying, et al. Effect of locomotion and feeding on metabolic mode of juvenile lenok,Brachymystaxlenok(Pallas) under different water temperatures[J]. Chinese Journal of Applied Ecology, 2014, 25: 1156-1162.
[3] 刘永新, 周勤, 张红涛, 等. 温度对红鳍东方鲀早期生长和性别分化的影响 [J]. 南方水产科学, 2014(5): 24-29.
LIU Yong-xin, ZHOU Qin, ZHANG Hong-tao, et al. Effect of temperature on growth and sex differentiation at early developmental stage of redfin puffer (Takifugurubripes)[J]. South China Fisheries Science, 2014(5): 24-29.
[4] Chen W H, Sun L T, Tsai C L, et al. Cold-Stress induced the modulation of catecholamines, cortisol, immunoglobulin m, and leukocyte phagocytosis in tilapia [J]. General & Comparative Endocrinology, 2002, 126: 90-100.
[5] Magnadóttir B, Jónsdóttir H, Helgason S, et al. Immune parameters of immunised cod (Gadusmorhua L.) [J]. Fish & Shellfish Immunology, 2001, 11: 75-89.
[6] Hardie L J, Fletcher T C, Secombes C J. Effect of temperature on macrophage activation and the production of macrophage activating factor by rainbow trout (Oncorhynchusmykiss) leucocytes [J]. Developmental & Comparative Immunology, 1994, 18: 57-66.
[7] 强俊, 杨弘, 王辉, 等. 急性温度应激对吉富品系尼罗罗非鱼(Oreochromisniloticus)幼鱼生化指标和肝脏HSP70mRNA表达的影响 [J]. 海洋与湖沼, 2012, 43: 943-953.
QIANG Jun, YANG Hong, WANG Hui, et al. The effect of acute temperature stress on biochemical indices and expression of liverHSP70 mRNA in GIFT nile tilapia juveniles (Oreochromisniloticus) [J]. Oceanologia et Limnologia Sinica, 2012, 43: 943-953.
[8] Mu W, Wen H, Li J, et al. Cloning and expression analysis of a HSP70 gene from Korean rockfish (Sebastesschlegelii)[J]. Fish & Shellfish Immunology, 2013, 35(4): 1111-1121.
[9] 向建国, 何福林. 水温影响虹鳟红细胞数量变化的初步研究 [J]. 当代水产, 2006, 31: 37-38.
Xiang Jian-guo, He Fu-lin. Preliminary study on temperature affect red blood cell count changes on rainbow trout [J]. Current Fisheries, 2006, 31: 37-38.
[10] 刘波. 高温应激与大黄蒽醌提取物对团头鲂生理反应及相关应激蛋白表达的影响[D]. 南京: 南京农业大学, 2012.
Liu Bo. Effects of High Temperature Stress and Anthraquinone Extract fromRheumofficinaleBail on the Physiological Response and Gene Expression of Heat Shock Protein of Wuchang Bream (MegalobYamaamblycephala) [D]. Nanjing: Nanjing Agricultural University, 2012.
[11] 彭婷, 胡庭俊, 林勇, 等. 低温胁迫对罗非鱼血液生化、免疫及抗氧化指标的影响 [J]. 水产科学, 2012, 31: 259-263.
Peng Ting, Hu Ting-jun, Lin Yong, et al. Effects of low temperature stress on indices of biochemistry, immunity and antioxidation in nile tilapia [J]. Fisheries Science, 2012, 31: 259-263.
[12] Snedecor J G, King D B, Henrikson R C. Studies on the chick glycogen body: Effects of hormones and normal glycogen turnover [J]. General & Comparative Endocrinology, 1963, 3: 176-183.
[13] 韩京成, 刘国勇, 梅朋森, 等. 温度对鲫血液生化指标和消化酶的影响 [J]. 水生态学杂志, 2010(1):87-92.
Han Jing-cheng, Liu Guo-yong, Mei Peng-sen, et al. Effects of temperature on the hematological indices and digestive enzyme activities of Crucian carp (Carassiusauratus)[J]. Journal of Hydroecology, 2010(1):87-92.
[14] 马文涛, 杨来启, 林玉梅, 等. 应激对大鼠血清皮质醇及白细胞介素2、6、8水平的影响 [J]. 中国心理卫生杂志, 2002, 16: 14-15.
Ma Wen-tao, Yang Lai-qi, Lin Yu-mei, et al. Effects of stress on serum interleukin 2, 6, 8 and cortisol levels in rats [J]. Chinese Mental Health Journal, 2002, 16: 14-15.
[15] 刘伟, 李佐锋. 温度对链鳙鱼生理生化指标的影响 [J]. 东北师大学报: 自然科学版, 1996(2): 108-112.
Liu Wei, Li Zuo-feng. Effeets of temperatures on the physiological and bioehemical index of silver carp and bighead carp [J]. Journal of Northeast Normal University(Natural Science Edition), 1996(2): 108-112.
[16] 张桂兰. 虹鳟鱼血液学指标的测定 [J]. 水产学杂志, 1991,4(2): 80-84.
Zhang Gui-lan. Determination of hematological indices of rainbow trout [J]. Chinese Journal of Fisheries, 1991,4(2): 80-84.
[17] 何福林, 向建国, 李常健, 等. 水温对虹鳟血液学指标影响的初步研究 [J]. 水生生物学报, 2007, 31: 363-369.
He Fu-lin, Xiang Jian-guo, Li Chang-jian, et al. Preliminary study on the effect of water temperature on hematology indices of Rainbow trout [J]. Acta Hydrobiologica Sinica, 2007, 31: 363-369.
[18] Encomio V G, Chu F L. Heat shock protein (hsp70) expression and thermal tolerance in sublethally heat-shocked eastern oysters Crassostreavirginica infected with the parasite Perkinsusmarinus [J]. Diseases of Aquatic Organisms, 2007, 76: 251-260.
[19] 明建华, 谢骏, 刘波, 等. 团头鲂HSP70 cDNA的克隆、序列分析以及热应激对其mRNA表达的影响 [J]. 中国水产科学, 2009, 16: 635-648.
Ming Jian-hua, Xie Jun, Liu Bo, et al. Cloning, sequence analysis ofHSP70 cDNA and effects of heat stress on its mRNA expression inMegalobramaamblycephala[J]. Journal of Fishery Sciences of China, 2009, 16: 635-648.
[20] 边原, 李刚, 杨勇, 等. 甲状腺激素在免疫应答方面的研究进展 [J]. 实用药物与临床, 2015, 18: 219-222.
Bian Yuan, Li Gang, Yang Yong, et al. Research progress of thyroid hormone upon immune response [J]. Practical Pharmacy and Clinical Remedies, 2015, 18: 219-222.
[21] Duntas L H. Thyroid disease and lipids [J]. Thyroid Official Journal of the American Thyroid Association, 2002, 12: 287-293.
[22] 刘波, 王美垚, 谢骏, 等. 低温应激对吉富罗非鱼血清生化指标及肝脏HSP70基因表达的影响 [J]. 生态学报, 2011, 31: 4866-4873.
Liu Bo, Wang Mei-yao, Xie Jun, et al. Effects of acute cold stress on serum biochemical and immune parameters and liver HSP70 gene expression in GIFT strain of Nile tilapia (Oreochromisniloticus) [J]. Acta Ecologica Sinica, 2011, 31: 4866-4873.
[23] 刘群, 温海深, 李吉方, 等. 网箱养殖密度对虹鳟甲状腺激素及血脂指标的影响 [J]. 水生生物学报, 2014, 38: 1076-1083.
Liu Qun, Wen Hai-shen, Li Ji-fang, et al. Effects of different stocking density on the levels of thyrioid hormone and plasma lipids inoncorhynchusmykiss[J]. Acta Hydrobiologica Sinica, 2014, 38: 1076-1083.
[24] Yen P M, Ando S, Xu F, et al. Thyroid hormone action at the cellular, genomic and target gene levels [J]. Molecular & Cellular Endocrinology, 2006, 246: 121-127.
[25] 张俊玲, 施志仪. 牙鲆早期阶段的变态发育及其机制 [J]. 上海海洋大学学报, 2003, 12: 348-352.
Zhang Jun-ling, Shi Zhi-yi. Metamorphosis and mechanism during early development of Japanese flounder,Paralichthysolivaceus[J]. Journal of Shanghai Ocean University, 2003, 12: 348-352.
[26] 张晓娜, 田华, 汝少国. 鱼类甲状腺轴对胚胎发育、仔鱼变态及性别分化的调控作用研究进展 [J]. 中国海洋大学学报(自然科学版), 2012(S1): 94-101.
Zhang Xiao-na, Tian Hua, Ru Shao-guo. Advances in piscine thyroidal axis and its regulatory effects on embryogenesis, metamorphosis and sex differentiation [J]. Periodical of Ocean University of China, 2012(S1): 94-101.
[27] Andrade T, Afonso A, Pérez-Jiménez A, et al. Evaluation of different stocking densities in a Senegalese sole (Soleasenegalensis) farm: implications for growth, humoral immune parameters and oxidative status[J]. Aquaculture, 2015, 438: 6-11.
责任编辑 朱宝象
Effect of Temperature on Physiological and Biochemical Parameters and Gene Expression of MaleSebastesschlegelii
WEN Hai-Shen, LV Li-Kang, LI Lan-Min, ZHAO Ji, ZHANG Si-Min
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
In this study, we took the male black rockfish (Sebastesschlegelii) as the research object. Physiological and biochemical parameters of this species and the expressions of its related liver genes were detected after acute temperature treat. The results showed that RBC and HGB first increased and then decreased; and WBC increased significantly(P<0.05). At the same time, serum cortisol (COR), serum glucose (GLU) and protein contents changed significantly after acute heat treat (P<0.05). GLU had varied similarly with the blood cells while COR significantly increased throughout the whole process (P<0.05) and serum protein content tended to decrease overall(P<0.05). The activity of alanine aminotransferase (GPT) and aspartate aminotransferase (GOT) significantly elevated at 2 h and 6 h after acute heat treat (P<0.05). After the acute heat shock, the abundance ofHSP70 mRNA increased significantly at 2 h and 6 h in male black rockfish (P<0.05). The level of thyroid hormone showed a downward trend as well. Lipid level changed similarly to thyroid hormone but showed a significant change as the temperature and time went by. The abundance ofTRαandTRβmRNA decreased significantly after acute heat treat (P<0.05). The male black rockfish was in stress state after acute heat treat, its physiological and physiological parameters and liver gene expression were affected by high temperature.
Sebastesschlegelii; hematological physiology; HSP70; thyroid hormone; thyroid hormone receptor; heat shock
国家自然科学基金项目(41476110)资助
2016-06-30;
2016-08-19
温海深(1963-),男,教授,研究方向:鱼类生理与繁育。E-mail: wenhaishen@ouc.edu.cn
S917.4
A
1672-5174(2016)11-044-08
10.16441/j.cnki.hdxb.20160241
温海深, 吕里康, 李兰敏, 等. 急性高温胁迫对雄性许氏平鲉血液生理生化及相关基因表达的影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(11): 44-51.
WEN Hai-Shen, LV Li-Kang, LI Lan-Min, et al. Effect of temperature on physiological and biochemical parameters and gene expression of maleSebastesschlegelii[J]. Periodical of Ocean University of China, 2016, 46(11): 44-51.
Supported by the National Natural Science Foundation of China(41476110)

