五个绵羊群体KAP11-1基因核苷酸序列变异分析
朱建勋,王继卿,胡 江,刘 秀,李少斌,闫 伟,罗玉柱
(甘肃农业大学 动物科学技术学院,甘肃省草食动物生物技术重点实验室,甘肃 兰州 730070)
五个绵羊群体KAP11-1基因核苷酸序列变异分析
朱建勋,王继卿,胡 江,刘 秀,李少斌,闫 伟,罗玉柱
(甘肃农业大学 动物科学技术学院,甘肃省草食动物生物技术重点实验室,甘肃 兰州 730070)
为了分析绵羊KAP11-1基因的核苷酸序列变异,采用PCR-SSCP方法和DNA测序技术检测了欧拉羊、甘肃高山细毛羊、滩羊、湖羊和青海细毛羊5个群体(749只个体)KAP11-1基因的单核苷酸多态性,同时分析了等位基因频率、遗传杂合度、有效等位基因数和多态信息含量等群体遗传特征。结果表明,5个绵羊群体的KAP11-1基因中共检测到c.93C/T、c.240G/A、c.285C/G/A和c.331A/G 4个单核苷酸多态位点,且c.331A/G为非同义突变。等位基因A在5个群体中出现的频率最高(87.70%),为优势等位基因,其次为等位基因B(基因频率为11.03%),等位基因C和D的频率最低(分别为0.53%和0.74%)。群体遗传学分析结果表明,滩羊KAP11-1基因的遗传杂合度、有效等位基因数和多态信息含量均高于其余4个群体。KAP11-1基因作为羊毛经济性状的主要候选基因之一,其核苷酸序列的变异导致KAP11-1中相应氨基酸的改变,最终可能会影响羊毛纤维的结构和羊毛主要经济性状。
绵羊;KAP11-1基因;核苷酸序列变异;PCR-SSCP;单核苷酸多态性
羊毛纤维的主要结构由角蛋白(Keratins)和角蛋白关联蛋白(Keratin-associated proteins,KAPs)构成。大量的角蛋白聚集成束形成8~10 nm的角蛋白中间丝(Keratin intermediate filaments,KIFs),KAPs则通过大量的二硫键交联形成半刚性基质嵌入到KIFs的半胱氨酸残基中[1]。KAPs最典型的特征是结构中含有较高比例的半胱氨酸或甘氨酸/酪氨酸残基,并根据其含量的不同分为3类,分别是高硫角蛋白关联蛋白(HS-KAPs,≤30 mol% Cysteine)、超高硫角蛋白关联蛋白(UHS-KAPs,>30mol% Cysteine)、高甘氨酸/酪氨酸角蛋白关联蛋白(HGT-KAPs,35~60 mol% Glycine/Tyrosine)[1]。目前,共发现和命名了27个KAPs家族成员,其中KAP1~3、KAP10~16和KAP23~27属于HS-KAPs;KAP4、KAP5、KAP9和KAP17属于UHS-KAPs;KAP6~8和KAP18~22属于HGT-KAPs[2]。
KAPs基因是编码羊毛纤维的重要结构基因,长度较小(约600~1 500 bp),一般包含一个单独的外显子,且外显子被一些介入序列隔开[3]。研究表明,KAPs基因与羊毛的质量和产量存在相关性[4],因此可以找到一些与毛用性状密切相关的分子遗传标记,为绵羊品种改良提供繁殖新技术。艾买提·买买提[5]通过对KAP9-2基因位点不同基因型与剪毛量的相关性分析发现,AA、AB、BB和CC基因型对应羊只个体的剪毛量差异显著(P<0.05),推测KAP9-2基因可作为中国美利奴羊(新疆型)剪毛量的有效分子标记。Parsons等[6]研究发现KAP6和KAP8与羊毛产量和纤维直径有明显的相关性,并推测在KAP6和KAP8同一区域可能存在着控制羊毛纤维直径的主效基因。Cockett等[7]进一步证实了KAP6和羊毛纤维直径之间的相关性。孙福亮等[8]发现新吉细毛羊KAP13-1基因的CC基因型对应个体的产毛量显著高于TT基因型(P<0.05),NN基因型对应个体的产毛量和羊毛拉伸长度显著高于MM基因型(P<0.05),认为可通过提高CC和NN基因型的频率来增加新吉细毛羊的产毛量和羊毛拉伸长度。
KAP11-1基因是目前在KAP11基因家族中发现的唯一一个基因,有关该基因的遗传变异在绵羊、人、牛和小鼠上已有报道[9-12],但在中国绵羊品种上没有相关研究。因此,本试验以绵羊KAP11-1基因为候选基因,采用PCR-SSCP方法,结合DNA测序技术,分析该基因在5个中国绵羊群体中的遗传特征,丰富我国羊毛基因组研究内容,为绵羊毛用性状的分子标记辅助选择提供理论基础依据。
1 材料和方法
1.1 试验材料及DNA提取
采集5个绵羊品种的749份血样,包括欧拉羊、甘肃高山细毛羊、滩羊、湖羊和青海细毛羊,具体采样地点、血样储存类型及样本数量见表1。根据常规采样要求,每只羊颈静脉采血2 mL,不加任何抗凝剂,直接滴于FTA卡(Whatman,Middlesex,UK)上,室温下放置、晾干备用。用Zhou等[13]描述的2步法提取FTA卡中的基因组DNA,用于PCR扩增。

表1 试验样本信息
1.2 引物设计和PCR扩增
根据GenBank中绵羊KAP11-1基因序列(登录号:HQ595347),利用DNAMAN 软件(version 5.2.10,Lynnon BioSoft,Vaudreuil,Canada)设计特异性引物,扩增该基因部分编码区序列,目的片段大小为408 bp。上游引物序列为5′-GGATTGGAGGAGAAT
ACACTG-3′;下游引物序列为5′-ACTGCTGGTACGT
CCTGGAG-3′。引物由上海生工生物工程有限公司合成。
PCR反应总体积20 μL,其中Taq预混酶(北京百泰克生物技术有限公司)10 μL,上、下游引物(0.25 μmol/L)各0.4 μL,ddH2O为8.2 μL,基因组DNA为1.2 mm 的FTA卡小圆片1个(约相当于50 ng/μL基因组DNA 1.0 μL)。
PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,63 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃终延伸7 min,4 ℃保存。PCR扩增产物用1%的琼脂糖凝胶电泳检测。
1.3 SSCP分析
取2 μL的PCR扩增产物,加入8 μL变性上样缓冲液(98%去离子甲酰胺,10 mmol/L EDTA,0.025%溴酚蓝和0.025%二甲苯氰),95 ℃变性5 min后,立即置于冰水混合物中,迅速上样于10%的非变性聚丙烯酰胺凝胶(Acr∶Bis=37.5∶1)中,于260 V、18 ℃条件下在0.5×TBE 缓冲液中电泳20 h。
1.4 银染
电泳结束后,根据Byun等[14]描述的方法银染聚丙烯酰胺凝胶。
1.5 等位基因序列测定
等位基因测序方法因纯合子和杂合子而异。如果SSCP条带是纯合子,用PCR 扩增产物直接测序;如果SSCP条带是杂合子,按照Gong等[15]描述的方法切胶测序。序列测定由上海生工生物工程有限公司完成。
1.6 数据统计分析
利用DNAMAN 软件(version 5.2.10,Lynnon BioSoft,Vaudreuil,Canada)比对等位基因核苷酸序列,用GenBank中在线Blast软件(http://www.ncbi.nlm.nih.goc/)比对本试验获得的等位基因序列与绵羊基因组(Genome assembly v3.1,Oar3.1)已有序列的同源性。利用Popgen 32.0软件计算等位基因频率、遗传杂合度(He)、有效等位基因数(Ne)和Hardy-Weinberg平衡定律。采用PIC软件计算群体多态信息含量(PIC)。在GenBank数据库中,选取绵羊(HQ595347)、山羊(NM_001285767.1)、牛(NM_001080740.1)、人(NM175858.2)、猕猴(XM_001083627.1)和小家鼠(NM_001113406.1)KAP11-1基因的核苷酸序列,比较物种间核苷酸序列同源性,并根据不同物种间KAP11-1基因的遗传距离,用MEGA(version 5.0)软件构建NJ系统发育树。
2 结果与分析
2.1KAP11-1基因的PCR扩增结果
KAP11-1基因的PCR产物经1%的琼脂糖凝胶电泳检测,得到一条特异性较好的电泳条带(图1),且片段大小为408 bp,与目的片段大小一致,可以进行下一步的SSCP分析。

M.Marker;1~3.欧拉羊;4~5.甘肃高山细毛羊;6.滩羊;7~8.湖羊;9.青海细毛羊。
M.DNA Marker;PCR products in lane 1-3,lane 4-5,lane 6,lane 7-8 and lane 9 are random individual from Oula sheep,Gansu Alpine Merino,Tan sheep,Hu sheep and Qinghai merino sheep,respectively.
图1 绵羊KAP11-1基因的PCR扩增检测图
Fig.1 PCR amplification ofKAP11-1 gene in sheep
2.2KAP11-1基因的SSCP检测结果
KAP11-1基因的PCR扩增产物经SSCP分析后,在5个绵羊群体的749只个体中共检测到4个等位基因(分别命名为A、B、C、D)和6种基因型(AA、BB、AB、AC、AD、BD)(图2)。经在线Blast软件比对发现,等位基因A、B、C的核苷酸序列与已提交的绵羊KAP11-1基因的部分序列相同(登录号:HQ595347、HQ595351、HQ595352),等位基因D为本试验首次发现。
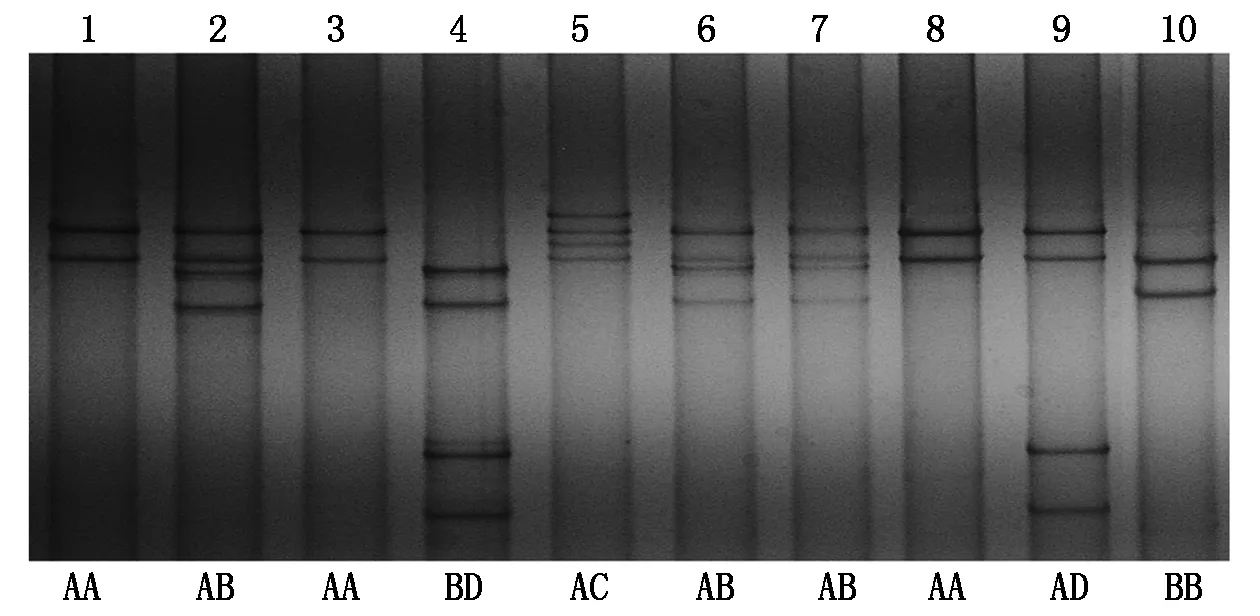
图2 绵羊KAP11-1基因的PCR-SSCP检测结果
4个等位基因中共检测到4个SNPs位点(表2),占分析位点总数的0.98%。其中转换位点3个(c.93C/T、c.240G/A和c.331A/G),占核苷酸多态位点的75%;颠换位点1个(c.285C/G/A),占25%。在4个SNPs位点中,c.93C/T、c.240G/A和c.285C/G/A是同义突变;c.331A/G是非同义突变,导致KAP11-1多肽链上1个氨基酸的改变(p.Ser111Gly)。

表2 绵羊KAP11-1基因的核苷酸和氨基酸序列变异
注:原始序列指GenBank中绵羊的核苷酸序列(登录号:HQ595347);-.氨基酸没有发生变化。
Note:Original sequence refers to the nucleotide sequence of sheep in GenBank (Accession number:HQ595347);-.No amino acid change.
对20种常见氨基酸在绵羊KAP11-1中的数量和摩尔百分比分析发现,在等位基因B编码的氨基酸序列中,由于存在p.Ser111Gly,使得Ser的数量由原来的30个变为29个,摩尔百分比由原来的18.87%变为18.24%;相应的,Gly的数量由原来的9个变为10个,摩尔百分比由原来的5.66%变为6.29%(表3)。

表3 绵羊KAP11-1中各氨基酸的数量及其在氨基酸序列中所占的比例
注:表中氨基酸的数量和摩尔百分比是利用DNAMAN软件(version 5.2.10,Lynnon BioSoft,Vaudreuil,Canada)对绵羊KAP11-1基因编码区(480 bp)编码的氨基酸(159个)组成分析所得。
Note:The number and mole percentage of amino acids (159) listed in this table were obtained from the coding region (480 bp) of ovineKAP11-1 gene by using DNAMAN software (version 5.2.10,Lynnon BioSoft,Vaudreuil,Canada).
2.4KAP11-1基因在5个绵羊群体中的等位基因频率和基因型频率
5个绵羊群体KAP11-1基因的基因型频率和等位基因频率具有品种差异性(表4)。在欧拉羊、甘肃高山细毛羊、湖羊和青海细毛羊中仅检测到A和B 2个等位基因及AA、BB和AB 3种基因型。在滩羊中检测到全部4个等位基因和6种基因型。在5个绵羊群体中,等位基因A出现的频率最高(87.70%),为优势等位基因,其次为等位基因B,等位基因C和D出现的频率最低,两者之和仅占1.27%。基因型AA在5个绵羊群体中出现的频率最高 (82.38%),为优势基因型。

表4 五个绵羊群体KAP11-1基因的基因型频率与等位基因频率
2.5KAP11-1基因的杂合度、有效等位基因数和多态信息含量
5个绵羊群体KAP11-1基因的遗传多态性信息(表5)显示,滩羊具有较高的遗传变异,其遗传杂合度(He)和有效等位基因数(Ne)分别为0.17和1.38。甘肃高山细毛羊上述2个参数均最低,说明在5个绵羊群体中其遗传变异最小。滩羊KAP11-1基因的PIC值为0.26,属中度多态,其余4个群体KAP11-1基因的PIC值均小于0.25,呈低度多态。
2.6KAP11-1基因的Hardy-Weinberg平衡检验和中性检验
5个绵羊群体KAP11-1基因的遗传平衡检验和中性检验见表6。5个绵羊群体KAP11-1基因的χ2值和G2值均未达到显著水平,说明群体处于Hardy-Weinberg平衡状态(P>0.05)。中性检验结果显示,5个绵羊群体的观测F值在KAP11-1基因中处于95%的置信区间内,并接近区间上限(U95)。

表5 五个绵羊群体KAP11-1基因的遗传多态参数

表6 绵羊KAP11-1基因的遗传平衡检验和中性检验
2.7KAP11-1基因的核苷酸序列同源性及系统发育分析
绵羊、山羊和牛等6个物种KAP11-1基因的核苷酸序列同源性比较结果见表7。绵羊KAP11-1基因的核苷酸序列与山羊、牛的同源性最高,分别为99.2%和95.4%,与人、猕猴和小家鼠的同源性依次为83.1%,82.9%和80.8%。不同物种KAP11-1基因的核苷酸序列同源性高低与系统发育树结果一致(图3)。系统发育树中,绵羊与山羊、牛的亲缘关系最近,在系统发育树中聚为一支,而与人、猕猴和小家鼠的亲缘关系较远。
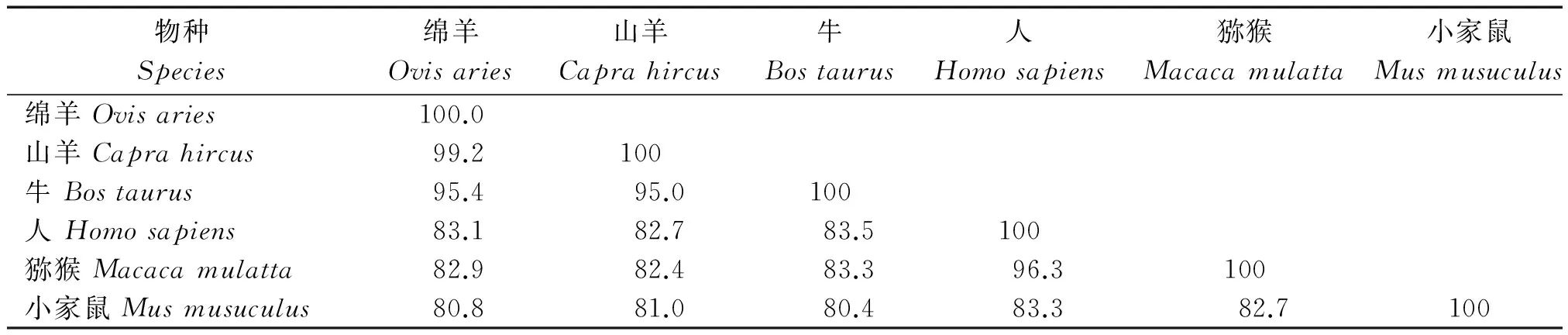
表7 六个物种KAP11-1基因核苷酸序列同源性比较结果

图3 基于KAP11-1基因核苷酸序列构建不同物种的NJ树
3 讨论
羊毛纤维具有高度的组织结构,其纤维的90%由KIFs和KAPs组成,这2种类型的蛋白都由多基因家族编码。目前国内外大多学者把KAPs基因家族的遗传变异与羊毛(羊绒)经济性状的相关性分析作为研究热点。张亚妮等[16]以KAP6-1(S1位点)、KAP1-1(S2位点)和KAP1-3(S3和S4位点)为候选基因,研究其多态性与辽宁绒山羊经济性状的相关性。试验结果发现,S1-AB、S1-BB、S3-BB和S4-AB可作为辽宁绒山羊产绒量性状的优势标记基因型。Parsons等[6]通过对美利奴羊半同胞家系研究发现KAP6、KAP7和KAP8基因所在染色体区段与羊毛纤维直径有相关关系。Gong等[17]以320只新西兰绵羊为研究对象,采用PCR-SSCP技术分析了KAP1-4基因的遗传多态性,结果在9条等位基因序列中发现了14个SNPs位点,预测该基因可能是绵羊毛用性状的候选基因。
本试验首次研究了中国绵羊群体KAP11-1基因的遗传多态性。在所分析的749只绵羊个体中,共发现了A、B、C和D 4个等位基因,其中等位基因D为本试验首次发现。KAP11-1基因的等位基因频率在细毛羊、裘皮羊、羔皮羊等不同毛用绵羊品种中的分布表现出品种差异性,在一定程度上反映了毛用羊品种的生产力方向。在5个绵羊品种中,仅在滩羊中检测到C和D 2种等位基因。滩羊是我国独有的轻裘皮用绵羊品种,以生产洁白、美观、轻便、保暖、耐用的二毛裘皮(滩羊出生后1月龄左右屠宰所得的皮张,其毛股长而弯曲,有“9道湾”之称。)著称于世。等位基因C和D可能与滩羊二毛裘皮毛股弯曲数有关。杨丽娟等[18]采用PCR-RFLP分子标记技术,在258只滩羊的KAP1-3基因中检测到2个等位基因A、B和3种基因型AA、AB、BB。相关性分析表明,BB基因型的毛股弯曲数显著高于AA和AB基因型(P<0.05),认为可以通过提高BB基因型频率来增加滩羊二毛裘皮的毛股弯曲数。等位基因B在湖羊中出现的频率最高,这可能与小湖羊皮(湖羊出生后1~2 d内宰剥的羔皮称为“小湖羊皮”,毛色洁白光润,皮质轻柔,花纹呈波浪形,有“软宝石”之称。)的特性有关,但目前没有这方面的研究报道,还需进行相关性分析加以验证。欧拉羊、甘肃高山细毛羊和青海细毛羊各等位基因频率差异不大,这可能与上述这3个品种都含有藏绵羊的血统有关。
4个等位基因的编码区共检测出4个SNPs位点(c.93C/T、c.240G/A、c.285C/G/A和c.331A/G),其中转换位点(c.93C/T、c.240G/A和c.331A/G)多于颠换位点(c.285C/G/A)。这是因为SNPs在CG序列上出现的频率较高,而CpG二核苷酸上的胞嘧啶残基容易发生甲基化,从而自发脱去氨基形成胸腺嘧啶。同义突变(c.93C/T、c.240G/A和c.285C/G/A)多于非同义突变(c.331A/G),占核苷酸变异位点的75%。同义突变虽然不引起氨基酸的改变,但因为改变了核苷酸序列(三联体密码子),有可能影响转录后的加工和切接信号的顺序,同时降低mRNA的稳定性[19-21],最终影响基因的表达。非同义突变(c.331A/G)导致KAP11-1多肽链上1个氨基酸由丝氨酸(Ser)变为甘氨酸(Gly),该变异可能对绵羊的毛用性状有一定影响,但需要进行相关性分析检验其对羊毛性状的作用。Gong等[9]采用PCR-SSCP方法分析了新西兰罗姆尼羊KAP11-1基因的遗传变异,结果在6个等位基因序列中发现了5个SNPs位点(c.69G/T、c.93C/T、c.288C/G/A、c.334A/G和c.426C/T),除c.93C/T外,其余SNPs位点均与本研究结果不同,这可能是由于研究品种不同所造成的。这也说明如果增加绵羊品种的数量,在KAP11-1基因中可能会发现更多的等位基因和SNPs位点,同时也印证了该基因在不同绵羊品种中的分布具有品种差异性。
杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC)是度量群体遗传变异的重要指标,不同的遗传参数体现各群体的遗传差别,度量数值越高,遗传变异就越大。在5个绵羊群体中,滩羊的He、Ne和PIC均最大。这说明试验滩羊在饲养过程中,人工选择压力不大,主要经济性状在群体内变异较大。同时也反映出该群体选育空间很大,如果育种措施(如表型选择+后裔测定、分子标记辅助选择)得当,可使生产性能在较短的时间内有较大的提高,从而使主要表型性状趋于一致。χ2适合性检验表明,KAP11-1基因在5个绵羊群体中处于Hardy-Weinberg平衡状态(P>0.05),说明在随机遗传漂变和人工选择过程中5个群体的KAP11-1基因处于动态平衡,选择压力对该基因的作用不强。
KAP11-1基因的核苷酸序列同源性及系统发育分析结果表明,绵羊与山羊、牛的同源性和亲缘关系最近,在系统发育树中聚为一支,而与人、猕猴和小家鼠的同源性和亲缘关系较远。该结论符合动物分类学上将绵、山羊和牛归为同一科(牛科或洞角科)的分类方法。
绵羊KAP11-1基因包含由480个核苷酸组成的开放阅读框(Open reading frame,ORF),共编码159个氨基酸。其中丝氨酸(Ser)、半胱氨酸(Cys)和苏氨酸(Thr)含量最高,分别占氨基酸总数的18.87 mol%,12.58 mol%,11.95 mol%。丝氨酸和苏氨酸是易于发生磷酸化的氨基酸,绵羊KAP11-1中丝氨酸和苏氨酸残基数占整个多肽链上氨基酸总数的30.82 mol%,潜在磷酸化位点数是其他高硫KAPs基因的2~4倍[9]。磷酸化是蛋白质翻译后一种最常见和最重要的修饰方式。蛋白质磷酸化作用发生于许多生物化学过程中,如在细胞外信号的传递以及细胞内调整代谢过程(包括基因表达、细胞生长、细胞分裂和增殖等)中起着关键的调节作用[22-23]。虽然目前对于KAPs蛋白的磷酸化没有系统的研究结论,但是Ku等[24]指出角蛋白(Keratins)的磷酸化对其组装可能有较大的影响,Feng等[25]发现酪蛋白磷酸化能对角蛋白起总体修饰作用。
绵羊KAP11-1基因的核苷酸序列变异可能会影响表达、蛋白质磷酸化水平及其结构,最终可能会影响羊毛的质量或产量等毛用性状,但因缺乏表型数据,有关KAP11-1基因与绵羊毛用性状的相关性分析有待进一步研究。
[1] Matsunaga R,Abe R,Ishii D,et al.Bidirectional binding property of high glycine-tyrosine keratin-associated protein contributes to the mechanical strength of and shape of hair[J].Journal of Structural Biology,2013,183(3):484-494.
[2] Gong Hua,Zhou Huitong,Mckenzie G W,et al.An updated nomenclature for Keratin-Associated proteins (KAPs)[J].International Journal of Biological Sciences,2012,8(2):258-264.
[3] Powell B C,Sleigh M J,Ward K A,et al.Mammalian keratin gene families:organisation of genes coding for the B2 high-sulphur proteins of sheep wool[J].Nucleic Acids Research,1983,11(16):5327-5346.
[4] Purvis I W,Franklin I R.Major genes and QTL influencing wool production and quality:a review[J].Genetics,Selection,Evolution,2005,37(1):S97-107.
[5] 艾买提·买买提.5个KAP基因在中国美利奴羊(新疆型)群体中的多态性及其与毛性状关联性分析[D].乌鲁木齐:新疆农业大学,2013.
[6] Parsons Y,Cooper D,Piper L.Evidence of linkage between high-glycine/tyrosine keratin gene loci and wool fibre diameter in a Merino half/sib family[J].Animal Genetics,1994,25(2):105-108.
[7] Cockett N E,Shay T L,Smit M.Analysis of the sheep genome[J].Physiological Genomics,2001,7(2):69-78.
[8] 孙福亮,曹 阳,鲁 承,等.新吉细毛羊KAP13.1基因多态性及其对部分经济性状的影响[J].中国兽医学报,2014,34(12):2022-2026.
[9] Gong Hua,Zhou Huitong,Dyer J M,et al.Identification of the ovine KAP11-1 gene (KRTAP11-1) and genetic variation in its coding sequence[J].Molecular Biology Reports,2011,38(8):5429-5433.
[10] Rogers M A,Langbein L,Winter H,et al.Characterization of a first domain of human high glycine-tyrosine and high Sulfur keratin-associated protein (KAP) genes on chromosome 21q22.1[J].The Journal of Biological Chemistry,2002,277(50):48993-49002.
[11] Rogers G E.Hair follicle differentiation and regulation[J].International Journal of Developmental Biology,2004,48(2/3,SI):163-170.
[12] Huh N,Kashiwagi M,Konishi C,et al.Isolation and characterization of a novel hair follicle-specific gene,Hacl-1[J].The Journal of Investigative Dermatology,1994,102(5):716-720.
[13] Zhou H,Hickford J G,Fang Q.A two-step procedure for extracting genomic DNA from dried blood spots on filter paper for polymerase chain reaction amplification[J].Analytical Biochemistry,2006,354(1):159-161.
[14] Byun S O,Fang Q,Zhou H,et al.An effective method for silver-staining DNA in large numbers of polyacrylamide gels[J].Analytical Biochemistry,2009,385(1):174-175.
[15] Gong Hua,Zhou Huitong,Hickford J G.Diversity of the glycine/tyrosine-rich keratin-associated protein 6 gene (KAP6) family in sheep[J].Molecular Biology Reports,2011,38(1):31-35.
[16] 张亚妮,张恩平,吴 迪,等.KAP基因的多态性与辽宁绒山羊经济性状的关系研究[J].中国农业科学,2007,40(9):2062-2607.
[17] Gong Hua,Zhou Huitong,Hickford J H.Polymorphism of the ovine keratin-associated protein 1-4 gene (KRTAP1-4)[J].Molecular Biology Reports,2010,37(7):3377-3380.
[18] 杨丽娟,李爱华,张 蕊,等.滩羊角蛋白KAP1.3基因与二毛裘皮主要性状相关性研究[J].宁夏大学学报:自然科学版,2010,31(4):381-384,388.
[19] 张正圣,李先碧,刘大军,等.陆地棉高强纤维品系和Bt基因抗虫棉的配合力与杂种优势研究[J].中国农业科学,2002,35(12):1450-1455.
[20] Lee M,Godshalk E B,Lamkey K R,et al.Association of restriction fragment length polymorphisms among maize inbreeds with agronomic performance of their crosses[J].Crop Science,1989,29:1067-1071.
[21] Smith O S,Smith J S C,Bowen S L,et al.Similarities among a group of elite maize inbred as measured by pedigree,F1 grain yield,heterosis and RFLPs[J].Theoretical and Applied Genetics,1990,80:833-840.
[22] Boyle W J,van der G P,Hunter T.Phosphopeptide mapping and phosphoamino acid analysis by two-domensional separation on thin-layer cellulose plates[J].Methods Enzymology,1991,201:110-149.
[23] Flick M B,Sapi E,Perrotta P L,et al.Recognition of activated CSF-1 receptor in breast carcinomas by a tyrosine 723 phosphospecific antibody[J].Oncogene,1997,14(21):2553-2561.
[24] Ku N O,Liao J,Chou C F,et al.Implications of intermediate filament protein phosphorylation[J].Cancer and Metastasis Reviews,1996,15(4):429-444.
[25] Feng L,Zhou X J,Liao J,et al.Pervanadate-mediated tyrosine phosphorylation of keratins 8 and 19 via a p38 mitogen-activated protein kinase-dependent pathway[J].Journal of Cell Science,1999,112(13):2081-2090.
Nucleotide Sequence Variations ofKAP11-1 Gene in 5 Chinese Sheep Populations
ZHU Jianxun,WANG Jiqing,HU Jiang,LIU Xiu,LI Shaobin,YAN Wei,LUO Yuzhu
(College of Animal Science and Technology,Gansu Agricultural University,Gansu Key Laboratory of Herbivorous Animal Biotechnology,Lanzhou 730070,China)
In order to analyze sequence variations ofKAP11-1 gene,single nucleotide polymorphisms (SNPs) of Oula sheep,Gansu Alpine Merino,Tan sheep,Hu sheep and Qinghai merino sheep (a total of 749 individuals) were detected using PCR-SSCP and DNA sequencing techniques in this study.Population genetics characteristics such as allele frequency,genetic heterozygosity,effective number of alleles and polymorphism information content (PIC) were analyzed simultaneously.The results suggested that four SNPs (c.93C/T,c.240G/A,c.285C/G/A and c.331A/G) inKAP11-1 gene of 5 sheep populations were discovered,and c.331A/G was non-synonymous substitution.Allele Aexhibited the highest frequency (87.70%) among five sheep populations,and it was the most common allele,allele B was the next common with the allele frequency of 11.03%,the frequency of allele C and D were the lowest,which were 0.53% and 0.74% respectively.Population genetics results showed that heterozygosity,effective number of alleles and polymorphic information content of Tan sheep were higher than those of another four sheep populations.KAP11-1 gene is one of the major candidate genes of wool economic traits.The nucleotide sequence variations ofKAP11-1 gene will lead to amino acid changes of KAP11-1,then eventually affect wool fibre structure and wool economic traits.
Sheep;KAP11-1 gene;Nucleotide sequence variations;PCR-SSCP;Single nucleotide polymorphism
2016-06-16
甘肃省创新研究群体计划项目(1210RJIA005);国际科技合作与交流项目(2011DFG33310);甘肃省高校基本科研业务费项目;甘肃农业大学自列课题
朱建勋(1988-),男,甘肃通渭人,硕士,主要从事动物遗传育种与牛羊生产系统研究。
罗玉柱(1962-),男,甘肃景泰人,教授,博士,博士生导师,主要从事现代生物技术与动物育种应用研究。
Q78;S826
A
1000-7091(2016)05-0101-07
10.7668/hbnxb.2016.05.015

