转大豆GmPRP和SbPRP基因烟草对非生物胁迫耐受能力分析
翟 莹,张 军,赵 艳
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.黑龙江省兽医科学研究所,黑龙江 齐齐哈尔 161005)
转大豆GmPRP和SbPRP基因烟草对非生物胁迫耐受能力分析
翟 莹1,张 军2,赵 艳1
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.黑龙江省兽医科学研究所,黑龙江 齐齐哈尔 161005)
为实现PRPs基因在植物抗逆基因工程中的应用,将大豆中的2个脯氨酸富集蛋白基因GmPRP和SbPRP构建到植物表达载体pRI101上,通过叶盘法转化烟草。共获得GmPRP阳性转基因烟草2株,SbPRP阳性转基因烟草4株。对转基因烟草植株进行高盐、干旱和低温胁迫处理。结果表明,高盐处理后,SbPRP转基因烟草的脯氨酸含量和可溶性糖含量分别显著和极显著高于野生型,丙二醛含量极显著低于野生型。干旱处理对GmPRP和SbPRP转基因烟草脯氨酸含量、可溶性糖含量和丙二醛含量的影响均不明显。低温处理后,GmPRP和SbPRP转基因烟草的脯氨酸含量均极显著高于野生型,丙二醛含量均低于野生型。由此推测SbPRP可以提高转基因烟草的耐盐性和耐寒性,GmPRP可以提高转基因烟草的耐寒性,为后续SbPRP和GmPRP的应用奠定基础。
大豆;脯氨酸富集蛋白;烟草;抗逆性
大豆(GlycinemaxL.)是我国重要的经济作物,然而环境因子(例如干旱、盐碱、极端温度)和病虫害等每年都会影响大豆的产量。大豆也是分子生物技术应用最为成功的作物之一,其转基因品种的种植面积和比例一直位居大田作物之首[1]。所以,能否发掘有效的抗逆候选基因就成为大豆抗逆分子育种的关键之一。
植物细胞壁中结构蛋白含量最丰富的主要有5类:富含羟脯氨酸糖蛋白(Hydroxyprolin-rich glycoproteins,HRGPs)、茄科凝集素(Solanaceous lectins)、阿拉伯半乳糖蛋白(Arabinogalactan proteins,AGPs)、甘氨酸富集蛋白(Glycine-rich proteins,GRPs)和脯氨酸富集蛋白(Proline-rich proteins,PRPs)[2-3]。这些结构蛋白在植物细胞壁的形成及应对环境胁迫过程中发挥非常重要的作用[4]。其中,PRPs为一类富含脯氨酸和羟脯氨酸的蛋白,它们中的一部分结构较为特殊,N 端为信号肽序列,中间为脯氨酸富集区,C 端为含有8个保守半胱氨酸元件(8CM)的区域[5]。此类蛋白可在植物发育及应对生物及非生物胁迫时发挥功能。研究表明,草莓中的HyPRP基因与果实生长和成熟过程中的多酚固定相关[6]。木豆中的CcHyPRP基因能够赋予酵母和拟南芥多种非生物胁迫(干旱、高盐和高温)抗性[7]。OsPRP3的过量表达可以提高转基因水稻抗冷性,因为它在寒冷条件下可以提高细胞壁的完整性[8]。而芝麻SiPRP和海岛棉GbHyPRP1则受病菌诱导后下调表达[9-10]。
大豆中的SbPRP可被病毒感染、高盐、干旱以及植物激素等调节,但其是否能提高转基因植物的抗逆性并未见报道[11]。大豆中的另一个脯氨酸富集蛋白基因GmPRP为笔者前期所克隆,实时荧光定量PCR结果显示其可被干旱、高盐、低温、乙烯及ABA等诱导上调表达[12]。本试验将大豆GmPRP和SbPRP基因构建植物表达载体并转化烟草,对转基因烟草的非生物胁迫耐受性进行鉴定,为它们的进一步应用奠定基础理论,并为筛选大豆优良抗逆基因提供理论依据。
1 材料和方法
1.1 材料与试剂
大豆品种合丰46、烟草品种NC89、大肠杆菌DH5α菌株及根癌农杆菌EHA105菌株均由齐齐哈尔大学遗传研究室提供。植物表达载体pRI101购自大连宝生物工程公司。所用引物均由上海生工生物工程公司合成。
1.2 植物表达载体构建
采用Plant RNAzol试剂(鼎国生物公司)提取大豆叶片总RNA,按照cDNA第一链合成试剂盒(鼎国生物公司)说明书合成第一链cDNA,-20 ℃保存备用。根据GmPRP(GenBank登录号:JN222914)和SbPRP(GenBank登录号:AF248055)基因序列设计引物,以cDNA为模板,扩增目的基因全序列。扩增引物如下(下划线为酶切位点):GmPRP-F:ACGCGTCGACATGGCTTCCAACAAGGTTATTG,SalⅠ;GmPRP-R:GGAATTCTTAATAGCAGACGAAACC CTTG,EcoR Ⅰ;SbPRP-F:ACGCGTCGACATGGCTT
CCAACAAG GTTATTG,SalⅠ;SbPRP-R:GGAATTC
CTATGCACATTGGAAGCC AG,EcoR Ⅰ。退火温度均为56 ℃。PCR产物经切胶回收后连接至pMD-18T载体上,送上海生工生物工程公司测序。测序正确后,将目的基因连接到pRI101植物表达载体上,构建成由CaMV35S启动子驱动目的基因表达的重组载体pRI101-GmPRP和pRI101-SbPRP。重组载体转化大肠杆菌DH5α,提取质粒,经质粒双酶切鉴定后采用冻融法转化根癌农杆菌EHA105。
1.3 转基因烟草植株的获得
将含有植物表达载体pRI101-GmPRP和pRI101-SbPRP的农杆菌菌液经叶盘法转化烟草[13],MS培养基中卡那霉素的筛选浓度为50 mg/L。以具有卡那霉素抗性的烟草转化幼苗叶片cDNA为模板,pRI101-GmPRP和pRI101-SbPRP质粒为阳性对照,非转基因烟草叶片cDNA为阴性对照,进行转基因植株的RT-PCR鉴定。单株收获T0呈阳性植株的种子,将其继续在含有30 mg/L卡那霉素的MS培养基上进行抗性筛选,获得T1抗性植株。继续对T1抗性植株叶片进行RT-PCR检测,获得T1阳性转基因植株。
1.4 转基因烟草植株非生物胁迫处理
选取T1中RT-PCR目的条带最亮的转基因株系进行非生物胁迫处理。将正常生长于花盆中的6周龄的野生型烟草和T1转基因烟草用含有400 mmol/L NaCl的水浇透,处理5 h,进行盐害处理;停止浇水10 d,进行干旱处理;烟草连同花盆一起至于4 ℃培养箱中12 h,进行冷害处理。每个处理进行3次重复。脯氨酸含量的测定采用Bates等[14]描述的方法。丙二醛含量的测定采用Shao等[15]描述的方法。可溶性糖含量的测定采用Zhai等[16]描述的方法。
2 结果与分析
2.1 植物表达载体的构建
通过RT-PCR分别从大豆叶片中扩增出396 bp的GmPRP序列和381 bp的SbPRP序列(图1)。将GmPRP和SbPRP分别构建到植物表达载体pRI101上,经质粒双酶切鉴定(图2),酶切条带与期望值一致,说明目的基因均已整合进植物表达载体中。将阳性质粒转化农杆菌EHA105即获得转基因工程菌。
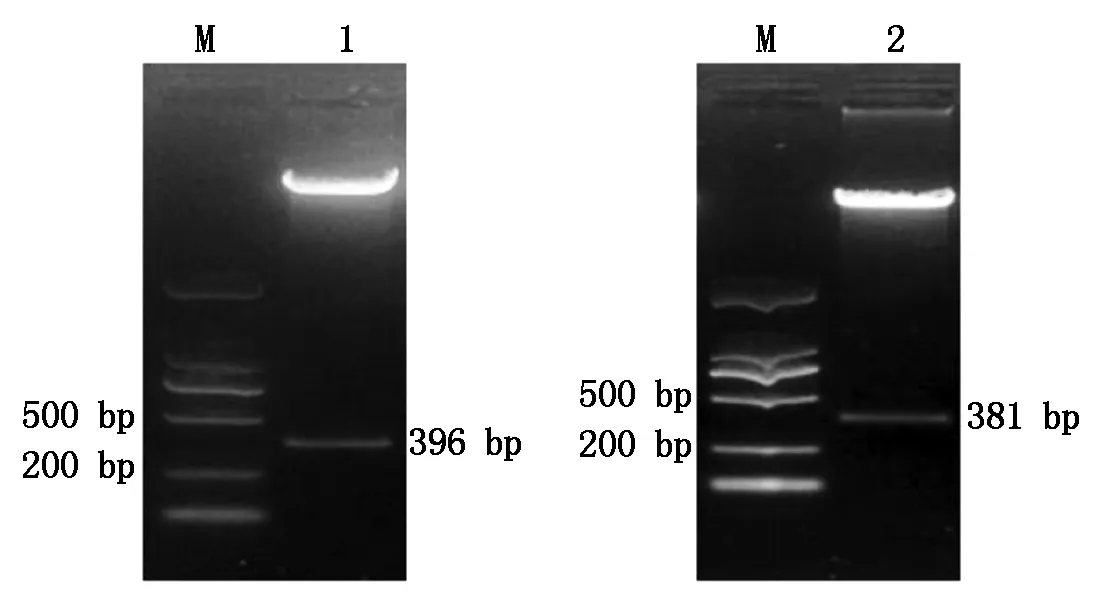
M.DL2000 Marker;1.GmPRP质粒双酶切产物;
2.2 转基因烟草植株的筛选
取无菌条件下培养的烟草叶片进行遗传转化。待抗性芽生长至1 cm左右时(图3-A),将其从愈伤组织中分离并转到生根培养基中。约28~35 d抗性芽长出根系并逐渐成苗(图3-B)。经RT-PCR检测(图4),共获得GmPRP阳性转基因烟草2株,SbPRP阳性转基因烟草4株。

图3 转基因烟草植株筛选过程

M.DL2000 Marker;1.野生型烟草;2.pRI101-GmPRP阳性质粒;3.pRI101-SbPRP阳性质粒;4~5.GmPRP转基因烟草;6~9.SbPRP转基因烟草。
M.DL2000 Marker;1.Wild type tobacco;2.Positive plasmid of pRI101-GmPRP;3.Positive plasmid of pRI101-SbPRP;4-5.Transgenic tobacco ofGmPRP;6-9.Transgenic tobacco ofSbPRP.
图4GmPRP和SbPRP转基因烟草的RT-PCR检测结果
Fig.4 RT-PCR detection results ofGmPRPandSbPRPtransgenic tobacco plants
2.3 转基因烟草植株的耐盐性分析
盐胁迫处理前,野生型烟草和转基因烟草的脯氨酸含量、可溶性糖含量和丙二醛含量均没有显著差别。盐胁迫处理5 h时,野生型烟草和转基因烟草的脯氨酸含量和可溶性糖含量均升高,且SbPRP转基因烟草的脯氨酸含量和可溶性糖含量分别显著和极显著高于野生型(图5-A、B);野生型烟草和GmPRP转基因烟草的丙二醛含量均升高,SbPRP转基因烟草的丙二醛含量变化不明显,并且SbPRP转基因烟草的丙二醛含量极显著低于野生型(图5-C)。以上结果表明,SbPRP转基因烟草植株在高盐胁迫下可以提高脯氨酸和可溶性糖的积累,降低丙二醛的产生,提高耐盐性。
2.4 转基因烟草的耐旱性分析
干旱胁迫处理前,野生型烟草和转基因烟草的脯氨酸含量、可溶性糖含量和丙二醛含量均没有显著差别。干旱胁迫处理10 d时,三者含量在野生型烟草和转基因烟草中均升高,但在野生型烟草和转基因烟草之间并没有显著差别(图6)。表明GmPRP和SbPRP对转基因烟草植株的耐旱性没有显著影响。
2.5 转基因烟草的耐寒性分析
低温胁迫处理前,野生型烟草和转基因烟草的脯氨酸含量和丙二醛含量均没有显著差别。低温胁迫处理12 h时,野生型烟草和转基因烟草的脯氨酸含量均升高,且2个转基因烟草的脯氨酸含量均极显著高于野生型(图7-A);野生型烟草和GmPRP转基因烟草的丙二醛含量均升高,SbPRP转基因烟草的丙二醛含量变化不明显,并且2个转基因烟草的丙二醛含量均低于野生型烟草(图7-C)。以上结果表明GmPRP和SbPRP转基因烟草植株在低温胁迫下可以提高脯氨酸的积累,降低丙二醛的产生,提高耐寒性。

WT.野生型;**.在1%概率水平上差异显著;*.在5%概率水平上差异显著。图6-7同。

图6 野生型和转基因烟草植株耐旱性分析
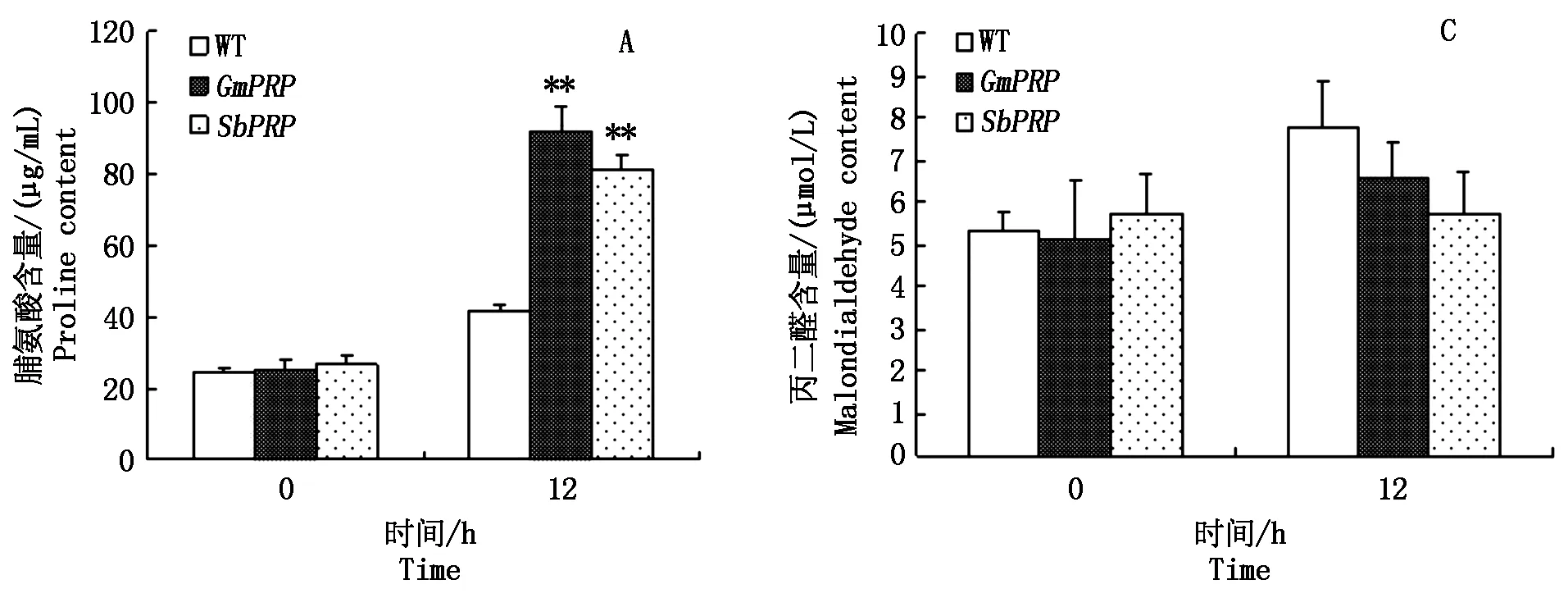
图7 野生型和转基因烟草植株耐寒性分析
3 讨论与结论
植物细胞壁直接与外界接触,一旦植物遭受逆境时,首先需要细胞壁的一系列变化来适应这些不利环境,因此,可以预见植物细胞壁蛋白可能在植物抗逆中发挥重要作用。研究表明,PRPs基因的过量表达能够提高植物叶片的木质化程度,使细胞壁变厚,因而在细胞壁的建造和细胞的防御过程中发挥重要作用[17-18]。Deutch和Goodwin等[19-20]认为,PRPs可能通过蛋白的双功能域在细胞壁和膜之间起牢固的连接作用,来确保细胞的完整性,从而提高植物抗性。相反,将拟南芥中编码HyPRP的EARLI1基因敲除后,突变植株的细胞在冷胁迫下更易受到破坏[21]。同样将拟南芥中的另一个编码PRP的SICKLE(SIC)基因敲除后,突变植株与正常拟南芥相比对冷和盐胁迫更加敏感[22]。
本试验将大豆中已经克隆的2个细胞壁脯氨酸富集蛋白基因GmPRP和SbPRP转化烟草并对非生物胁迫处理下转基因烟草的生理指标进行检测。脯氨酸是植物体内重要的渗透调节物质之一,它不仅能够提高细胞的保水能力,还能对蛋白质起一定保护作用[23]。同样,可溶性糖的积累也在减轻细胞渗透胁迫,保护细胞膜等方面发挥重要作用[24]。丙二醛是由活性氧引起的膜脂过氧化产物,它在植物体内的含量可以用来衡量植物遭受逆境的程度[25]。结果显示SbPRP转基因烟草的综合抗性较好,其通过提高脯氨酸和可溶性糖的积累,减少细胞膜的损伤,降低丙二醛的产生,可以提高转基因烟草的耐盐性和耐寒性,但对转基因烟草的耐旱性没有显著影响。而GmPRP只能提高转基因植物的耐寒性。这可能与GmPRP和SbPRP对不同胁迫的响应模式不一致有关[11-12],正如前人所说,某些条件下胁迫基因表达水平的上调可能不足以提高对胁迫的抗性[26]。
本试验将大豆中的2个脯氨酸富集蛋白基因GmPRP和SbPRP构建植物表达载体并转化烟草。对转基因烟草植株进行高盐、干旱和低温胁迫处理。试验结果表明,高盐处理后,SbPRP转基因烟草的脯氨酸含量和可溶性糖含量分别显著和极显著高于野生型,丙二醛含量极显著低于野生型。低温处理后,GmPRP和SbPRP转基因烟草的脯氨酸含量均极显著高于野生型,丙二醛含量均低于野生型。由此推测SbPRP可以提高转基因烟草的耐盐性和耐寒性,GmPRP可以提高转基因烟草的耐寒性。
[1] 蒋炳军,岳岩磊,王彩洁,等.大豆分子育种研究进展[J].大豆科学,2012,31(4):662-667.
[2] 韩 青,陈 瑞,杨 野,等.植物富含脯氨酸蛋白的研究进展[J].植物生理学报,2015,51(8):1179-1184.
[3] 翟 莹,张 军,陈 阳,等.大豆GmPRP转基因拟南芥抗盐性鉴定[J].大豆科学,2015,34(2):345-348.
[4] Minorsky P V.The wall becomes surmountable[J].Plant Physiology,2002,128(2):345-353.
[5] 许文亮,黄耿青,王秀兰,等.两个棉花HyPRP基因的分子鉴定与初步表达分析[J].作物学报,2007,33(7):1146-1153.
[6] Blanco-Portales R,Lopez-Raez J A,Bellido M L,et al.A strawberry fruit-specific and ripening-related gene codes for a HyPRP protein involved in polyphenol anchoring[J].Plant Molecular Biology,2004,55(6):763-780.
[7] Priyanka B,Sekhar K,Reddy V D.Expression of pigeonpea hybrid-proline-rich protein encoding gene(CcHyPRP) in yeast andArabidopsisaffords multiple abiotic stress tolerance[J].Plant Biotechnology Journal,2010,8(1):76-87.
[8] Gothandam K M,Nalini E,Karthikeyan S,et al.OsPRP3,a flower specific proline-rich protein of rice,determines extracellular matrix structure of floral organs and its overexpression confers cold-tolerance[J].Plant Molecular Biology,2010,72(1/2):125-135.
[9] 吕高强,吴向阳,王心宇.芝麻中一个富含脯氨酸新基因的克隆与特征分析[J].作物学报,2015,41(12):1810-1818.
[10] 杨 君,张 艳,王伟巧,等.海岛棉GbHyPRP1克隆及其转基因拟南芥抗黄萎病验证[J].植物遗传资源学报,2015,16(3):594-602.
[11] He C Y,Zhang J S,Chen S Y.A soybean gene encoding a proline rich protein is regulated by salicylic acid,an endogenous circadian rhythm and by various stresses[J].Theoretical and Applied Genetics,2002,104(6/7):1125-1131.
[12] 翟 莹,雷婷婷,闫 帆,等.大豆逆境诱导基因GmPRP的克隆与表达[J].作物学报,2011,37(12):2152-2157.
[13] Hoekema A,Hirsch P R,Hooykaas P J,et al.A binary plant vector strategy based on separation of vir-and T-region of theAgrobacteriumtumefaciensTi-plasmid[J].Nature,1983,303(5913):179-180.
[14] Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water stress studies[J].Plant and Soil,1973,39(39):205-207.
[15] Shao H B,Liang Z S,Shao M.Osmotic regulation of 10 wheat(TriticumaestivumL.) genotypes at soil water deficits[J].Colloids and Surfaces B-Biointerfaces,2006,47(2):132-139.
[16] Zhai Y,Wang Y,Li Y J,et al.Isolation and molecular characterization of GmERF7,a soybean ethylene-response factor that increases salt stress tolerance in tobacco[J].Gene,2013,513(1):174-183.
[17] Bradley D J,Kjellbom P,Lamb C J.Elicitor-and wound-induced oxidative cross-linking of a proline-rich plant cell wall protein:a novel,rapid defense response[J].Cell,1992,70(1):21-30.
[18] Brisson L F,Tenhaken R,Lamb C.Function of oxidative cross-linking of cell-wall structural proteins in plant-disease resistance[J].The Plant Cell,1994,6(12):1703-1712.
[19] Deutch C E,Winicov I.Post-transcriptional regulation of a salt inducible alfalfa gene encoding a putative chimeric proline-rich cell wall protein[J].Plant Molecular Biology,1995,27(2):411-418.
[20] Goodwin W,Pallas J A,Jenkins G I.Transcripts of a gene encoding a putative cell wall-plasma membrane linker protein are specifically cold-induced inBrassicanapus[J].Plant Molecular Biology,1996,31(4):771-781.
[21] Zhang Y,Schlappi M.Cold responsive EARLI1 type HyPRPs improve freezing survival of yeast cells and form higher order complexes in plants[J].Planta,2007,227(1):233-243.
[22] Zhan X Q,Wang B,Li H J,et al.Arabidopsisproline-rich protein important for development and abiotic stress tolerance is involved in microRNA biogenesis[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(44):18198-18203.
[23] 陈丽萍,何道一.植物抗旱耐盐基因的研究进展[J].基因组学与应用生物学,2010,29(3):542-549.
[24] Sharma P,Sharma N,Deswal R.The molecular biology of the low-temperature response in plants[J].BioEssays,2005,27(10):1048-1059.
[25] Deeba F,Pandey A K,Ranjan S,et al.Physiological and proteomic responses of cotton(GossypiumherbaceumL.) to drought stress[J].Plant Physiology and Biochemistry,2012,53(6):6-18.
[26] Kim K N,Cheong Y H,Grant J J,et al.CIPK3,a Calcium sensor-associated protein kinase that regulates abscisic acid and cold signal transduction inArabidopsis[J].The Plant Cell,2003,15(2):411-423.
Analysis of Abiotic Stress Resistance Ability of Transgenic Tobacco ExpressingGmPRPandSbPRPfrom Soybean
ZHAI Ying1,ZHANG Jun2,ZHAO Yan1
(1.College of Life Science and Agro-Forestry,Qiqihar University,Qiqihar 161006,China;2.Heilongjiang Institute of Veterinary Science,Qiqihar 161005,China)
In order to realize the application of PRPs genes in plant genetic engineering,theGmPRPandSbPRPfrom soybean were cloned into plant expression vector of pRI101,respectively,and then introduced into tobacco byAgrobacterium-mediated transformation.Two positive transgenic tobacco plants ofGmPRPand four positive transgenic tobacco plants ofSbPRPwere obtained.The transgenic tobacco plants were treated with salt,drought and cold stresses.The results showed that the contents of proline and soluble sugar inSbPRPtransgenic plants were significant higher than wild-type plants and the contents of malondialdehyde inSbPRPtransgenic plants were significant lower than wild-type plants under salt stress.While the contents of proline,soluble sugar,and malondialdehyde inGmPRPandSbPRPtransgenic plants had no significant differences compared to wild-type plants under drought stress.The contents of proline inGmPRPandSbPRPtransgenic plants were both significant higher than wild-type plants and the contents of malondialdehyde inGmPRPandSbPRPtransgenic plants were both lower than wild-type plants under cold stress.These data indicated that the transgenic tobacco plants constitutively expressingSbPRPshowed an increased tolerance to salt and cold stresses and the transgenic tobacco plants constitutively expressingGmPRPshowed an increased tolerance to cold stress,which may provide a way toward the application of them.
Soybean;Proline-rich protein;Tobacco;Stress resistance
2016-07-17
国家自然科学基金项目(31301335);黑龙江省教育厅科学技术研究项目(12541889);黑龙江省自然科学基金项目(C201458)
翟 莹(1982-),女,吉林省吉林市人,副教授,博士,主要从事大豆分子育种研究。
Q78;S565.03
A
1000-7091(2016)05-0056-06
10.7668/hbnxb.2016.05.009

