响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析
陈红梅,谢 翎
(安庆师范学院生命科学学院,安徽 安庆 246011)
响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析
陈红梅,谢 翎*
(安庆师范学院生命科学学院,安徽 安庆 246011)
研究半枝莲黄酮的提取工艺及其抗氧化活性。以黄酮得率为指标,在单因素试验的基础上,利用Box-Behnken设计四因素三水平进行响应面试验,建立各因素与响应值之间的数学模型,确定最佳提取工艺。结果表明,最佳提取工艺条件为乙醇体积分数75%、液料比40∶1(mL/g)、超声时间80 min、超声功率220 W,在此工艺条件下,半枝莲黄酮得率为11.53%。通过对1,1-二苯基-2-三硝基苯肼自由基、羟自由基清除率及还原力测定,表明半枝莲黄酮提取物具有一定的抗氧化活性。
半枝莲;黄酮;响应面法;抗氧化
半枝莲(Soutellaria barbata D. Don)别名并头草、牙刷草、窄叶韩信草等,为唇形科黄芩属草本植物。半枝莲全草可入药,具有清热解毒、活血散瘀、利尿消肿、止痛抗癌等功效,现代药理学研究表明常用于治疗各种感染,单方或复方治疗肺癌、胃癌、肝癌等疾病[1]。在我国有广泛的种植面积。半枝莲中含有多种化学成分,主要含有生物碱、类黄酮、甾体化合物等,其中类黄酮物质含量最高[2-4],为植物生长过程中产生的次生代谢产物[5],具有抗氧化、抗辐射、抗肿瘤、降血脂、延缓衰老等作用[6-7],是一种天然的抗氧化剂[8],已被广泛应用于食品、医药及化妆品行业。
超声波机械热振动的传播过程中有助于植物有效成分的溶出和扩散,空穴作用可能以将能量全部释放,产生瞬时的高温和高压促使细胞壁破解,使得内含物直接溶出与溶剂充分接触,增加提取物的得率[9]。超声波辅助提取法已广泛应用于植物次生代谢物质的提取[10-13]。响应面法可以通过回归方程和直观图形分析,高效地对实验进行研究[14]。采用超声波辅助提取的方法,在单因素试验的基础上考察乙醇体积分数、液料比、超声时间、功率对黄酮得率的影响,结合响应面法对黄酮提取工艺进行优化。另外,对半枝莲黄酮提取物抗氧化清除1,1-二苯基-2-三硝基苯肼(1,1-d i p h e n y l-2-picrylhydrazyl,DPPH)自由基及羟自由基能力及其还原力进行测定,评价其抗氧化活性,为半枝莲黄酮资源的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
半枝莲购于安庆市安庆大药房,置于60 ℃恒温干燥箱中烘干,粉碎后过50 目筛,密封保存备用。
芦丁标准品 中国食品药品检定研究院;DPPH美国Sigma公司;无水乙醇、硝酸铝、氢氧化钠、亚硝酸钠、甲醇、硫酸铁、铁氰化钾、三氯乙酸、双氧水等均为分析纯。
1.2 仪器与设备
UV759型紫外-可见分光光度计 上海佑科仪器仪表有限公司;FA2004A型电子天平 上海精天电子仪器有限公司;RE-2000型旋转蒸发仪 上海洪旋实验仪器有限公司;SY-360型台式数控超声波提取机 昆山市超声仪器有限公司;FW-100高速粉碎机 上海楚定分析仪器有限公司;HH-6型数显恒温水浴锅 常州国华电器有限公司。
1.3 方法
1.3.1 标准曲线的制作
准确称取烘干至恒质量的芦丁标准品10 mg,用70%乙醇溶液溶解,并定容至50 mL,得到质量浓度为0.2 mg/mL的芦丁标准溶液。分别精准吸取0、1.0、2.0、3.0、4.0、5.0 mL标准溶液于25 mL容量瓶中,加70%乙醇溶液补充至10 mL,再依此加入5%的亚硝酸钠溶液1.5 mL,混匀,放置6 min,再加入10%的硝酸铝溶液2 mL,摇匀,放置6 min,加入4%的氢氧化钠溶液2 mL,用70%乙醇溶液定容,摇匀,放置15 min,置于510 nm波长处测定吸光度。以芦丁标准溶液的质量浓度(mg/mL)为横坐标,吸光度(A)为纵坐标,得到标准曲线方程:A=0.192 3C-0.202 3,R2=0.998 5。
1.3.2 黄酮提取工艺及含量测定
准确称取半枝莲粉末10.0 g,放入磨口三角烧瓶中,加入乙醇溶液,超声波辅助提取,过滤,石油醚脱色处理后,所得滤渣用70%乙醇溶液溶解并定容至50 mL,作为待测液,按1.3.1节进行操作,测定黄酮含量。
1.3.3 单因素试验
1.3.3.1 乙醇体积分数的选择
准确称取烘干至质量恒定的半枝莲粉末10.0 g,按液料比20∶1的比例分别加入体积分数为30%、40%、50%、60%、70%、80%、90%的乙醇溶液,在超声功率200 W的条件下,提取55 min,测定不同乙醇体积分数条件下半枝莲黄酮得率。
1.3.3.2 液料比的选择
称取烘干至质量恒定的半枝莲粉末10.0 g,分别按液料比10∶1、20∶1、30∶1、40∶1、50∶1、60∶1、70∶1加入体积分数为70%的乙醇溶液,在超声功率200 W条件下,提取55 min,测定不同液料比条件下半枝莲黄酮得率。
1.3.3.3 超声时间的选择
称取烘干至质量恒定的半枝莲粉末10.0 g,按液料比20∶1的比例加入体积分数为70%的乙醇溶液,在超声功率200 W的条件下,分别提取45、55、65、75、85、95、105 min,测定不同超声时间条件下半枝莲黄酮得率。
1.3.3.4 超声功率的选择
称取烘干至质量恒定的半枝莲粉末10.0 g,按液料比20∶1的比例加入体积分数为70%的乙醇溶液,分别在超声功率150、200、250、300、350、400、450 W的条件下,提取55 min,测定不同超声功率条件下半枝莲黄酮得率。
1.3.4 响应面试验设计
在单因素试验的基础上,利用Design-Expert 8.0软件进行响应面优化设计,以黄酮得率为响应值,以乙醇体积分数、液料比、超声时间、超声功率为因变量,设计四因素三水平响应面分析试验,中心试验重复5 次,共29 个试验点,试验因素水平如表1所示。

表1 响应面试验设计因素与水平Table 1 Factors and levels used in response surface experiments
1.3.5 黄酮体外抗氧化性实验
1.3.5.1 DPPH自由基清除率测定[15-16]
配制不同质量浓度的样品溶液,取2.0 mL样品溶液,加入2.5 mL 0.1 mmol/L的DPPH甲醇溶液,充分混匀,在室温条件下反应2 h,置于517 nm波长处测定吸光度,以未加入样品的DPPH甲醇溶液作空白参比,同时以VC和2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)作阳性对照。DPPH自由基的清除率按公式(1)计算。

式中:A0为空白对照吸光度;A1为样品溶液吸光度。
1.3.5.2 还原力的测定[17-18]
配制不同质量浓度的样品溶液,取1.5 mL样品溶液,加入1.5 mL pH 6.6的磷酸盐缓冲溶液和1.5 mL 1%的铁氰化钾溶液,充分混匀,置于50 ℃恒温水浴锅中保温25 min,冷却后加入1 mL 10%三氯乙酸溶液,充分振荡,于4 500 r/min条件下离心10 min。取其上清液1 mL再加入1 mL 0.1% FeCl3溶液和2 mL蒸馏水,充分混匀,静置10 min,置于700 nm波长处测定其吸光度,以蒸馏水作空白参比。同时以VC作阳性对照。
1.3.5.3 羟自由基清除率[19-20]
配制不同质量浓度的样品溶液,取1.5 mL样品溶液,分别加入1.0 mL 2.5 mmol/L的水杨酸溶液、1.0 mL 5 mmol/L的FeSO4溶液和2.0 mL蒸馏水,充分混匀,加入1.0 mL 5 mmol/L的H2O2,置于37 ℃恒温水浴锅中反应30 min,再置于510 nm波长处测定其吸光度,以蒸馏水作空白参比,同时以VC作阳性对照。羟自由基的清除率按公式(2)计算。

式中:A0为空白对照吸光度;A2为样品溶液吸光度(加H2O2);A1为样品溶液吸光度(不加H2O2)。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对黄酮得率的影响

图1 乙醇体积分数对黄酮得率的影响Fig.1 Effects of ethanol concentration on flavonoid yield
如图1所示,当乙醇体积分数较低时,随着乙醇体积分数的增加,黄酮得率也增加。乙醇体积分数达到70%时,黄酮得率随乙醇体积分数的增加而下降。这可能是因为当乙醇体积分数达到70%时,黄酮类物质溶出趋于饱和,而同时随着乙醇体积分数的进一步升高,其他醇溶性物质溶出也增多,从而使得黄酮得率反而下降。因此,乙醇体积分数选用70%为宜。
2.1.2 液料比对黄酮得率的影响

图2 液料比对黄酮得率的影响Fig.2 Effects of liquid-to-solid ratio on flavonoid yield
如图2所示,随着提取溶剂用量的增加,黄酮得率也随之呈增长趋势,当液料比达到50∶1(mL/g)时,此时若继续增加溶剂的用量,黄酮得率反而呈缓慢下降趋势,这可能是因为液料比达到50∶1(mL/g)时,黄酮类物质已基本溶出,继续增加溶剂用量反而会促使其他杂质的溶出,使得黄酮得率下降。考虑到节约成本和后续回收操作,确定液料比为40∶1(mL/g)比较合适。
2.1.3 超声时间对黄酮得率的影响

图3 超声时间对黄酮得率的影响Fig.3 Effects of extraction time on flavonoid yield
由图3可知,随着超声提取时间的延长,黄酮得率呈上升趋势,但当超声提取时间达到85 min后,此时继续延长超声提取时间,黄酮得率略呈缓慢下降趋势。分析原因,可能在于当超声时间达到85 min,黄酮类物质已大部分溶出,继续延长超声时间,有可能使黄酮类物质发生降解或也伴随着其他杂质的溶出。因此,选择超声时间为85 min为宜。
2.1.4 超声功率对黄酮得率的影响

图4 超声功率对黄酮得率的影响Fig.4 Effects of ultrasonic power on flavonoid yield
由图4可知,当超声功率在150~300 W范围内,随着超声功率的增加,黄酮得率也不断增加,但当超声功率达到300 W后,此时继续增加超声功率,黄酮得率反而呈下降趋势。这可能是因为超声功率较高时,使得溶液温度也较高,导致黄酮类物质稳定性下降,部分被氧化,得率降低。因此,超声功率选为300 W较合适。
2.2 响应面试验结果
利用Design-Expert 8.0软件的Box-Behnken设计,以乙醇体积分数、液料比、超声时间和超声功率为响应变量,黄酮得率为响应值,进行响应面试验,结果如表2所示,对表2数据进行多元二次回归拟合,建立提取工艺参数回归模型。回归方程为:
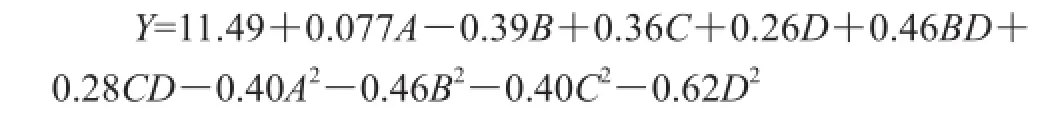

表2 Box-Behnken试验方案及结果Table 2 Box-Behnken design with experimental results
由表3可知,二次回归模型的F值为1 0.9 9,P<0.000 1,表明模型达到了极显著水平;失拟项是模型中数据的变异,失拟项P=0.253 3>0.05,说明失拟项差异不显著,试验无失拟因素存在,能充分反映实际情况,回归模型是适合的;试验模型的决定系数R2=0.916 6,说明黄酮得率的结果与模型预测结果有着良好的一致性,试验模型的校正系数R2Adj=0.833 2,试验结果有83.32%受试验因素的影响。因此,结果可靠,此模型可以对黄酮得率结果进行分析和预测。回归方程各项方差分析中F检验可以判断自变量对因变量的影响,由此得到各因素对黄酮得率影响的主次顺序为B>C>D>A,即液料比对黄酮得率的影响最大,其次是超声时间和超声功率,最后是乙醇体积分数。由回归方程和方差分析还可知,模型中一次项B、C、D对黄酮得率的影响达到极显著水平(P<0.01);模型中交互项BD对黄酮得率的影响达到极显著水平(P<0.01),CD对黄酮得率的影响达到显著水平(P<0.05);模型中二次项A2、B2、C2、D2对黄酮得率的影响达到极显著水平(P<0.01)。
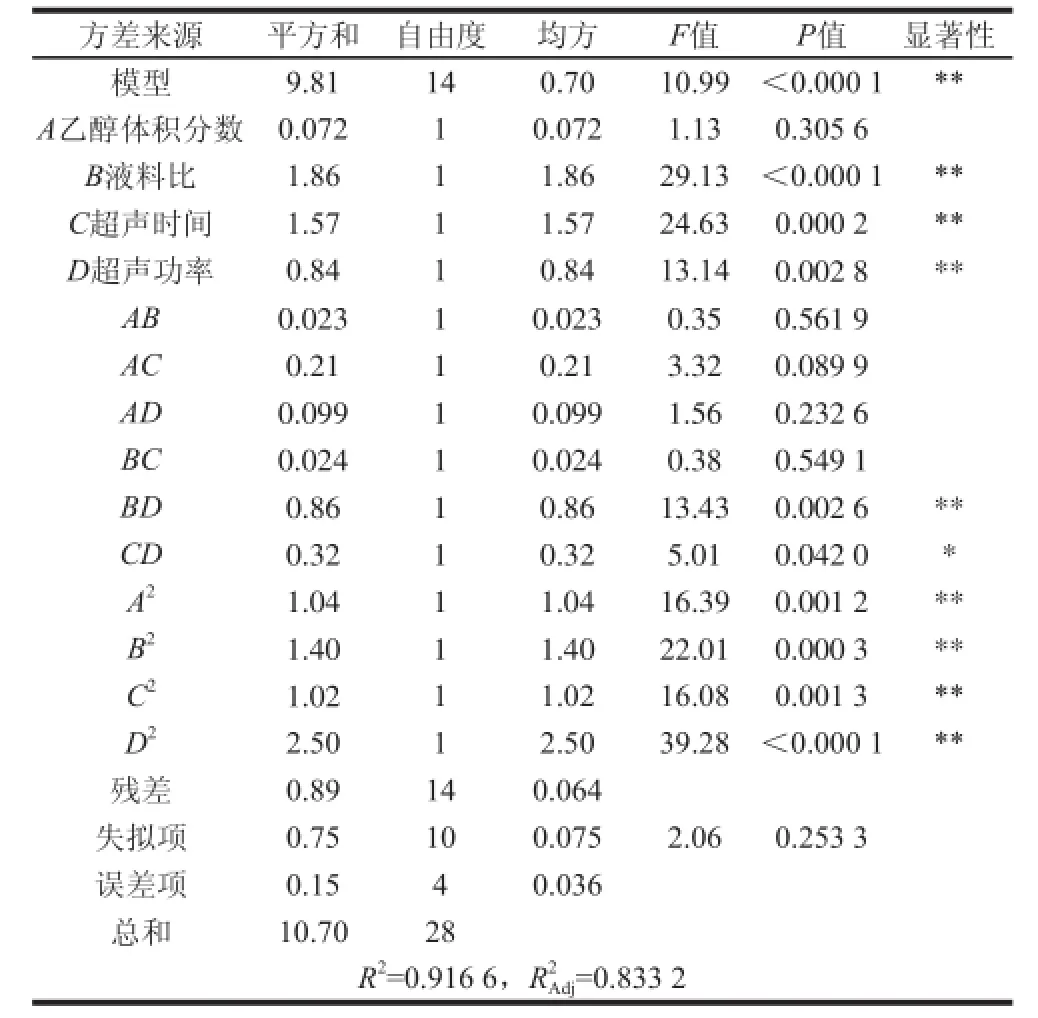
表3 回归方程方差分析Table 3 Analysis of variances for the developed regression equation
2.3 响应面分析
通过Box-Behnken试验得到的多元二次回归模型所作的响应面图,响应面图形是响应值对各试验因素A、B、C、D所构成的三维空间的曲面图。在其他试验因素固定不变的情况下,考察交互项对得率的影响,响应面分析图可用于评价试验因素对黄酮得率影响的两两交互作用[21-22]。各因素交互作用对响应值的影响如图5所示。响应面坡度越陡峭,表明响应值对于操作条件的改变越敏感,该因素对黄酮得率的影响越大;反之则表明因素对黄酮得率的影响越小[23-24]。在交互项对得率的影响中,液料比与超声功率和超声时间与超声功率之间交互作用明显,其他因素之间交互作用不明显,这与方差分析的结果一致。
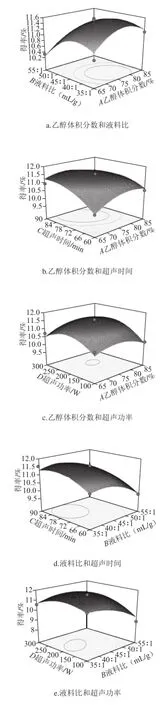
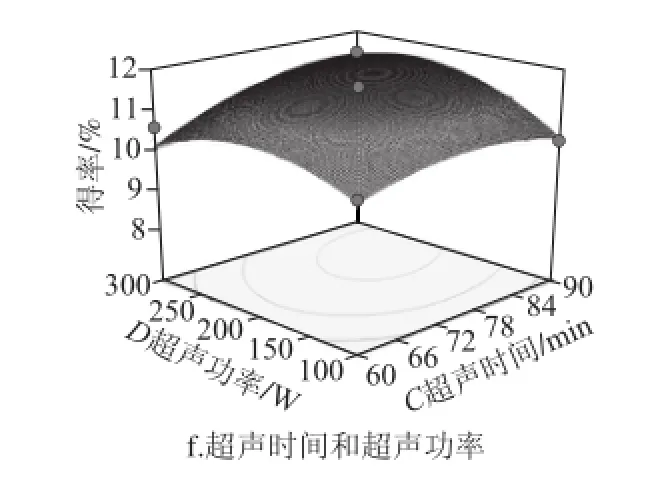
图5 各因素交互作用对对黄酮得率的影响Fig.5 Response surface graphs showing the effect of extraction conditions on the yield of flavonoid
利用Design-Expert 8.0软件进行工艺参数的优化组合,得到预测的黄酮提取的最佳工艺条件为乙醇体积分数75.23%、液料比42.31∶1(mL/g)、超声时间82.56 min、超声功率222.95 W,此时黄酮的得率最高,达到11.66%。但为了验证模型的有效性,考虑到实际情况将最佳工艺条件修改为乙醇体积分数75%、液料比40∶1(mL/g)、超声时间80 min、超声功率220 W,在此工艺条件下,黄酮得率为11.53%,与预测值总体吻合,说明模型能较好预测半枝莲中黄酮得率,优化工艺条件较可靠。
2.4 黄酮抗氧化活性测定结果
2.4.1 半枝莲黄酮提取物清除DPPH自由基效果

图6 半枝莲黄酮提取液对DPPH自由基的清除效果Fig.6 DPPH free radical scavenging capacity of flavonoid from Soutellaria barbata
由图6可知,在测定的质量浓度范围内,随着黄酮提取液、对照品VC和BHT质量浓度的增加,三者对DPPH自由基的清除率均在增加。当质量浓度比较低时,黄酮提取液对DPPH自由基的清除率低于对照品VC和BHT;当黄酮提取液质量浓度达到0.3 mg/mL后,它对DPPH自由基的清除率略高于BHT,而当质量浓度达到0.4 mg/mL时,黄酮提取液对DPPH自由基的清除率与对照品VC对DPPH自由基的清除率相当。
2.4.2 半枝莲黄酮提取物的还原力
吸光度的变化可以反映出样品还原力的高低,吸光度越大,则样品的还原力越强[25]。由图7可知,在测定的质量浓度范围内,半枝莲黄酮提取物的还原力随着质量浓度的升高也在不断增强。在质量浓度较低时,黄酮提取液的还原力也较低,当黄酮提取液质量浓度达到0.2 mg/mL时,随着质量浓度的升高,还原力也呈大幅增长趋势,甚至接近于对照品VC的还原力。但整体来说,半枝莲黄酮提取液的还原力低于对照品VC的还原力。

图7 半枝莲黄酮提取液的还原力Fig.7 Total reducing power of flav onoid from Soutellaria barbata
2.4.3 半枝莲黄酮提取物清除羟自由基效果

图8 半枝莲黄酮提取液对羟自由基的清除效果Fig.8 Hydroxyl free radical scavenging capacity of flavonoid from Soutellaria barbata
由图8可知,在测定的质量浓度范围内,随着黄酮提取液和对照品VC质量浓度的增加,二者对羟自由基的清除率均在增加。在质量浓度较低时,半枝莲黄酮提取液清除羟自由基的效果远差于VC,但当质量浓度达到0.4 mg/mL时,半枝莲黄酮提取液对羟自由基的清除能力大幅增强,只略低于VC的清除能力。
3 结 论
以半枝莲为原料,通过有机溶剂提取法从中提取出黄酮,在单因素试验的基础上,选择乙醇体积分数、超声时间、超声温度和液料比进行Box-Behnken试验设计,使用Design-Expert 8.0软件进行数据拟合,得到最佳工艺提取条件为乙醇体积分数75%、液料比40∶1(mL/g)、超声时间80 min、超声功率220 W,在此工艺条件下,黄酮得率为11.53%。抗氧化性研究表明,黄酮提取物具有较强的还原力,对DPPH自由基和羟自由基均具有一定的清除能力,可以作为抗氧化剂的新型来源。
[1] 刘俊, 张晨晨, 方圆, 等. 半枝莲黄酮提取物、野黄芩苷及洛伐他汀对细胞炎症模型中细胞因子IL-1β、IL-6和TNF-α基因表达及含量的影响[J]. 时珍国医国药, 2011, 22(10): 2432-2434. DOI:10.3969/ j.issn.1008-0805.2011.10.050.
[2] GAO J, LU W F, DAI Z J, et al. Induction of apoptosis by total fl avonoids from Scutellaria barbata D. Don in human hepatocarcinoma MHCC97-H cells via the mitochondrial pathway[J]. Tumour Biology, 2014, 35(3): 2549-2559. DOI:10.1007/s13277-013-1336-4.
[3] DAI Z J, WANG B F, LU W F, et al. Total fl avonoids of Scutellaria barbata inhibit invasion of hepatocarcinoma via MMP/TIMP in vitro[J]. Molecules, 2013, 18(1): 934-950. DOI:10.3390/ molecules18010934.
[4] 郗玉玲, 刘敏华, 张晓峰, 等. 半枝莲黄酮对去卵巢大鼠记忆障碍的改善作用[J]. 中国老年学杂志, 2011, 31(2): 242-245. DOI:10.3969/ j.issn.1005-9202.2011.02.030.
[5] MORIMOTO M, TANIMOTO K, NAKANO S, et al. Insect antifeedant activity of flavones and chromones against Spodoptera litura[J]. Journal of Agricultural and Food Chemistry, 2003, 51(2): 389-393. DOI:10.1021/jf025627a.
[6] STANISLAW B, WIESLAW O. Antioxidant and antiradical activities of flavonoids[J]. Journal of Agricultural and Food Chemistry, 2001, 49(6): 2774-2779. DOI:10.1021/jf001413m.
[7] 于晶, 郝再彬, 苍晶, 等. 黄酮类化合物的活性研究进展[J].东北农业大学学报, 2008, 39(12): 125-130. DOI:10.3969/ j.issn.1005-9369.2008.12.028.
[8] 肖崇厚, 杨松松, 洪筱坤. 中药化学[M]. 上海: 上海科学技术出版社, 1997: 256-274.
[9] 雷德柱, 高大维, 于淑娟. 超声波在食品技术中的应用[J]. 应用声学, 2000, 19(5): 44-48. DOI:10. 3969/j.issn.1000-310X.2000.05.009.
[10] 金东日, 洪波, 李宗亮, 等. 响应面法优化瓜蒌薤白汤总黄酮的提取工艺[J]. 食品工业科技, 2014, 35(7): 221-226. DOI:10.13386/ j.issn1002-0306.2014.07.012.
[11] 易阳, 艾有伟, 王宏勋. 莲藕总黄酮的超声波提取工艺优化[J].食品工业科技, 2014, 35(13): 207-212. DOI:10.13386/ j.issn1002-0306.2014.13.036.
[12] 邱远, 芮昕, 谢翌冬, 等. 响应面法优化超声提取葛根素工艺[J]. 食品科学, 2014, 35(6): 1-5. DOI:10.7506/spkx1002-6630-201406001.
[13] 赵强, 索有瑞, 李天才, 等. 响应面法优化苦荞皮中总黄酮超声波提取工艺[J]. 食品科学, 2014, 35(16): 64-70. DOI:10.7506/spkx1002-6630-201416012.
[14] 王海燕, 李睿, 曾秀, 等. 响应面优化超声波提取桑叶槲皮素工艺[J]. 食品科学, 2014, 35(22): 56-62. DOI:10.7506/spkx1002-6630-201422011.
[15] 朱艳华, 谭军. 玉米多肽抗氧化作用的研究[J]. 中国粮油学报, 2008, 23(1): 36-43.
[16] HATANO T, KAGAWA H, YASUHARA T, et al. Two new fl avonoids and other constituents in licorice root: their relative astringency and scavenging effects[J]. Chemical and Pharmaceutical Bulletin, 1988, 36(6): 2090-2097. DOI:10.1248/cpb.36.2090.
[17] APATI P, SZENTMIHALYI K, KRISTO S T, et al. Herbal remedies of Solidago-correlation of phytochemical characteristics and antioxidant properties[J]. Journal of Pharmaceutical and Biomedical Analysis, 2003, 32(4/5): 1045-1053. DOI:10.1016/S0731-7085(03)00207-3.
[18] 吕英华, 苏平, 那宇, 等. 桑椹色素体外抗氧化能力研究[J]. 浙江大学学报, 2007, 33(1): 102-107. DOI:10.3321/j.issn:1008-9209.2007.01.018. [19] 刘水英, 李新生, 党娅, 等. 响应面法优化紫山药花青苷提取工艺及其抗氧化活性[J]. 食品科学, 2014, 35(22): 84-91. DOI:10.7506/ spkx1002-6630-201422016.
[20] 殷军, 葛青, 毛建卫, 等. 竹叶多糖的组分及抗氧化活性分析[J]. 食品工业科技, 2013, 34(2): 100-103. DOI:10.13386/ j.issn1002-0306.2013.02.042.
[21] 王顺民, 汤斌, 余建斌, 等. 响应面法优化菜籽皮可溶性膳食纤维提取工艺[J]. 中国粮油学报, 2011, 26(9): 98-103.
[22] 陈仕学, 郁建平, 杨俊. 等. 响应面法优化阳荷水溶性膳食纤维的微波提取工艺研究[J]. 食品科学, 2014, 35(18): 57-62. DOI:10.7506/ spkx1002-6630-201418011.
[23] 刘奉强, 肖鉴谋, 刘太泽. 应用响应面法优化超声波提取荆芥中总黄酮的工艺[J]. 南昌大学学报(工科版), 2011, 33(2): 149-155. DOI:10.3969/j.issn.1006-0456.2011.02.009.
[24] 张丙云, 孙莉, 黄艳, 等. 响应面法优化竹叶椒总木脂素的超声提取工艺[J]. 食品工业科技, 2014, 35(7): 198-201. DOI:10.13386/ j.issn1002-0306.2014.07.024.
[25] LIU J, WANG C N, WANG Z Z, et al. The antioxidant and free-radical scavenging activities of extract and fractions from corn silk (Zea mays L.) and related fl avone glycosides[J]. Food Chemistry, 2011, 126(1): 261-269. DOI:10.1016/j.foodchem.2010.11.014.
Optimization of Extraction Process for Flavonoid from Soutellaria barbata by Response Surface Methodology and Evaluation of Its Antioxidant Activity
CHEN Hongmei, XIE Ling*
(School of Life Science, Anqing Normal University, Anqing 246011, China)
Flavonoid with antioxidant activity was extracted from Soutellaria barbata based on single factor experiments. A Box-Behnken design involving four factors at three levels each was used to determine the optimum extraction conditions using fl avonoid yield as the response. The optimal extraction conditions were obtained as follows: extraction solvent, 75% ethanol; liquid to material ratio, 40:1 (mL/g); extraction time, 80 min; and ultrasonic power, 220 W. Under the optimized conditions, the yield of fl avonoid was 11.53%. The antioxidant activity was evaluated based on 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging capacity, hydroxyl free radical scavenging capacity and reducing power. The results showed that the fl avonoid from S. barbata had good antioxidant activity.
Soutellaria barbata; fl avonoid; response surface analysis; antioxidant activity
10.7506/spkx1002-6630-201602008
Q946.5
A
1002-6630(2016)02-0045-06
陈红梅, 谢翎. 响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J]. 食品科学, 2016, 37(2): 45-50. DOI:10.7506/ spkx1002-6630-201602008. http://www.spkx.net.cn
CHEN Hongmei, XIE Ling. Optimization of extraction process for flavonoid from Soutellaria barbata by response surface methodology and evaluation of its antioxidant activity[J]. Food Science, 2016, 37(2): 45-50. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201602008. http://www.spkx.net.cn
2015-05-12
安徽省教育厅自然科学重点项目(KJ2015A185)
陈红梅(1980—),女,副教授,硕士,研究方向为植物生物化学。E-mail:hongmeichen2000@163.com
*通信作者:谢翎(1980—),男,副教授,博士,研究方向为生物化学与分子生物学。E-mail:xxvexl9@163.com

