16种市售酵素食品功能分析与评价
张 思王 蕾 张志旭 杨继国 任 杰 刘东波
(1. 湖南农业大学园艺园林学院,湖南 长沙 410128; 2. 国家中医药管理局亚健康干预技术实验室,湖南 长沙 410128;3. 辽宁晟启昊天生物医药科技有限公司,辽宁 沈阳 110000; 4. 华南理工大学食品科学与工程学院,广东 广州 510640;5. 华南协同创新研究院,广东 东莞 523808)
16种市售酵素食品功能分析与评价
张 思1,2王 蕾2,3张志旭2杨继国4,5任 杰5刘东波1,2
(1. 湖南农业大学园艺园林学院,湖南 长沙 410128; 2. 国家中医药管理局亚健康干预技术实验室,湖南 长沙 410128;3. 辽宁晟启昊天生物医药科技有限公司,辽宁 沈阳 110000; 4. 华南理工大学食品科学与工程学院,广东 广州 510640;5. 华南协同创新研究院,广东 东莞 523808)
采用紫外分光光度法、滴定法、HPLC法等分别分析了16种市售酵素食品清除DPPH自由基、超氧阴离子、羟自由基的能力,脂肪酶、淀粉酶活力以及有机酸的种类和含量,并建立其相应的评价体系。结果显示,16种酵素食品均具有较强的自由基清除能力,总抗氧化性能是20 μg/mL Vc的1~2倍,具有一定的脂肪酶与淀粉酶活性,含有3~7种有机酸。研究结果表明,酵素食品具有一定的抗氧化能力及助消化、调节肠道菌群的功能。
酵素;抗氧化;功效酶;有机酸;评价体系
酵素食品是一种以新鲜水果、蔬菜、食用真菌、中草药等为原料,经过酵母菌、乳酸菌及醋酸菌等多种有益菌发酵而产生的功能性发酵产品[1]。酵素富含多种对人体有益的活性物质,如酚类、黄酮类、有机酸类、多糖类以及酶类(脂肪酶、淀粉酶、蛋白酶、SOD等)[2],具有抗氧化、润肠通便、抗菌消炎、解酒护肝等作用[3-6]。酵素食品所使用的发酵技术,使果蔬原料通过复杂的中间代谢或交叉代谢,实现代谢物质之间的生物转化,不仅可以改善发酵基质原有的一些不良风味,还可以产生一些新的生物活性成分,增加酵素食品的风味、口感及功效[7-8]。
当下,酵素食品发展迅速,在不少厂家将其产业化、规范化的同时,一些自制酵素也开始流行。商品化的酵素从发酵基质、菌种选择到发酵工艺、后续处理都严格把控。与之相比,自制酵素制作过程的不可控因素可能使其对人体造成一定伤害:① 发酵过程中,由于器具消毒不彻底,发酵过程密封不严等,可能引入杂菌,造成污染;② 代谢过程受外界环境的影响,代谢产物不可控;③ 水果的成分复杂,在发酵过程中可能会产生杂醇油,它是水果在酒精发酵过程中的副产物,如果未分离除去,对人体会有一定的危害[9]。
规范化生产的酵素食品在食品安全、功效、营养和口感方面都具有明显的优势,盛行于日本、台湾、美国和一些欧洲国家及东南亚地区。2014年,全球酵素市场规模已超过50亿美元,年增长率达7%以上[10]。中国酵素食品的生产尚处于初级阶段,酵素食品的市场也才起步。由于缺乏具有针对性的监管和控制,中国市场上出现的酵素食品质量参差不齐,并且缺乏相应的评价标准[11-12]。
现代社会人们饮食不规律、运动时间少,由氧化胁迫、肠道菌群紊乱所导致的消化系统疾病、代谢性疾病、心血管疾病等发病频繁[13-14]。因此,在良好的市场前景的背景下,研究具有抗氧化性、能够调理肠胃功能的酵素食品有着重大的意义。
目前中国对酵素食品的研究主要有功效酶活力[1]、功能验证[4-6]、体外抗氧化[15]等,结果显示其相关功效酶均有一定活力,也具有较好的抗氧化能力。而对酵素食品抗氧化、功效酶、有机酸进行测定并作出相应功能评价目前还没有。
本研究拟以市售酵素食品为研究对象,对其清除DPPH自由基、超氧阴离子、羟自由基的能力,脂肪酶、淀粉酶这两种主要功效酶活力以及有机酸等有益活性物质进行分析评价,建立抗氧化性能、助消化、改善肠道菌群的评价体系,为酵素食品的理论研究及产品开发提供数据基础。
1 材料与方法
1.1 材料
1.1.1 试验原料
酵素食品:市售的不同产地,不同品牌的酵素,16种。本研究涉及的16种酵素食品,均为正规的工业化生产产品,经过规范化、标准化的相关工序,得到生产许可。
1.1.2 主要试剂
DPPH(2,2-Diphenyl-1-picryhydrazyl):美国Sigma 公司;
抗坏血酸:纯度≥99.7%,国药化学试剂有限公司;
乳酸、醋酸:色谱纯,国药化学试剂有限公司;
苹果酸、琥珀酸、甲酸、柠檬酸、正戊酸、丙酸、异丁酸、正丁酸、异戊酸、丙酮酸、Tris试剂、邻苯三酚、硫酸亚铁、过氧化氢、水杨酸、聚乙烯醇、磷酸氢二钠、磷酸二氢钾、3,5-二硝基水杨酸、酒石酸钾钠、柠檬酸钠、福林试剂等:分析纯,国药化学试剂有限公司。
1.1.3 主要仪器
高效液相色谱仪:Agilent 1260型,美国安捷伦科技有限公司;
紫外可见分光光度计:UV-1800型,日本岛津公司;
高速离心机:2-16R型,湖南恒诺仪器设备有限公司。
1.2 方法
1.2.1 酵素清除DPPH自由基能力的测定 在文献[16]的基础上进行部分修改,准确称取20 mg DPPH,用无水乙醇定容于500 mL容量瓶中,得到浓度为 0.04 mg/L 的DPPH溶液(现配现用)。分别取酵素样品1 mL,加1 mL 蒸馏水及2 mL 的DPPH溶液,混匀后黑暗反应30 min,在517 nm下测定吸光度,用20 μg/mL 的Vc溶液代替酵素作为阳性对照,按式(1)计算清除率:
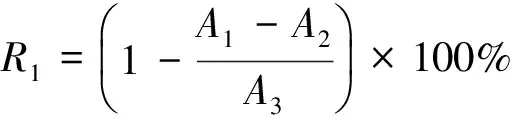
(1)
式中:
R1——DPPH自由基清除率,%;
A1——DPPH溶液与酵素的吸光度;
A2——酵素与无水乙醇的吸光度;
A3——DPPH溶液与无水乙醇的吸光度。
1.2.2 酵素清除超氧阴离子能力的测定 在文献[15]基础上稍有改进。取 pH 8.2的Tris—HCL缓冲液4.5 mL,分别加入4.2 mL 蒸馏水和 25 mmol/L邻苯三酚0.3 mL,混匀后25 ℃ 反应5 min,立即加入1 mL 8 mol/L 的HCl,终止反应,在299 nm测定吸光度,空白管以 Tris—HCL 缓冲液作参比,测得A1。另取缓冲液,在加入邻苯三酚前加入酵素样品溶液1 mL,蒸馏水减少相应体积,空白管用同样的酵素样品作参比,不加邻苯三酚,测得A2。用20 μg/mL 的Vc溶液代替酵素作为阳性对照,按式(2)计算清除率:
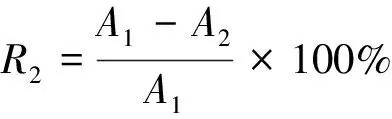
(2)
式中:
R2——超氧阴离子清除率,%;
A1——空白试剂的吸光度;
A2——酵素与试剂的吸光度。
1.2.3 酵素清除羟自由基能力的测定 参照文献[17]稍作改进。在试管中依次加入6 mmol/L FeSO4溶液2 mL、酵素样品1 mL、蒸馏水1 mL、6 mmol/L H2O2溶液2 mL,摇匀,静置10 min,再加入6 mmol/L水杨酸溶液2 mL,摇匀,静置30 min后于510 nm处测定吸光度A1;用蒸馏水代替水杨酸溶液时测得本底吸光度A2;用蒸馏水代替酵素样品时测得空白对照吸光度A3。用20 μg/mL 的Vc溶液代替酵素作为阳性对照,按式(3)计算清除率:
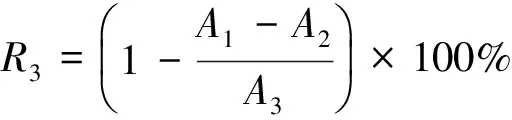
(3)
式中:
R3——羟自由基清除率,%;
A1——酵素与试剂的吸光度;
A2——本底吸光度;
A3——空白对照的吸光度。
1.2.4 酵素脂肪酶活力测定 按GB/T 23535—2009的滴定法执行。
1.2.5 酵素淀粉酶活力测定 在文献[18]的基础上进行改进。
(1) 标准曲线的绘制:分别精密量取1 mg/mL的麦芽糖标准品溶液0.0,0.2,0.6,1.0,1.4,1.8,2.0 mL,置试管中,加水至2 mL。再加入2 mL DNS试剂,摇匀,置沸水浴中加热5 min,取出,流水冷却,用水转移至25 mL容量瓶中,定容,摇匀,以未加麦芽糖标准品溶液的相应溶液为空白,在540 nm处测定吸光度。以吸光度A为纵坐标,质量浓度C为横坐标,绘制标准曲线。
(2) 样品测定:取试管两批,分别作为供试管和空白管,各精密加入1%淀粉溶液1 mL,置37 ℃水浴保温5 min。供试管中精密加入酵素样品1 mL,37 ℃水浴准确反应5 min后,立即加入2 mL DNS试剂,摇匀,沸水浴10 min;空白管中加入2 mL DNS试剂,37 ℃水浴反应5 min,精密加入酵素样品1 mL,摇匀,沸水浴10 min。在540 nm处测定吸光度。
在上述条件下,每分钟水解淀粉生成1 μmol麦芽糖的量,为一个淀粉酶活力单位(1 U = 1 μmol/min)。淀粉酶活力按式(4)计算:

(4)
式中:
U——淀粉酶活力单位,U/mL;
m——酵素样品水解淀粉产生的麦芽糖的质量,μg;
M——麦芽糖分子质量,342.3;
V1——酵素样品稀释体积,mL;
V2——酵素样品加入量,mL;
W——酵素样品取样量,g;
t——反应时间,min。
1.2.6 酵素有机酸的定性及定量试验 参考文献[19],稍作修改。
(1) 色谱分离条件:使用Aminex HPX-87H型色谱柱(300 mm×7.8 mm:Bio-Rad. Hercules),以0.005 mol/L的H2SO4溶液为流动相,流速0.6 mL/min,柱温50 ℃,紫外检测器波长210 nm。
(2) 样品预处理:准确量取一定体积的酵素样品经10 000 r/min离心5 min后取上清液1 mL,适当稀释后经0.22 μm膜过滤,进样10 μL。
(3) 标准品制备:精确称取标准品,稀释为不同浓度,使用0.22 μm膜过滤进样,进样量20 μL。
2 结果与分析
2.1 酵素对自由基清除能力的测定
1 mL不同的酵素样品对DPPH自由基、超氧阴离子、羟自由基清除能力不同(表1)。所检测的市售酵素样品对DPPH自由基均有较强的清除能力。其中4号样品最高(96.64%),与20 μg Vc清除能力相当(20 μg Vc的1.04倍);所检测的酵素样品对超氧阴离子清除能力均远远大于Vc,12号样品最低,仍有20 μg Vc的6倍之高,15号样品是20 μg Vc的14倍;对羟自由基的清除能力,所检测的样品均高于20 μg Vc,清除率基本上是Vc的2.7~3.2倍。
酵素对DPPH自由基、超氧阴离子、羟自由基都具有较好的清除能力,这可能与酵素中所含的有效成分相关。16种酵素均是以多种蔬菜、水果、食药用菌以及传统中药为原料,经多种益生菌发酵而成的,含有丰富的次生代谢产物,其中的酚类、黄酮类物质能够提供氢离子或者自由的羟基,与自由基结合,使其稳定或被还原,从而起到清除或抑制自由基的作用。
2.2 酵素酶活力的测定
酵素样品脂肪酶、淀粉酶活力测定结果见表2。所检测样品脂肪酶酶活均较低,最高的10号样品仍只有2 U/mL,与于晓艳等[1]所测定的微生物酵素脂肪酶活力结果较为一致。麦芽糖线性回归方程为:y=0.454 4x-0.036 9,R2=0.999 2,不同样品淀粉酶活力差异较大,15号样品酶活最高,为43.04 U/mL,而13、14号样品却显示无淀粉酶活,可能与样品配方的种类、含量及菌种有关。
脂肪酶、淀粉酶都属于消化酶,能够将脂肪和淀粉分解成人体能够吸收的小分子,不仅可以维护胃肠道功能,缓解各种原因引起的消化不良症状,同时还可间接向机体提供各种营养。结果表明大部分所检测的酵素食品有一定的脂肪酶活性、淀粉酶活性,但脂肪酶活性较低,推测其起到助消化作用的可能主要是淀粉酶。

表1 不同酵素对自由基的清除率
2.3 酵素有机酸的定性及定量试验
乳酸、乙酸的线性回归方程分别为:y=1 112.3x-54.278,R2=0.999 9;y=577.09x+3 425.9,R2=0.999 7。
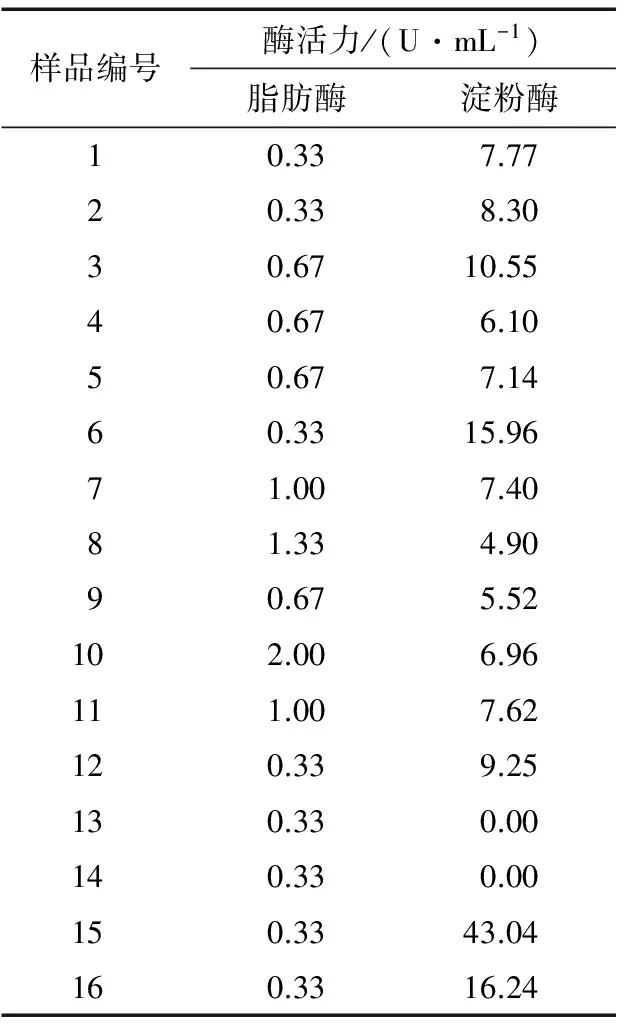
表2 不同酵素的酶活力
有机酸是水果和蔬菜中的天然产物,强烈影响着果蔬的感官品质、颜色、味道和香味以及水果饮料的稳定性[20]。本研究测定酵素样品的有机酸种类,主要包括乳酸、乙酸、柠檬酸、苹果酸和异丁酸,部分还有丙酮酸、正戊酸、琥珀酸、丙酸和异戊酸(表3、4)。不同的有机酸对酵素风味、口感的贡献不同,乳酸的酸味较强,但较温和、稍有涩味;乙酸具有刺激性酸味;柠檬酸温和爽快、有新鲜感、后苦时间短;苹果酸酸度大、稍苦涩、滞留时间长;异丁酸具有奶酪味与陈酒花味[21]。所检测的大多数酵素产品均含有4种以上有机酸,使其具有较宽泛的风味阈值、综合口感以及较强的风味稳定性。
在改善有机酸口味的同时,有机酸还可通过降低肠道 pH,提高消化酶活性,增殖有益菌、抑制有害菌,从而调控肠道微生物平衡[22]。由结果可知酵素食品能够起到一定的调节肠道微生物,改善肠道健康的作用。
2.4 酵素评价体系的建立
2.4.1 酵素抗氧化性能评价体系的建立 以清除自由基测定抗氧化能力的方法,是目前最常用的方法。对于不同的自由基,酵素食品的清除机制也不相同。所以,为了综合评价酵素食品抗氧化性能,可以采用式(5)的计算方法,建立评价酵素食品抗氧化性能的体系,定义为总自由基清除能力大于50%时的产品具有较好的抗氧化性能。
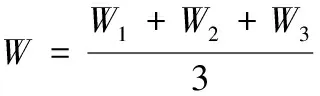
(5)
式中:
W——总抗氧化性能,%;
W1——清除DPPH自由基性能,%;
W2——清除超氧阴离子性能,%;
W3——清除羟自由基性能,%。
根据式(5)计算出结果见图1。由图1可知,其抗氧化性能约为20 μg/mL Vc的1~2倍,总自由基清除能力也都大于50%。由此体系可以初步对酵素食品抗氧化性能进行综合评价。
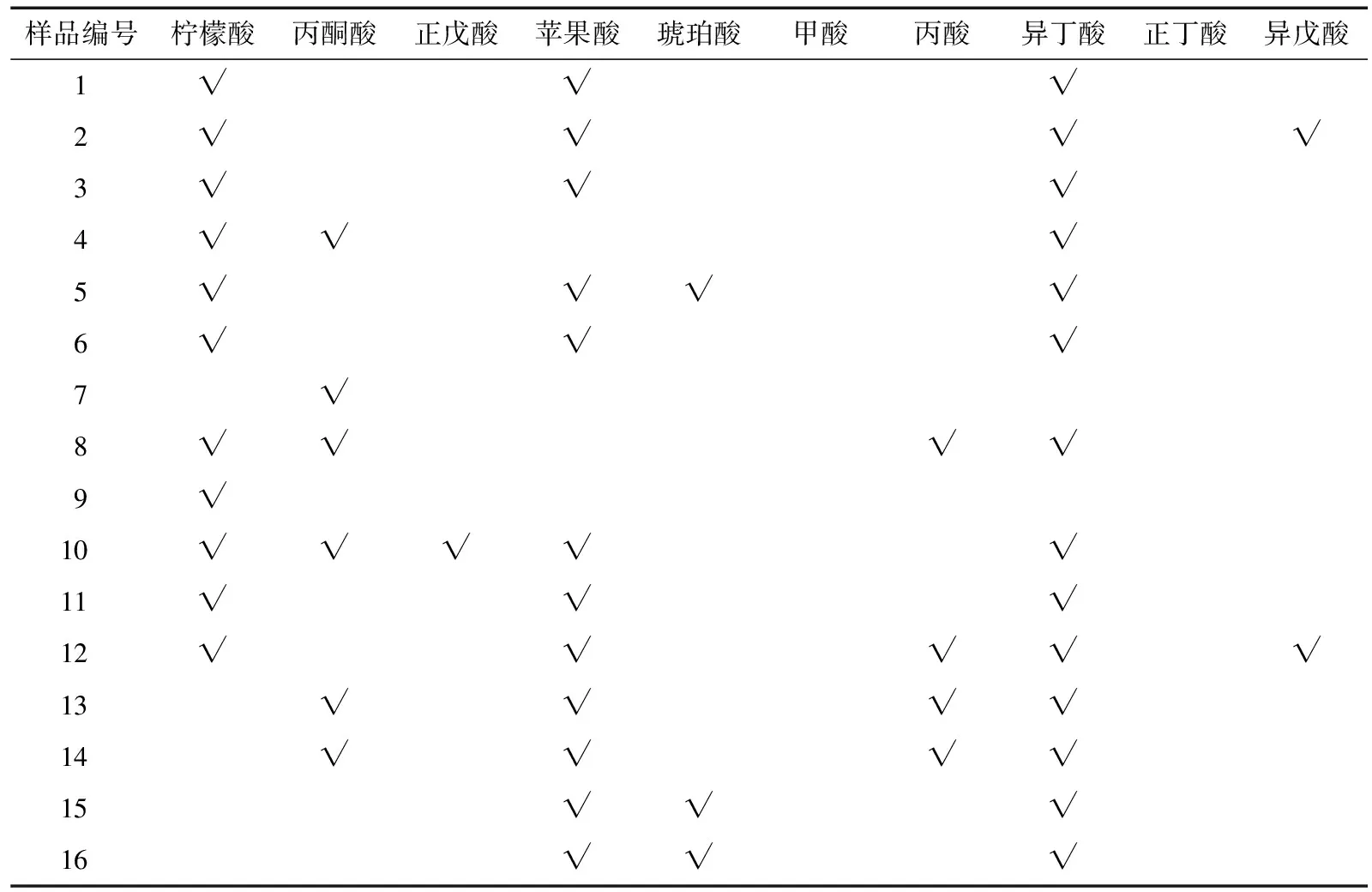
表3 酵素样品有机酸定性†
† “√”表示存在此种物质。
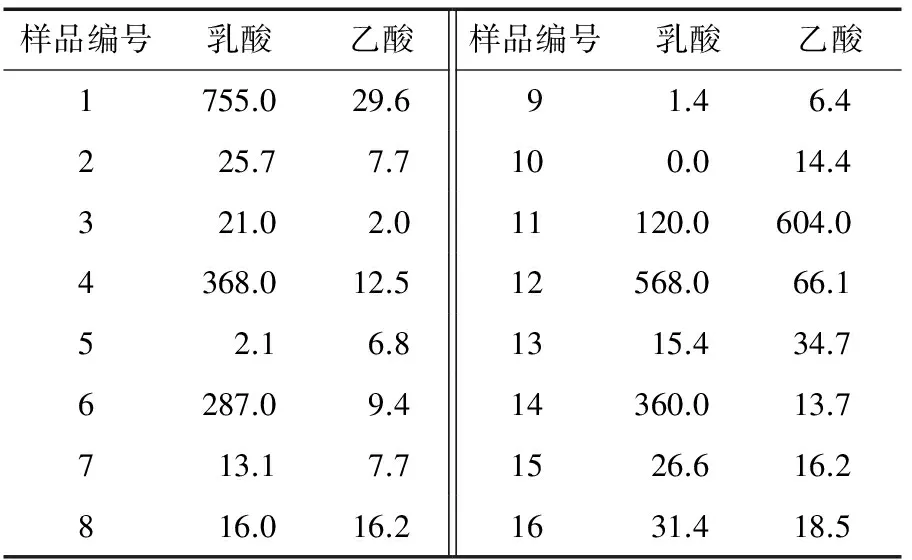
表4 酵素样品有机酸定量
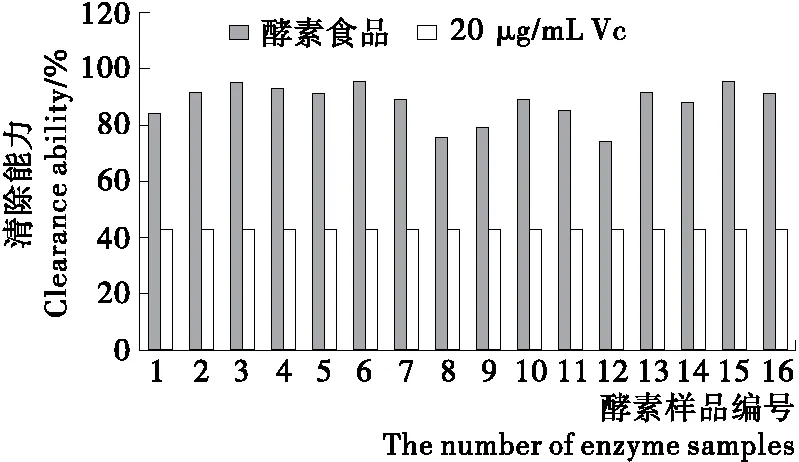
图1 不同酵素总抗氧化性能
2.4.2 酵素助消化性能评价体系的建立 消化酶依消化对象的不同而大致可分为蛋白酶、淀粉酶、脂肪酶和纤维素酶等几种。酵素食品的主要功效酶有淀粉酶和脂肪酶,根据中国人的膳食结构,碳水化合物占总能量的70%左右,脂肪占总能量的20%左右。可以由此建立酵素助消化性能的评价体系,见式(6):
X=U1×0.2+U2×0.7,
(6)
式中:
X——助消化性能,U/mL;
U1——脂肪酶活力,U/mL;
U2——淀粉酶活力,U/mL。
由图2可知,15号样品具有最强的助消化能力,13、14号样品作用基本为零。此体系可以对酵素食品助消化性能进行初步评价。

图2 不同酵素助消化性能
2.4.3 酵素调节肠道菌群性能评价体系的建立 有机酸的抑菌机制多种多样且有差异,可能是单一机制,也可能是多机制协同作用[23]。种类越多,越有利于肠道菌群的多样性。其中,乳酸具有抑菌、延长保质期、调节pH值、保持食品色泽、调味、提高产品质量等作用,乙酸是一种酸度调节剂,为避免细胞质的pH值发生破坏性改变,通常在细胞中的乙酸的浓度被严格控制在一个很低的范围内[24]。因此,可以建立酵素食品有机酸的评价体系:乳酸含量高,乙酸含量低,种类多者有较强的改善肠道菌群性能。
由图3、4可知,1、4、6、12、14号样品乳酸含量很高,乙酸含量很低,有机酸种类也有多种,而11号样品乙酸含量远高于乳酸,其调节肠道菌群的性能也就弱于前面几号样品。
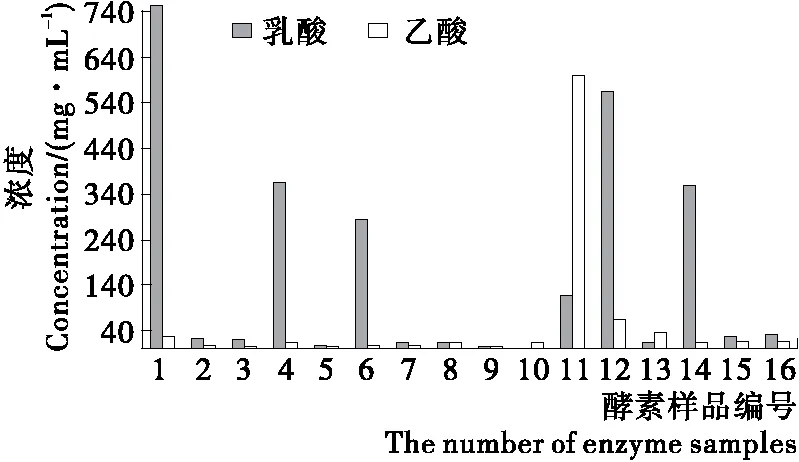
图3 不同酵素乳酸、乙酸浓度
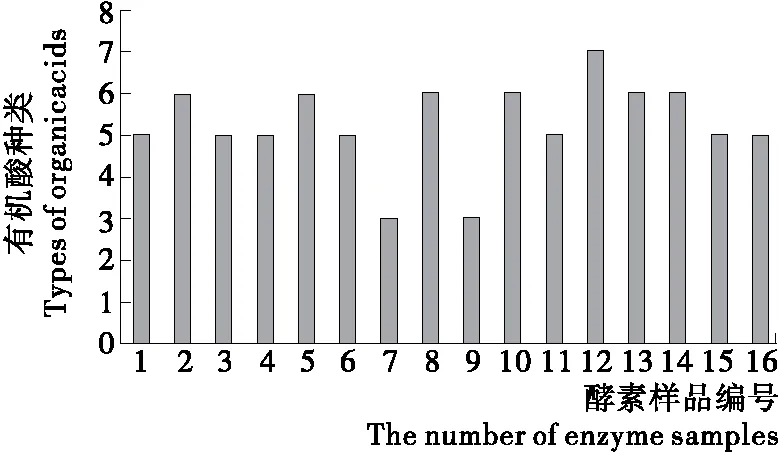
图4 不同酵素有机酸数量
3 结论与讨论
(1) 本研究分析了16种市售酵素食品清除DPPH自由基、超氧阴离子、羟自由基的能力,淀粉酶、脂肪酶的活力,以及有机酸的种类和含量。结果表明,与20 μg/mL的Vc相比,酵素具有更强的自由基清除能力,但仍需要进一步研究其抗氧化的物质基础,提高其抗氧化能力;酵素食品有一定的脂肪酶、淀粉酶活性,淀粉酶活性较高;有3~7种不等的有机酸,且乳酸含量高于乙酸。从检测结果可知,这16种产品的质量良莠不齐,可能与其果蔬配方及生产工艺有关。
(2) 根据研究结果,初步建立了酵素食品抗氧化性能、助消化性能以及调节肠道菌群性能的评价体系:将酵素食品对DPPH自由基、超氧阴离子、羟自由基的清除率进行综合,计算总的抗氧化性能;按照中国人的膳食结构权重酵素食品中脂肪酶和淀粉酶的活力,建立其助消化性能的评价体系;根据有机酸的性质与作用机制建立了酵素食品调节肠道菌群性能的评价体系。此评价体系的建立对于酵素食品产业的健康发展具有重要意义。
[1] 于晓艳, 任清, 卢舒娴, 等. 微生物酵素主要功效酶活力的测定[J]. 食品科技, 2008(7): 193-196.
[2] 刘敏, 熊燕, 忠旭, 等. 不同配方发酵的酵素产品中活性物质的对比研究[J]. 食品与发酵科技, 2015, 51(5): 27-31.
[3] 蒋增良, 毛健卫, 黄俊, 等. 葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J]. 中国食品学报, 2014, 14(10): 29-34.
[4] 赵金凤, 曲佳乐, 皮子凤, 等. 植物酵素润肠通便保健功能研究[J]. 食品与发酵科技, 2012, 48(3): 54-56.
[5] 董银卯, 于晓艳, 潘妍, 等. 微生物酵素抑菌功效研究[J]. 香料香精化妆品, 2008(4): 27-29.
[6] 曲佳乐, 赵金凤, 皮子凤, 等. 植物酵素解酒护肝保健功能研究[J]. 食品科技, 2013, 38(9): 51-54.
[7] 蒋增良. 天然微生物酵素发酵机理、代谢过程及生物活性研究[D]. 浙江: 浙江理工大学, 2012: 1-3.
[8] KOMATSUZAKI N, TSULAHARA K, TOYOSHIMA H, et al. Effect of soaking and gaseous treatment on GABA content in germinated brownrice[J]. J. Food Eng., 2007, 78(2): 556-560.
[9] 李艳鸣. 酵素被神化,自制须谨慎[J]. 营养饮食, 2016(2): 30-31.[10] 潘宣如, 毛旸昊. 浙江果蔬酵素新兴产业现状分析及对策[J]. 北方经贸, 2015(11): 103-105.[11] 刘加友, 王振斌. 微生物酵素食品研究进展[J]. 食品与发酵工业, 2016, 42(1): 273-276.
[12] 王小萱. 健康产业后起之秀--酵素产业可持续发展提速快行[N]. 中国食品报, 2015-12-11(001).
[13] 王晓宇, 杜国荣, 李华. 抗氧化能力的体外测定方法研究进展[J]. 食品与生物技术学报, 2012, 31(3): 248.
[14] 陆颖影, 胡国勇, 王兴鹏. 肠道菌群与相关代谢性及消化系统疾病的关系[J]. 国际消化病杂志, 2015, 35(2): 126-128.
[15] 董银卯, 何聪芬, 王领, 等. 火龙果酵素生物活性的初步研究[J]. 食品科技, 2009, 34(3): 192-196.
[16] 金寒冰, 方丽, 赖蓓蕾, 等. 苦苣多酚超声辅助提取及抗氧化研究[J]. 食品与机械, 2014, 30(5): 211-215.
[17] 朱晓宦, 吴向阳, 仰榴青, 等. 马齿苋粗多糖的提取及清除羟自由基活性作用[J]. 江苏大学学报: 医学版, 2007, 17(1): 57-60.[18] 宋阳, 王亚琼, 赵丽恋, 等. 基于淀粉酶活性检测的麦芽质量评价方法[J]. 药学进展, 2010, 34(9): 411-417.
[19] 刘文信, 姜开荣. 发酵醪液中糖、有机酸、乙醇的HPLC分析[J]. 化学工程师, 2013(3): 27-28.
[20] KADER A A. Flavor quality of fruits and vegetables[J]. Journal of the Science of Food and Agriculture, 2008, 88(11): 1 863-1 868.[21] 董霞. 啤酒中有机酸类物质的研究——啤酒有机酸与口感关系的初步研究[D]. 江苏: 江南大学, 2004: 3-4.
[22] 张旭晖, 王恬, 冀凤杰, 等. 有机酸化剂对断奶仔猪生长性能和肠道健康的影响[J]. 动物营养学报, 2012, 24(3): 507-514.
[23] BRUL S, COOTE P. Preservative agents in foods. Mode of action and microbial resistance mechanisms[J]. Int. J. Food Microbiol., 1999, 50(1/2): 1-17.
[24] 李志华. 泡菜中五种有机酸的高效液相色谱分离分析[D]. 湖南: 湖南师范大学, 2011: 9-13.
Functional analysis and evaluation on commercially available enzyme food
ZHANG Si1,2WANGLei2,3ZHANGZhi-xu2YANGJi-guo4,5RENJie5LIUDong-bo1,2
(1.CollegeofHorticultureandLandscape,HunanAgriculturalUniversity,Changsha,Hunan410128,China;2.StateKeyLaboratoryofSubhealthInterventionTechnology,Changsha,Hunan410128,China;3.LiaoningShengQiHeavenBiomedicalScienceTechnologyCo.,Ltd.,Shenyang,Liaoning110000,China;4.CollegeofFoodScienceandEngineering,SouthChinaUniversityofTechnology,Guangzhou,Guangdong510640,China; 5.SouthChinaInstituteofCollaborativeInnovation,Dongguan,Guangdong523808,China)
UV spectrophotometric, titration and HPLC method were used to test the scavenging ability of DPPH, superoxide anion and hydroxyl radical, the activities of lipase, amylase and the number of organic acid of 16 kinds of enzymes in market. Further, the corresponding evaluation system was established. The results showed that the enzymes have strong free radical scavenging ability, nearly 1~2 times of 20 μg/mL Vc, a certain lipase and amylase activity and 3~7 kinds of organic acids. Therefore, enzyme foods have good antioxidant capacity, digestive function and intestinal flora regulation.
enzyme; antioxidant capacity; efficacy enzyme; organic acid; evaluation system
张思,女,湖南农业大学在读硕士研究生。
刘东波(1970-),男,湖南农业大学教授,博士。
E-mail:chinasaga@163.com.
2016—06—20

