婴幼儿辅食营养补充品中叶酸的测定方法
罗敏婷吴克刚 黄伟乾
(1. 广东工业大学轻工化工学院食品科学与工程系,广东 广州 510006;2. 广州质量监督检测研究院,广东 广州 510110)
婴幼儿辅食营养补充品中叶酸的测定方法
罗敏婷1吴克刚1黄伟乾2
(1. 广东工业大学轻工化工学院食品科学与工程系,广东 广州 510006;2. 广州质量监督检测研究院,广东 广州 510110)
采用微生物法、固相萃取—高效液相色谱法和直接氨水提取—高效液相色谱法3种方法分别对婴幼儿辅食营养补充品中叶酸进行检测,选出最为准确、快速的方法。结果表明:采用pH 6.3的甲醇—0. 05 mol/L磷酸二氢钾(体积比为5∶95)作为流动相,控制叶酸在6.5 min出峰的氨水提取—高效液相色谱法,其标准曲线相关系数为0.999 8,检出限为0.019 0 mg/L。与另外两种方法相比,该方法具有简便、快速、灵敏、重现性好等优点,为建立婴幼儿辅食营养补充剂中叶酸含量的测定方法提供了理论依据。
婴幼儿辅食;营养补充品;叶酸;微生物法;固相萃取;氨水提取;高效液相色谱
叶酸(folic acid)又称维生素B9,是一种重要的水溶性维生素,必须从日常食物中获取来维持人体正常的生理功能,人体内缺乏叶酸会引起巨幼红细胞贫血、新生胎儿神经管畸形等疾病[1]。2015年9月,北京举办的第四届中国出生缺陷防控论坛再次强调了叶酸在预防神经管畸形及其他出生缺陷中的重要性。辅食营养补充品是由多种微量营养素混合成的粉末或颗粒状补充品,其中含或不含食物基质和其他辅料,是应用于婴幼儿辅食家庭强化使用的营养素补充品[2-3]。随着人民生活水平的提高和营养知识的广泛普及,人们通过服用膳食补充剂来弥补膳食中摄入不足的营养素。但是目前国内外尚未有此类产品标准,而基质复杂膳食补充剂的监督监测工作尚处于起步阶段,尚无国家标准和国际标准对其叶酸进行检测的方法[4]。所以研发一种快速灵敏的、可以用于检测低质量分数、基质复杂的营养补充品中叶酸的方法成为当务之急。
针对食品中叶酸含量检测方法的研究,国内外的科技工作者近年来已进行了深入的研究,根据检测食品的类型不同而开发出多种检测叶酸含量的分析方法[5]。目前,测定叶酸的分析方法主要有微生物法、分子荧光法等,这些前处理方法往往较复杂、重现性差、检测周期长等,而微生物法灵敏度高、结果准确,所以许多国际机构仍将微生物法作为叶酸分析的标准方法或第一方法[6];对于检测限较低的蔬菜、保健食品等的检测,中国多采用高效液相色谱法[7-9];据报道[10]国外对于强化叶酸的产品的检测,一般都通过固相萃取小柱富集、纯化,然后用检出限高、选择性好的高效液相色谱法紫外检测器检测。上述常用的3种叶酸的检测方法都各有优缺点,而目前研究工作中针对基质复杂的婴幼儿辅食营养补充剂叶酸测定方法的研究尚少见报道。本研究针对中国基质复杂的婴幼儿辅食营养补充剂中叶酸分析方法的不足,拟采用了微生物法、固相萃取—液相色谱和氨水提取—液相色谱3种不同的检测方法比较分析测定的差异性,用氨水提取—液相色谱法建立了一个适用于此类样品叶酸定量检测的快速、简便、准确的分析方法,为实际检测提供有效的数据支撑。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
干酪乳杆菌(Lactobacillus casei)ATCC 7469:美国典型培养物保藏中心;
乳酸杆菌琼脂(/肉汤)培养基、叶酸酪蛋白培养基:美国碧迪医疗器械(上海)有限公司;
婴幼儿辅食营养补充品:叶酸声称含量4 000 μg/100 g,市售;
叶酸标准品:99.9%,上海安谱科学仪器有限公司;
抗坏血酸:分析纯,广州化学试剂厂;
甲醇:色谱纯,美国Fisher公司;
磷酸二氢钾:分析纯,广州化学试剂厂;
氨水(氢氧化铵):分析纯,国药集团化学试剂公司;
试验用水为蒸馏水,流动相经0.45 μm微孔滤膜过滤。
1.1.2 主要仪器设备
高压灭菌锅:HVE-50型,日本平山公司;
隔水式恒温培养箱:GNP-9270型,上海精宏实验设备有限公司;
紫外—可见分光光度计:UV-1800型,日本岛津公司;
高效液相色谱仪(配二极管阵列检测器):1260型,美国安捷伦Agilent公司;
超声波清洗机:JP-080S型,深圳洁盟清洁设备有限公司;
萃取柱:Waters Sep-Pak○RVac 6cc C18-500 mg型,美国Waters公司。
1.2 试验方法
1.2.1 微生物法
(1) 标准曲线制作:叶酸标准工作溶液的浓度为0.60 ng/mL。在无菌条件下,按照表1的顺序在灭菌试管中进行叶酸标准工作液的稀释,从而制备一系列浓度梯度的标准曲线溶液[11]。
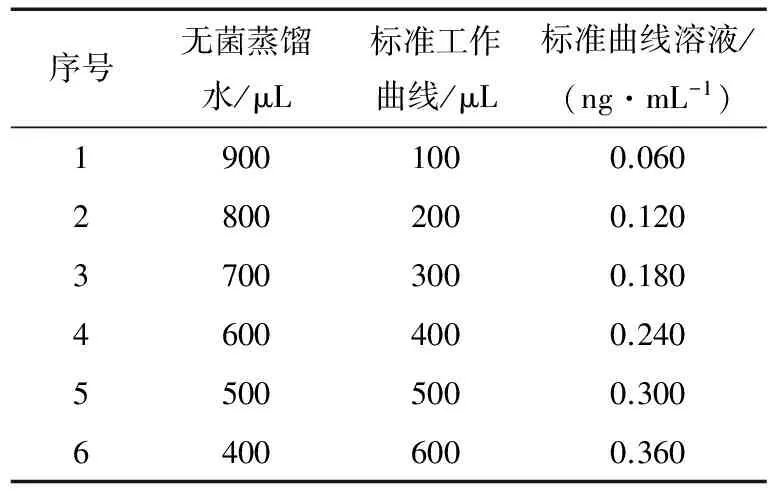
表1 叶酸的标准曲线溶液的制备
(2) 样品测定溶液的制备:准确称取约2 g(精确到0.000 1 g)样品于100 mL烧杯中,用25~30 mL二级水复原样品,定容至100 mL。然后吸取1 mL该样液于试管中,加19 mL含抗坏血酸的磷酸缓冲液,并于100 ℃水浴加热5 min。再用磷酸盐缓冲液稀释,定容至100 mL,作为叶酸样品溶液。制备完样品测定溶液后,在无菌条件下,按照表2的顺序在灭菌试管中进行样品工作液的稀释,从而制备相应浓度梯度的样品测定溶液[12]。

表2 样品测定溶液的制备
(3) 接种培养:在已灭菌的小管中每管加入300 μL系列标准曲线溶液(或样品测定溶液)和300 μL含有0.05%浓度试验用菌悬液的无菌叶酸酪蛋白培养基,加盖,充分振荡混匀置于(36±1) ℃恒温箱中培养16~24 h[11]。
(4) 测定:混合均匀,使用紫外—可见分光光度计于550 nm下测定各小管溶液的吸光度(A)。
1.2.2 固相萃取—液相色谱法
(1) 色谱分析条件:色谱柱,迪马C18(2)柱(250 mm×4.6 mm);流动相,甲醇—0.05 mol/L磷酸二氢钾(体积比为5∶95,0.1 mol/L KOH溶液调节pH值为6.3);柱温,30 ℃;流速,1.0 mL/min;进样量,20 μL;波长选择,二极管阵列检测器对叶酸标准品进行全波长扫描,结果显示出的最大吸收峰为278 nm[13]。
(2) 标准溶液的配制:叶酸标准储备液浓度为114 μg/mL,贮于4 ℃冰箱中避光保存。
(3) 样品前处理:准确称取5 g左右(精确到0.000 1 g)样品于50 mL锥形瓶中,加约30 mL pH 6.3的0.05 mol/L磷酸二氢钾溶液(不含甲醇)、0.25 mL浓氨水和2 mL 1% VC溶液,振荡溶解再超声提取20 min,摇匀后用磷酸二氢钾溶液(不含甲醇)将超声后溶液定容至100 mL比色管中,混匀,过滤。
活化:先用10 mL甲醇(色谱纯)活化C18萃取柱,再用5 mL蒸馏水冲去甲醇;
上样:取10 mL样品清液加到活化的C18小柱柱床上,控制流速在40滴/min;
淋洗:待样液全部通过固相萃取柱后,用5 mL蒸馏水淋洗,弃去滤液;洗脱:用3 mL的氨水—甲醇水(5∶95)进行洗脱,直至C18萃取柱上的肉眼可见的色素全部洗脱下来,收集洗脱液,再用1 mL蒸馏水再次洗脱,氮气吹干,定容到5 mL。混匀,经0.45 μm微孔滤膜过滤。
(4) 测定:按照1.2.2(1)中的色谱分析条件,等待仪器自检稳定后,则分别注入标准溶液和样品溶液。以保留时间定性,记录峰面积(或峰高),用标准曲线计算样品中待测组分的含量。
1.2.3 氨水提取—液相色谱法
(1) 色谱分析条件:按照1.2.2方法。
(2) 标准溶液的配制:按照1.2.2方法。
(3) 样品前处理:精确称取1 g(精确到0.000 1 g)样品,置于50 mL比色管中,加约20 mL流动相、0.25 mL浓氨水和1 mL 1% VC溶液,振荡均匀后超声提取20 min,用流动相定容至刻度。混匀,静置,取上清液经0.45 μm微孔滤膜过滤后进样。整个试验操作过程用铝箔纸避光,以免叶酸见光分解。
(4) 测定:按照1.2.2方法中(4)进行测定。
2 结果与讨论
2.1 微生物法
2.1.1 线性分析 表1中叶酸的浓度作为横坐标,吸光度值(A)作为纵坐标,根据四参数方程来拟合微生物法的标准曲线,结果见图1。其中标准曲线的相关系数达到R2=0.999 4,表明相关性较好。
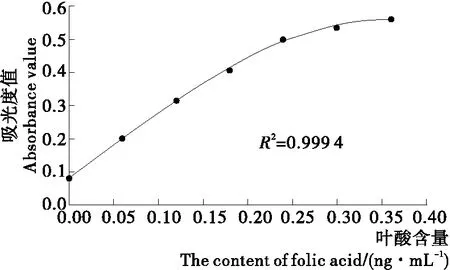
图1 微生物法测叶酸标准曲线
2.1.2 结果 按照GB 5413.16—2010方法和上述方法步骤,根据测定数据的平均值进行计算,得到样品中叶酸的量为(1 000.0±12.5) μg/100 g。
2.1.3 讨论 在制作微生物法标准曲线的过程发现,在图中描绘的各检测点不是形成一条直线,而是随着叶酸浓度的增加其相应的吸光度值(A)缓慢增加。为了能进行更加精确的计算,本试验则采用四阶方程进行拟合标准曲线。
虽然微生物法是检测叶酸含量的第一法,但是检测出来的结果为(1 000.0±12.5) μg/100 g,与样品的明示值4 000 μg/100 g存在较大的偏差。从标准曲线看,其相关性良好说明试验方法和试剂都不存在问题。但通过与婴幼儿配方奶粉的营养配方表相比较,发现存在较大不同的就是婴幼儿辅食营养补充品中含有大量的维生素和矿物质,所以可以初步判定结果差异在于样品基质,而是否因为维生素和矿物质含量过多导致微生物生长不起来则需进一步的研究。
在冯阿姨家一年多的工作中,我认为自己可以胜任这些零碎的家务活了,想挑战自己换家客户试试,换个工作环境,提高自己的工作水平,当然也希望在工资待遇方面可以更高。几经考虑之后,我和阿姨商量,阿姨同意了我的请求,就这样我怀着不舍和对未来的期待离开了我的第一个客户家。在门店短暂休息后,我很快去了第二个客户家——一个三口之家。客户黄女士怀有身孕,我的工作是给他们做饭,打扫卫生,照顾孕妇,接送八岁的孩子上学。他们是山东人,喜欢吃面食,正好我擅长做面食,加上在冯阿姨家学到的做菜方法,这些工作对我来说得心应手。特别是她家的孩子很喜欢吃我做的土豆沙拉、 油饼、蛋卷。
2.2 固相萃取—液相色谱法
2.2.1 前处理条件的确定 与氨水提取—液相色谱法相比,由于固相萃取—液相色谱法的提取液在空气停留的时间较长,特别是富集过程,所以将1%抗坏血酸添加量增加到2 mL;再由于固相萃取—液相色谱法中的洗脱液为氨水—甲醇水(体积比为5∶95),所以提取液的溶剂不应该含有甲醇,以免影响检测的结果。
2.2.2 流动相组成的选择 为了使固相萃取—液相色谱法能与氨水提取—液相色谱法具有有效的可比性,所以选择相同的流动相组成进行试验,即采用pH 6.3的甲醇—磷酸二氢钾(体积比为5∶95)作为流动相。
2.2.3 方法线性范围与检出限 标准曲线的绘制及线性范围:准确移取114 μg/mL叶酸标准储备液稀释,用流动相配制成含叶酸的浓度为0.0,0.1,0.5,1.0,2.5,5.0,7.5,10.0 μg/mL的标准系列,各个浓度重复进样3次,取相应3次峰面积的平均值。然后以叶酸的质量浓度(C)作为横坐标,峰面积(A)为纵坐标来绘制线性关系曲线。根据图2可得到结果的线性回归方程为:y=51.79x+2.869 4,相关系数R2为0.999 7,表明在0~10 μg/mL时,叶酸的质量浓度(C)和峰面积(A)的线性关系良好,适合用来做定量分析。
检出限:以3倍信噪比条件下对应的样品浓度计算检测限,S/N=2.638 3/0.034 56=76.33(浓度为0.501 6 μg/mL)。所以仪器S/N=3时,检出限LOQ为0.019 7 μg/mL;S/N=10时,定量限为0.065 6 μg/mL。
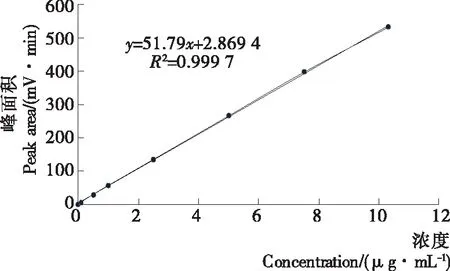
图2 固相萃取—液相色谱法测叶酸的标准曲线
2.2.4 加标回收率 采用加标回收率评价方法的准确度:取样品4份,向其中一份样品加入1 mL标准储备液,按前处理方法处理后重复进样3次,测定其相应的3次峰面积,计算其相应的回收率及RSD,结果见表3。
由表3可知,叶酸的相对标准偏差为0.88%~1.76%,但是其回收率仅为37.7%~42.8%,说明本方法的准确性有待研究和验证。

表3 固相萃取—液相色谱法测叶酸的回收率和RSD值
2.2.5 精密度 取标准储备液进样20 μL,按上述色谱条件连续重复进样6次,峰面积分别是6 064,6 080,6 006,6 044,6 032,6 076,计算出峰面积的平均值为6 046.8,其相对标准偏差为0.18%,表明仪器精密度良好。
2.2.6 重现性试验 取叶酸样品适量,共6份,按前处理制备样品溶液,进样20 μL,计算叶酸的含量及RSD,结果测得叶酸含量分别是1.135,1.016,1.043,1.021,1.048,1.122 mg/100 g,其平均含量为1.064 mg/100 g,RSD为0.86%,表明重复良好。
2.2.7 讨论 此方法与氨水提取—液相色谱法的前处理基本相同,根据理论同一个样品两种方法测定出来的结果应该相同的,然而两者得出的结果却截然不同,可能与样品的基质、提取不完全、洗脱不充分等影响的因素有关。
本试验根据固相萃取的提取方法得到的回收率仅为30%~40%,但测定的标准曲线、精密度、准确度和重现性都良好,结果说明了叶酸的标准品及仪器的精密度及准确性不存在任何问题,仅仅是对样品提取的方法出现问题,需要进一步进行改善。影响其测定结果的因素也很多,例如样品中叶酸含量少、样品的基质、洗脱液的性质、洗脱终点的判定等。
2.3 氨水提取—液相色谱法
2.3.1 前处理条件的确定 叶酸具有光不稳定性、易被氧化等性质,这些均会影响试验的准确性,所以操作过程中用铝箔纸避光;因为叶酸在中性偏碱性情况下较为稳定,所以选取0.5%氨水作为提取液,使提取液处于弱碱性状态;因为抗氧化剂Vc对叶酸的稳定性具有明显的保护作用,所以在提取液中加入1% Vc溶液。
2.3.2 流动相组成优化试验 叶酸属于极性的两性化合物,流动相的酸碱性是影响叶酸存在形式的关键因素。查阅大量高效液相色谱法测定食品中的叶酸含量相关文献[1,13]及GB 5413.16—2010标准时发现,流动相大多采用磷酸盐缓冲液与有机溶剂按一定比例混合的溶液,同时也有资料[14]采用乙酸铵作为流动相。经试验分析研究磷酸二氢钾和乙酸铵的分离效果,得出的结果与赵雯玮等[14]研究的结果一致:当流动相为乙酸铵时,不仅会出现拖尾现象,而且其分离度也不如磷酸二氢钾溶液。
有机溶剂的选择方面,相比乙腈,甲醇毒性比较低,价格也相当廉价,在吸光度等各方面的表现也毫不逊色。尽管使用时对柱子会产生较大的压力,但若能使用普遍压力较低的色谱柱,依然可以达到理想的分析效果。
根据叶酸的性质,试验主要采用甲醇与磷酸二氢钾体系作为流动相。在研究甲醇—磷酸二氢钾不同比例混合的影响时发现,如果流动相中甲醇的量增加时,叶酸的保留时间会提前,但是其色谱峰不能有效分离。当甲醇—磷酸二氢钾的体积比为5∶95时,叶酸的色谱峰在6.5 min出现,且能有效分离出来。
本研究最终采用甲醇—磷酸二氢钾(体积比为5∶95)作为流动相,固定其他试验条件不变,改变流动相的pH值,比较了不同pH值对叶酸分离情况,结果表明当流动相的pH 6.3时,叶酸的保留时间和分离度都较好。
2.3.3 方法线性范围与检出限 标准曲线的绘制及线性范围:准确移取114 μg/mL叶酸标准储备液稀释,用流动相配制成含叶酸的浓度为0.0,0.1,0.5,1.0,2.5,5.0,10.0 μg/mL的标准系列,各个浓度重复进样3次,取相应3次峰面积的平均值。然后以叶酸的质量浓度(C)作为横坐标,峰面积(A)为纵坐标来绘制线性关系曲线。根据图3可得到结果的线性回归方程为:y=68.591x-0.712 3,相关系数R2为0.999 8,从而表明在0~10 μg/mL时,叶酸的质量浓度(C)和峰面积(A)的线性关系良好,适合用来做定量分析。
检出限:以3倍信噪比条件下对应的样品浓度计算检测限,S/N=2.236 8/0.028 39=78.79(浓度=0.5 μg/mL)。所以仪器S/N=3时,检出限LOQ为0.019 0 μg/mL;S/N=10时,定量限为0.063 4 μg/mL。
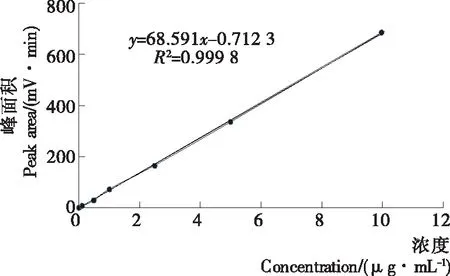
图3 氨水提取—液相色谱法测叶酸的标准曲线
Figure 3 Folic acid standard curve of direct-ammonia-extraction-HPLC method
2.3.4 加标回收率 采用加标回收率评价方法的准确度:取样品4份,向其中一份样品加入1 mL标准储备液,按前处理方法处理后重复进样3次,测定其相应3次峰面积,计算其相应的回收率及RSD,结果见表4。
由表4可知,叶酸的回收率为91.65%~99.4%,相对标准偏差为0.76%~1.50%,说明本方法比较准确。
2.3.5 精密度 取标准储备液进样20 μL,按上述色谱条件连续重复进样6次,峰面积分别是7 822,7 878,7 732,7 594,7 892,8 004,计算出峰面积的平均值为7 820.3,其相对标准偏差为 0.69%,表明仪器精密度良好。
表4 氨水提取—液相色谱法测叶酸的回收率和RSD值
Table 4 The recovery rates and determination precision of folic acid of direct-ammonia-extraction-HPLC method

序号加入值/(10-2μg·g-1)测定平均值/(10-2μg·g-1)RSD/%回收率/%1054241.45-2049521.76-3045461.00-411330158081.4591.65~99.4
2.3.6 重现性试验 取叶酸样品适量,共6份,按前处理制备样品溶液,进样20 μL,计算叶酸的含量及RSD,测得叶酸含量分别是5.022,4.950,4.946,4.943,5.011,4.945 mg/100 g,其平均含量为 4.969 mg/100 g,RSD为1.22%,表明重复良好。2.3.7 讨论 叶酸在酸性溶液中对热不稳定,溶于热水、碱性溶液,而选择流动相pH值呈弱酸性的第一个原因是叶酸在碱性溶液中易被氧化,第二原因是配制的标准品溶液和样品溶液均为弱碱性,叶酸大部分以离子形式存在,若流动相是偏弱酸性,则可抑制叶酸的电离,使叶酸以分子形式在柱中分离,防止出现拖尾峰,提高试验的准确性。
2.4 三种方法测定婴幼儿辅食营养补充品叶酸含量的比较
按照上述三种方法对婴幼儿辅食营养补充品的叶酸含量进行测定,结果见表5。由表5可知,只有氨水提取—高效液相色谱测定出来的结果最靠近试验样品的明示值。直接用氨水提取—液相色谱测定婴幼儿辅食营养补充剂中的叶酸更为准确,且前处理简单,分析速度快、适用的基质范围广、实用性强,为婴幼儿辅食营养补充剂中叶酸含量的测定提供了有效的数据支撑。
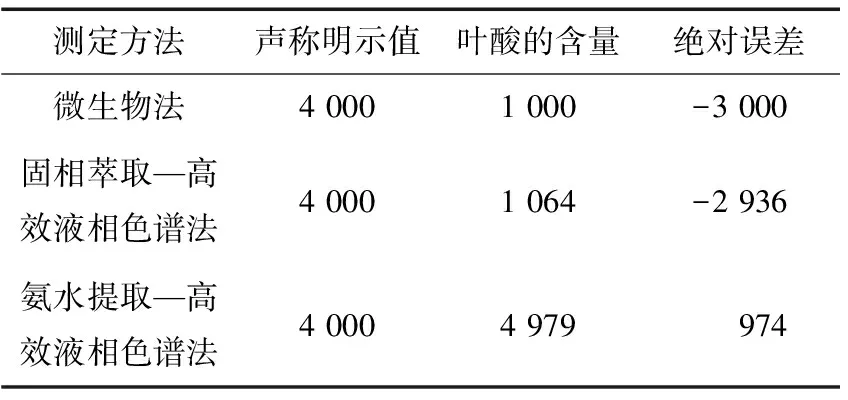
表5 三种方法测定结果比较
3 结论
虽然微生物法被中国定为检测食品中叶酸的第一法,但是由于婴幼儿辅食营养补充品的基质与传统的食品不同,所以检测出来的结果与样品的明示值有所偏差。再加上微生物法的前处理较复杂、干扰物质多、检测周期较长等因素,与社会需求的快速高效检测不相符合。由于婴幼儿辅食营养补充剂中含有的叶酸比较少,从理论上通过固相萃取后进行洗脱,会使得检测叶酸的结果更加准确。但实际上,洗脱过程难以控制,难以判断洗脱终点;加上样品中含有大量的矿物质;可能洗脱液的洗脱能力不够强而导致叶酸不能洗脱完全等因素导致检测结果有所偏差。
方法学考察结果表明,采用pH 6.3的甲醇—0.05 mol/L磷酸二氢钾(体积比为5∶95)作为流动相,控制叶酸在6.5 min出峰的氨水直接提取—液相色谱法检测婴幼儿辅食营养补充品中叶酸含量,操作简便迅速、准确度和精密度均较理想,方法的线性范围广。在针对婴幼儿辅食营养补充品叶酸含量的实际检测工作中,采用快速、准确的氨水直接提取—液相色谱法更为合适,为建立婴幼儿辅食营养补充剂中叶酸含量测定的方法提供有效的理论依据。
[1] 刘泰然, 李浩, 王颖, 等. 柱后衍生—高效液相色谱法测定保健食品、强化食品和营养素补充剂中的叶酸[J]. 中国卫生检验杂志, 2008, 18(2): 268-270.
[2] PAWAR R S, TAMTA H, MA Jun, et al. Updates on chemical and biological research on botanical ingredients in dietary supplements[J]. Anal Bioanal Chem, 2013, 405(13): 4 373-4 384.
[3] NESTEL P, BENOIST B, BRIEND A, et al. Complementary food supplements to achieve micronutrient adequacy for infants and young children[J]. J. Pediatr Gastr Nutr, 2003, 36: 316-328.
[4] CAMARA J E, LOWENTHAL M S, PHINNEY K W. Determination of fortified and endogenous folates in food-based Standard Reference Materials by liquid chromatography-tandem mass spectrometry[J]. Anal Bioanal Chem., 2013, 405(13): 4 561-4 568.
[5] 石丹, 贾云虹, 包怡红, 等. 叶酸检测方法的研究现状及发展趋势[J]. 中国乳品工业, 2009, 37(3): 42-45.
[6] SUH J H, YANG Dong-Hyug, LEE B K, et al. Simultaneous determination of B group vitamins in supplemented food products by high performance liquid chromatography-diode array detection[J]. Bull Korean Chem. Soc., 2011, 32(8): 2 648-2 656.
[7] 戴金凤, 徐明芳, 段翰英, 等. 超高效液相串联质谱测定四棱豆中总叶酸和多聚谷氨酸叶酸的含量[J]. 现代食品科技, 2015, 31(10): 295-299.
[8] ARAUJO M M, MARCHIONI E, VILLAVICENCIO A L, et al. Pressurized liquid extraction and HPLC quantification of folic acid in fortified wheat flours[J]. J. Agr. Food Chem., 2012, 60(31): 7 629-7 633.
[9] 蒲明清, 戴舒春, 张连龙, 等. 超高效液相色谱法测定保健食品中的多种水溶性维生素[J]. 现代食品科技, 2012, 28(7): 886-889.
[10] GANDARA J S, PRIETO S P, GRANDE B C, et al. Screening for folic acid content in vitamin-fortified beverages[J]. Food Control, 2006, 17(11): 900-904.
[11] 中华人民共和国卫生部. GB 5413.16—2010 婴幼儿食品和乳品中叶酸(叶酸盐活性)的测定[S]. 北京: 中国标准出版社, 2010.
[12] 张慧, 吴环, 黄伟乾, 等. 微生物法快速检测婴幼儿配方奶粉中叶酸含量[J]. 食品研究与开发, 2015, 36(5): 66-69.
[13] 包怡红, 石丹, 贾云虹, 等. 固相萃取—反相高效液相色谱法检测婴幼儿配方乳粉中叶酸的含量[J]. 营养学报, 2009, 31(3): 289-292.
[14] 赵雯玮, 陈祥贵, 杨潇, 等. 高效液相色谱法测定液态奶中的叶酸[J]. 中国乳品工业, 2009, 37(12): 51-53.
Methods of detecting the content of folic acid in infant complementary food supplements
LUO Min-ting1WUKe-gang1HUANGWei-qian2
(1.DepartmentofFoodScienceandEngineering,FacultyofChemicalEngineeringandLightIndustry,GuangdongUniversityofTechnology,Guangzhou,Guangdong510006,China; 2.GuangzhouQualitySupervisionandTestingInstitute,Guangzhou,Guangdong510110,China)
To detect infant complementary food supplements of folic acid, methds of microbiological method, solid-phase-extraction-HPLC and direct-ammonia-extraction-HPLC were utilized respectively. Analyses among the three methods were compared and the most accurate and rapid one was determined. The results showed the direct-ammonia-extraction-HPLC analysis by using the CH3OH-0.05 mol/L KH2PO4(volum ratio,5∶95; pH 6.3) as mobile phase and controlling the peak time at 6.5 min, and the standard curve coefficient was 0.999 8 with detection limit 0.019 0 mg/L. Compared with the other two methods, this method was simple, rapid, sensitive and reproducible characteristics, and provided an effective theoretical basis to establish method of folic acid detections in infant complementary food supplements.
infant complementary food; nutritional supplements; folic acid; microbiological method; solid phase extraction; ammonia extraction; HPLC
国家科技支撑计划(编号:2015BAD16B08);广东省科技计划项目(编号:2014B020205005,2015B020204002)
罗敏婷,女,广东工业大学在读硕士研究生。
吴克刚(1969—),男,广东工业大学教授,博士。
E-mail:wukegang2003@163.com
2016-02-09

