Fmoc-F多肽水凝胶对丁香精油的控释作用研究
张 琳周天啸 王 奔 郝雅晏 陆 俊,2
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 稻谷及副产物深加工国家工程实验室,湖南 长沙 410004)
Fmoc-F多肽水凝胶对丁香精油的控释作用研究
张 琳1,2周天啸1王 奔1郝雅晏1陆 俊1,2
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 稻谷及副产物深加工国家工程实验室,湖南 长沙 410004)
探讨Fmoc-F(Phe)多肽形成的凝胶对丁香精油的包埋和控制释放作用。结果表明,Fmoc-F形成的凝胶对丁香精油的包埋率可达98.69%;在pH>6.5时,Fmoc-F凝胶的分解率低于9.0%,该条件下凝胶可有效降低丁香精油的挥发损失;当pH=6.0时,3 h Fmoc-F—丁香精油分解率接近36.0%,当pH=5.0时,Fmoc-F凝胶迅速分解,3 h分解率达到100%,该条件下丁香精油被快速释放到大肠杆菌的菌液中可有效抑制大肠杆菌的生长。说明Fmoc-F凝胶可以有效防止丁香精油常温下的挥发,并控制精油在酸性条件下有效释放并发挥抑菌效果。
Fmoc-F;多肽水凝胶;凝胶;丁香精油;控制释放
丁香精油是由桃金娘科植物丁香提取而来,其主要成分为丁香酚、乙酰丁香酚、水杨酸甲酯、丁香烯等[1]。丁香精油具有抑菌、麻醉、解热、抗氧化等多种功能[2]。由于其良好的抑菌效果和抗氧化作用,丁香精油被作为食品防腐剂和保鲜剂应用在食品加工中。但因其难溶于水,易挥发,易氧化的缺点,导致丁香精油对食品或果蔬的保鲜期限不长,因而限制了丁香精油的广泛应用[3]。利用包埋材料对丁香精油进行包埋,可降低其挥发性,增加其抑菌时间和抑菌效果[4]。目前被广泛研究的包埋材料为环糊精[5]、明胶和阿拉伯胶[6]。但此类包埋材料一般包埋率不高,并且不具有对丁香精油进行控制释放的作用。
多肽水凝胶是以多肽和水为主要原料形成的凝胶,其生物相容性好,无毒副作用,具有特殊pH响应等特点,近年来被广泛作为新型药物载体来研究[7-9]。但目前尚未有将多肽凝胶应用于丁香精油的包埋方面的报道。
Fmoc-F水凝胶是利用Fmoc-F为凝胶因子,在疏水作用、范德华力等作用力的作用下自组装形成的具有网状的超分子结构,并束缚水分子形成的固体状的水凝胶[10]。本研究拟利用Fmoc-F凝胶包埋丁香精油,测定其包埋效率和抑菌效果,研究在大肠杆菌整个生长过程中,Fmoc-F凝胶对丁香精油的控制释放作用,旨在为精油类物质包埋材料的新方向提供理论依据。
1 材料与方法
1.1 材料与试剂
丁香精油:河南焦作市化工三厂;
N-(9-芴甲氧羰基)-L-苯丙氨酸(Fmoc-F):纯度>99%,吉尔生化有限公司;
大肠杆菌(Escherichiacoli):南京便诊生物科技有限公司;
葡萄糖酸内酯(Gluconolactone,GDL):纯度>99%,美国Sigma-Aldrich公司;
β-环糊精、无水乙醇、酵母提取物、蛋白胨、营养琼脂、氯化钠、氢氧化钠:分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
紫外可见光光度计:UV1800型,日本岛津公司;
超净工作台:SW-CJ-1FD型,苏州安泰空气技术有限公司;
循环水真空泵:SHB-ⅢA型,北京中兴伟业仪器有限公司;
数显恒温水浴锅:HH-S24S型,金坛市大地自动化仪器厂;
pH计:PHS-3C型,上海仪电科学仪器有限责任公司;
超声波清洗机:JRC-2000型,济宁市润通超声电子有限公司;
高压灭菌锅:G154DWS型,致微仪器有限公司;
微型旋涡混合仪:WH-3型,上海沪西分析仪器厂有限公司;
电热恒温培养箱:DH4000BII型,天津市泰斯特仪器有限公司;
恒温振荡器:IS-RDD3型,郑州南北仪器有限公司。
1.3 试验方法
1.3.1 丁香精油标准曲线的测定 用无水乙醇将丁香精油稀释为0.002%,0.004%,0.006%,0.008%,0.010% 的标准液。以无水乙醇为测定背景液,测定丁香精油标准液在263 nm处的吸光值,以OD263 nm表示(optical density,OD)。试验平行3次,以丁香精油的体积分数为横坐标,OD263 nm为纵坐标,绘制丁香精油浓度的标准曲线。
1.3.2β-环糊精—丁香精油包埋物的制备 将6 gβ-环糊精在60 ℃,36 mL的水中缓慢搅拌溶解,将用无水乙醇稀释20倍的丁香精油以芯/壁材比为1∶8的比例加入到β-环糊精过饱和溶液中,边加边搅拌。待有白色沉淀析出后继续搅拌2 h,停止加热。冷却至室温后放入4 ℃冰箱中静置24 h,常温抽滤,无水乙醇冲洗后,40 ℃干燥至恒重,得白色β-环糊精—丁香精油包埋产物。
1.3.3 Fmoc-F凝胶及其丁香精油包埋物的制备
(1) Fmoc-F凝胶的制备:在3 mL超纯水中加入42 mg Fmoc-F粉末,混匀后,缓慢加入1 mL 0.1 mmol/L NaOH 溶液,混匀并在40 ℃的水浴锅中加热5 min后,加入5 mg GDL,并利用涡旋振荡器在1 000 r/min下震荡10 s,室温下静置,1 h后形成凝胶。
(2) Fmoc-F凝胶—丁香精油包埋物的制备:在3 mL超纯水中加入42 mg Fmoc-F粉末,再加入0.1 mL丁香精油,混匀后,按照1.3.3(1)中后续方法加入1 mL 0.1 mmol/L NaOH 溶液,40 ℃水浴中加热5 min,加入5 mg GDL,1 000 r/min下震荡10 s,静置1 h后形成凝胶。
1.3.4 包埋率的计算 包埋率计算公式[11]:

(1)
表面油含量测定:无水乙醇快速冲洗法间接测定;
产品中总油含量:破坏β-环糊精微胶囊壁材或Fmoc-F凝胶后,用无水乙醇提取丁香精油后进行测定。平行3次,计算平均值。
1.3.5 Fmoc-F多肽水凝胶在不同pH值下的分解率测定
配制不同pH值的磷酸缓冲溶液(10 mmol/L),pH分别为5.0,5.5,6.0,6.5。取不同pH值的缓冲溶液5 mL,加入4 mL Fmoc-F凝胶溶液制成的凝胶。37 ℃下,在10,40,70,100,140,180 min时取100 μL样品,稀释10倍后测定264 nm下Fmoc-F的特征吸光值,表示缓冲液中的Fmoc-F凝胶的分解情况。平行3次,取平均值。
1.3.6 丁香精油及其包埋物的抑菌试验方法 在LB平板培养基[12]上用滤纸片扩散法[13]检验丁香精油对大肠杆菌的抑菌效果。
利用液体LB培养基检验Fmoc-F凝胶对丁香精油的控制释放作用和抑菌效果。具体试验方法如下:分别向A、B、C、D四个锥形瓶中加入含有1%大肠杆菌悬浊液的LB培养液15 mL。向空白组(A瓶)中加入10.25 mL 无菌水;向控制组(B瓶)中加入250L无菌水,10 mL Fmoc-F凝胶;向对照组(C瓶)中加入250L丁香精油,10 mL Fmoc-F凝胶;向试验组(D瓶)中加入包埋了250L丁香精油的10 mL 的Fmoc-F—丁香精油凝胶。混匀后,将锥形瓶在210 r/min,37 ℃下培养,在培养的不同时间点取100L样品在600 nm下测定吸光度,以OD600 nm表示。大肠杆菌的浓度用OD600 nm的值来表示。平行3次,取平均值。
2 结果与分析
2.1 标准曲线
由图1可知,丁香精油的浓度与其在263 nm下的吸光度有良好的线性相关性。当丁香精油的浓度在0.002%~0.010%时,丁香精油的浓度与其在263 nm下的吸光度的标准线性方程为:Y=0.014 6+76.107X,线性相关系数R2为 0.996。
2.2 β-环糊精及Fmoc-F凝胶对丁香精油包埋率的比较
按照1.3.2及1.3.3的试验方法,分别利用β-环糊精和Fmoc-F凝胶对丁香精油进行包埋,根据图1丁香精油的标准曲线和1.3.4包埋率的计算方法分别计算两种材料对丁香精油的包埋率,结果见表1。
由表1可知,Fmoc-F凝胶对于丁香精油的包埋率(98.69%)显著大于β-环糊精对丁香精油的包埋率(18.71%)。文献[14]中报道利用新的超声波法制备β-环糊精—丁香精油包埋物的最优方案下,包埋率也只能达到21.5%。根据芯壁材比,可以看出,包埋同样体积的丁香精油,需要的β-环糊精的质量(8.0 g)远远大于所需的Fmoc-F的质量(0.42 g)。因此,相对于β-环糊精,Fmoc-F是一种高效的可应用于丁香精油包埋的新型包埋材料。
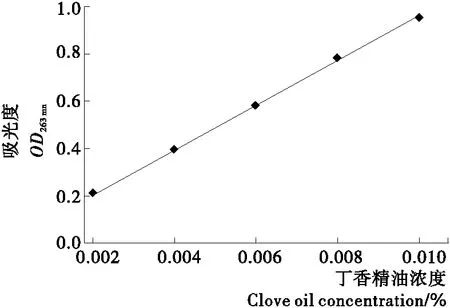
图1 丁香精油浓度的标准曲线

包埋材料包埋率/%芯壁材比(mL/g)Fmoc⁃F自组装多肽水凝胶98.691∶0.42β⁃环糊精18.711∶8
2.3 Fmoc-F凝胶—丁香精油包埋物的形成机制
Fmoc-F可溶解在NaOH溶液中,此时Fmoc-F分子式呈无规则的状态(图2A),当GDL加入后,随着时间的增长,GDL水解,释放H+,使溶液的pH值下降,苯丙氨酸得到质子,在静电作用力和疏水作用力的作用下,Fmoc-F逐渐由无规则的状态形成有序的β-折叠结构(图2b)。随着时间的增长,有序的β-折叠纤维相互缠绕形成多孔的三维网状结构(图2c)从而形成凝胶[15]。当Fmoc-F溶液中有丁香精油存在时(图2a),由于丁香精油具有疏水性,在Fmoc-F进行有序排列时,由于疏水作用力,丁香精油会排列在Fmoc-F纤维的疏水端附近(图2b),当Fmoc-F纤维进一步发生缠绕时,会带着丁香精油形成立体三维的网状结构,进而将丁香精油紧紧地包埋在凝胶中(图2c)。因此利用Fmoc-F可高效包埋丁香精油(包埋率达98.69%)。
2.4 Fmoc-F凝胶在不同pH值的溶液中的分解情况
Fmoc-F凝胶在不同的pH环境下具有不同的响应特性,为了研究Fmoc-F凝胶的这一特性,将Fmoc-F凝胶分别置于不同pH的缓冲液中,并每隔一定的时间测定其分解率,结果见图3。
检测成胶后的Fmoc-F凝胶,其pH为7.0。将Fmoc-F凝胶置于pH 6.5的磷酸缓冲溶液中,在前10 min内仅有8.1%的凝胶分解,20~180 min时,分解率基本维持在9%左右。在pH为6.0的磷酸缓冲溶液中,前10 min,凝胶分解率为12.54%;10~140 min时,凝胶分解率有缓慢增长,从12.54%上升到35.67%;140 min后,凝胶分解率没有明显上升。进一步降低溶液的pH,在pH为5.5的磷酸缓冲溶液中,前10 min,凝胶分解率为18.62%;10~140 min时,凝胶分解率有显著增长,上升到52.68%;140 min后,凝胶分解率没有明显上升。当溶液pH为5.0时,前10 min,凝胶快速分解,分解率为58.62%;10~140 min时,凝胶分解率不断增长;140 min时,凝胶基本分解完全,分解率达到100%。
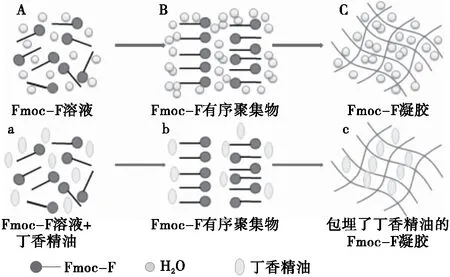
图2 Fmoc-F凝胶形成示意图

图3 Fmoc-F凝胶在不同pH溶液中分解率的变化
上述结果表明,Fmoc-F在碱性条件下呈无定形结构,在中性条件下成胶体,在酸性条件下可以分解。这是由于在中性条件下,Fmoc-F由于疏水作用力和静电作用力形成三级网络结构,当pH降低后,Fmoc-F分子带正电荷,过多的正电荷使分子间斥力增大,导致Fmoc-F纤维与纤维间缠结解体,从而导致Fmoc-F凝胶解体,Fmoc-F分子被释放到溶液中[10]。
2.5 Fmoc-F凝胶在大肠杆菌菌液中对丁香精油的控制释放作用
因为Fmoc-F凝胶可在中性条件下成胶,在酸性条件下分解[10],而大肠杆菌在生长过程中其菌液的pH可以从开始的中性不断降低到酸性[16],因此将包埋了大蒜精油的Fmoc-F凝胶加入大肠杆菌菌液中,通过检测大肠杆菌菌液的pH和OD600 nm值研究Fmoc-F对丁香精油的控制释放作用及其抑菌效果。
2.5.1 丁香精油抑菌浓度的确定 丁香精油具有广谱抗菌活性,对大肠杆菌也有显著的抑菌活性[17]。为了选择合适的丁香精油浓度,通过滤纸片扩散法,检测不同浓度的丁香精油对大肠杆菌的抑菌圈的大小,结果见表2。
由表2可知,在0.5%~5.0%浓度范围中,丁香精油对大肠杆菌均有良好的抑菌效果。当丁香精油浓度为5.0%时,平板上没有菌体长出;随着丁香精油浓度的降低,抑菌圈的直径从(1.80±0.25) cm降到(0.60±0.24) cm。为了在控制释放研究中,使丁香精油既有明显的抑菌效果,在不同时间又有比较明显的差异,在控制释放的研究中选择丁香精油的浓度为2.5%。

表2 不同浓度的丁香精油对大肠杆菌的抑菌效果
2.5.2 Fmoc-F对丁香精油的控制释放作用 由表3可知,当溶液中只有大肠杆菌和Fmoc-F凝胶存在时,大肠杆菌的生长周期并没有受到影响,其OD值的变化规律与大肠杆菌正常的生长周期一致(A和B组):即大肠杆菌的生长平缓期(0~2 h),对数生长期(2~9 h)和稳定期(9~12 h)。在C组溶液中,因为添加了丁香精油,在大肠杆菌的生长平缓期(0~2 h),大肠杆菌的生长已经受到了丁香精油的抑制,其OD值明显(0.126)小于同时间的A组菌液(0.289);在随后的时间里(2~12 h),菌液的OD值有缓慢上升,从0.126增长到0.743。这可能是由于一方面,丁香精油具有挥发性,其挥发造成丁香精油在溶液中有效浓度的降低;另一方面,丁香精油在空气中也容易被氧化[18],被氧化后的丁香精油的抑菌效果明显降低。当大肠杆菌的菌液中添加了包埋了丁香精油的Fmoc-F时(D组),在大肠杆菌生长的平缓期(0~2 h),大肠杆菌的生长并没有得到抑制(OD600 nm为 0.283,与A组同时间的OD值接近),但在之后的时间内(2~12 h),大肠杆菌的生长受到了明显抑制,且从3 h开始D组菌液的OD值始终小于A、B、C组同时期的OD值,并保持在0.30以下。这是由于,在培养初期(2 h前)菌液的pH值在6.0以上(D组),Fmoc-F凝胶的分解率还没有超过36%(图3),大部分丁香精油还被包埋在凝胶中,没有发挥抑菌作用。但随着培养时间的增长,菌液pH不断下降,当菌液pH下降到5.5以下后(4 h后),Fmoc-F凝胶快速分解,释放出丁香精油从而起到很好的抑菌效果。由于在培养前期,Fmoc-F凝胶对丁香精油的包埋作用抑制了精油的挥发,因此在后期抑菌过程中,D组中丁香精油的有效浓度大于C组的,从而起到了更好的抑菌效果。
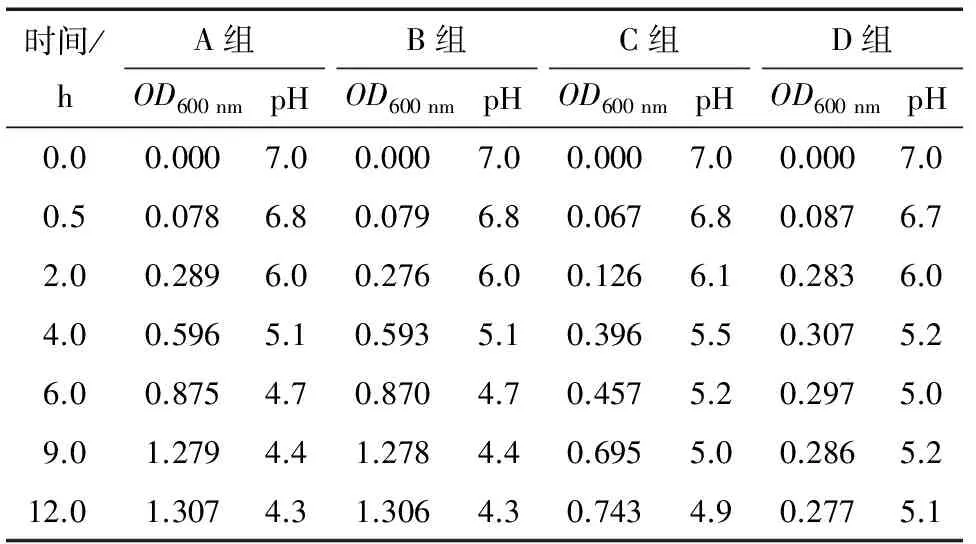
表3 Fmoc-F凝胶—丁香精油包埋产物的抑菌效果
3 结论
利用具有pH响应特性的Fmoc-F凝胶包埋丁香精油,研究了Fmoc-F凝胶对丁香精油的控制释放作用。结果表明:
(1) Fmoc-F凝胶对丁香精油的包埋率可达98.67%,远远大于β-环糊精对丁香精油的包埋率。
(2) Fmoc-F凝胶对丁香精油有延缓其挥发并控制其释放的作用。在中性pH值下,Fmoc-F凝胶可以很好地保护丁香精油,抑制其挥发;当溶液pH值下降到6.5后,Fmoc-F凝胶开始分解,当溶液pH值下降到5.0左右时,Fmoc-F凝胶会快速分解,释放出包埋的丁香精油。
利用Fmoc-F凝胶对丁香精油控制释放的特性,可以将Fmoc-F凝胶对丁香精油的包埋产物应用到食品防腐领域中,该凝胶可以有效延缓丁香精油的挥发,并当在食品中致病菌增多,环境pH下降时有效释放丁香精油,从而发挥长效、高效的抑菌作用。
[1] 刘晓丽, 钟少枢, 于泓鹏, 等. 微波法和水蒸气蒸馏法提取丁香精油的研究[J]. 食品与机械, 2012, 28(4): 110-112.
[2] FRIEDMAN M, HENIKA P R, LEVIN C E, et al. Antibacterial activities of plant essential oils and their components againstEscherichiacoliO157:H7 and Salmonella enterica in apple juice[J]. Journal of Agricultural & Food Chemistry, 2004, 52(19): 6 042-6 048.
[3] ESPINA L, GARCA-GONZALO D, LAGLAOUI A, et al. Synergistic combinations of high hydrostatic pressure and essential oils or their constituents and their use in preservation of fruit juices[J]. International Journal of Food Microbiology, 2013, 161(1): 23-30.
[4] 郝喜海, 孙淼, 邓靖, 等. 丁香精油-β-环糊精包合物的缓释抗菌性能[J]. 食品科学, 2012, 33(11): 86-88.
[5] 孙淼. 基于丁香精油/β-环糊精包合物的聚乙烯醇抗菌膜的制备及性能研究[D]. 株洲: 湖南工业大学, 2012: 21.
[6] 张慧芸, 郭新宇. 丁香精油-壳聚糖复合可食性膜对生肉糜保鲜效果的影响[J]. 食品科学, 2014, 35(18):196-200.
[7] KOUTSOPOULOS S, UNSWORTH L D, NAGAI Y, et al. Controlled release of functional proteins through designer self-assembling peptide nanofiber hydrogel scaffold[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(12): 4 623-4 628.
[8] ALTUNBAS A, LEE S J, RAJASEKARAN S A, et al. Encapsulation of curcumin in self-assembling peptide hydrogels as injectable drug delivery vehicles[J]. Biomaterials, 2011, 32(25): 5 906-5 914. [9] LIANG Gao-lin, YANG Zhi-mou, ZHANG Rong-jun, et al. Supramolecular hydrogel of aD-amino acid dipeptide for controlled drug release in vivo[J]. Langmuir, 2009, 25(15): 8 419-8 422.
[10] SINGH V, SNIGDHA K, SINGH C, et al. Understanding the self-assembly of Fmoc-phenylalanine to hydrogel formation[J]. Soft Matter, 2015, 11(26): 5 353-5 364.
[11] 范方宇, 蒋生, 旺曹颖. 复凝聚法制备茶油微胶囊[J]. 食品与机械, 2016, 32(7): 181-185.[12] 王升智, 高波, 周智慧, 等. 重组大肠杆菌DH5α生长曲线的测定[J]. 黑龙江畜牧兽医, 2010(21): 96-98.
[13] 王步江, 刘金福, 樊秀花, 等. 肉桂精油抑菌活性研究[J]. 食品与机械, 2011, 27(6): 166-167.
[14] 韩春然, 张静, 李煜. 超声波法制备丁香精油-β-环糊精微胶囊[J]. 食品科学, 2013, 34(22): 97-100.
[15] SUTTON S, CAMPBELL N L, COOPER A I, et al. Controlled release from modified amino acid hydrogels governed by molecular size or network dynamics[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2009, 25(17): 10 285-10 291.
[16] 刘宁, 姚元锋, 齐瑛, 等. 强化工业大肠杆菌生长特性的研究[J]. 科学技术与工程, 2013, 13(5): 1 223-1 228.
[17] MICHIELS J, MISSOTTEN J, FREMAUT D, et al. In vitro, dose-response of carvacrol, thymol, eugenol and trans -cinnamaldehyde and interaction of combinations for the antimicrobial activity against the pig gut flora[J]. Livestock Science, 2007, 109(1/3): 157-160.[18] CUI Hai-ying, LI Wei, LI Chang-zhu, et al. Intelligent release of cinnamon oil from engineered proteoliposome via stimulation of Bacillus cereus, protease[J]. Food Control, 2016, 67: 68-74.
Fmoc-F hydrogel for clove oil controlled-release
ZHANG Lin1,2ZHOUTian-xiao1WANGBen1HAOYa-yan1LUJun1,2
(1.CollegeofFoodScienceandEngineering,CentralSouthUniversityofForestryandTechnology,Changsha,Hunan410004,China; 2.NationalEngineeringLaboratoryofRiceandBy-productDeepProcessing,Changsha,Hunan410004,China)
Fmoc-F was utilized for embedding of clove oil. The results demonstrated that Fmoc-F hydrogel could prevent the volatilization and achieve the controlled-release of clove oil. The loading efficiency of Fmoc-F gel was 98.69%, much higher than the one achieved withβ-cyclodextrin. When pH was above 6.5, the decomposition rate of Fmoc-F hydrogel was less than 9.0%, and this could prevent the volatilization of clove oil. When pH was adjusted from 6.5 to 6.0, the structure of hydrogel began to disaggregate, and the decomposition rate was around 36%. When pH was below 5.0, the hydrogel disaggregated completely. Then the clove oil could be released completely to inhibit the growth ofE.Coli. Thus, Fmoc-F based hydrogel could prevent the volatilization and achieve the controlled-release of clove oil in an acidic condition.
Fmoc-F; gel; clove oil; controlled-release
湖南省自然科学基金项目(编号:2015JJ3177);湖南省教育厅一般项目(编号:14C1184);湖南省大学生研究性学习和创新性实验计划项目(编号:湘教通2015);中南林业科技大学大学生研究性学习和创新性实验计划项目(编号:2016)
张琳,女,中南林业科技大学讲师,博士。
陆俊(1978—),男,中南林业科技大学副教授,博士。
E-mail: 690056167@qq. com
2016-05-09

