对羟基苯甲酸处理对采后柑橘炭疽病的抑制及机理研究
黄小兰盖智星 王日葵,2,3贺明阳,2,3 韩 冷,2,3 周 炼,2,3
(1. 西南大学柑桔研究所,重庆 400712;2. 中国农业科学院柑桔研究所,重庆 400712;3. 国家柑桔工程技术研究中心,重庆 400712)
对羟基苯甲酸处理对采后柑橘炭疽病的抑制及机理研究
黄小兰1盖智星1王日葵1,2,3贺明阳1,2,3韩 冷1,2,3周 炼1,2,3
(1. 西南大学柑桔研究所,重庆 400712;2. 中国农业科学院柑桔研究所,重庆 400712;3. 国家柑桔工程技术研究中心,重庆 400712)
采用体外平板接菌试验和体内果实接种试验测定对羟基苯甲酸对采后柑橘炭疽病致病菌(胶孢炭疽菌)的生长抑制作用;观测经对羟基苯甲酸处理后,接种和未接种病原真菌的柑橘果实中多酚氧化酶(PPO)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、苯丙氨酸解氨酶(PAL)活性、丙二醛(MDA)含量的动态变化。结果表明:对羟基苯甲酸对采后柑橘炭疽病病原菌有较强的抑菌活性,浓度越高,对病原菌的抑制作用越强,其EC50为0.056 mg/mL。经对羟基苯甲酸处理的柑橘果实中,PPO、POD、SOD、PAL活性升高,MDA含量下降。并且对羟基苯甲酸诱导的抗性相关酶在整个试验过程中维持较高的活性。对羟基苯甲酸处理对采后柑橘炭疽病病原菌有较强的抗菌作用,能提高柑橘果实相关抗性酶活性以及抑制膜脂过氧化反应,诱导其果实抗性。对柑橘采后贮藏保鲜具有重要意义。
对羟基苯甲酸;胶孢炭疽菌;柑橘;贮藏保鲜;抑菌活性;抗氧化酶活性
柑橘是中国重要的经济水果,其年产量世界第一。中国种植柑橘已有4 000多年的历史,产业分布范围广[1-2]。柑橘的耐贮性较好,但随着经济的发展,人们对柑橘的需求增多,对柑橘的供应周期有更长的要求[3]。而每年因腐烂变质造成了严重的经济损失,柑橘真菌性病原菌的侵染是使其发生腐烂变质的主要原因之一。柑橘贮藏期间的主要真菌病害有青绿霉病、炭疽病、酸腐病等[4]。
柑橘炭疽病的病原菌主要为胶孢炭疽菌(Colletotrichumgloeosporioides)[5]。可侵染柑橘叶片、幼果以及成熟果实,其侵染特性为潜伏侵染[6]。控制炭疽病对于提高柑橘产量以及采后贮藏保鲜具有重要意义。目前炭疽病的防治有采用拮抗菌或喷洒杀菌剂来抑制、杀灭炭疽菌的生长繁殖[7-8]。然而最主要的方式依然为喷洒化学杀菌剂,而化学杀菌剂的药剂残留、病菌耐药性问题也同样日趋严重[9-10]。因此,寻找安全有效的保鲜方法已成为柑橘贮藏中亟待解决的问题。
柑橘果皮内含有香精油、总酚、类黄酮等多种活性成分[11]。如精油中含多种低分子的抗氧化和抗菌物质,可作为果蔬保鲜剂使用[12-13]。利用果实本身含有的抗菌物质来作为保鲜成分已成为目前研究的新趋势。对羟基苯甲酸(p-Hydroxybenzoic acid,p-HBA)是一种酚酸类物质,柑橘皮内本身也含有一定量的对羟基苯甲酸[14-15]。大量研究显示酚酸类物质具有抗菌、抗氧化、抗炎症以及抗心血管疾病等多种生理功能[16-17],如p-香豆酸就具有抗癌活性[18]。对羟基苯甲酸具有良好的抑菌性,且副作用较苯甲酸或水杨酸及其衍生物小,在一定浓度范围内对生物体无害[19]。其酯类常作为食品、药物等的防腐剂, GB 2760—2014《食品添加剂使用标准》中规定限量标准为0.012 g/kg。研究[20]表明,对羟基苯甲酸在一定浓度下对草莓专化型尖孢镰刀菌孢子萌发和菌丝生长均有显著的抑制作用。Heleno等[21]从灵芝提取物中分离得到对羟基苯甲酸,经抗菌试验发现,其对多种细菌和真菌均具有广谱的抑菌活性。与氨苄青霉素等多种抗菌药物的作用相当。Farhoosh等[22]研究发现对羟基苯甲酸及其衍生物有良好的抗氧化活性,在DPPH自由基清除试验中活性较高。
对羟基苯甲酸作为果蔬防腐保鲜剂尚未见报道,因此本研究拟选用低浓度对羟基苯甲酸为试验材料,研究其对柑橘炭疽病病原菌的抑菌活性及其对果实体内相关抗性酶和抗性物质的影响,旨在为柑橘炭疽病的防治和柑橘采后保鲜研究提供理论依据。
1 材料与方法
1.1 试验材料
菌种:胶孢炭疽菌(Colletotrichumgloeosporioides),由中国农业科学院柑桔研究所贮藏课题组保藏;
对羟基苯甲酸:分析纯,成都市科龙化工试剂厂;
锦橙:品种为北碚447#锦橙,采于重庆市歇马镇果园;
紫外分光光度计:TU-1901型,北京普析通用仪器有限公司;
通用环境实验箱:MIR-352H-PC型,松下健康医疗器械株式公社;
医用低温培养箱:MDF-U4186S型,松下健康医疗器械株式公社;
台式高速冷冻离心机:H1850R型,长沙湘仪离心机仪器有限公司。
1.2 试验方法
1.2.1 柑橘果皮内对羟基苯甲酸含量的测定 选择成熟度相近、外观整齐、无机械损伤的锦橙果实,清洗并用75%酒精消毒,晾干备用。试验组针刺接种10 μL孢子悬浮液,针刺深度为2 mm,针孔直径为1 mm,对照组接种等量无菌水。28 ℃ 95% RH培养,于不同天数取样(0,2,4,7,10 d),液氮速冻后,置于-80 ℃冰箱备用。参照文献[23]的方法进行。
1.2.2 病原菌及其孢子悬浮液的制备 将胶孢炭疽菌菌种于马铃薯琼脂培养基(Potato Dextrose Agar,PDA)上,28 ℃培养10 d。用无菌水将胶孢炭疽菌刮下,过滤后,用血球计数板计数,并调整浓度为1×106mL-1。
1.2.3 对羟基苯甲酸对胶孢炭疽菌体外生长抑制作用的测定 参照Bautista-Banos等[24]的方法,并加以改进。分别制成含不同浓度(2,1,0.5,0.25,0.125 mg/mL)对羟基苯甲酸的PDA培养基,以不含药物作为对照。首先使用打孔器将已培养5 d的菌盘制成菌饼,接于培养基中央,各个处理重复3次,放于28 ℃恒温培养箱中培养,定期观察菌落形态,并利用十字交叉法测量菌落直径,直到对照组的菌落即将长满整个培养皿。生长抑制率按式(1)计算:
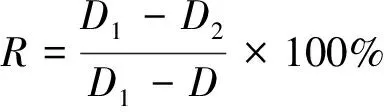
(1)
式中:
R——生长抑制率,%;
D1——对照组菌落直径,mm;
D2——处理组菌落直径,mm;
D——菌饼直径,mm。
1.2.4 对羟基苯甲酸对胶孢炭疽菌体内生长的抑制效果
以0.25 mg/mL对羟基苯甲酸为试验浓度,无菌水为对照。选择外观无损伤,大小一致且无病虫害的果实,清洗干净后用75%的酒精擦拭消毒,在果实的赤道部位切取直径为5 cm的果片为试验材料。将果片浸泡于溶液中2 min,晾干备用。在果片的中央打一个宽1 mm×深1 mm的伤口,接入浓度为1×106mL-1的孢子悬浮液10 μL。风干后置于铺有浸湿脱脂棉的消毒铁盘内,用保鲜膜密封,以保持盘内湿度。置于28 ℃、RH 95%的培养箱内贮藏。3 d后测定果片的发病率和病斑直径。每个处理20个果片,设3次重复。
1.2.5 柑橘抗性酶的诱导及抗性物质的测定 选择试验果清洗、消毒后晾干备用。本试验共分为5个处理:第一组为自然贮藏的果实,第二组为只打孔(宽4 mm×深2 mm)的果实,第三组打孔后接种10 μL浓度为1×106mL-1的孢子悬浮液,第四组打孔后接入20 μL 0.25 mg/mL的对羟基苯甲酸溶液,第五组为打孔后先接入20 μL 0.25 mg/mL的对羟基苯甲酸溶液,再接种10 μL浓度为1×106mL-1的孢子悬浮液。所有果实晾干后单果包装,放于28 ℃、RH 95%的保湿培养箱内培养。于处理后第0、1、2、4、6、9天取样后经液氮速冻,置于-80 ℃冰箱保存。测定酶活及MDA含量。测定时取样部位为病斑周围2 cm×2 cm组织。每个处理10个果实,每处理3个重复。
1.2.6 PPO及POD酶活性的测定 参照文献[25]。PPO以每分钟每克样品吸光度变化(△A410nm)0.01为一个酶活力单位,POD以每分钟每克样品吸光度变化(△A470nm)0.01为一个酶活力单位,试验重复3次。
1.2.7 SOD酶活性的测定 参照文献[26]。以抑制NBT光还原反应50%所需的酶量为一个酶活性单位。
1.2.8 PAL酶活性的测定 参照文献[27]。以每小时每克果皮(鲜重)酶促体系在290 nm波长吸光度增加0.01为一个酶活力单位。
1.2.9 MDA含量的测定 参照文献[28],修改如下:称取液氮研磨样品2.0 g。加入30 mL三氯乙酸(5%),于4 ℃冰箱放置过夜,10 000 r/min离心10 min,收集上清液用于测定。取5 mL上清液,再加入5 mL 2-硫代巴比妥酸(0.5%)。沸水浴20 min后水浴冷却,再次离心(5 000 r/min,10 min),以2-硫代巴比妥酸(0.5%)为空白对照测定在532,600,450 nm处的吸光值。

2 结果与分析
2.1 对羟基苯甲酸含量在果皮内的变化
图1为柑橘接种胶孢炭疽菌后,经HPLC测定果皮内对羟基苯甲酸含量的变化。由图1可知,试验组在接种病原菌后,对羟基苯甲酸含量呈先上升后下降的趋势。对照组的含量变化不明显。这可能是对羟基苯甲酸在病原菌侵染过程中作为抗菌物质大量合成,以此减轻对植物的伤害。因此推测在植物—病原菌互作过程中,病原菌的侵染诱导了果实的抗性反应,使得相关抗性物质含量升高。
2.2 不同浓度的对羟基苯甲酸对胶孢炭疽菌体外生长的抑制作用
由图2、3可知,对羟基苯甲酸对柑橘胶孢炭疽菌表现出不同程度的生长抑制作用。随着对羟基苯甲酸浓度的提高,抑制率逐渐增大,抑制作用逐渐增强。当浓度为2 mg/mL时的抑制作用最强,达到98.56%。对羟基苯甲酸浓度对数与病原菌生长抑制率之间为线性关系,线性方程Y=1.730+1.383X,模型拟合优度检验c2=0.087,P=0.993,表明模型拟合良好。

图1 不同处理柑橘果皮内对羟基苯甲酸含量的变化
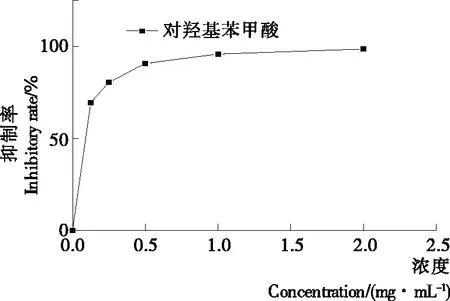
图2 对羟基苯甲酸浓度对柑橘炭疽病菌的抑制作用
Figure 2 Inhibitory effects of different concentrations ofp-Hydroxybenzoic acid onC.gloeosporiodies
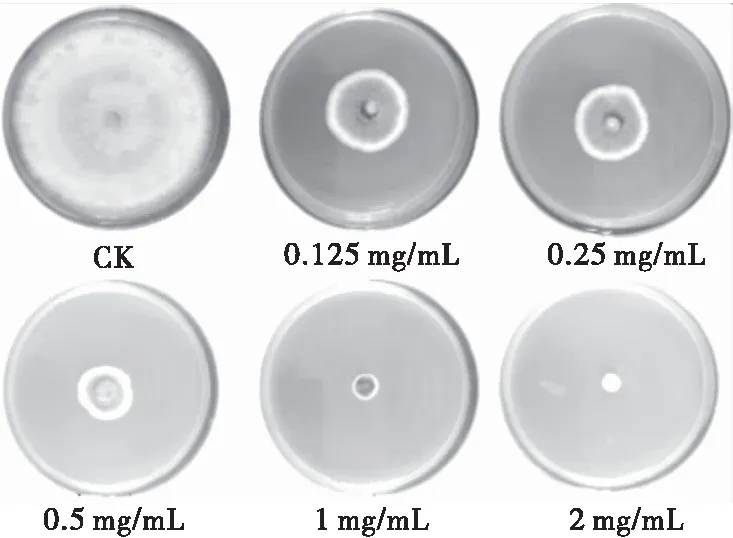
图3 对羟基苯甲酸浓度对胶孢炭疽菌生长的抑制作用
Figure 3 Inhibitory effects of different concentrations ofp-Hydroxybenzoic acid onC.gloeosporiodies
2.3 对羟基苯甲酸对胶孢炭疽菌体内生长的抑制效果
由表1可知,当对羟基苯甲酸浓度为0.25 mg/mL时,试验组的病斑直径为2.18 mm,对照组为3.51 mm,病斑抑制率为38.01%,对羟基苯甲酸明显抑制了病斑的扩展。因此,对羟基苯甲酸对柑橘炭疽病具有一定抑制效果。

表1 对羟基苯甲酸对柑橘炭疽病的抑制效果†
† 同列不同小写字母表示差异显著(P<0.05)。
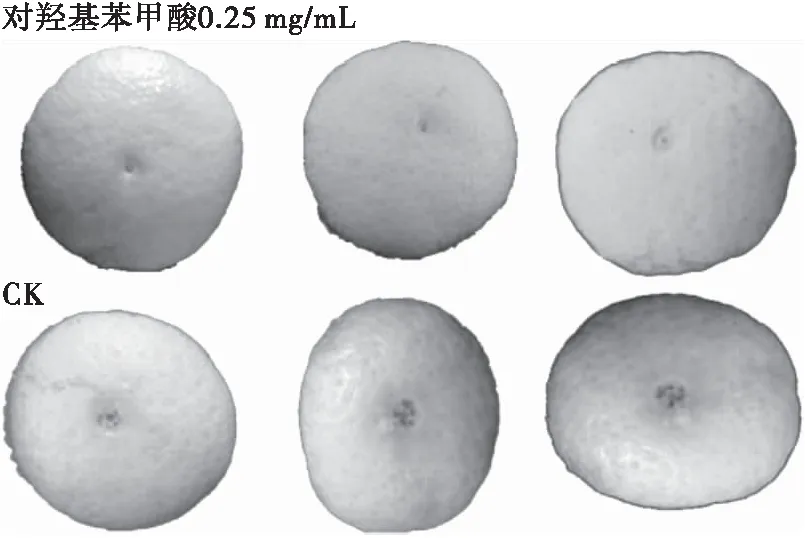
图4 对羟基苯甲酸对柑橘炭疽病的抑制效果
2.4 不同处理对柑橘果实相关抗性酶活性的影响
PPO为多酚氧化酶,能催化醌类物质和木质素的形成,在植物体内构成保护性屏障,阻挡病菌的侵害。图5中可看出试验组(打孔+对羟基苯甲酸)的PPO活性先上升后趋于稳定,且其酶活性在后期高于对照组。CK3组的酶活性高于CK1自然组,说明果实受病原菌侵染后会产生抗性反应,引起PPO活性的提高。试验组(孔+对羟基苯甲酸+菌)的PPO活性在第2天达到峰值后便下降,这可能有两方面原因:① 对羟基苯甲酸抑制病原菌的生长,使得病原菌无法诱导果实抗性;② 对羟基苯甲酸参与提高果实抗性的部分减弱,从而导致了酶活性的降低。综上所述,对羟基苯甲酸具有诱导果实PPO活性以及抑制病原菌生长的作用。
POD为过氧化物酶,能够催化过氧化氢的分解,防治过氧化氢对植物造成伤害。由图6可知,CK1、CK2、试验组(打孔+对羟基苯甲酸)果实的酶活性均呈先上升后下降的趋势,但试验组始终高于对照组。其酶活性在第4天达到峰值54.17 U/(g·min)。并且在贮藏前期试验组(孔+对羟基苯甲酸+菌)的酶活性均高于CK2和CK3,从第6天开始下降。试验结果表明:在果实表面接种病原菌和打孔都能使PPO活性升高,当添加对羟基苯甲酸后,果实的PPO活性更高。因此可以得出对羟基苯甲酸具有诱导果实POD活性升高的作用。
SOD是重要的保护酶,它能够清除超氧阴离子自由基,保护果实免于伤害。图7中CK1的酶活性在前期基本不变,CK2的酶活性波动较大,试验组(打孔+对羟基苯甲酸)SOD活性在整个试验期内波动较小,第4天达到峰值,但酶活性平均值高于对照,且下降速度较慢。图7中CK3的酶活性先急剧下降再上升,与试验组(打孔+对羟基苯甲酸+菌)基本相似,但试验组酶活性高于CK3组。可能是外源添加对羟基苯甲酸能触发果实内SOD酶合成,清除果实因机械损伤和病菌侵染产生的自由基等物质,使得果实维持生理状态。由此说明当有病原菌侵染柑橘果实时,用对羟基苯甲酸处理果实可以适当提高果实SOD活性。
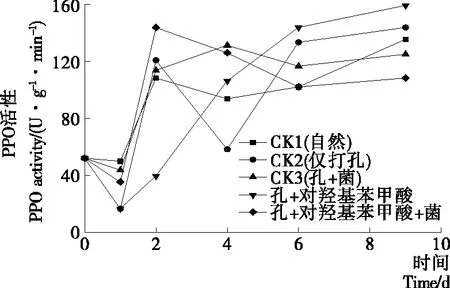
图5 不同处理下柑橘果实多酚氧化酶(PPO)活性的变化
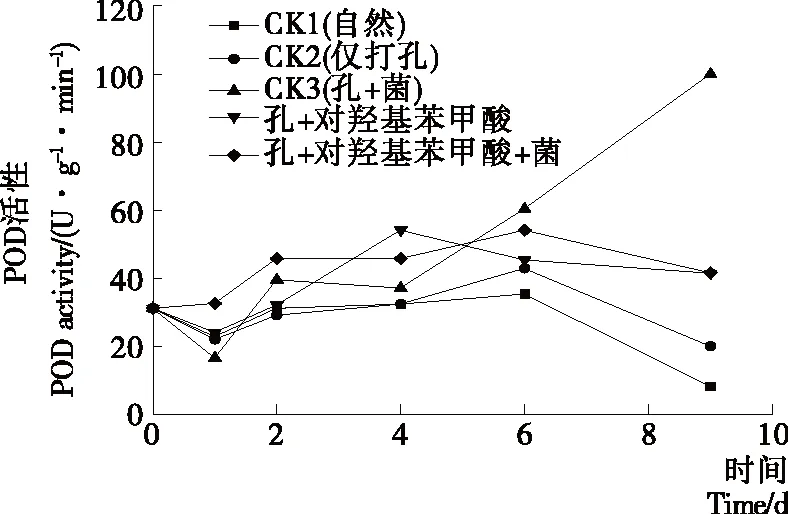
图6 不同处理下柑橘果实过氧化物酶(POD)活性的变化
PAL是苯丙烷代谢的关键酶,能够催化生成黄酮体、生物碱、木质素等与抗性相关的苯丙烷类物质。图8中试验组(打孔+对羟基苯甲酸)酶活性呈先上升后下降的趋势,在第4天达到峰值。对照组CK2酶活性波动范围较大,可能是打孔对果实造成物理伤害使得酶活性发生变化。图8中第1天试验组(打孔+对羟基苯甲酸+菌)的酶活性最高,说明对羟基苯甲酸的加入促进了PAL活性的升高,第2~4天时,CK3组酶活性上升,试验组酶活性下降,这与图5中PPO活性在后期的变化相似。但在第6天后,由于果实衰老加速和药物的作用,PAL活性又开始升高。因此可推测对羟基苯甲酸同样具有诱导PAL活性升高以及抑制病原菌生长的作用。
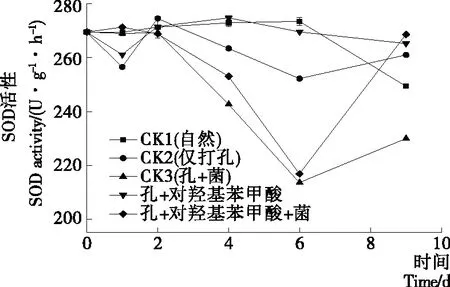
图7 不同处理下柑橘果实超氧化物歧化酶(SOD)活性的变化
Figure 7 Changes of Superoxide Dismutase (SOD) activity with different treatment in citrus

图8 不同处理下柑橘果实苯丙氨酸解氨酶(PAL)活性的变化
2.5 不同处理对柑橘果实MDA含量的影响
MDA是膜脂过氧化最重要的产物之一,它的产生还能加剧膜的损伤。因此在植物衰老生理和抗性生理研究中MDA含量是一个常用指标,通过MDA可了解膜脂过氧化程度,以间接测定膜系统受损程度以及植物的抗逆性。图9试验组中MDA含量与对照组MDA含量均呈先下降后上升再下降的趋势,但试验组(打孔+对羟基苯甲酸,打孔+对羟基苯甲酸+菌)含量分别低于CK2、CK3对照组,原因可能是对羟基苯甲酸能抑制果实内MDA的合成,减小膜脂过氧化程度,从而使果实的生理伤害较小。表明对羟基苯甲酸能降低果实膜脂过氧化程度,提高果实抗性。

图9 不同处理下柑橘果实丙二醛(MDA)含量的变化
3 结论与讨论
对羟基苯甲酸常用作食品添加剂和抗菌物质使用,在一定浓度范围内对生物体无害。本试验采用低浓度对羟基苯甲酸为材料,确保了其环保的优点。在体外试验中,对羟基苯甲酸能较强地抑制胶孢炭疽菌的生长繁殖,且浓度越高,抑制效果越好。浓度为2 mg/mL时的抑制作用达到98.56%,基本完全抑制了胶孢炭疽菌的生长。在体内试验中,测试的浓度为0.25 mg/mL,果实的病斑抑制率为38.01%。这与酚酸具有较强抗菌性的结果相吻合。经对羟基苯甲酸处理的柑橘果实,其抗性相关酶(PPO、POD、SOD、PAL)活性上升,MDA含量下降。说明对羟基苯甲酸具有诱导果实抗性升高的作用。综上所述,对羟基苯甲酸具有抑制胶孢炭疽菌生长和诱导果实抗性的作用。对柑橘采后保鲜具有重要意义。
前人研究[29]表明,在植物—病原菌互作过程中,植物可通过生成相关抗病物质包括木质素等以抵抗外界病菌侵染。因此利用外源的添加物如酚酸、酯类等化合物来提高植物抗性成为目前研究的热点,本试验在前人研究的基础上,使用对羟基苯甲酸作为外源添加物,证实了其对柑橘果实相关抗性酶具有诱导作用,能减少膜脂过氧化程度。但其内在机制还有待研究,需要运用其他一些生物学方法。
[1] 单杨. 中国柑橘工业的现状、发展趋势与对策[J]. 中国食品学报, 2008(1): 1-8.
[2] 刘铮. 中国柑橘产业国际竞争力动态[D]. 武汉: 华中农业大学, 2012: 9-11.
[3] 颜小挺, 祁春节. 加入WTO以来中国柑橘国际竞争力变化及出口增长源泉的分析[J]. 世界农业, 2013(1): 71-76.
[4] 胡媛媛, 马良, 张宇昊. 柑橘果实中主要的真菌毒素及其检测技术[J]. 食品工业科技, 2013(24): 385-391.
[5] 陈国庆. 中国柑橘炭疽病病原种类及种群遗传多样性研究[D]. 浙江: 浙江大学, 2010: 11-15.
[6] 李菲菲, 龙超安. 柑橘炭疽病菌的分离、鉴定及在果实上的潜伏侵染特性[J]. 果树学报, 2015, 32(1): 108-114.
[7] CHALFOUN N R, CASTAGNARO A P, DAZ RICCI J C. Induced resistance activated by a culture filtrate derived from an avirulent pathogen as a mechanism of biological control of anthracnose in strawberry[J]. Biological Control, 2011, 58(3): 319-329.
[8] CAO Shi-feng, ZHENG Yong-hua, WANG Kai-tuo, et al. Effect of yeast antagonist in combination with methyl jasmonate treatment on postharvest anthracnose rot of loquat fruit[J]. Biological Control, 2009, 50(1): 73-77.
[9] GOPINATH K, RADHAKRISHNAN N V, JAYARAJ J. Effect of propiconazole and difenoconazole on the control of anthracnose of chilli fruits caused by Colletotrichum capsici[J]. Crop Protection, 2006, 25(9): 1 024-1 031.
[10] 朱玲风, 李高阳, 张菊花, 等. 高浓度臭氧水对柑橘多菌灵的降解及其精油品质的影响[J]. 食品与机械, 2014, 30(3): 49-53.
[11] 黄寿恩, 李忠海, 何新益. 干燥方式对柑橘皮中主要抗氧化成分及其活性的影响[J]. 食品与机械, 2014, 30(5): 190-195.
[12] VASUDEVA N, SHARMA T. Chemical Composition and Antimicrobial Activity of Essential Oil of Citrus limettioides Tanaka[J]. Journal of Pharmaceutical Technology & Drug Research, 2012(1): 1-7.
[13] 李巧巧, 雷激, 唐洁, 等. 商品柑橘精油的抑菌性及其应用研究[J]. 食品与机械, 2011, 27(6): 160-162.
[14] 朱豪, 梁彬霞, 赵文红, 等. 橘皮中酚酸的研究进展[J]. 中国食品添加剂, 2012(2): 155-160.
[15] 郑洁, 赵其阳, 张耀海, 等. 超高效液相色谱法同时测定柑橘中主要酚酸和类黄酮物质[J]. 中国农业科学, 2014(23): 4 676-4 687.
[16] SCHMIDT C G, GONÇALVES L M, PRIETTO L, et al. Antioxidant activity and enzyme inhibition of phenolic acids from fermented rice bran with fungus Rizhopus oryzae[J]. Food Chemistry, 2014, 146: 371-377.
[17] 王海敏, 虞海霞, 董蕊, 等. 苕子蜜总酚酸和总黄酮含量测定及抗氧化活性的研究[J]. 食品科学, 2010(1): 54-57.
[18] FERGUSON L R, ZHU S, HARRIS P J. Antioxidant and antigenotoxic effects of plant cell wall hydroxycinnamic acids in cultured HT-29 cells[J]. Molecular Nutrition & Food Research, 2005, 49(6): 585-593.
[19] 张庭廷, 何梅, 吴安平, 等. 对羟基苯甲酸对铜绿微囊藻的化感效应以及对鲤鱼的毒性作用[J]. 环境科学学报, 2008(9): 1 887-1 893.[20] 田给林. 连作草莓土壤酚酸类物质的化感作用及其生物调控研究[D]. 北京: 中国农业大学, 2015: 5-11.
[21] HELENO S A, FERREIRA I C F R, ESTEVES A P, et al. Antimicrobial and demelanizing activity of Ganoderma lucidum extract,p-hydroxybenzoic and cinnamic acids and their synthetic acetylated glucuronide methyl esters[J]. Food and Chemical Toxicology, 2013, 58: 95-100.
[22] FARHOOSH R, JOHNNY S, ASNAASHARI M, et al. Structure-antioxidant activity relationships ofo-hydroxyl,o-methoxy, and alkyl ester derivatives ofp-hydroxybenzoic acid[J]. Food Chemistry, 2016, 194: 128-134.
[23] 冉玥, 焦必宁, 赵其阳, 等. 超高效液相色谱法同时测定柑橘中11种类黄酮物质[J]. 食品科学, 2013(4): 168-172.
[24] BAUTISTA-BAOS S, HERNNDEZ-LPEZ M, BOSQU-EZ-MOLINA E, et al. Effects of chitosan and plant extracts on growth of Colletotrichum gloeosporioides, anthracnose levels and quality of papaya fruit[J]. Crop Protection, 2003, 22(9): 1 087-1 092.
[25] ZHOU Ya-han, MING Jian, DENG Li-li, et al. Effect of Pichia membranaefaciens in combination with salicylic acid on postharvest blue and green mold decay in citrus fruits[J]. Biological Control, 2014, 74: 21-29.
[26] LIU Feng-juan, TU Kang, SHAO Xing-feng, et al. Effect of hot air treatment in combination with Pichia guilliermondii on postharvest anthracnose rot of loquat fruit[J]. Postharvest Biology and Technology, 2010, 58(1): 65-71.
[27] LUO Yang, ZENG Kai-fang, MING Jian. Control of blue and green mold decay of citrus fruit by Pichia membranefaciens and induction of defense responses[J]. Scientia Horticulturae, 2012, 135: 120-127.
[28] 胡花丽, 梁丽松, 王贵禧, 等. 外源乙烯对CA贮藏桃果实MDA含量、PPO和LOX活性变化的影响[J]. 西北林学院学报, 2007(3): 38-42.
[29] LIN Jin-he, GONG De-qiang, ZHU Shi-jiang, et al. Expression of PPO and POD genes and contents of polyphenolic compounds in harvested mango fruits in relation to Benzothiadiazole-induced defense against anthracnose[J]. Scientia Horticulturae, 2011, 130(1): 85-89.
Mechanism and inhibitory effect of p-hydroxybenzoic acid on anthracnose in postharvest citrus
HUANG Xiao-lan1GEZhi-xing1WANGRi-kui1,2,3HEMing-yang1,2,3HANLeng1,2,3ZHOULian1,2,3
(1.CitrusResearchInstitute,SouthwestUniversity,Chongqing400712,China;2.CitrusResearchInstitute,ChineseAcademyofAgriculturalScience,Chongqing400712,China;2.NationalCitrusEngineeringResearchCenter,Chongqing400712,China)
To explore the antifungal activity and potential mechanism ofp-Hydroxybenzoic acid againstColletotrichumgloeosporioidesin postharvest Citrus. The addition ofp-HBA in-vitro and in-vivo was conducted to test the inhibitory effect. Dynamic changes of peroxidase (POD), polyphenoloxidase(PPO), Superoxide Dismutase (SOD), Ammonia-lyase (PAL)activity and the content of Malondialdehyde(MDA) with different treatment was studied in postharvest citrus.p-HBA displayed strong antifungal activity toC.gloeosporioides,when the concentration was higher, the effect was increased. The value ofEC50is 0.056 mg/mL. The activities of PPO, POD, SOD and PAL were increased when inoculated withp-HBA andC.gloeosporioides, while the content of MDA was decreased.p-Hydroxybenzoic acid has a strong antimicrobial activity, which can induce the increase of defending enzyme’s activity and decrease the peroxidation of membrane lipid, The significance obviously is there for citrus fresh-keeping.
p-hydroxybenzoic acid;Colletotrichumgloeosporioides; postharvest citrus; storage and fresh-keeping; antifungal activity; antioxidase activity
公益性行业(农业)科研专项经费项目(编号:201203034);重庆市科技支撑示范工程项目(编号:cstc2014fazktjcsf80007);中央高校基本科研业务费专项基金项目(编号:XDJK2013C014)
黄小兰,女,西南大学在读硕士研究生。
王日葵(1962—),男,西南大学柑桔研究所副研究员。
E-mail:ewrk@163.com
2016—01—20

