猪口蹄疫O型合成肽VP1结构蛋白ELISA抗体检测方法的建立
董春娜,肖 进,2,张 蕾,巴利民,栗利芳,宋 芳,齐 鹏
(1.农业部兽用生物制品与化药重点实验室 北京市兽用多肽疫苗设计与制备工程技术中心中牧实业股份有限公司研究院,北京 丰台 100070;2.中国农业大学动物医学院,北京 海淀 100093)
猪口蹄疫O型合成肽VP1结构蛋白ELISA抗体检测方法的建立
董春娜1,肖进1,2,张蕾1,巴利民1,栗利芳1,宋芳1,齐鹏1
(1.农业部兽用生物制品与化药重点实验室 北京市兽用多肽疫苗设计与制备工程技术中心中牧实业股份有限公司研究院,北京 丰台 100070;2.中国农业大学动物医学院,北京 海淀 100093)
根据猪口蹄疫O型流行毒株VP1序列设计出5条合成肽,以固相法合成并以此合成肽作为包被抗原建立猪口蹄疫O型合成肽VP1结构蛋白ELISA抗体检测方法,并对该方法敏感性、特异性、重复性等进行验证。结果表明:该检测方法敏感性为96.0%,特异性为99.1%,批内与批间重复试验变异系数小于10.0%。比对试验结果显示,该检测方法与UBI猪口蹄疫病毒VP1结构蛋白抗体酶联免疫吸附试验诊断试剂盒符合率为93.2%,与中国农业科学院兰州兽医研究所口蹄疫O型液相阻断ELISA抗体检测试剂盒符合率为85.7%。该猪口蹄疫O型合成肽VP1结构蛋白ELISA抗体检测方法敏感性好、特异性强、稳定性高、操作简便,可用于检测O型口蹄疫抗体水平。
口蹄疫;合成肽;抗体;ELISA
口蹄疫(foot and mouth disease,FMD)是由FMDV感染引起偶蹄动物发生的烈性传染病,该病毒传播途径多、传染性强,严重危害畜牧业发展和肉食及其畜产品生产供应。OIE在1984年将口蹄疫列为A类传染病之首[1]。FMDV分为A、O、C、SAT I、SAT II、SAT及Asia 1七个血清型,每个型分为若干个亚型,型及亚型间几乎无交叉免疫反应。FMDV衣壳含有4种结构蛋白,分别为VP1、VP2、VP3和VP4,其中VP1蛋白暴露于病毒颗粒表面,能诱导感染动物产生中和抗体,在分子流行病学调查、毒株型与亚型分析、基因工程疫苗研制等方面具有较重要学术价值和现实意义[2]。目前,口蹄疫防治主要依靠疫苗免疫,我国对口蹄疫施行强制性免疫。快速、准确的诊断是控制口蹄疫疫情蔓延和追踪疫源的重要环节。由于口蹄疫病毒近些年流行毒的突变发生频率越来越高,而市售口蹄疫抗体检测试剂盒仅能涵盖较少毒株,因而已经不能满足对现有毒株的检出能力,为了克服这一缺陷,本试验针对国内5种口蹄疫流行毒株(OS/99、OZK/93、O/HB、O/XJ/10-11和O/GX/09-7),采用生物信息学方法对这5种毒株VP1结构蛋白进行精确分析[3],筛选出5条肽,用全自动多肽合成仪(PSI500)进行合成[4],制备出更新更全的包被抗原,建立了猪口蹄疫O型合成肽VP1结构蛋白ELISA抗体检测方法,为进一步研发猪口蹄疫O型合成肽VP1结构蛋白ELISA抗体检测试剂盒奠定了基础。
1 材料与方法
1.1材料
1.1.1包被抗原分别为来自OS/99、OZK/93、O/ HB、O/XJ/10-11和O/GX/09-7毒株VP1结构蛋白的表位(位于氨基酸140~160区域),由中牧实业股份有限公司研究院合成并纯化。
1.1.2主要试剂兔抗猪IgG酶标二抗,购自Sigma公司;其他试剂,购自Amresco公司;猪口蹄疫病毒VP1结构蛋白抗体酶联免疫吸附试验诊断试剂盒,购自上海优耐特生物医药公司(UBI);口蹄疫O型液相阻断ELISA抗体检测试剂盒,购自中国农业科学院兰州兽医研究所。
1.1.3血清猪口蹄疫O型阴、阳性对照血清 本公司制备;100份猪口蹄疫O型病毒感染猪血清,100份猪口蹄疫O型疫苗免疫血清,100份健康猪血清(口蹄疫抗体为阴性),280份猪临床血清由兰州生物药厂提供;猪瘟阳性血清,购自中国兽医药品监察所;猪水疱病阳性血清、猪口蹄疫A型阳性血清,中国农业科学院兰州兽医研究所提供;猪圆环病毒和猪繁殖与呼吸综合征病毒(PRRSV)阳性血清,成都生物药厂提供。
1.2方法
1.2.1最佳抗原包被浓度和血清稀释度的确定
采取方阵滴定方法,用包被液将合成肽包被抗原分别作8、4、2、1、0.5、0.25、0.125、0.0625(μg/ml/肽)倍比稀释;将阳、阴性血清从1∶10、1∶20稀释至1∶320,比较P/N值(P:阳性对照孔OD450值;N:阴性对照孔OD450值),以P/N值最大的孔所对应的抗原包被浓度和血清稀释度为最佳抗原包被浓度和血清稀释度。
1.2.2最佳封闭条件的确定分别用含0.2%、0.5%和1%BSA的0.01%Tween-20 PBS(0.01 mol/L,pH值7.2)作为封闭液,进行ELISA检测,比较P/N值,以P/N值最大孔对应封闭液配方作为最佳封闭液。
1.2.3底物反应时间的确定分别置37℃孵育10、15 min及20 min,进行ELISA检测,比较P/N值,以确定底物最佳反应时间。
1.2.4临界值的确定对100份健康猪血清进行测定,根据健康动物血清样本ELISA测定OD450平均值(X)加上3个标准差(SD)得出试剂盒临界值。
1.2.5敏感性试验对100份感染猪血清和100份免疫血清进行检测。
1.2.6特异性试验对100份健康猪血清、猪瘟、猪水疱病、猪圆环病毒病、猪PRRS、猪口蹄疫A型阳性血清各2份分别进行检测。
1.2.7重复性试验用同一批次包被酶标反应板和相应试剂,分别检测已知背景15份血清样本,其中阴性、强阳性和弱阳性血清各5份,计算批内变异系数。用3批包被酶标反应板和相应试剂,分别检测已知背景15份血清样本,计算批间变异系数。
1.2.8与其他试剂盒比对试验对280份临床血清用本方法、UBI试剂盒和中国农业科学院兰州兽医研究所试剂盒进行比对试验。
2 结果与分析
2.1最佳抗原包被浓度和血清稀释度的确定
结果显示(表1),当抗原包被浓度为0.5 μg/mL/肽,血清稀释度为1∶20时,P/N值最大。从而确定抗原最佳包被浓度为0.5 μg/mL/肽,血清最佳稀释度为1∶20。

表1 方阵滴定结果 (P/N比值)
2.2最佳封闭条件的确定结果显示(图1),含有1%BSA、0.01%Tween-20的PBS封闭效果最好。
2.3底物反应时间的确定结果显示(图2),加入底物液反应15 min后,P/N值最高。
2.4临界值的确定所测得100份健康猪血清平均OD450值(X)为0.143,标准方差(SD)值为0.036,X+3SD=0.254。≥0.254判为阳性;<0.254判为阴性。
2.5敏感性试验本方法对100份感染猪血清和100份免疫血清进行检测(见表2),其中192份血清为阳性,8份血清为阴性,敏感性为96.0%。

图1 封闭液的确定
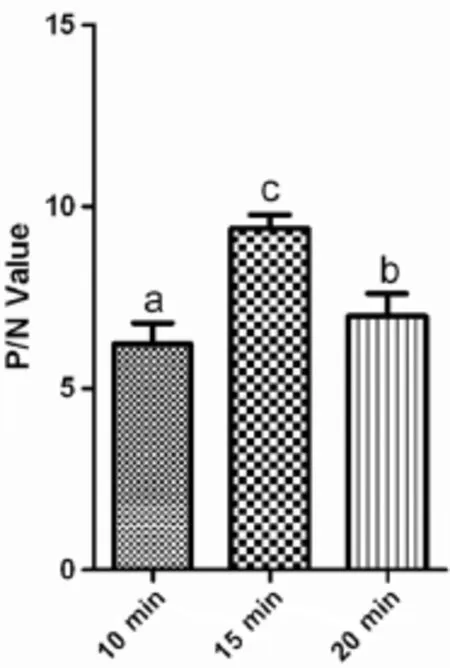
图2 底物反应时间的确定
2.6特异性试验本方法对100份健康猪血清检测仅有1份为阳性,其他病原阳性血清均为阴性(表2),特异性为99.1%(109/110)。

表2 试剂盒敏感性和特异性试验结果
2.7重复性试验批内重复性结果显示,批内变异系数在3.0%~9.7%之间。批间重复性结果显示,批间变异系数在1.5%~7.2%之间,表明该试剂盒重复性较好。
2.8与其他试剂盒比对试验对280份临床血清进行检测,本检测方法阳性率为44.6%。UBI试剂盒检出阳性率为42.9%。两者共有261份血清检测结果一致,因而符合率为93.2%。中国农业科学院兰州兽医研究所试剂盒检测阳性率为47.5%。两者总共有240份血清检测结果一致,因而符合率为85.7%。

表3 试剂盒重复性试验结果

表4 与其他试剂盒比对试验
3 讨论
目前FMD诊断方法主要包括临床诊断、病毒分离、血清学及分子生物学诊断技术。本试验建立的间接ELISA检测方法采用生物信息学方法针对国内流行的口蹄疫病毒O型流行毒株结构蛋白VP1进行精确分析,从5个代表毒株主要抗原表位上筛选出合适的5条肽段,制备更新更全的包被抗原。将合成肽做为包被抗原,有很多优越性,首先,合成肽是化学合成的,生产过程中无需接触和使用病毒,无生物安全隐患,不含杂蛋白。其次,合成肽是FMDV外壳表面蛋白质VP1特定抗原决定簇序列,与相应抗体的结合力强,从而决定了本检测方法检测的敏感性。此外合成肽是短肽,这种短肽的特定区域不具有对其他非特异性抗体的交叉反应性[5],因此该试剂盒在高效、特异、快捷及生物安全性上实现了较完美的结合。该试剂盒敏感性为96.0%,特异性为99.1%,重复性好,与UBI公司的猪口蹄疫病毒VP1结构蛋白抗体ELISA诊断试剂盒符合率为93.2%,与中国农业科学院兰州兽医研究所的口蹄疫O型液相阻断ELISA抗体检测试剂盒符合率为85.7%,符合市场要求。
[1]Kitching R P.Foot-and-mouth disease:currentworld situation[J]. Vaccine,1999,17(13-14):1772-1774.
[2]Acharya R,Fry E,Stuart D,et al.The three-dimensional structure of foot-and-mouth disease virus at 2.9 A resolution[J].Nature,1989,337(6209):709-716.
[3]Krebs O,Berger H G,Marquardt O.The capsid protein-coding sequence of foot-and-mouth disease virus O Brescia[J].Arch Virol,1991,120:135-143.
[4]Baxt B,Becker Y.The effect of peptides containing the arginine glycine aspartic acid sequence on the adsorption of foot-andmouth disease virus to tissue culture cells[J].Virus Genes,1990,4:73-83.
[5]Wang C Y,Chang T Y,Walfield A M,et al.Effective syntheticpeptide vaccine for foot and mouth disease in swine[J].Vaccine,2002,2603-2610.
Development of an ELISA based on synthetic peptidefor detection of porcinefoot-and-mouth diseasevirus VP1 antibody infection by O serotype
DONG Chun-na1,XIAO Jin1,2,ZHANG Lei1,BA Li-min1,LI Li-fang1,SONG Fang1,QI Peng1
(1.China Animal Husbandry Industry Co.Ltd.Ministry of Agriculture Key Laboratory of veterinary biologics and drugs;Veterinary peptide vaccine design and preparation of engineering and technology center of Beijing,Beijing 100070,China;college of veterinary Medicine,China Agricultural University,Beijing 100093,China)
Five specific peptides of FMDV VP1 were synthesized by a solid-phase method and used to detect antibody of FMDV serotype O.The ELISA reaction system was optimized and the sensitivity,specificity and repeatability were tested.The result showed that the sensitivity and specificity of this method were 96.0%and 99.1%,and variations of intra-assay and inter-assay repeatability test of the method were below 10.0%.Comparing this assay with UBI VP1 ELISA kits and the liquid phase blocking ELISA kits by detecting 280 samples,we showed that the agreement was 93.2%and 85.7%,respectively.This assay has high sensitivity and specificity,and is also stable and convenient,which can be used to monitor the antibody level of FMDV serotype O.
FMDV;synthetic peptide;antibody;ELISA
QI Peng
S854.43
A
0529-6005(2016)04-0039-03
2014-10-20
“十二五”863项目牛口蹄疫合成肽疫苗研制(2011-AA10A211)
董春娜(1973-),女,兽医师,硕士,主要从事动物免疫学,E-mail:dongchunna@126.com
肖进(1978-),男,工程师,博士生,主要从事合成肽疫苗及诊断试剂研发工作,E-mail:13611015197@126.com
注:肖进与董春娜对本文具有同等贡献
齐鹏,E-mail:cahic_ivd@vip.tom.com

