水貂绿脓杆菌(山东株)血清分型和ERIC-PCR分型的研究
秦晓冰,王 瑷,单 虎
(青岛农业大学 山东省预防兽医学重点实验室,山东 青岛 266109)
水貂绿脓杆菌(山东株)血清分型和ERIC-PCR分型的研究
秦晓冰,王瑷,单虎
(青岛农业大学 山东省预防兽医学重点实验室,山东 青岛 266109)
为了探明水貂出血性肺炎病原和流行特点,2011-2012年对山东省15个水貂养殖场进行水貂出血性肺炎流行病学调查。从病貂中分离出19株绿脓杆菌,分别测定了分离株的血清型,同时应用肠杆菌科基因间重复序列聚合酶链反应(ERIC-PCR)对菌株进行DNA分型。结果19株分离株中血清型G型15株,血清型B型2株,血清型E型和I型各1株;ERIC-PCR谱型表现为7种基因型,其中15株G型株存在于谱型Ⅰ~Ⅶ中(Ⅵ除外),B型株属于谱型Ⅱ,I型株属于谱型Ⅳ,E型株属于谱型Ⅵ。表明山东地区水貂出血性肺炎由绿脓杆菌引起,其分离株血清型以G型为主,基因型呈现多样性。
水貂;绿脓杆菌;血清分型;ERIC-PCR
绿脓杆菌(Pseudomonas aeruginosa,PA)是广泛存在于自然界,水、土壤、空气、正常动物的肠道、呼吸道、皮肤中的一种条件性致病菌。PA属于革兰阴性杆菌,引起以出血性肺炎和败血症为主要特征的人兽共患病[1-3]。PA是引起水貂出血性肺炎的主要病原菌,该病发病急、死亡快,呈地方性暴发流行,发病貂场死亡率在10%~50%[4]。近年来貂养殖场频繁出现貂出血性肺炎的报道,该病严重威胁着养貂业的发展。但该病临床治疗的难度却在不断增加,这是由于对PA的防治长期依赖抗生素的使用,造成PA病原天然或获得性多重耐药,具有了广谱耐药性。
山东省是毛皮动物养殖大省,养貂数量占全国的2/3。本试验自2011年1月到2012年12月,从该省3个地区15个水貂养殖场发生的貂出血性肺炎病料中分离病原菌,经生化鉴定获得了19株绿脓杆菌,分别对各菌株进行了血清型分型和ERIC-PCR分型。本试验旨在为水貂绿脓杆菌病的防治提供理论基础,并且为水貂PA疫苗的研制提供了可行性思路及有效数据。
1 材料与方法
1.1菌株绿脓杆菌标准菌株ATCC27853,购自中国兽医药品监察所。
试验菌株:2011-2012年,实验室分离鉴定的19株水貂源绿脓杆菌。
1.2主要试剂绿脓杆菌血清分型用标准阳性血清,购自日本生研株式会社。dNTP、ExTaq DNA聚合酶、DL-2 000 DNA Marker,购自宝生物工程(大连)有限公司。西班牙Biowest琼脂糖,购自上海夏夷实业有限公司;GoldView(GV),购自北京赛百盛基因技术有限公司。
1.3绿脓杆菌临床分离株的血清学分型按阳性血清试剂盒附带的说明书进行操作。
抗原的制备:将被检菌株划线接种于NAC培养基上,置37℃培养24 h,再挑取单个菌落接种于普通琼脂培养基上,37℃培养24 h。取单个菌落溶于100 μL生理盐水,置于EP管中,制成抗原备用;(2)玻板凝集反应:取10 μL抗原与20 μL血清在洁净的玻板上充分混合,同时取10 μL抗原与20 μL生理盐水混合作为空白对照;(3)结果判定:1 min内,在透明的背景下观察到有凝集块,且空白对照为阴性,判定凝集反应阳性。
1.4绿脓杆菌ERIC-PCR分型技术的建立
1.4.1细菌总DNA提取参照《预防兽医学检验技术》[5],细菌接种于培养基中,37℃摇床(300 r/ min)培养过夜,离心弃上清液,收集沉淀,加入6 μL 50 mg/mL的溶菌酶作用2 h,再加入NaCl、10% SDS、蛋白酶作用3 h,制成透明黏稠液体。取菌液加等体积的酚∶氯仿∶异戊醇(25∶24∶1)混匀,离心抽提,再离心沉淀洗涤,晾干后溶于50 μL dd H2O中,在紫外分光光度计上测其吸光度值,计算DNA浓度。取4 μL电泳,作PCR模板用。
1.4.2ERIC-PCR反应引物参照Debast等[6]报道,ERIC-2(5′-AAG TAA GTG ACT GGG TGA GCG-3′),反应总体积25 μL,其中10×PCR Buffer 2.5 μL,d-DNT 2 μL,引物1 μL,Tag酶2.5 U,DNA模板5 μL,含量分别为1、50、250 ng。反应条件为94℃预变性5 min,然后 94℃ 45 s,38℃~46℃45 s,72℃1 min,35个循环,最后72℃延伸5 min。
1.4.3PCR产物电泳和鉴定参考《分子克隆实验指南》[7]方法对PCR产物进行凝胶电泳。用0.5×TAE缓冲液配制25 mL 1%琼脂糖凝胶,琼脂糖在微波炉中加热熔化后,加入2 μL GoldView(GV),混匀制凝胶板。取5 μL扩增产物加1 μL 6×Loading Buffer混匀,加入上样孔,同时以标准DNA分子量DL-2 000作为对照,120 V恒压电泳3 min,利用Alpha凝胶成像系统观察扩增片段并拍照记录。
1.4.4采用1.4.2中优化的最佳反应条件,对实验室分离到的19株水貂源绿脓杆菌进行ERICPCR分析。
1.4.5DNA同一基因型判定标准以每一分离物的所有可见带具有相同的移动距离定为一型,带移动的距离不同或所有可见带的移动距离相同但缺少两条带以上定为另一基因型[8]。
2 结果
2.1绿脓杆菌血清学分型结果血清学分型凝集反应明显,分辨率为100%,结果见表1。在分离的19株绿脓杆菌中G型有15株,占分离株的78.9%,可见G型株在流行菌中占主导地位,将来可能作为疫苗源的备选菌株。其中还有2株B型株,E和I型株各1株。
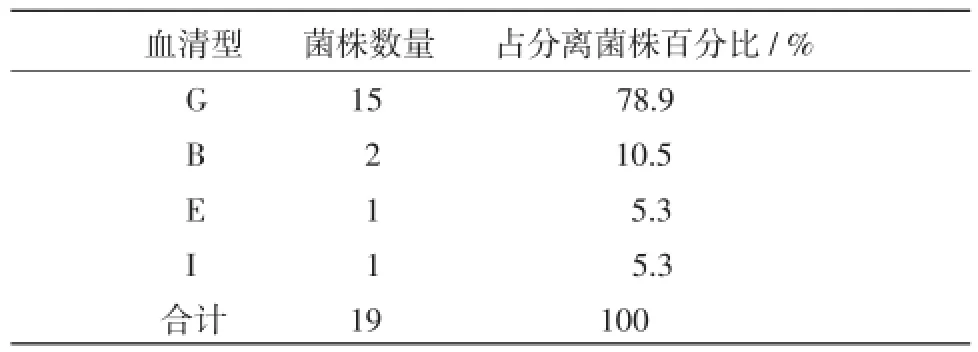
表1 绿脓杆菌血清学分型结果
2.2绿脓杆菌ERIC-PCR分型结果
2.2.1ERIC-PCR最佳反应条件的确定通过反复多次对ERIC-PCR反应过程中的模板浓度、退火温度、延伸时间、循环次数等条件的优化,确定了ERICPCR最佳反应体系(见表2)。最佳反应条件:94℃预变性5 min,94℃变性45 s,42℃退火45 s,72℃延伸1 min,共35个循环,7℃终延伸5 min。

表2 绿脓杆菌ERIC-PCR反应体系 (25 μL)
2.2.2临床分离株分型结果如图1、2所示,对19株绿脓杆菌进行ERIC-PCR扩增并对产物电泳后出现清晰可见的特征性图谱。其中,第1(2011、G)、6(2011、G)、10(2011、G)、11(2012、G)、12(2012、G)泳道为谱型Ⅰ;第2(2011、G)、4(2011、B)、5(2011、B)、7(2011、G)、8(2011、G)、9(2011、G)泳道为谱型Ⅱ;第3(2011、G)泳道为谱型Ⅲ;第13(2012、G)、14(2012、I)、15(2012、G)为谱型Ⅳ;第16(2012、G)、17(2012、G)泳道为谱型Ⅴ,18(2012、E)泳道为谱型Ⅵ、19(2012、G)泳道Ⅶ。由此可知这19株绿脓杆菌从分子生物学方法可分为7种血清型,并且同为G型的15株菌按照分子生物学方法分型存在于谱型Ⅰ~Ⅶ中(除谱型Ⅵ中没有),B型属于谱型Ⅱ,I型属于谱型Ⅳ,E型属于谱型Ⅵ。

表3 绿脓杆菌ERIC-PCR分型结果

图1 绿脓杆菌ERIC-PCR分型结果

图2 绿脓杆菌ERIC-PCR分型结果
3 讨论
3.1血清学分型血清分型是研究细菌的基本方法之一,既可用于种和型的鉴别的同时,也是流行病学调查的重要手段。绿脓杆菌血清型众多,目前国际上尚无标准的分型方法。国际抗原分型系统(IATS)和日本生研株式会社血清分型系统是目前国际上通行的PA基本分型方法。前者根据细菌外膜蛋白抗原、脂多糖抗原的不同从而将细菌分成20个不同的血清型。后者有3群多价血清,共有A、B、C、D、E、F、G、H、I、G、K、L、M、N 14种血清型。通过对细菌进行血清学分型可对不同地区所检出的不同菌株进行比较,从而了解不同地区绿脓杆菌感染的规律。
丹麦[9]1998-2001年分离的72株水貂绿脓杆菌中G型占75%,B型占8%、C型占17%,说明水貂绿脓杆菌感染以G型为主,欧洲和美国主要流行血清型也是G型。徐修礼等[10]采用日本血清分型系统对100株人源分离株进行分型,分型结果以B型为主,其次为G型和E型,说明人绿脓杆菌的感染以B型为主。本试验中,从山东省分离的水貂绿脓杆菌的分型结果来看,貂源感染以G型为主,这点与国内其他貂源绿脓杆菌分型的结果是相一致的[11-13],其次是B型,E型、I型也有分离到,这说明山东地区水貂绿脓杆菌流行菌株既具有流行普遍性,又具有其地区特异性和复杂性。水貂绿脓杆菌血清型的鉴定为山东地区水貂绿脓杆菌疾病的防治提供了理论依据。
3.2分子生物学分型ERIC-PCR分型方法是在随机扩增多态性指纹图谱(RAPD)基础上发展起来的一种PCR方法。ERIC-PCR的原理是:许多革兰阴性杆菌中存在一段约126 bp重复序列,即ERIC片段。这段序列散在分布于基因组中,遗传性稳定,在不同种间仅有拷贝数和位置的变化。这段序列具有高度保守性,依据此重复序列设计引物,对细菌基因组DNA进行扩增,同一条泳道可得到多条50~3 000 bp的独特条带,形成指纹图谱[14]。根据指纹图谱的不同可区分细菌的株型。
国内外不少学者将ERIC-PCR与脉冲场凝胶电泳,随机扩增多态性等技术进行了比较研究,证明ERIC-PCR退火温度较高,错配较少,重复性优于随机扩增多态性DNA,易于实现标准化,与脉冲场凝胶电泳相比,重复性和其相当,还可以克服脉冲场凝胶电泳所需仪器、试剂价格昂贵,操作复杂,检测通量小,耗时较长的缺点[15]。
晏群等采用ERIC-PCR分型技术对临床分离的30株人源绿脓杆菌的DNA进行扩增。结果显示,30株绿脓杆菌中,来自于不同患者的27株绿脓杆菌指纹图谱表现出多态性,同一患者不同时间分离的细菌具有相同的谱型[14]。宋振银对属于同一血清型的产气荚膜梭菌做亚型分类。按照菌株指纹图谱相似率达到80%则判定为同一菌株的标准,ERIC-PCR将8株A型产气荚膜梭菌分为5个亚型,REP-PCR分为3个亚型。可见多重序列PCR反应能够对产气荚膜梭菌的亚型做有效分类,比较两种重复序列反应,ERIC-PCR对产气荚膜梭菌亚型分类具有更好效果[16]。Hammer等[12]应用脉冲场电泳方法对分离自55个水貂发病场的绿脓杆菌进行分子生物学分析,发现,其中54个场分离的绿脓杆菌为同一亚型,并推测是同一株菌的传播引起54个场的水貂感染绿脓杆菌型肺炎。
本研究采用ERIC-PCR分型方法对临床上分离到的19株绿脓杆菌进行分型,共可分为7个基因亚型。可知,山东地区绿脓杆菌基因型呈现多样性。
[1]Savoia D.New perspectives in the management of Pseudomonas aeruginosa infections[J].Future Microbiol,2014,9:917-928.
[2]姜晓东,邵明旭,刘丽萍,等.山东地区羊绿脓杆菌的分离鉴定及系统发育分析[J].中国兽医学报,2015,35(3):429-433.
[3]王月虎,李瑛,李焕荣,等.猛禽源绿脓杆菌分离鉴定及药敏试验[J].中国兽医杂志,2011,47(1):83-84.
[4]Hammer A S,Pedersen K,Andersen T H.Comparison of Pseudomonas aeruginosa isolates from mink by serotyping and pulsedfield gel electrophoresis[J].Veterinary Microbiology,2003,94:237-243.
[5]倪宏波,何宏轩,乔军.预防兽医学检验技术[M].长春:吉林人民出版社,2002:46-54.
[6]Debast S B,Meis JFGM,Melchers W J,et al.Use of interrepeat PCR fingerinting to investigate an Acinetobacher baumanni outbreak in an interisive care unit[J].Scan J Infect Dis,1996,28(2):577-581.
[7]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].黄培堂,王嘉玺,朱厚础,等译.3版.北京:科学出版社,2002.
[8]Chatelut M,Dournes J L,Chabanon G,et al.Epidemiological typing of stenotrophomonas(Xanthomonas)maltophilia by PCR[J].J Chin Microbiol,1995,33(4):912-914.
[9]Hammer A S,Pedersen K,Andersen T H.Comparison of Pseudomonas aeruginosa isolates from mink by serotyping and pulsedfield gel electrophoresis[J].Veterinary Microbiology,2003,94:237-243.
[10]徐修礼,孙怡群,樊新.绿脓杆菌的血清分型及耐药性分析[J].中华现代临床医学杂志,2005,3(1):27-29.
[11]白雪,柴秀丽,闫喜军,等.水貂绿脓杆菌分离株的生物学特性和血清型分析[J].畜牧与兽医,2011,43(7):31-35.
[12]马俊,张超,曲新泽,等.水貂绿脓杆菌的分离与鉴定[J].中国动物传染病学报,2014,22(1):44-49.
[13]闫新武,雷连成,张明亮,等.貂源绿脓杆菌分离鉴定及生物学特性[J].中国兽医学报,2014,34(10):1610-1614.
[14]晏群,陈丽华,刘文恩,等.分子生物学分型技术ERIC-PCR的建立[J].实用医学杂志,2003,19(6):688-689.
[15]朱琴,彭少华.铜绿假单胞菌耐亚胺培南现状与分子水平研究[D].武汉:武汉大学,2004:24.
[16]宋振银.鸡源魏氏梭菌的分离、鉴定及分子分型研究[D].雅安:四川农业大学,2008.
Comparison of Pseudomonas aeruginosa isolates from mink in Shandong provinceby serotyping and enterobacterial repetitiveintergenic consensus PCR
QIN Xiao-bing,WANG Ai,SHAN Hu
(College of Animal Science and Veterinary Medicine,Qingdao agricultural University,Qingdao 266109,China)
Minks suffering from hemorrhagic pneumonia occur frequently in large-scale mink farms in Shandong province over the past several years.The objective of the experiment was to study the etiological characteristics on the basis of the epidemiological investigations from 20 large-scale mink farms in Shandong province from 2011 to 2012.Nineteen strains of Pseudomonas aeruginosa isolated from sick and/or dead minks were identified by the biochemical characterizations,serotype,and genotype by enterobacterial repetitive intergenic consensus PCR(Eric-PCR).The 19 isolates were divided into four serotypes:group G(15/19),group B(2/19),group E(1/19)and group I(1/19).The 19 strains were classified to 7 genotypes by Eric-PCR,including group G existed in spectral typeⅠ~Ⅶ(exceptⅥ),group B existed in spectral typeⅡ,group I existed in spectral typeⅣand group E existed in spectral typeⅥ.The results showed that Pseudomonas aeruginosa was isolated from the mink hemorrhagic pneumonia in Shandong district and most serotype of clinical isolated strains were group G and their genotypes had high degree of clonal diversity.
mink;Pseudomonas aeruginosa;serotyping;ERIC-PCR
SHAN Hu
S858.92
A
0529-6005(2016)09-0091-04
2015-05-20
科技部科技基础性工作专项项目(2012FY111000);山东省优秀中青年科学科研奖励基金(博士基金)BS2011SW010;山东省自主创新及成果转化专项(2014ZZCX07105)
秦晓冰(1971-),女,副教授,博士,研究方向为动物传染病的诊断和生物制品研发,E-mail:xiaobingqin@yeah.net
单虎,E-mail:shanhu67@163.com

