转pGH IGF-1基因对猪生长和繁殖性能的影响
范岩岩,刘倩倩,张廷荣,孙金海
(青岛农业大学动物科技学院,山东 青岛 266109)
转pGH IGF-1基因对猪生长和繁殖性能的影响
范岩岩,刘倩倩,张廷荣,孙金海
(青岛农业大学动物科技学院,山东 青岛 266109)
为了解转双基因在猪生长发育中作用及意义,选取23头健康仔猪,其中转pGH、IGF-1双基因猪4头,转pGH基因猪12头,非转基因猪7头,研究pGH、IGF-1基因对猪生长和繁殖性能的影响。结果表明,转pGH、IGF-1双基因猪个体均重比转pGH单基因猪高2.83%,差异显著(P<0.05);转双基因猪比非转基因猪高7.37%,差异显著(P<0.05)。转双基因猪体重达100 kg的日龄比转单基因猪少8.93 d,差异显著(P<0.05),转双基因猪比非转基因猪少12.23 d,差异显著(P<0.05),转单基因猪比非转基因猪少3.30 d,差异不显著(P>0.05);转双基因公猪的精液量,分别比转pGH单基因公猪与非转基因公猪提高27.61%、18.31%,差异均显著(P<0.05);精子密度,三者之间差异均不显著(P>0.05);转双基因公猪与非转基因猪的精子活力之间差异不显著(P>0.05);转单基因公猪畸形率分别比转双基因公猪、非转基因猪高23%、18%,差异均显著(P<0.05)。为进一步分析pGH-IGF-1生长轴对家猪生产性能的具体影响提供参考依据,也为转基因技术的推广与应用提供有力依据。
猪;生长激素(GH);胰岛素样生长因子(IGF);生长性能;繁殖性能
动物生长通过促生长激素轴控制,由生长激素释放因子(GHRH)、胰岛素样生长因子(IGFs)、生长激素(GH)构成,各激素之间发挥重要的调节作用,共同调控机体的整个生长发育过程[1]。pGH能够减少脂肪组织对葡萄糖的利用,降低Co A羧化酶和脂肪合成酶的活性,抑制脂肪的合成[2]。同时,pGH还能有效促进脂肪组织的分解[3],从而使猪的背膘厚和胴体脂肪含量下降。IGFs是GH-IGF中的重要调控因子,是pGH发挥生物学作用的主要介导者[4]。Davies等[7]研究发现,IGF-1无功能变异小鼠因为缺乏IGF-1导致其成年后间质细胞不能成熟,导致类固醇分泌的减少,IGF-1基因控制着睾丸的功能[5],生长轴对动物繁殖起着至关重要的作用。
2013年本实验室,姚延珠等[6]将双基因重组真核表达载体用纳米材料包裹后转染长白猪精子,通过人工授精导入受体母猪。待其产仔后,经检测其中4头仔猪为转双基因猪,转双基因阳性率为30.76%,成功制备出转(pGH-IGF-1)双基因猪。本试验从生产数据角度进一步分析pGHIGF-1生长轴对家猪生产性能的具体影响。
1 材料与方法
1.1试验动物的选择试验于2013年10月至2014年10月在青岛农业大学实验基地种猪场进行。选取同品种2头转双基因母猪与正常公猪杂交,得到23头健康仔猪并取耳组织样,检测后代中转双基因、转单基因的子代个数,测得数据。
引物的设计与合成:根据GenBank数据库中猪pGH基因序列(GenBank=M17704.1)和IGF-1基因序列(GenBank=M31175.1),利用Prime Premier5.0分别设计上、下游引物:
pGH F:5′-ATGCCCTTGTCCAGCCTAT R:AGGTATGTCTCAGCCTTGTGC-3′;
IGF-1 F:5′-TGCCCTTGTCCAGCCTATTT R:GCAGGTATGTCTCAGCCTTGTG-3′。
1.2测定项目
1.2.1测定体重测定猪不同日龄试验猪体重和3月龄、5月龄、6月龄体尺及体重100 kg时等指标。对体重在85~105 kg范围的试验猪,记录实测日龄和体重,按加拿大校正公式转换成体重达100 kg的日龄。
校正日龄=测定日龄-[(实测体重-100)/CF]
其中:(公猪)CF=(实测体重/测定日龄)× 1.826;(母猪)CF=(实测体重/测定日龄)×1.715。
前文不避琐赘,对清初传记散文中遗民形象书写的道德范式做四个方面的梳理,然尚有一个重要的问题,亦需做出系统的解释,即这些传记散文中遗民道德范式的实现途径。兹试作粗略之解如下。
1.2.2射精量测量精液量主要用电子天平称量法。按1 g=1 mL计,精液量(g)=(精子的质量+集精杯的质量)集精杯子的质量。尽量避免用量筒转移精液造成精子的死亡。
1.2.3精子活力检测方法:用100 μL移液器准确吸取50 μL样品,取0.95 mL的3.0%氯化钠溶液与精液混合均匀。将备好的血球计数板用血盖片将计数室盖好,用小吸管吸取,滴一滴于血盖片边缘,使精液自行流入计数室,均匀充满,避免气泡和液层过厚,然后用显微镜观察计数。计算方法:3个视野活力评价值的平均数。如下:式中:M 表示活力;n1表示第一视野活力;n2表示第二视野活力;n3表示第三视野活力。
1.2.4精子密度检测正常情况下公猪的精子密度为3~5亿/mL,有的可高达7亿/mL。检测精子密度的方法主要有估测法、精子密度仪法、血细胞计数方法等。本试验使用精子密度仪进行检测。
1.2.5精子畸形率检测制作精子抹片,用姬姆萨染料对精子进行染色,用普通显微镜进行观察,计算畸形百分率。具体方法如下:(1)抹片:在载玻片的一端滴一滴精液,然后取另一载玻片与有样品的载玻片呈35°夹角,轻轻推动载玻片,将精液均匀地涂抹于载玻片上,静置约10 min风干,每组样品制作两个精子抹片;(2)固定:取1.0 mL~2.0 mL中性福尔马林固定液,滴在已风干的抹片上,静置15 min,用清水将固定液吹去,待吹干或自然风干后染色;(3)染色:将配好的姬姆萨染液滴在固定好后的抹片,染色2 h后冲去染液,凉干待检;(4)镜检:在显微镜下观察制备好的精子抹片,每个抹片观察精子200个以上,记录抹片上畸形精子个数,取两片的平均值,如两片的畸形率相差大于6则认为不符合要求应重新检测。
精子畸形率计算公式如下:
2 结果与分析
2.1仔猪转基因数的测定仔猪转基因猪的PCR检测,1%琼脂糖凝胶电泳,检测出转pGH、IGF-1双基因猪4头,转pGH基因猪12头,非转基因猪7头,如图1、2所示:
2.2仔猪不同日龄体重的分析对23头试验猪不同日龄进行体重生长的测定,比较同期转

图2 IGF-1基因PCR扩增结果
pGH、IGF-1双基因猪、转pGH单基因猪与非转基因猪生长性能,结果如表1所示。
由表1统计分析结果可以看出,除30日龄和90日龄体重外,转双基因猪与非转基因猪各月龄均差异显著(P<0.05),在30日龄时,转单基因猪的体重高于转双基因猪和非转基因猪。其后,转双基因猪生长迅速,60日龄体重超过转单基因和非转基因猪。总的来说,转双基因猪分别比转单基因猪、非转基因猪高2.83%、7.37%,差异显著(P<0.05)。
2.3F1代的转基因猪与非转基因猪生长分析
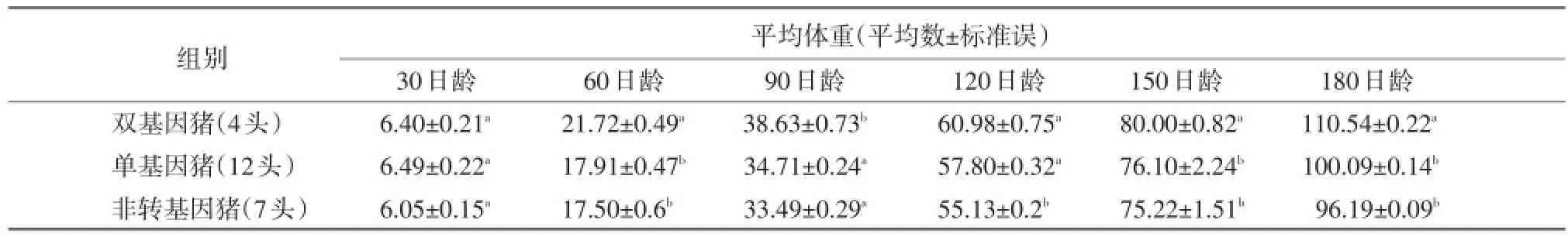
表1仔猪不同日龄的体重 单位:kg
2.3.1不同时期转基因猪的体尺对比对23头试验猪3月龄、5月龄、6月龄进行体尺生长的测定,比较同期转pGH、IGF-1双基因猪、转pGH单基因猪与非转基因猪,结果如表2所示。
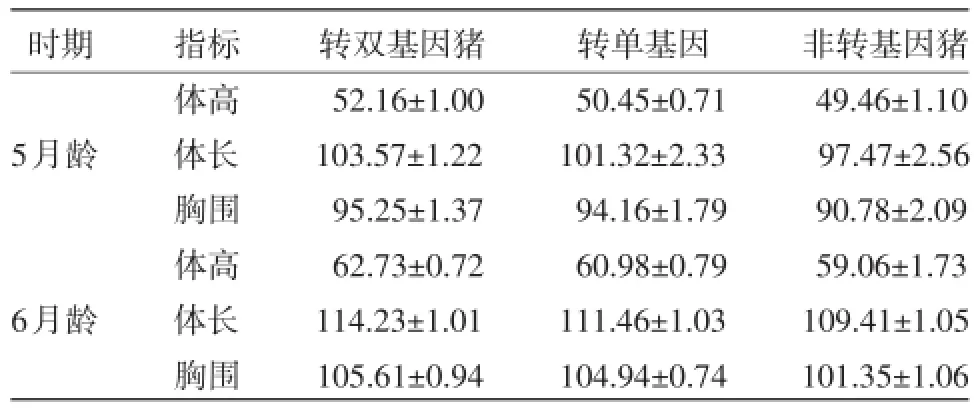
表2 不同时期仔猪体尺
从表2可以看出,5月龄时,转双基因猪、转单基因猪和非转基因猪的体高均差异显著(P<0.05);转双基因猪和转单基因猪的胸围差异不显著(P>0.05),但都显著高于非转基因猪。6月龄时,3者之间在体高、体长两个指标上均差异显著(P<0.05)。总的来说,在体尺指标上,无论是体高、体长还是胸围,转双基因猪优于转单基因猪,转单基因猪优于非转基因猪。
2.3.2仔猪体重达100 kg的日龄控制试验猪的体重在80~110 kg范围之内,转双基因猪体重达100 kg的日龄为171.07 d,转单基因为180.00 d,非转基因为183.30 d。转双基因猪比转单基因猪少8.93 d,差异显著(P<0.05),转双基因猪比非转基因猪少12.23 d,差异显著(P<0.05),转单基因猪比非转基因猪少3.3 d,差异不显著(P>0.05)。由此可见,转双基因猪的的生长潜力最大,其次为转单基因猪,非转基因猪的生长潜能最弱小。
2.3.3检测精液量、精子密度、精子活力和畸形率采集6月龄公猪(转双基因2头,转单基因6头,非转基因3头)精液,在光镜下统计计算精子品质如图3,分别测定数据,如表3所示:
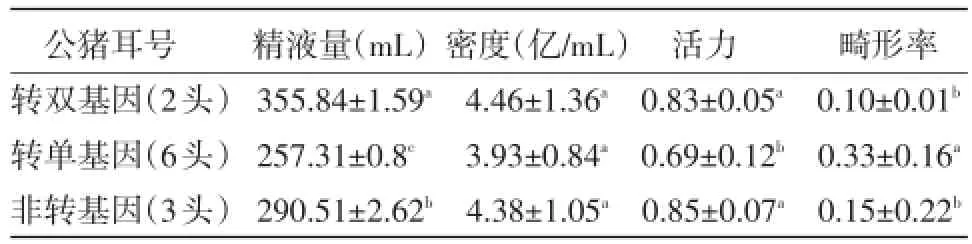
表3 不同公猪精液品质

图3 光镜下精子活力图 (80×)
经测量对比可以看出,就精液量而言,转双基因公猪分别与转单基因公猪、非转基因猪提高27.61%、18.31%,均差异显著(P<0.05);精液密度,三者之间差异不显著(P>0.05);精子活力,转双基因公猪与非转基因公猪之间差异不显著(P>0.05);畸形率,转单基因公猪畸形率分别与转双基因公猪、非转基因公猪高23%、18%,差异均显著(P<0.05)。
3 讨论
3.1IGF-1基因与家猪生长繁殖的相关性IGF-1是一类多肽,调控着骨骼肌的生长发育,有研究表明,将IGF-1注入高龄或肌肉损伤的动物肌肉中,能够促进成肌细胞快速增殖分化形成肌细胞,并且明显增加肌肉重量[8]。Rhoads R.P.等[9]研究表明,降低营养水平使羊IGF-1基因表达量下降。IGF-1促进大鼠和猪初情期前支持细胞的增殖[10],IGF-I促进未成熟间质细胞有丝分裂。IGFs促进精原细胞DNA合成,体外培养时维持大鼠有丝分裂前DNA合成。IGF-1促进睾酮生产,对未成熟细胞的作用比成熟细胞明显[11]。
结合本试验数据,转双基因猪生长和繁殖优于转单基因猪优于非转基因猪,与其他动物得到的结果一致。
3.2GH基因与家猪生长繁殖的相关性GH直接作用于肝脏、脂肪、肌肉等组织。有研究表明,注射入提纯的南方黑鲷GH的欧亚鱼卢表现出明显的生长优势,大麻哈鱼也显现出额外的生长特性[12]。GH参与雄性动物的生殖调节,雄性动物的繁殖状态伴随着GH分泌水平的变化[13]。GH缺乏的雄性动物模型显示多个内分泌靶腺功能低下,生长和性发育障碍,精子形成受阻,GH替代治疗可取得明显效果[14]。从生产上测得的转基因公猪精子的数据,可知转基因的公猪精液体积和密度优于非转基因公猪,但在精子活力方面非转基因猪要优于转基因猪,特别是转单基因猪与非转基因猪差异显著(P<0.05),可能是GH过量表达对精子活力产生一种阻碍,其原理有待进一步深入研究。
3.3pGH-IGF-1生长轴与家猪生产性能的相关性生长轴在动物的生长其中扮演了十分重要的角色,由动物体内下丘脑-垂体-靶器官的一系列激素及其受体所组成的神经内分泌系统[15]。GH经血液循环至肝脏,与细胞膜表面的GH结合,促进IGFs的表达;IGFs通过血液循环到达机体的局部组织,促进组织细胞的生长和分化[16]。由GH刺激的肝脏及肝外组织中IGF-1 mRNA升高,IGF-1的合成与分泌增加。本试验通过数据统计,转双基因猪要比非转基因猪体重增长快,差异显著(P<0.05),转双基因要比转单基因在生长更有优势,说明GH与IGF-1基因之间具有稳定的联系,两者在家畜生长发育中发挥着重要的作用。
[1]王子荣,赵茹茜,陈杰.通过生长轴调控动物生长[J].草食家畜,1999,01:41-45.
[2]Etherton T D,Bauman D E.Biology of somatotropin in growth and lactation of domestic animals[J].Physiol Rev,1998,78:74-761.
[3]Pell J M,Bates P C.The nutritional regulation of growth hormone action[J].Nutr Res Rev,1990,3:169-192.
[4]Perrini S,Laviola L,Carreiram C,et al.The GH/IGF1axis and signaling pathways in the muscle and bone:mechanisms underlying age-related skeletal muscle wasting and osteoporosis[J].J Endocrinol,2010,205(3):201-210.
[5]Roser J F.Regulation of testicular function in the st al lion:an intricate network of endocrine,paracrine and autocrine systems[J]. Anim Reprod Sci,2008,107(3-4):179-196.
[6]姚延珠.转双基因(pGH-IGF-1)猪的制备及检测[J].青岛农业大学学报,2015,03:39-62.
[7]Davies J S,Thompson N IM,Christian H C,et al.Hypothalamic expression of human growth hormone induces post-pubertal hypergonadotrophism in male trans genic growth rectarded rats[J].Neuroendocrinol,2006,18(10):719-731.
[8]Tapscoot S J,Davis R L,Thayer M J,et al.Myo D1:a nuclear phosphoprotein requiring a Myc homology region to convert fibroblasts to myoblasts[J].Science,1988,242:405-411.
[9]Rhoads R P,Greenwood P L,Bell A W,et al.Nutritional regulation of the genes encoding the acid-labile subunit and other components of the circulating insulin-like growth factor system in the sheep[J].J Animal Sci,2000,78(10):2681-2689.
[10]Jaillard C,Chatelain P G,Saez J M.In vitro regulation of pig Sertoli cell growth and function:effects of fibroblast growth factor and somatomedin-C[J].Biol Reprod,1987,37:665-674.
[11]胡义洁.转基因猪pGH与IGF-1双基因差异表达的研究[J].青岛农业大学学报,2015,01:15-45.
[12]Gnessi L,Fabbri A,Spera G.Gonadal peptides as mediators of development and functional control of the testis:an Integrated system with hormones and local environment[J].Endocrine Reviews,1997,18(4):541-609.
[13]Bunter K L,Cai W,Johnston D J,et al.Selection to reduce residual feed intake in pigs produces a correlated response in juvenile insulin-like growth factor-I concentration[J].J AnimSci,2010,88(6):1973-1981.
[14]Hartke J L,Monaco M H,Wheeler M B,et al.Effect of a shortterm fast on intestinal disaccharidase activity and villus morphology of piglets suckling insulin-like growth factor-I transgenic sows[J].J Anim Sci,2005,83(10):2404-2413.
[15]Li Z,Wu Z,Ren G,et al.Expression patterns of insulin-like growth factor system members and their correlations with growth and carcass traits in Landrace and Lantang pigs during postnatal development[J].Mol Biol Rep,2013,40(5):3569-3576.
[16]王开云,张国生,曾检华,等.利用生长轴各激素调控动物生长[J].江西畜牧兽医杂志,2008,06:4-6.
S828
A
0529-6005(2016)09-0015-04
2016-01-26
山东省现代农业产业技术体系生猪创新团队投资项目(SDAIT-08-13);科技部转基因生物新品种培育科技重大专项(2014ZX08006-003)
范岩岩(1990-),男,硕士,主要从事动物遗传育种学研究,E-mail:1013844827@qq.com
张廷荣,E-mail:zhangtr2006@126.com;孙金海,E-mail:sunjihai00528@sina.com

