次黄嘌呤对营养性肥胖小鼠的抗肥胖作用
顾效瑜,李 哲,郑毅男,刘玉敏*,王全凯,*
(1.吉林农业大学中药材学院,吉林 长春 130118;2.长春科技学院,吉林 长春 130118)
次黄嘌呤对营养性肥胖小鼠的抗肥胖作用
顾效瑜1,李 哲1,郑毅男1,刘玉敏2,*,王全凯1,*
(1.吉林农业大学中药材学院,吉林 长春 130118;2.长春科技学院,吉林 长春 130118)
目的:研究次黄嘌呤(hypoxanthine,Hx)对营养性肥胖小鼠抗肥胖作用的影响。方法:将ICR(Institute of Cancer Research)小鼠随机分成6 组:空白组、模型组、阳性对照组(左旋肉碱100 mg/kg)和Hx干预组(30、60、90 mg/kg),采用高脂饲料饲喂建立肥胖小鼠模型。口服给药4 周后,处死小鼠,收集血液,离心。检测各组小鼠血清甘油三酯、总胆固醇、瘦素和脂联素的含量。制作脂肪组织石蜡切片,经苏木精-伊红(HE)染色颜色观察脂肪细胞的变化。取附睾脂肪经实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR),观察小鼠体内肥胖基因(瘦素和脂联素基因)mRNA表达变化。结果:Hx干预组小鼠的脂肪质量显著低于模型组(P<0.05);总胆固醇含量水平均显著低于模型组(P<0.05、P<0.01);Hx中、低剂量组和对照组的瘦素和脂联素mRNA表达量显著低于模型组(P<0.05)。结论:Hx中、低剂量组有较好的抗肥胖作用,其中低剂量组的抗肥胖效果最好。小鼠脂肪细胞切片中脂肪组织形态学为小鼠肥胖造模提供进一步的研究依据。
肥胖;次黄嘌呤;切片;实时荧光定量聚合酶链式反应(qRT-PCR)
顾效瑜, 李哲, 郑毅男, 等. 次黄嘌呤对营养性肥胖小鼠的抗肥胖作用[J]. 食品科学, 2016, 37(15): 253-258.
GU Xiaoyu, LI Zhe, ZHENG Yinan, et al. Anti-obesity effect of hypoxanthine on nutritionally obese mice[J]. Food Science, 2016,37(15): 253-258. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615043. http://www.spkx.net.cn
随着生活方式及膳食结构的改变,肥胖已成为一个主要的健康问题。有研究显示,肥胖可以改变药物的药物代谢动力学性质[1],成为引发心血管功能障碍[2-4]、II型糖尿病、心脏代谢紊乱[5]、血栓栓塞[6]和健康性营养代谢综合征[7]相关的因素。嘌呤类物质是新陈代谢过程中的一种代谢产物,在能量供应和代谢调节等方面有着非常重要的作用。次黄嘌呤(hypoxanthine,Hx)是核苷的代谢产物,是一种重要的生物碱嘌呤,参与调节人体的一些生理机能[8-9]。本实验主要研究Hx对由高脂饮食引起肥胖的小鼠的减肥作用,为进一步研究其抗肥胖的分子机制及预防和治疗由肥胖引起的代谢综合征提供理论依据。
1 材料与方法
1.1动物、材料与试剂
ICR(美国癌症研究所,Institute of Cancer Research)种雄性小鼠无特定病原体(specific pathogen free,SPF)级,体质量18~22 g,购自于长春市亿斯实验动物技术有限责任公司,许可证号SCXK(吉)-2011-0004。
基础饲料和高脂饲料由吉林白求恩医学院动物实验中心提供,配方见表1。

表1 小鼠饲料组分Table 1 Compositions of animal feeds
Hx(纯度≥99.0%) 楷洋生物科技有限公司;左旋肉碱(L-carnitine) 北京中生瑞泰科技有限公司;总胆固醇(total cholesterol,TC)、总甘油三酯(triglycerid,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒 南京建成生物工程研究所;瘦素(leptin,LEP)、脂联素(adiponectin,ADP)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 美国R&D公司;RNAiso Plus试剂盒、SYBR Premix EXTaqTMⅡ试剂盒、Primescript RT reagent Kit With gDNA Erase试剂盒大连宝生物工程有限公司。
1.2仪器与设备
BSA124S-CW电子天平 德国Sartorius公司;MK-78HW-1恒温磁力搅拌器 金坛市华城敏科实验仪器厂;5424R离心机、Mastercycler ep realplex荧光定量PCR仪 德国Eppendorf有限公司;MD SPECTRAMAX PLUS384酶标仪 美国分子仪器公司;TD-202A切片机、YD-A生物组织摊片机、YD-B生物组织烤片机 浙江省金华市益迪医疗设备厂;PH-030A干燥箱 上海一恒科学仪器有限公司。
1.3方法
1.3.1模型建立
取雄性小鼠120只,在相对湿度(55±1)%,温度(23±1) ℃的条件下,自由饮水并采食普通饲料,适应饲养1 周[10]。从中随机挑出10 只作为空白组(normal control group,ND)喂食普通饲料直至实验结束。其他小鼠喂食普通饲料1 周后,饲喂高脂饲料配搭普通饲料1周,之后继续全高脂饲料喂养至实验结束,4 周后随机选取高脂饲料组小鼠测定TC、TG。确定造模成功后,将肥胖模型小鼠随机分为5 组,分别为模型组(HFD)、阳性对照组(左旋肉碱100 mg/kg,L-C)、Hx低剂量组(Hx 30 mg/kg,LHx)、Hx中剂量组(Hx 60 mg/kg,MHx)、Hx高剂量组(Hx 90 mg/kg,HHx)。模型组和正常组每天灌胃生理盐水。各组每天给药1 次,以0.1mL/10 g(以体质量计)灌胃给药,连续给药4 周。
1.3.2样本采集及检测
在实验结束时,将小鼠禁食12 h,眼球取血,收集血清后小鼠脱臼处死。4 ℃、3 500 r/min离心10 min,分离血清,将上清液贮存于-80 ℃备用。解剖后,快速摘取小鼠的肝脏、脂肪(腹部脂肪、附睾脂肪)并称质量。肝脏取0.5 g左右,按体积比1∶9的比例加入4 ℃生理盐水,匀浆,以4 200 r/min反复离心,取上清液。按照相应试剂盒说明书分别检测血清中TG、TC、HDL-C、LEP和APD含量及肝脏中MDA含量和SOD活性。用小鼠的体质量、体长和脂肪湿质量测量小鼠的Lee’s指数和脂肪系数,作为评价小鼠肥胖程度的指标。

1.3.3脂肪组织切片制作
解剖后将小鼠的腹部脂肪存入体积分数为4%甲醛中固定保存,溶液浸泡1 d后,石蜡包埋。所有组织切割厚度10 μm,并用苏木精和伊红染色。脂肪细胞染色后,染色切片在光镜下进行观察和图像分析,观察小鼠的脂肪组织变化情况。
1.3.4实时荧光定量PCR检测
按照试剂盒说明书进行操作,用Trizol试剂从附睾脂肪组织中提取总RNA后用试剂盒中的DNaseⅠ酶解去除染色体DNA。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因作为内参基因,所有引物均委托大连宝生物工程有限公司设计合成,引物序列见表2。以所提取的脂肪组织中的总RNA的mRNA为模板,按照反转录聚合酶链式反应(reverse transcription-PCR, RT-PCR)专用试剂盒说明书进行反转录反应,合成相应的cDNA第一链。采用SYBR@Premix Ex Taq II试剂盒进行实时荧光定量PCR,反应体系总体积为25 μL。所有实验重复3 次。实时荧光定量PCR反应条件:95 ℃预变性5 min,95 ℃变性5 s,60 ℃退火30 s,95 ℃延伸15 s,40 个循环。
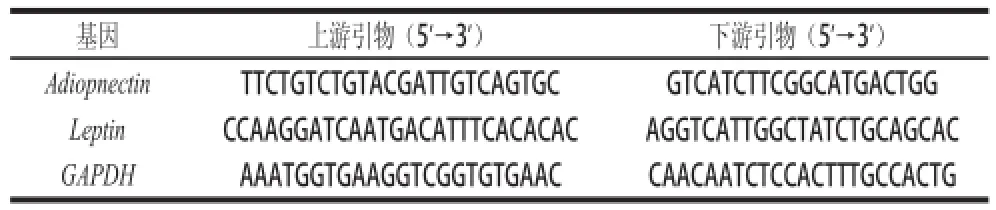
表2 荧光定量引物序列信息Table 2 Primer sequences used in qPCR analysis
1.4数据统计分析
2 结果与分析
2.1Hx对肥胖小鼠体质量、Lee’s指数和脂肪系数的影响

图1 Hx对小鼠体质量的影响Fig. 1 Effect of hypoxanthine on body weights of mice
由图1可知,灌胃前各肥胖组小鼠与空白组小鼠的体质量相比较有显著性差异。灌胃4 周后,阳性对照组和Hx给药组小鼠的体质量与模型组相比显著降低(P<0.05,P<0.01)。由表3可知,阳性对照组和Hx低、中、高剂量组的Lee’s指数与模型组相比显著降低(P<0.05,P<0.01);中、低剂量组的脂肪系数与模型组相比有显著降低(P<0.05,P<0.01)。
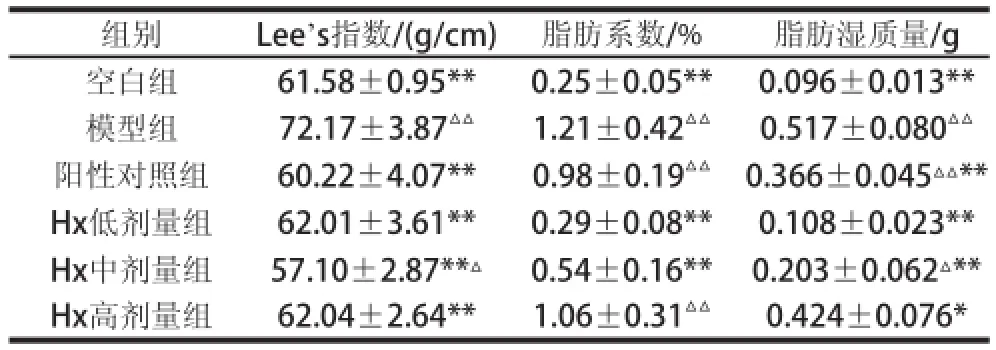
表3 Hx对肥胖小鼠Lee s指数和脂肪系数的影响Table 3 Effect of hypoxanthine on mouse Lee s index and fat coefficients
2.2Hx对肥胖小鼠内脏的影响
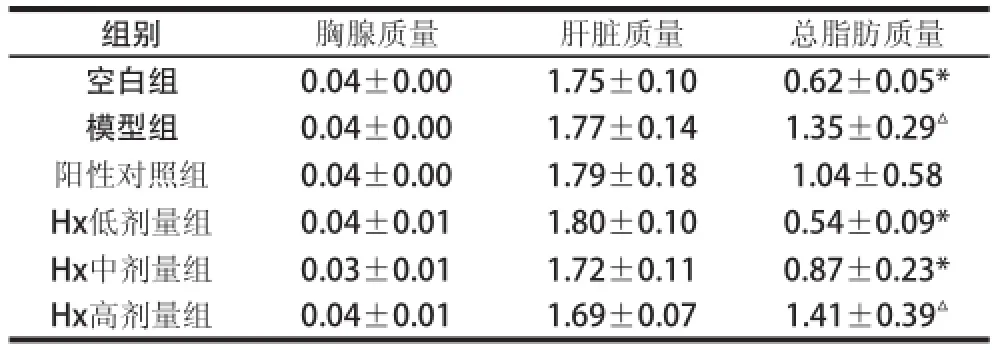
表4 Hx对小鼠内脏器官质量的影响Table 4 Effect of hypoxanthine on visceral weights of mice
由表4可知,小鼠的胸腺质量约为(0.04±0.01)g/只;肝质量约为(1.75±0.04)g /只;与空白组相比模型组总脂肪质量显著增长(P<0.05)。中、低剂量组的总脂肪质量均低于模型组小鼠,差异显著(P<0.05)。其中低剂量组小鼠总脂肪质量最低。阳性对照组脂肪质量也有一定程度的下降趋势,但没有显著性差异。阳性对照组和Hx低、中剂量组总脂肪质量分别降低了23.0%、60.0%、35.6%。
2.3Hx对肥胖小鼠血清脂质水平的影响
喂食高脂饮食的肥胖小鼠经Hx给药4 周后小鼠的血清脂质水平的影响如表5所示。高脂饮食小鼠的TG浓度明显高于空白组小鼠。经给药后,与模型组相比,Hx对给药组小鼠体内的TG浓度具有显著性的抑制作用(P<0.05,P<0.01)。阳性对照组、Hx低剂量组与模型组小鼠体内的TC浓度相比具有显著性的抑制作用(P<0.05)。
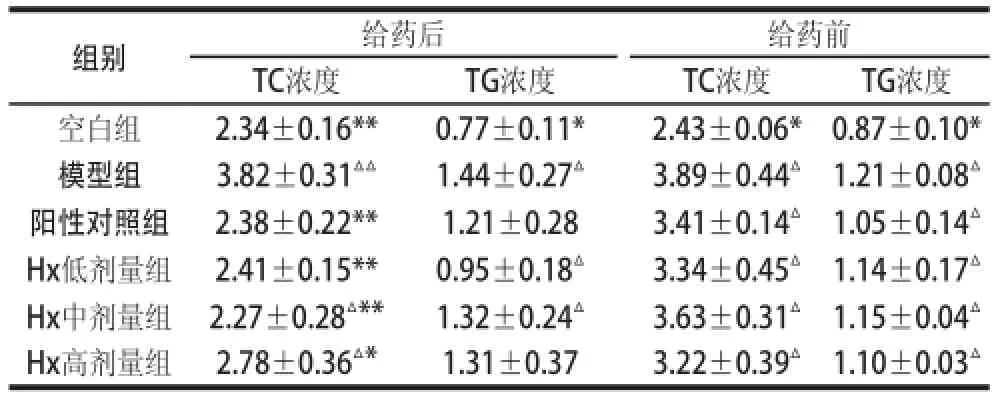
表5 Hx对肥胖小鼠体内血清TC、TG浓度的影响Table 5 Effect of hypoxanthine on serum TC and TG levels of obese mice mmol/L
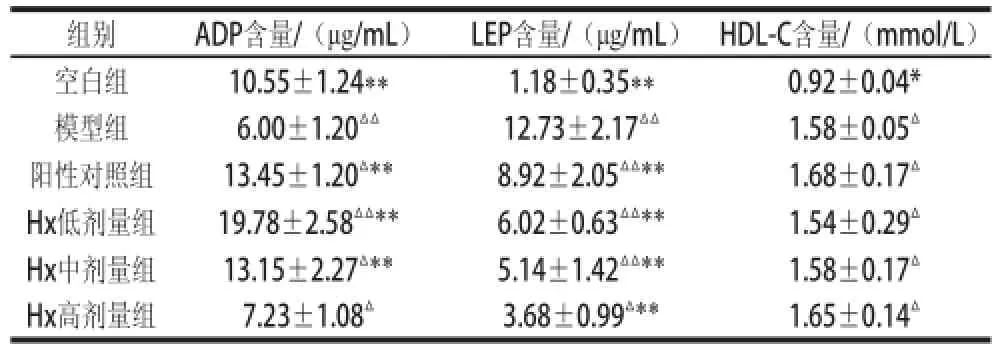
表6 Hx对肥胖小鼠ADP、LEP、HDL-C水平的影响Table 6 Effect of hypoxanthine on blood lipid levels of obese mice
高脂饮食小鼠血清中LEP、ADP、HDL-C水平的影响如表6所示。与模型组相比,阳性对照组和Hx给药组LEP含量受到了明显抑制(P<0.01)。由表6还可知,虽然模型组和Hx高剂量组中血清ADP含量无显著性差异(P<0.05),但是L-C、LHx、MHx组的ADP含量与模型组相比有极显著的增加(P<0.01),分别为124.2%、229.7%和119.2%。Hx给药组和空白组相比,HDL-C浓度均显著增加(P<0.05),与模型组相比,差异不显著。2.4 Hx对营养性肥胖小鼠肝脏参数的影响

表7 Hx对肥胖小鼠肝组织MDA、SOD和GSH水平的影响Table 7 Effect of hypoxanthine on MDA, SOD and GSH levels in liver of mice ice
营养性肥胖小鼠肝功能相关酶活性会受到一定程度的影响(表7),模型组小鼠的SOD活力明显低于空白组小鼠28.5%。MDA的水平明显高于空白组、阳性对照组和Hx给药组(P<0.01)。Hx使肥胖小鼠肝组织中MDA含量明显下降,SOD活性明显上升(P<0.05)。模型组小鼠GSH水平明显高于空白组小鼠96.8%。左旋肉碱治疗和Hx可显著降低肥胖小鼠肝组织中GSH活力(P<0.01)。
2.5脂肪组织切片分析

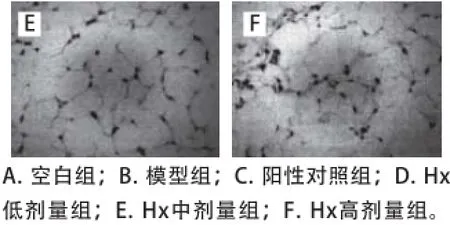
图2 小鼠的脂肪组织切片图 (× 400)Fig. 2 Histological images of mouse adipose tissues (×400)
由图2可知,正常小鼠脂肪组织脂肪细胞体积较小,大小均一,饱满。模型组小鼠的腹腔脂肪组织脂肪细胞呈大空泡状,体积较大,细胞形状不规则,且细胞膜不完全清晰,细胞相交处见融合现象。给药组小鼠腹腔脂肪组织细胞的体积出现了不同程度的恢复状态,其中Hx高剂量组细胞的形状仍不规则,其他给药组细胞的形态基本上较规则且饱满。Hx低剂量组和中剂量组脂滴较模型组明显缩小。
2.6小鼠脂质代谢相关基因的表达
通过实时荧光定量PCR研究Hx对关于脂质代谢及脂肪生成的各种基因的mRNA表达情况的影响(图3)。Hx给药组与模型组比较,瘦素和脂联素基因的mRNA表达量具有显著差异(P<0.05)。其中Hx低剂量组的mRNA表达量变化最显著。

图3 小鼠瘦素(A)和脂联素(B)基因表达Fig. 3 Gene expression levels of leptin (A) and adiponectin (B) in mice
3 讨 论
肥胖及相关疾病现已成为影响全世界各个国家的主要健康问题之一[11]。同时肥胖引起的健康问题在儿童和青少年中也越演越烈[12-13]。肥胖是多种因素引起的由脂肪组织堆积而形成的慢性疾病,会增加肾功能衰竭的机率[14-16],且与心脏和心血管疾病[17]、营养代谢综合征[18]和血栓疾病[19]相关联。
肥胖症人常出现高脂血症,因此血脂指标通常作为考察肥胖的主要因素之一。本研究发现Hx能促进小鼠的脂肪分解,起到降低体内脂肪质量的作用。Hx对营养性肥胖小鼠的抗肥胖研究结果显示:给药4 周后,Hx给药组可以有效的降低肥胖小鼠体质量、总脂肪质量、Lee’s指数和脂肪系数,其中Hx低剂量组与模型组差异最明显。血清方面,与模型组相比较,Hx中、低剂量组能降低小鼠血清中的TC、TG含量,增加脂联素含量,瘦素水平明显受到了抑制,其中Hx低剂量组对治疗小鼠的高脂血症作用最为明显。小鼠的肥胖情况与肝脏中SOD活性和MDA含量均有密切联系,与模型组相比较,Hx具有抑制SOD、MDA活性的作用,且Hx低剂量组差异性最为明显。Hx通过调节SOD、MDA的活性,能有改善实验小鼠肝组织情况,减少体内脂肪分解吸收,达到减肥作用。综上判断Hx对实验小鼠具有减重降脂功能,其中低剂量组的效果最显著。
本实验采用3~4周龄的小鼠,经10 周实验处于成年状态。肥胖在细胞水平的解释是脂肪细胞数目的增加和体积的增大。高脂饮食会导致成年小鼠的脂肪细胞体积增大[20],从而增加了肥胖发生的机率。脂肪组织苏木精-伊红染色切片的研究结果表明模型组脂肪细胞体积明显增大,Hx低剂量组脂肪组织的细胞体积恢复状态最好且脂滴明显缩小,为减肥药物的开发利用提供参考。
瘦素抑制啮齿类动物胰岛β细胞分泌胰岛素,进而影响胰岛素原mRNA 的表达和胰岛素的释放。瘦素是通过直接作用于下丘脑弓状核和室旁核的受体而发挥这一作用的[21-22]。瘦素的干预可以引起体质量和脂肪含量的变化,肥胖模型组小鼠脂肪组织中瘦素 mRNA表达量显著高于对照组,Hx低剂量组可以显著降低肥胖小鼠脂肪组织中ob基因的表达以及血清中瘦素的含量。目前提出瘦素调节能量代谢与体质量的基本框架,主要由两部分构成,即NPY递质系统和黑素皮质素受体-4(melanocortin-4,MC4)受体系统,分别在低和高瘦素含量时发挥作用[23-25]。瘦素的生物学功能是瘦素受体介导的,瘦素的含量上升影响下丘脑MC4受体增加使摄食量减少、能量消耗增加、交感活动增加,具有广泛的生物学功能[26]。
减肥药物种类越来越多,减肥过程中导致不同程度的毒副作用,因此寻找能代替药物的天然健康产品的需求在全球不断的增长[27]。本研究旨在应用天然药物生产无毒副作用的减肥产品,达到让人们轻松减肥,健康瘦身的目的,同时为进一步研究其抗肥胖的机制及预防提供理论依据。
[1] RICHARD A A, KIM S, MOFFETT B S, et al. Comparison of anti-Xa levels in obese and non-obese pediatric patients receiving treatment doses of enoxaparin[J]. Journal of Pediatrics, 2013, 162(2): 293-296. DOI:10.1016/j.jpeds.2012.07.047.
[2] LI Hua, LI Honglian, BAO Yige, et al. Free fatty acids induce endothelial dysfunction and activate protein kinase C and nuclear factor-κB pathway in rat aorta[J]. International Journal of Cardiology,2010, 152 (2): 218-224. DOI:10.1016/j.ijcard.2010.07.019.
[3] BERG A H, SCHERER P E. Adipose tissue, inflammation, and cardiovascular disease[J]. Circulation Research, 2005, 96(9): 939-949. DOI:10.1161/01.RES.0000163635.62927.34.
[4] BURKE G L, BERTONI A G, SHEA S, et al. The impact of obesity on cardiovascular disease risk factors and subclinical vascular disease: the Multi-Ethnic Study of Atherosclerosis[J]. Archives of Internal Medicine, 2008, 168(8): 928-935. DOI:10.1001/archinte.168.9.928.
[5] BARTON M. Obesity and aging: determinants of endothelial cell dysfunction and atherosclerosis [J]. Pflügers Archiv-European Journal of Physiology, 2010, 460(5): 825-837. DOI:10.1007/s00424-010-0860-y.
[6] RAFFINI L, HUANG Y S, WITMER C, et al. Dramatic increase in venous thromboembolism in children’s hospitals in the United States from 2001 to 2007[J]. Pediatrics, 2009, 124(4): 1001-1008. DOI:10.1542/peds.2009-0768.
[7] BLUHER M. The distinction of metabolically ‘healthy’ from‘unhealthy’ obese individuals[J]. Current Opinion in Lipidology, 2010,21(1): 38-43. DOI:10.1097/MOL.0b013e3283346ccc.
[8] 马晓琴, 辛华雯, 李亮, 等. HPLC法测定人红细胞中次黄嘌呤鸟嘌呤磷酸核糖转移酶活性[J]. 中国药师, 2013, 16(2): 196-199. DOI:10.3969/j.issn.1008-049X.2013.02.011.
[9] 丁慧, 岳丽洁, 杨春兰, 等. 次黄嘌呤鸟嘌呤磷酸核糖转移酶研究进展[J]. 遗传, 2013, 35(8): 948-954. DOI:10.3724/ SP.J.1005.2013.00948.
[10] CHO A S, JEON S M, KIM M J. Chlorogenic acid exhibits antiobesity property and improves lipid metabolism in high-fat dietinduced-obese mice[J]. Food and Chemical Toxicology, 2010, 48(3): 937-943. DOI:10.1016/j.fct.2010.01.003.
[11] TCHERNOF A, DESORES J P. Pathophysiology of human visceral obesity: an update[J]. Physiological Reviews, 2013, 93(1): 359-404. DOI:10.1152/physrev.00033.2011.
[12] OGDEN C L, CARROLL M D, CURTIN L R, et al. Prevalence of high body mass index in US children and adolescents, 2007-2008[J]. The Journal of the American Medical Association, 2010, 303(3): 242-249. DOI:10.1001/jama.2009.2012.
[13] DENG G, LONG Y, YU Y R, et al. Adiponectin directly improves endothelial dysfunction in obese rats through the AMPK-eNOS Pathway[J]. International Journal of Obesity, 2010, 34(1): 165-171. DOI:10.1038/ijo.2009.205.
[14] DUPLAGA B A, RIVERS C W, NUTESCU E. Dosing and monitoring of low-molecular-weight heparins in special populations[J]. Pharmacotherapy, 2001, 21(2): 218-234. DOI:10.1592/ phco.21.2.218.34112.
[15] STOLIC R. Obesity in renal failure-Health or disease[J]. Medical Hypotheses, 2010, 75(6): 497-500. DOI:10.1016/j.mehy.2010.07.004.
[16] BURKE G L, BERTONI A G, TRACY R, et al. The impact of obesity on cardiovascular disease risk factors and subclinical vascular disease: the Multi-Ethnic Study of Atherosclerosis[J]. Archives Internal Medicine, 2008, 168(8): 928-935. DOI:10.1001/archinte.168.9.928.
[17] BONORA E, KIECHL S, WILLEIT J, et al. Prevalence of insulin resistance in metabolic disorders: the Bruneck Study[J]. Diabetes,1998, 47: 1643-1649. DOI:10.2337/diabetes.47.10.1643.
[18] LIU W, WAHAFY T, CHENG M, et al. The influence of obesity on primary total hip arthroplasty outcomes: a meta-analysis of prospective cohort studies[J]. Orthopaedics & Traumatology: Surgery & Research,2015, 101(3): 289-296. DOI:10.1016/j.otsr.2015.01.011.
[19] FERRANNINI E, NATALI A, BELL P, et al. Insulin resistance and hypersecretion in obesity. European Group for the Study of Insulin Resistance (EGIR)[J]. Journal of Clinical Investigation, 1997, 100(5): 1166-1173. DOI:10.1172/JCI119628.
[20] DEMERDASH H M, SHARARA G, KATRI K. Differential effects of gastric bypass and banding on the cardiovascular risk profile in morbidly obese subjects: the correlation with plasma apolipoprotein A-IV concentration[J]. Alexandria Journal of Medicine, 2013, 49(1): 17-23. DOI:10.1016/j.ajme.2012.07.002.
[21] PELLEYMOUNTER M A, CULLEN M J, BAKER M B, et al. Effects of the obese gene product on body weight regulation in ob/ob mice[J]. Science, 1995, 269: 540-543. DOI:10.1126/science.7624776.
[22] 黄之瑜, 孙志娟. 肥胖与神经调节[J]. 生理科学进展, 2001, 32 (1): 45-51. DOI:10.3321/j.issn:0559-7765.2001.01.010.
[23] FAN W, BOSTON B A, KESTERSON R A, et al. Role of melanocortinergic neurons in feeding and the agouti obesity syndrome[J]. Nature, 1997, 385:165-168. DOI:10.1038/385165a0.
[24] HUSZAR D,LYNCH C, DUNMORE J, et al. Targeted disruption of the melanocortin-4 receptor result in obesity in mice[J]. Cell, 1997,88(1): 131-141. DOI:10.1016/S0092-8674(00)81865-6.
[25] ERIKSON J C, HOLLOPETER G, PALMITER R D. Attenuation of the obesity syndrome of ob/ob mice by the loss of neuropeptide Y[J]. Science, 1997, 274: 1704-1707. DOI:10.1126/science.274.5293.1704.
[26] 刘华珍, 彭美克. leptin及其受体的研究进展[J]. 华中农业大学学报,2003, 22(1): 90-94. DOI:10.3321/j.issn:1000-2421.2003.01.020.
[27] HOSSEN N, KAJIMOTO K, AKITA H, et al. Vascular-targeted nanotherapy for obesity: unexpected passive targeting mechanism to obese fat for the enhancement of active drug delivery[J]. Journal of Controlled Release, 2012, 163 (2): 101-110. DOI:10.1016/ j.jconrel.2012.09.002.
Anti-Obesity Effect of Hypoxanthine on Nutritionally Obese Mice
GU Xiaoyu1, LI Zhe1, ZHENG Yinan1, LIU Yumin2,*, WANG Quankai1,*
(1. College of Chinese Medicinal Materials, Jilin Agricultural University, Changchun 130118, China;2. Changchun University of Science and Techology, Changchun 130118, China)
Objective: To explore the anti-obesity effect of hypoxanthine (Hx) on nutritionally obese mice. Methods: An obese mouse model was established successfully by feeding high-fat diet. The ICR mice were randomly divided into six groups, namely, normal control, model control, positive control (L-carnitine, 100 mg/kg) and hypoxanthine treatment groups (30, 60, and 90 mg/kg). After 4 weeks of oral administration, blood samples were collected and centrifuged and then the mice were sacrificed. The contents of triglyceride, total cholesterol, leptin and adiponectin in mouse serum were detected. The adipose tissues were made into paraffin section to observe the changes of adipose cells by HE staining. The gene expression levels of leptin and adiponectin in mouse epididymal adipose tissue were measured by real-time quantitative polymerase chain reaction (qRT-PCR). Results: The body weight of the Hx treatment groups were significantly lower than that of the model group (P < 0.05); TC levels were significantly lower than those of the model group (P < 0.05, P < 0.01). The gene expression levels of leptin and adiponectin in the middle- and low-dose Hx groups and normal control were significantly different from those of the model group(P < 0.05). Conclusion: The middle- and low-dose Hx groups had good anti-obesity effect, and the best effect was achieved at the low dose.
obesity; hypoxanthine; slice; real-time quantitative polymerase chain reaction (qRT-PCR)
10.7506/spkx1002-6630-201615043
R965
A
1002-6630(2016)15-0253-06
10.7506/spkx1002-6630-201615043. http://www.spkx.net.cn
2015-10-08
吉林省科技发展计划项目(20120246);吉林省教育厅“十二五”科学技术研究项目(2014628)
顾效瑜(1988—),女,硕士研究生,主要从事生药学动物药研究。E-mail:358574235@qq.com
刘玉敏(1986—),女,讲师,主要从事兽医药理和生物化学研究。E-mail:598295941@qq.com王全凯(1958—),男,教授,主要从事鹿的研究与开发。E-mail:quankaiwang1@163.com
引文格式:

