青香蕉淀粉对乳酸菌在冻干和贮存过程中活性的保护效果
周中凯,王俊轩,李 莹
(天津科技大学食品工程与生物技术学院,天津 300457)
青香蕉淀粉对乳酸菌在冻干和贮存过程中活性的保护效果
周中凯,王俊轩,李 莹
(天津科技大学食品工程与生物技术学院,天津 300457)
研究青香蕉淀粉对冷冻干燥过程中乳酸菌活性的保护作用和对乳酸菌耐酸耐胆盐性、菌粉贮藏稳定性的影响以及与乳酸菌的协同抗氧化作用,旨在为香蕉的加工与开发以及益生菌保护技术提供思路与理论依据。青香蕉淀粉富含2型抗性淀粉,结果表明,青香蕉淀粉能与乳酸菌协同发挥抗氧化作用,1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率达到63.62%,高于两者各自抗氧化作用之和;乳酸菌可以附着于该淀粉颗粒的表面,并且可以将其作为底物缓慢利用;青香蕉淀粉可以显著提高乳酸菌在冷冻干燥过程中的存活率,其值达到73.17%,保护效果优于单独使用甘油和海藻糖;添加了青香蕉淀粉还展现出提高乳酸菌耐酸和耐胆盐的能力,加强其合生元产品的稳定性。
益生活性;青香蕉淀粉;乳酸菌;冷冻干燥;保护作用
周中凯, 王俊轩, 李莹. 青香蕉淀粉对乳酸菌在冻干和贮存过程中活性的保护效果[J]. 食品科学, 2016, 37(15): 144-148.
ZHOU Zhongkai, WANG Junxuan, LI Ying. Protective effect of unripe banana starch on viability of Lactobacillus plantarum during freeze-drying and storage[J]. Food Science, 2016, 37(15): 144-148. (in Chinese with English abstract)
益生菌类食品的流行与其消费需求的不断增长带动了益生菌保护技术的发展,为使益生菌能起到较好的益生作用,一般要求产品在到期之前其活菌数仍能达到105~107CFU/mL或CFU/g[1]。然而一些研究者发现,很多益生菌产品中的活菌数并不能够达到标签上所标明的活菌数[2]。因此,保持益生菌在加工、贮藏过程中的活性以及到达肠道时的活性就显得尤为重要。
通过低温或冷冻可以相对地提高益生菌的存活率,然而冷冻贮藏需要使温度维持在-20~-40 ℃,造成很高的贮藏及运输成本,因此通过干燥的手段移走水分是目前保藏益生菌较为常用的方式,但干燥过程中的脱水现象会造成益生菌的活力变弱[3]。脱水产生的细胞间的压力直接作用在细胞质膜上,改变了膜的流动性以及其他物理性质,膜的脱水还会激发脂质过氧化反应[4]。近年来有报道指出某些种类的碳水化合物表现出很好的保护细胞膜在冷冻和干燥过程中降低损伤的潜力[5-7]。
青香蕉中抗性淀粉的含量很高,利用香蕉中丰富的淀粉资源,研究开发高抗性淀粉产品,可缓解香蕉采后贮运、销售环节压力,提升香蕉的高层次应用和香蕉产业链的综合竞争能力[8]。香蕉中的抗性淀粉可以不被胃和小肠消化而到达大肠,本身就对人类健康具有重要的生理功能,如预防结肠癌、调节血糖浓度、降低胆固醇、抑制脂肪堆积、增加矿物质的摄入、刺激益生菌的生长等功能[9]。抗性淀粉可以与乳酸菌相辅相成,共同发挥作用,组成的合生元在人体内具有调节肠道微生态及预防和辅助治疗疾病的功效。然而,对于抗性淀粉作为保护剂对于乳酸菌在冻干和贮存过程中的活性和稳定性,却很少被研究。本实验研究了青香蕉淀粉对冷冻干燥过程中乳酸菌活性的保护作用,及其对于乳酸菌耐酸耐胆盐性、菌粉贮藏稳定性和与乳酸菌的协同抗氧化性的影响,旨在为香蕉资源的开发利用及益生菌保护技术开拓思路和提供理论依据。
1 材料与方法
1.1材料与菌株
青香蕉 塘沽金元宝水果批发市场。
乳酸菌:植物乳杆菌Lactobacillus plantarum,酸奶中分离纯化得到,由天津科技大学粮油科学与营养实验室提供。
1.2仪器与设备
JYL-C051料理机 九阳股份有限公司;DGG-100-2S电热鼓风干燥箱 天津天宇实验仪器有限公司;XW-80A漩涡混合仪 上海沪西分析仪器厂;ALPHA 1-2 LD plus真空冷冻干燥机 德国Christ公司;Quanta 250环境扫描电子显微镜 美国FEI公司。
1.3方法
1.3.1青香蕉淀粉的制备
采用张雅媛等[10]的方法并做修改,将未成熟的青香蕉剥皮并切成小片,立即放入0.5 g/100 mL亚硫酸氢钠溶液中护色,浸泡10 min后一同倒入九阳料理机中打浆,浆液依次通过60 目和100 目筛网,水洗离心(4 000 r/min,10 min),得到淀粉浆,加入0.5 g/100 mL NaOH溶液以除去可溶性纤维,反复水洗至呈中性,离心(4 000 r/min,10 min)后,置于50 ℃电热鼓风干燥箱烘干,粉碎后过100 目筛得到青香蕉淀粉。
1.3.2乳酸菌的培养与菌悬液制备[11]
将植物乳杆菌Lactobacillus菌种活化后,接种到MRS液体培养基中37 ℃过夜培养,以4 ℃、10 000 r/min离心15 min得到菌体,用pH 7.2磷酸盐缓冲液(phosphate buffered saline,PBS)清洗2 次后重新悬浮于PBS中,调整菌体浓度为109CFU/mL(以N0表示)。
1.3.3协同抗氧化性测定
将1 mL待测菌悬液、0.1 g青香蕉淀粉以及二者混合物分别加入到装有1 mL 0.2 mmol/L (无水乙醇配制)1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)溶液试管中,摇匀后于室温下避光放置30 min,离心后测定上清液在517 nm波长处的吸光度,用等体积PBS缓冲液代替样品为空白对照,按公式(1)计算样品对DPPH自由基的清除率[12]。每次实验重复3 次并取平均值。
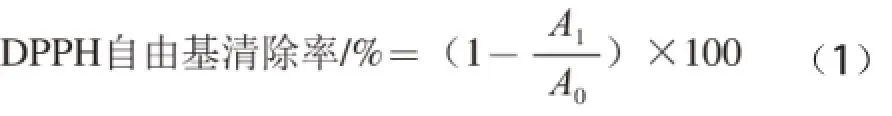
式中:A0为空白对照组的吸光度;A1为实验组的吸光度。
1.3.4淀粉-益生菌合生元的制备
采用Chotiko等[13]的方法并进行改进,将5 g青香蕉淀粉加入到50 mL制备好的菌悬液中,用漩涡混合仪混合均匀,在振荡器中室温缓慢振荡2 h后进行预冻(-20 ℃,24 h),预冻好的样品用真空冷冻干燥机进行冻干处理,研碎得到合生元粉。
1.3.5扫描电子显微镜观察结构
采用环境扫描电子显微镜(environmental scanning electron microscope,ESEM)进行淀粉颗粒外形观察。将各个样品均匀分散在带有固定胶的圆形托盘上,然后置于电子显微镜下进行观察、拍照[14]。
1.3.6青香蕉淀粉对乳酸菌冻干过程中活性的影响
对Jagannath等[15]的方法稍作修改进行活菌数的测定:冻干前菌液浓度为109CFU/mL(N0),冷冻干燥后,合生元粉恢复到室温,用无菌PBS缓冲液溶解并恢复到冻干前的体积,并继续用无菌PBS缓冲液进行梯度稀释,用含有0.75 g/100 mL碳酸钙的培养基进行浇注培养48 h后,平板计数,计算出等体积复原后的菌液浓度(N1),每次实验重复3 次并取平均值。以不加青香蕉淀粉直接冻干的菌粉和分别添加海藻糖、甘油作为保护剂冻干的菌粉作为对照,用公式(2)计算乳酸菌的存活率。
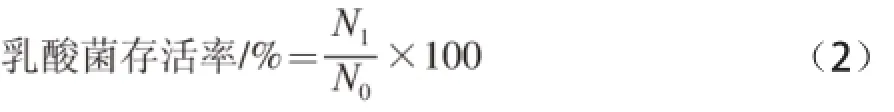
1.3.7合生元产品贮藏期稳定性实验
干燥的合生元粉真空包装并密封进行常温保存,分别于第2周和第4周测定其剩余活菌数,每一阶段样品乳酸菌存活率通过计算贮存前后活菌数比值表示。
1.3.8青香蕉淀粉对乳酸菌耐酸、耐胆盐性影响
调整乳酸菌菌悬液浓度为7.32×108CFU/mL,与等体积复原后的合生元溶液菌浓保持一致。对Cebeci等[16]的方法稍作修改进行耐酸水平测定:将复原后的合生元溶液和菌悬液分别取1 mL加入到9 mL无菌酸化的MRS液体培养基中(pH 2.0),培养2 h后取出,活菌数通过MRS琼脂培养基进行平板计数,计算出菌液浓度;对于耐胆盐性,将复原后的合生元溶液和原菌液分别取1 mL加入9 mL含有1 g/100 mL牛胆粉的液体MRS培养基中培养12 h,活菌数通过MRS琼脂培养基平板计数,计算出菌液浓度。
2 结果与分析
2.1青香蕉淀粉-乳酸菌协同抗氧化性
DPPH自由基是一种稳定的自由基,可溶解于乙醇,其溶液呈紫色,在517 nm波长处有强吸收。将自由基清除剂加入DPPH溶液中后吸收会减弱或消失,通过这种变化可以检测和评价某种物质的抗氧化能力[17]。在反应体系中分别加入乳酸菌菌体、青香蕉淀粉及二者混合物,测定三者对DPPH自由基的清除效果从而确定其抗氧化能力,结果如表1所示。
表1 乳酸菌、抗性淀粉及其混合物对DPPH自由基的清除能力TTaabbllee 11 DDPPPPHH ffrreeee rraaddiiccaall ssccaavveennggiinngg aaccttiivviittyy ooff llaaccttiicc aacciidd bbaacctteerriiaa,resistant starch and their mixture
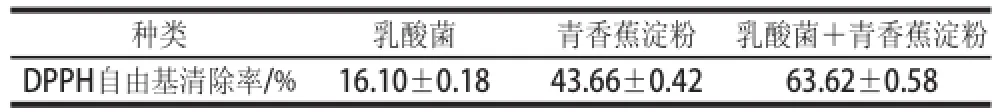
表1 乳酸菌、抗性淀粉及其混合物对DPPH自由基的清除能力TTaabbllee 11 DDPPPPHH ffrreeee rraaddiiccaall ssccaavveennggiinngg aaccttiivviittyy ooff llaaccttiicc aacciidd bbaacctteerriiaa,resistant starch and their mixture
种类乳酸菌青香蕉淀粉乳酸菌+青香蕉淀粉DPPH自由基清除率/%16.10±0.1843.66±0.4263.62±0.58
由表1可知,乳酸菌和青香蕉本身都表现出一定的清除DPPH自由基能力,分别达到16.10%和43.66%,将相同量的乳酸菌液和青香蕉淀粉混合均匀后缓慢振荡作用2 h,将得到的混合物加入到DPPH乙醇溶液反应后,测定DPPH自由基清除率达到了63.62%,高于乳酸菌和青香蕉淀粉各自的抗氧化能力,并且还略高于二者单独作用的DPPH自由基清除率之和,这说明乳酸菌和抗性淀粉不仅不会互相影响各自的抗氧化能力,可能还具有协同抗氧化的作用。
2.2ESEM观察乳酸菌和抗性淀粉的交互作用

图1 青香蕉淀粉(A)、淀粉-乳酸菌复合物冻干粉(BB)ESEM图(×5 000000)Fig. 1 Environmental scanning electron micrographs of unripe banana starch (A) and freeze-dried lactic acid bacteria adhered on unripe banana starch (B) (×5 000)
青香蕉淀粉与乳酸菌作用前后扫描电子显微镜结果如图1所示,青香蕉淀粉颗粒多为扁平状,表面光滑,和乳酸菌作用后,乳酸菌可以附着于淀粉的表面,形成物理屏障,这与其他研究者观察到益生菌与纤维附着方式相类似[18-19],这可能是淀粉能起到保护作用的原因之一。除此之外,还可以观察到部分淀粉表面出现一些轻微侵蚀,这表明抗性淀粉可以作为底物被乳酸菌利用且利用速率缓慢,抗性淀粉既可为乳酸菌生存生长提供营养源,又不会被过快利用使代谢产物过多积累,有利于延长冻干合生元粉的贮藏时间。淀粉结构基本保持完整,有利于抗性淀粉进入体内后益生功能的发挥[20]。
2.3青香蕉淀粉对乳酸菌冻干存活率的影响
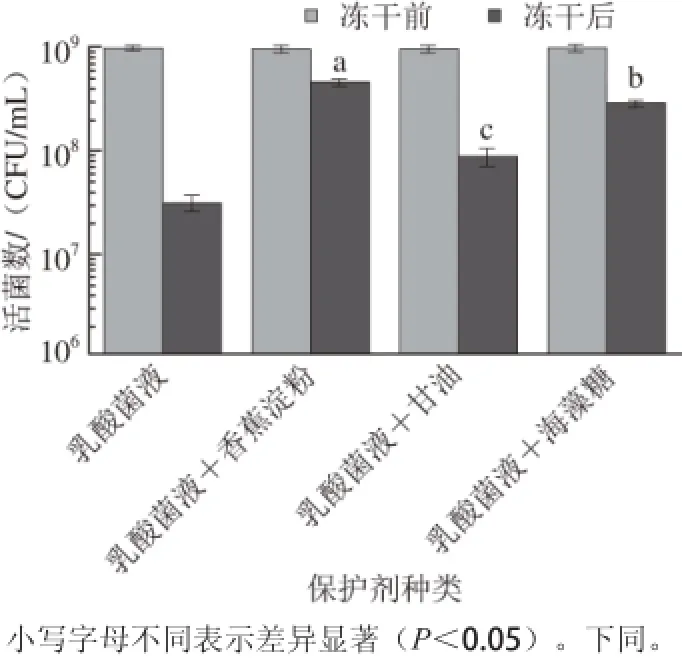
图2 添加不同保护剂的乳酸菌冻干后存活率(n==33)Fig. 2 Effect of protectants on survival rate of lactic acid bacteria after freeze drying (n = 3)
分别测定冻干过程中乳酸菌本身及其分别添加青香蕉淀粉、甘油和海藻糖作为保护剂的复合物中乳酸菌的存活率,其结果如图2所示。不添加保护剂直接将菌体冻干后,乳酸菌的活菌数严重下降,存活率仅有3.15%,添加不同保护剂后,与裸菌相比,复合物中乳酸菌存活率均显著提高(P<0.05)。添加甘油后乳酸菌存活率提高到8.85%,添加海藻糖存活率提高到29.30%,添加青香蕉淀粉后乳酸菌存活率提高最为显著,提高到73.17%,青香蕉淀粉对乳酸菌在冷冻干燥过程中的保护作用最佳,优于海藻糖和甘油做保护剂的效果。结合电子显微镜观察的结果,由于青香蕉淀粉起到了较好的物理屏障的功能,从而降低了乳酸菌细胞在冻干过程受到的损伤,使得存活率提高。
2.4青香蕉淀粉对乳酸菌耐酸耐胆盐能力的影响
乳酸菌本身以及与合生元粉的耐酸耐胆盐性测定结果见图3。耐酸耐胆盐是乳酸菌作为食补因子的重要指标之一[21]。胃酸和胆盐具有抗菌作用,益生乳酸菌随着食物进入口腔,经过胃和小肠,最终到达小肠末端。通常人体胃液pH值为3左右,空腹和食用酸性食品pH值可达2,食物通过胃的时间一般是1~2 h[22],通过胃液后存活的菌株将在小肠的上部遇到胆盐,故对胆盐具有抗性是它能够在肠道中生长、存活、发挥功效的另一个重要指标。
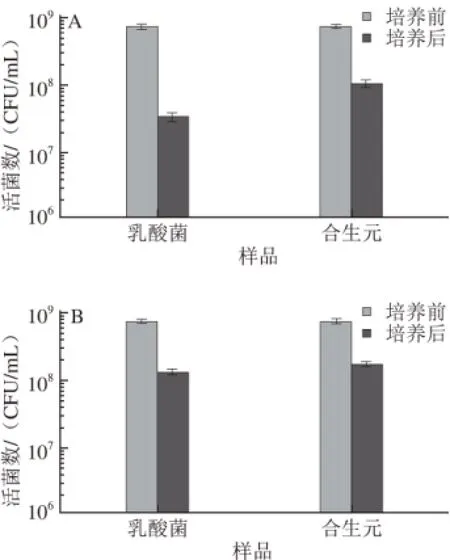
图3 青香蕉淀粉对乳酸菌耐酸性(A)和耐胆盐性(B)的影响(n=3)=3Fig. 3 Effect of unripe banana starch on acid tolerant (A) and bile-salt tolerant capacity (B) of lactic acid bacteria (n = 3)
由图3可知,乳酸菌在pH 2的环境中培养2 h后,活菌数由开始的7.32×108CFU/mL下降到3.41×107CFU/mL,存活率仅为4.6 5%,合生元粉溶液则从开始的7.32×108CFU/mL下降到1.06×108CFU/mL,存活率提高到了14.42%;在耐胆盐测试中,乳酸菌存活率由18.17%提高到23.47%。综上可以看出,青香蕉淀粉作为保护剂,与乳酸菌复合后有利于提高乳酸菌在酸性环境中和胆盐环境中的存活率,对耐酸性提高更为明显。有研究表明,冻干过程会使细胞质膜受到损伤,从而对酸性和胆盐环境变得敏感,胞内水分向外渗透,导致细胞受损[23],而添加青香蕉淀粉提高了乳酸菌对于酸性和胆盐环境的耐受力,可能是由于淀粉降低了冻干过程对乳酸菌细胞质膜的损伤,此外,淀粉可以与酸及胆盐作用[24],降低环境浓度,这也是潜在机理之一,其具体保护机制还有待进一步研究。
2.5青香蕉淀粉对冻干菌粉贮藏稳定性作用
经过1 个月的常温贮藏后,直接冻干的菌粉活菌数剩余4.35×107CFU/g,而合生元中剩余的活菌数仍然能达到7.32×108CFU/g。由图4可知,合生元体系中由于有青香蕉淀粉的保护作用,活菌数的下降速率比直接冻干的菌粉更为缓慢,提高了乳酸菌产品的稳定性。研究显示[25],菌粉存活率的下降与水分含量的上升具有一致性,青香蕉淀粉的存在可以稳定水分含量,提高耐贮藏性。在本研究中贮藏1 个月后剩余的活菌数远高于发挥乳酸菌益生作用所要求的106CFU/g,体现出很好的应用潜力。
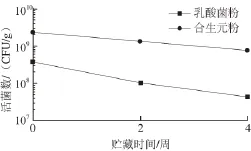
图4 青香蕉淀粉对乳酸菌贮藏稳定性的影响Fig. 4 Effect of unripe banana starch on the storage stability of lactic acid bacteria
3 结 论
通过实验结果可以看出,青香蕉淀粉对乳酸菌在冷冻干燥过程中起到很好的保护作用,效果优于海藻糖和甘油的添加,并且能显著提高冻干乳酸菌粉在贮藏期间的稳定性,可以作为益生菌的冻干保护剂。此外,青香蕉淀粉展现出自身的益生元特性,不仅可以和乳酸菌起到协同抗氧化作用,还有助于加强乳酸菌的耐酸性和耐胆盐性,提高其在胃肠道的存活率,从而更好的发挥体内益生特性。
[1] YING D Y, PHOON M C, SANGUANSRI L, et al. Microencapsulated Lactobacillus rhamnosus GG powders: relationship of powder physical properties to probiotic survival during storage[J]. Journal of Food Science,2010, 75(9): 588-595. DOI:10.1111/j.1750-3841.2010.01838.x.
[2] LIN W H, HWANG C F, CHEN L W, et al. Viable counts,characteristic evaluation for commercial lactic acid bacteria products[J]. Food Microbiology, 2006, 23(1): 74-81. DOI:10.1016/ j.fm.2005.01.013.
[3] SANTIVARANGKNA C, KULOZIK U, FOERST P. Effect of carbohydrates on the survival of Lactobacillus helveticus during vacuum drying[J]. Letter in Applied Microbiology, 2006, 42(3): 271-276. DOI:10.1111/j.1472-765X.2005.01835.x.
[4] FU N, CHEN X D. Towards a maximal cell survival in convective thermal drying processes[J]. Food Research International, 2011, 44(5): 1127-1149. DOI:10.1016/j.foodres.2011.03.053.
[5] GIULUO B D, ORLANDO P, BARBA G, et al. Use of alginate and cryo-protective sugars to improve the viability of lactic acid bacteria after freezing and freeze-drying[J]. World Journal of Microbiology & Biotechnology, 2005, 21(5): 739-746. DOI:10.1007/s11274-004-4735-2.
[6] ELIZABETH T, ESTEBAN G, ANDRES I, et al. Galactooligosaccharides as protective molecules in the preservation of Lactobacillus delbrueckii subsp. bulgaricus[J]. Cryobiology, 2011,62(2): 123-129. DOI:10.1016/j.cryobiol.2011.01.013.
[7] HONGPATTARAKERE T, RATTANAUBON P, BUNTIN N. Improvement of freeze-dried Lactobacillus plantarum survival using water extracts and crude fibers from food crops[J]. Food and Bioprocess Technology, 2013, 6(8): 1885-1896. DOI:10.1007/s11947-012-1018-z.
[8] 李丽, 邓海燕, 游向荣, 等. 香蕉抗性淀粉的制备及理化特性研究[J]. 中国食品添加剂, 2011(6): 148-152. DOI:10.3969/ j.issn.1006-2513.2011.06.019.
[9] ROBERTSON M D. Dietary-resistant starch and glucose metabolism[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2012, 15(4): 362-367. DOI:10.1097/MCO.0b013e3283536931.
[10] 张雅媛, 游向荣, 洪雁, 等. 青香蕉全粉与淀粉理化性质及消化特性研究[J]. 食品与机械, 2014, 30(4): 67-72. DOI:10.13652/ j.issn.1003-5788.2014.04.013.
[11] 吴均. 牦牛酸乳中优良乳酸菌 的筛选鉴定及发酵酸乳抗氧化特性研究[D]. 重庆: 西南大学, 2014.
[12] ZHANG Liming, ZHANG Shuang, DONG Feng, et al. Antioxidant activity and in vitro digestibility of dialdehyde starches as influenced by their physical and structural properties[J]. Food Chemistry, 2014,149(15): 296-301. DOI:10.1016/j.foodchem.2013.10.126.
[13] CHOTIKO A, SATHIVEL S. Effects of enzymatically-extracted purple rice bran fiber as a protectant of L. plantarum, NRRL B-4496 during freezing, freeze drying, and storage[J]. LWT-Food Science and Technology, 2014, 59(1): 59-64. DOI:10.1016/j.lwt.2014.05.056.
[14] 周中凯, 陈晓姗, 郑排云. 多孔网状淀粉结晶体的形态观察及性质研究[J]. 粮食与饲料工业, 2014, 8(7): 23-26. DOI:10.7633/ j.issn.1003-6202.2014.08.007.
[15] JAGANNATH A, RAJU P S, BAWA A S. Comparative evaluation of bacterial cellulose (nata) as a cryoprotectant and carrier support during the freeze drying process of probiotic lactic acid bacteria[J]. LWTFood Science and Technology, 2010, 43(8): 1197-1203. DOI:10.1016/ j.lwt.2010.03.009.
[16] CEBECI A, G☒RAKAN C. Properties of potential probiotic Lactobacillus plantarum strains[J]. Food Microbiology, 2003, 20(5): 511-518. DOI:10.1016/S0740-0020(02)00174-0.
[17] 刘宏宇, 汪立平, 艾连中, 等. 乳酸菌的抗氧化活性和耐酸耐胆盐性能的研究[J]. 食品工业科技, 2014, 35(2): 92-99.
[18] MICHIDA H, TAMALAMPUDI S, PANDIELLA S S, et al. Effect of cereal extracts and cereal fiber on viability of Lactobacillus plantarum under gastrointestinal tract conditions[J]. Biochemical Engineering Journal, 2006, 28(1): 73-78. DOI:10.1016/j.bej.2005.09.004.
[19] GUERGOLETTO K B, MAGNANI M, MARTIN J S, et al. Survival of Lactobacillus casei (LC-1) adhered to prebiotic vegetal fibers[J]. Innovative Food Science & Emerging Technologies, 2010, 11(2): 415-421. DOI:10.1016/j.ifset.2009.11.003.
[20] 周中凯, 陈晓姗, 张岩, 等. 淀粉结构调控大肠微生物发酵生产丁酸的机制研究[J]. 食品工业科技, 2014, 35(4): 199-203.
[21] 靳志强, 王延祥, 李平兰, 等. 植物乳杆菌耐酸耐胆盐的体外试验及其降胆固醇作用[J]. 中国食品学报, 2009, 9(5): 24-28. DOI:10.3969/ j.issn.1009-7848.2009.05.004.
[22] 赵瑞香, 李元瑞, 孙俊良. 嗜酸乳杆菌在模拟胃肠环境中抗性的研究[J]. 微生物学通报, 2002, 29(2): 35-38. DOI:10.3969/ j.issn.0253-2654.2002.02.010.
[23] GOLOWCZYC M A, SILVA J, TEIXEIRA P, et al. Cellular injuries of spray-dried Lactobacillus spp. isolated from kefir and their impact on probiotic properties[J]. International Journal of Food Microbiology,2011, 144(3): 556-560. DOI:10.1016/j.ijfoodmicro.2010.11.005.
[24] 靳志强, 王延祥. 小米提取物对乳杆菌耐胆盐能力的影响[J]. 食品科学, 2008, 29(8): 414-417. DOI:10.3321/ j.issn:1002-6630.2008.08.094.
[25] BAUERA S A, SCHNEIDER S, BEHR J, et al. Combined influence of fermentation and drying conditions on survival and metabolic activity of starter and probiotic cultures after low-temperature vacuum drying[J]. Journal of Biotechnology, 2012, 159(4): 351-357. DOI:10.1016/j.jbiotec.2011.06.010.
Protective Effect of Unripe Banana Starch on Viability of Lactobacillus plantarum during Freeze-Drying and Storage
ZHOU Zhongkai, WANG Junxuan, LI Ying
(College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China)
This research investigated unripe banana starch as a protectant for Lactobacillus plantarum during the freeze drying process and its effect on acid and bile salt tolerance and storage stability of the lactic acid bacterium, as well as their synergistic antioxidant effect aiming to provide an idea and theoretical foundation for deep processing, development and probiotic bacterial protection of banana. Unripe banana starch from low maturity banana contained higher level of type 2 resistant starch. The experimental results indicated that unripe banana starch had synergistic antioxidant effect with Lactobacillus plantarum in scavenging 63.62% of 1,1-diphenyl-2-picrylhydrazyl (DPPH) free radicals, which was higher than the sum of their individual effects. The lactic acid bacterium could attach to the surface of the starch granules to use it slowly as a nutrient source. Meanwhile, unripe banana starch could significantly increase survival rate (up to 73.17%)of Lactobacillus plantarum during freeze drying, and its protective effect was better than that of glycerol and mycose,respectively. This study also suggests the potential of unripe banana starch to increase the tolerance of Lactobacillus plantarum to acid and bile salt, and enhance of the stability of synbiotic products.
probiotic viability; unripe banana starch; lactic acid bacteria; freeze-drying; protective effect
10.7506/spkx1002-6630-201615024
TS231
A
1002-6630(2016)15-0144-05
10.7506/spkx1002-6630-201615024. http://www.spkx.net.cn
10.7506/spkx1002-6630-201615024. http://www.spkx.net.cn
2015-09-20
国家自然科学基金面上项目(31471701)
周中凯(1964—),男,教授,博士,研究方向为谷物科学与营养。E-mail:zkzhou@tust.edu.cn
引文格式:

