乳清分离蛋白凝胶蔗糖释放过程的动力学分析
任 艳,李 娟,何莲君,董文明,和劲松*
(云南农业大学食品科学技术学院,云南 昆明 650201)
乳清分离蛋白凝胶蔗糖释放过程的动力学分析
任 艳,李 娟,何莲君,董文明,和劲松*
(云南农业大学食品科学技术学院,云南 昆明 650201)
以蔗糖为食品风味成分,封装于乳清分离蛋白凝胶内,探讨pH值、温度、载药量、释放液离子浓度对乳清分离蛋白凝胶释放蔗糖的动力学机制。结果表明:蔗糖在乳清分离蛋白凝胶中的释放过程符合Korsmeyer-Peppas模型,且拟合相关系数R2在0.95~0.99之间,扩散常数n均小于0.45,符合Fick扩散机理。动力学常数K随pH值、温度、以及释放液离子浓度(0.05~0.10 mol/L)的增加而增大,随载药量的增加而减小。乳清分离蛋白凝胶具有环境应答性,以其为载体的物质释放过程受环境温度、pH值、载药量、释放液离子浓度等因素影响。通过调节释放体系的pH值、温度、载药量、释放液离子浓度可以达到控制载物释放的目的。
乳清分离蛋白;凝胶;释放特性;动力学
任艳, 李娟, 何莲君, 等. 乳清分离蛋白凝胶蔗糖释放过程的动力学分析[J]. 食品科学, 2016, 37(15): 13-18. DOI:10.7506/spkx1002-6630-201615003. http://www.spkx.net.cn
REN Yan, LI Juan, HE Lianjun, et al. Kinetics of sugar release from whey protein isolate gel[J]. Food Science, 2016, 37(15): 13-18. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201615003. http://www.spkx.net.cn
乳清分离蛋白(whey portein isolate,WPI)是干酪生产的副产品,在许多食品产品中被广泛用作功能性成分[1-2],因其纯度高、吸收率好、氨基酸组合最合理等诸多优势被推为“蛋白之王”。WPI作为蛋白质替代原料,可降低成本、提高营养价值、改善产品质量[3-5]。凝胶化是WPI的一个重要功能特性,可赋予食品特殊结构和质地[6-10],因其拥有良好的加工特性,可作为功能性成分的载体[11-16]。蔗糖来源广泛、价格便宜而其本身又可作为食品中的有益成分,对食品的安全和风味等固有特性影响较少,在工业化大规模利用上前景广阔[17]。研究表明,利用WPI的凝胶特性,在适合的条件下制备以WPI为壁材的微胶囊,可以对功能性成分进行包埋并实现肠溶释放[18]。但国内对以食品风味成分封装乳清分离蛋白凝胶释放过程的动力学研究尚未见报道,因此本实验用乳清分离蛋白凝胶对蔗糖进行封装,对乳清分离蛋白凝胶释放特性影响因素(pH值、温度、离子浓度等)及动力学机理进行研究,以期为WPI在新型凝胶食品开发、功能性成分的无损封装以及控制释放等现代食品科学技术领域的应用提供理论参考。
1 材料与方法
1.1材料与试剂
WPI(蛋白质含量>95%) 美国Le Sueur Cheese公司。
蔗糖、磷酸二氢钠、磷酸氢二钠、冰乙酸、碳酸钠、氢氧化钠 天津市风船化学试剂科技有限公司;苯酚、浓硫酸 西陇化工股份有限公司;无水乙酸钠广东光华化学厂有限公司;牛血清白蛋白(bovine serum albumin,BSA) 上海源叶生物科技有限公司。
1.2仪器与设备
PL303型电子天平、FE20型实验室pH计 梅特勒-托利多仪器(上海)有限公司;WFJ7200型可见分光光度计 尤尼柯(上海)仪器有限公司;601超级恒温水浴锅 江苏省金坛市医疗仪器厂;TGL-16C高速离心机上海安亭科学仪器厂;XK96-A快速混匀器 姜堰市新康医疗器械有限公司;TTL-10B超纯水器 北京同泰联科技发展有限公司;D-160均质机 郑州南北仪器设备有限公司。
1.3方法
1.3.1蔗糖封装的WPI热凝胶制备
准确称取16 g WPI和所需蔗糖用量放入烧杯中,加入100 mL蒸馏水,玻璃棒混匀后用均质机处理10 min,使其充分溶解,用自封袋密封, 4 ℃条件下放置12 h后,在85 ℃恒温水浴锅中水浴25 min制成蛋白凝胶,于冰水混合物中迅速冷却后,用刀片切分成1 cm×1 cm×1 cm的正方体凝胶块。
1.3.2静态释放实验
为了探讨释放环境对WPI凝胶释放特性影响因素及其动力学规律,建立pH值、温度、释放液离子浓度(本实验中用磷酸盐缓冲液作为释放液)、载药量静态释放体系。
1.3.2.1pH值静态释放体系
准确称取16 g WPI和0.06 g蔗糖按1.3.1节方法制成凝胶,将切分好的WPI凝胶块分别浸泡于20.0 mL,20 ℃(恒温水浴锅控温)、0.05 mol/L,pH 2.0、3.0、4.0、 5.0、6.0、7.0、8.0的磷酸盐缓冲液中,释放30 min,每隔5 min取释放液1 mL测定一次蔗糖质量浓度,同时向释放液体系补充1 mL新缓冲液,以维持释放体系的体积不变。
1.3.2.2温度静态释放体系
按1.3.2.1节设置释放体系,控制pH 6.0,磷酸盐缓冲液离子浓度为0.05 mol/L,载药量(蔗糖,下同)为0.6 mg/mL,设置体系温度(电冰箱控温)分别为4、20、30、40、50 ℃,研究温度对WPI凝胶释放特性的影响。
1.3.2.3释放液离子浓度静态释放体系
按1.3.2.1节设置释放体系,控制pH 6.0、温度20 ℃、载药量为0.6 mg/mL,控制磷酸盐缓冲液浓度分别为0.05、0.10、0.15、0.20 mol/L,研究释放液离子浓度对WPI凝胶释放特性的影响。
1.3.2.4载药量静态释放体系
按1.3.2.1节设置释放体系,控制pH 6.0、温度20 ℃、磷酸盐缓冲液离子浓度为0.05 mol/L,设置载药量分别为0.2、0.4、0.6、0.8、1.0 mg/mL,研究载药量对WPI凝胶释放特性的影响。
1.3.3蔗糖标准曲线绘制
参考Rajeshwair等[19]的方法,配制质量浓度为100 ☒g/mL蔗糖标准溶液。取6 支25 mL试管,分别吸取0.2、0.4、0.6、0.8、1.0 mL的蔗糖标准溶液,按顺序向试管中加入体积分数6%的苯酚1.0 mL,摇匀,再沿管壁在5~20 s内加入5.0 mL浓硫酸,静置10 min后摇匀,室温放置20 min,于490 nm波长处测定其吸光度,以蔗糖质量浓度为横坐标,吸光度为纵坐标,绘制蔗糖标准曲线,得到线性回归方程:y=0.009 1x-0.004(R2=0.998 8)。
1.3.4释放液中蔗糖质量浓度测定
吸取1 mL释放液,按1.3.3节中蔗糖质量浓度测定方法加入苯酚、浓硫酸反应后于490 nm波长处测定其吸光度,平行测定3 次,取平均值。
1.3.5动力学参数分析方法
为了分析释放过程,通常运用动力学模型来描述释放动力学机理,而Korsmeyer-Peppas模型是用来分析活性成分在多孔材料中释放最为理想的模型[20]。公式如下:

式中:X为累积释放分数/%;t为释放时间/min;n为扩散常数;K为动力学常数。
由n来决定动力学机理:当n≤0.45时,活性成分释放机理符合Fick扩散机理;当0.45<n<0.89时,符合非Fick扩散机理;当n≥0.89时,符合以骨架溶蚀为主的机理。累积释放分数(X)计算公式如下:

式中:mt是时间t时刻的释放总量/(μg/mL);m0是释放所用凝胶块的载药量/(mg/mL);Atotal是凝胶的总载药量/(mg/mL);Vdisk是释放所用凝胶块的体积/mL;Vtotal是最初配制WPI溶液的体积/mL。通过对不同时刻t释放液中活性成分质量浓度进行测定,可以得累积释放分数X,用(1)式对累积释放分数进行拟合,分析可得释放过程动力学参数。
1.4数据分析
应用Excel进行绘图及显著性分析,显著性水平选取α=0.05,结果以表示。用Origin软件进行动力学拟合分析。
2 结果与分析
2.1蔗糖释放的饱和时间、饱和质量浓度
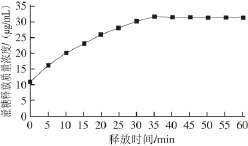
图1 WPI释放液中蔗糖质量浓度的变化Fig. 1 Time course of sucrose release from whey protein isolate gel
蔗糖在WPI凝胶中的释放质量浓度变化如图1所示,随着时间的推移,释放量先上升,后趋于平衡,存在一个饱和点。
对蔗糖释放质量浓度上升的部分和趋于饱和的部分分别添加趋势线(图2),两条趋势线相交处的对应时间即为释放饱和时间,对应释放质量浓度即为释放饱和质量浓度。
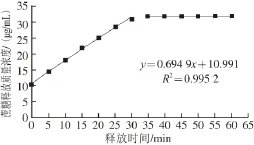
图2 WPI释放液中蔗糖释放饱和时间、饱和质量浓度的计算Fig. 2 Calculation of saturated time and saturation concentration during the release of sucrose
2.2pH值对WPI凝胶释放特性的影响及动力学分析
pH值是生理、生物和化学系统中的重要影响因素。不同pH值条件下蔗糖在WPI凝胶中的释放质量浓度变化曲线如图3所示。

图3 pH值对WPI凝胶释放特性的影响Fig. 3 Effect of pH on release properties of WPI gel
由图3可知,在释放前期蔗糖的释放质量浓度逐渐增大,随着释放时间延长释放速率逐渐减慢到释放后期蔗糖释放质量浓度逐渐饱和。
为了进一步说明不同pH值条件下蔗糖的释放变化,对释放过程中蔗糖的饱和时间、饱和质量浓度、释放比率进行了分析(表1)。
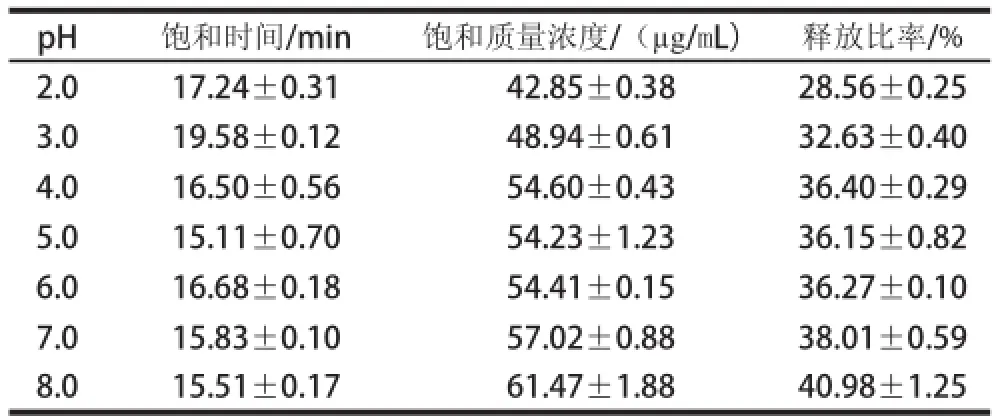
表1 不同pH值条件下蔗糖释放过程的特征参数Table 1 Characteristic parameters for sucrose release process under different pH conditions
由表1可知,pH值在2.0~8.0时,随着pH值的升高,蔗糖释放饱和质量浓度、释放比率均逐渐增大,但释放饱和时间与pH值的相关性不大。
为了探明不同pH值下蔗糖释放过程的动力学机理,按式(1)对不同pH值条件下,蔗糖的累积释放分数进行动力学拟合分析(图4)。由图4可知,各组实验数据点与模型拟合曲线基本吻合。
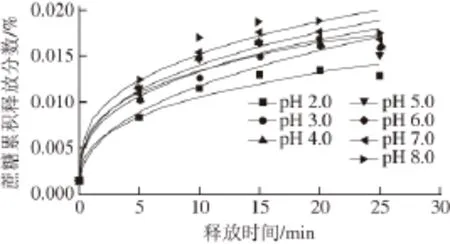
图4 不同pH值条件下蔗糖释放过程的动力学拟合Fig. 4 Dynamic fitting of sucrose release process under different pH conditions
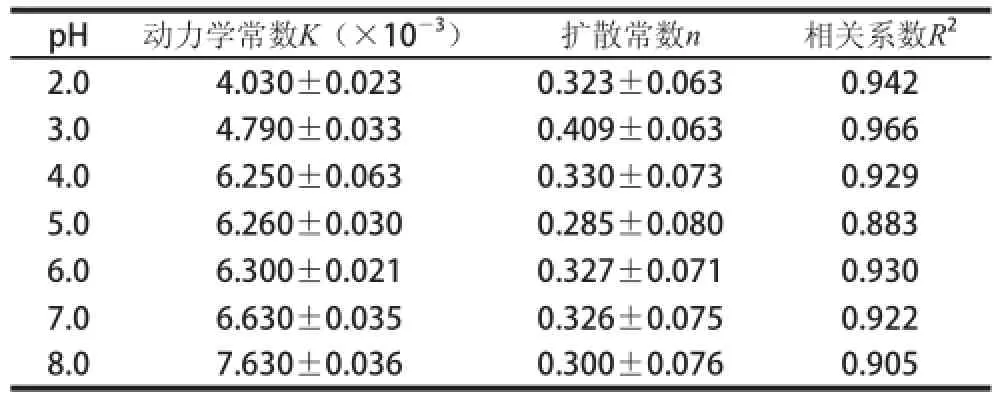
表2 不同pH值条件下蔗糖释放过程的动力学拟合参数Table 2 Kinetic fitting parameters for sucrose release process under different pH conditions
由表2可知,随着pH值的升高,蔗糖释放的动力学常数K逐渐增大,扩散常数n均小于0.45,符合Fick扩散,相关系数R2均大于0.88。
实验结果表明,随着pH值的升高,蔗糖释放饱和质量浓度、释放比率逐渐增大;动力学常数逐渐增大,表现出显著的酸碱敏感性。这可能是由于pH值的增大使WPI凝胶中凝胶网络发生变化引起的。凝胶在偏碱性的缓冲溶液中的溶胀程度比在酸性缓冲溶液中的溶胀程度大得多,溶胀程度大的凝胶网络上的间隙比较大,有利于药物从凝胶中释放出来[21-22]。因此,凝胶中药物的释放速率常数较高。George等[23]以海藻酸钠和瓜尔胶为原料,合成了具有酸碱敏感性的水凝胶,并以BSA为模型药物,结果表明,水凝胶在pH 1.2~7.4间具有较好的酸碱敏感性,且具有较好的控制释放效果。本实验的研究结果表明乳清白蛋白凝胶在pH 2.0~8.0间具有酸碱敏感性,且pH 7~8间控制释放效果较好,但酸碱敏感性与George等[23]的研究结果存在差异,这可能是乳清分离蛋白与海藻酸钠、瓜尔胶的结构不同造成的。Kumar等[24]采用悬浮聚合法制成了基于聚乙二醇二甲基丙烯酸酯和甲基丙烯酸的凝胶微球,并研究了其在不同pH值条件下对胰岛素的释放过程,发现pH 2.5时,胰岛素的释放量仅为18%~25%;而在pH 7.4时,胰岛素的释放量有显著增加,本实验的研究结果与其研究结果一致。
2.3不同温度对WPI凝胶释放过程的影响及动力学分析
温度是生理、生物和化学系统中的重要因素,热诱导形成的凝胶其性质会随周围环境温度变化而改变。不同温度下蔗糖在WPI凝胶中释放质量浓度变化如图5所示。
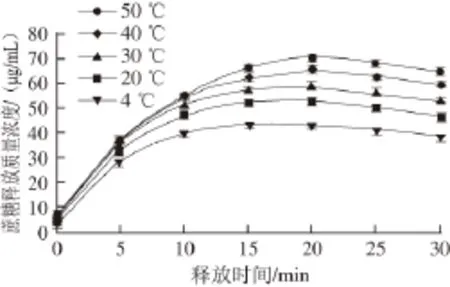
图5 温度对WPI凝胶释放特性的影响Fig. 5 Effect of temperature on release characteristics of WPI gel
由图5可知,随着温度的升高,蔗糖的释放质量浓度逐渐增大。在释放前期蔗糖的释放速率快,随着释放时间的推移,释放速率逐渐减慢,最后趋于饱和。
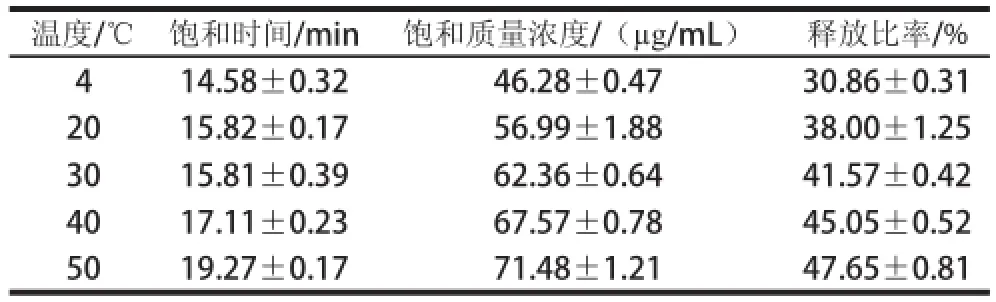
表3 不同温度条件下蔗糖释放过程的特征参数Table 3 Characteristic parameters for sucrose release process at different temperatures
由表3可知,蔗糖的释放质量浓度随着温度的升高而逐渐增大。饱和质量浓度、饱和时间以及释放比率,都随着释放体系温度的升高而增大,在50 ℃条件下,蔗糖释放的饱和质量浓度及释放比率高于其他组。
对不同温度下蔗糖的累积释放分数按式(1)进行动力学拟合分析,结果见表4。
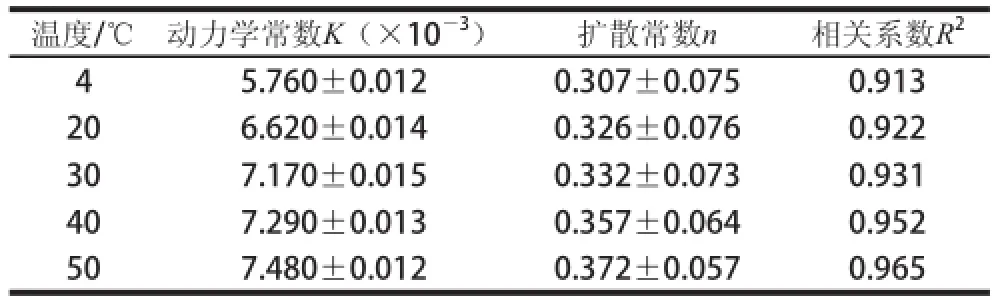
表4 不同温度下蔗糖释放过程的动力学拟合参数Table 4 Kinetic fitting parameters for sucrose release process at different temperatures
由表4可知,随着温度的升高,蔗糖释放的动力学常数K逐渐增大,扩散常数n均小于0.45,相关系数R2均大于0.9。
蔗糖释放的饱和质量浓度、饱和时间以及释放比率,都随着释放体系温度的升高而不断增大(表3),表现出较高的温度敏感性;动力学常数K也随着温度的升高逐渐增大(表4)。这可能是由两方面原因造成的,一是载物在高温时,分子自由扩散运动加快,从而使扩散速率加快;二是由于温度的升高,凝胶会胀开,乳清分离蛋白四级结构伸展,结构变得疏松,从而加速释放,同时增加了释放量,导致WPI凝胶在高温时的释放比率明显高于低温时的释放比率[25]。杨桔[26]的研究发现,载药凝胶在37 ℃时的释放速率明显高于25 ℃时的释放速率,表现出显著的温度敏感性;潘婷婷[27]研究发现,当释放温度从20 ℃升高到40 ℃时,最大释放量也随之增大。本研究中释放温度从4 ℃升高到50 ℃时,蔗糖的释放量逐渐增大,与杨桔[26]和潘婷婷[27]的研究结果一致。说明WPI凝胶与其他载物凝胶一样具有显著的温度敏感性。
2.4不同磷酸盐缓冲液离子浓度对WPI凝胶释放影响及动力学分析
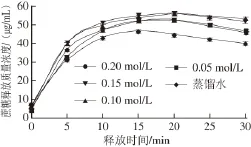
图6 离子浓度对WPI凝胶释放特性的影响Fig. 6 Effect of ion concentration on release characteristics of WPI gel
由图6可知,在释放的前10 min,蔗糖的释放速率快,释放量大,在10 min以后,蔗糖释放速率逐渐减慢,最后慢慢达到饱和。

表5 不同释放液离子浓度条件下蔗糖释放的特征参数Table 5 Characteristic parameters of sucrose release under different liquid-releasing concentrations
由表5可知,释放液离子浓度在0.05~0.15 mol/L范围内,蔗糖释放的饱和时间在0.10 mol/L的释放液中最短;饱和质量浓度以及释放比率,都随着释放液离子浓度的增加而增大,当释放液离子浓度超过0.15 mol/L时,蔗糖释放的饱和质量浓度以及释放比率反而降低。
对不同释放液离子浓度下蔗糖的累积释放分数按式(1)进行动力学拟合分析,结果见表6。
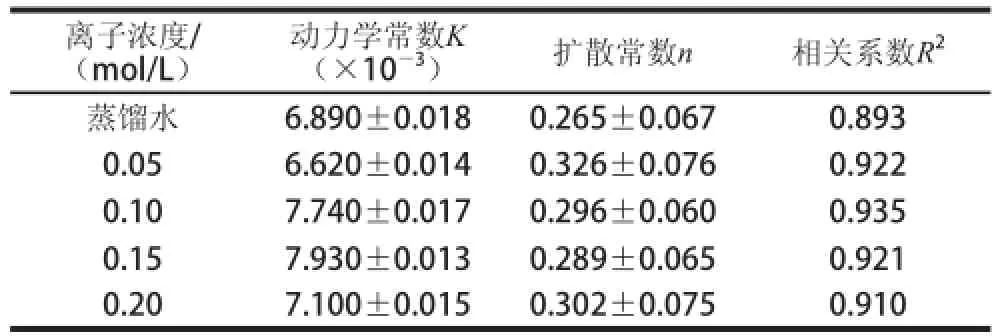
表6 不同释放液离子浓度下蔗糖释放过程的动力学拟合参数Table 6 Kinetic fitting parameters of sucrose-releasing process under different liquid-releasing concentrations
由表6可知,蔗糖释放的动力学常数K随着释放液离子浓度的增加逐渐增大,扩散常数n均小于0.45,符合Fick扩散机理,相关系数R2均大于0.89。
蛋白凝胶在释放介质具有较低离子强度下有较大的溶胀率,此时凝胶网络具有较好的可扩展性,使得载物易于从凝胶内部释放出来。而随着释放介质离子强度的逐渐增大,蛋白凝胶中高分子链变得卷曲,分子链的卷曲增强了分子内疏水缔合,大分子链间相互作用增强,使分子链更为卷曲,因而凝胶与水分子之间的相互作用力逐渐减小,凝胶的溶胀率逐渐下降,导致载物不容易从凝胶中释放出来,从而释放速率下降[28-29]。这说明在一定范围内增加释放介质中释放液离子浓度可以增大活性成分的释放量,改变释放介质的离子浓度可以改变载物的释放动力学机制[30-32]。
2.5不同载药量对WPI凝胶释放过程的影响及动力学分析
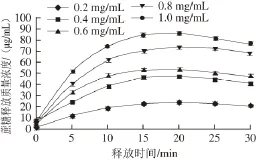
图7 载药量对WPI凝胶释放特性的影响Fig. 7 Effect of drug loading on release characteristics of WPI gel
由图7可知,随着载药量的增加,蔗糖的释放质量浓度逐渐增大;在释放前期随着载药量增加,释放速率逐渐增大,在释放15 min以后,蔗糖释放质量浓度逐渐减慢,最后趋于饱和。
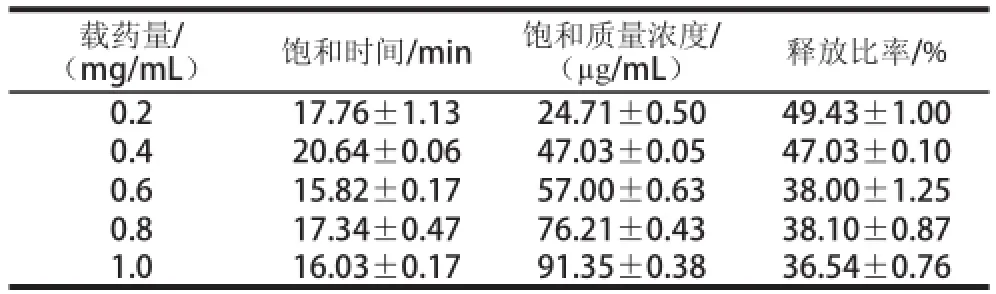
表7 不同载药量条件下蔗糖释放过程的特征参数Table 7 Characteristic parameters for sucrose release process under different loading levels
由表7可知,载药量0.2~1.0 mg/mL范围内,蔗糖释放的饱和时间与载药量的相关性不大;饱和质量浓度随着载药量的增加而增大;释放比率则随着蔗糖载药量的增加而逐渐降低。
对不同载药量条件下蔗糖的累积释放分数按式(1)进行动力学拟合得到特征参数,结果见表8。
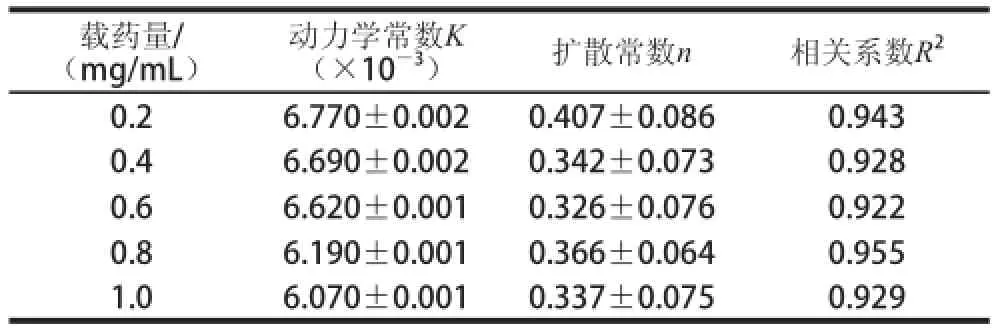
表8 不同载药量条件下蔗糖释放过程的动力学拟合参数Table 8 Kinetic fitting parameters for sucrose release process under different loading levels
如表8所示,随着载药量的增加,蔗糖释放的动力学常数K逐渐降低;扩散常数n均小于0.45;相关系数R2均大于0.9。
实验结果表明,蔗糖释放的饱和质量浓度随着载药量的增加而增大,释放比率则随着载药量的增加而逐渐降低(表7)。这可能是由于载药量的增大使乳清分离蛋白凝胶网络变得疏松多孔,使前期药物突释引起的。蔗糖的释放速率和动力学常数则随着载药量的增加而降低(表8),这是因为载药的质量浓度越大,溶液越黏稠,形成凝胶的结构越致密,对药物的包埋作用越强,所以药物从凝胶中释放出来的速率就越慢,释放比率就会越低。随着载药量增加,载药释放速率逐渐下降,这可能是因为载药质量浓度越大,耐水性越强,交联密度越高,凝胶的骨架越紧密,溶胀性变小,使进入微球的水量减少,药物的释放速率逐渐减慢[33-35]。载药量的改变使得释放速率改变,从而使动力学机制也随之改变。
3 结 论
蔗糖在乳清分离蛋白凝胶中的释放过程符合Korsmeyer-Peppas模型,且拟合相关系数R2在0.95~0.99之间,扩散常数n均小于0.45,符合Fick扩散机理,动力学常数K(即释放速率)随pH值、温度、以及释放液离子浓度的增加不断增大,随载药量的增加而不断减小。WPI凝胶具有环境应答性,以其为载体的物质释放过程受环境的pH值、温度、载药量、释放液离子浓度等因素影响,通过调节释放体系的pH值、温度、载药量、释放液离子浓度可以达到控制载物释放的目的。本研究结果可为乳清分离蛋白在新型凝胶食品开发、功能性成分的无损封装以及控制释放、靶向给药等现代食品科学技术领域的应用提供理论依据。
[1] HE J S, RUAN K C. Kinetics of phase separation during pressureinduced gelation of a whey protein isolate[J]. Food Hydrocolloids,2009, 23 (7): 1729-1733. DOI:10.1016/j.foodhyd.2009.02.003.
[2] HE J S, YANG H W, WAN P Z. Kinetics of microstructure formation of high-pressure induced gel from a whey protein isolate[R]. Tokyo: Joint AIRAPT-22 & HPCJ-50 International Conference on High Pressure Science and Technology, 2010. DOI:10.1088/1742-6596/215/1/012169.
[3] 卢晓明, 王静波, 任发政. 乳清分离蛋白在食品工业中的应用[J]. 食品科学, 2010, 31(1): 262-267.
[4] 李飞, 刘红娟, 王龙.乳清蛋白功能活性的研究[J]. 中国酿造, 2015,34(7): 20-23. DOI:10.11882/j.issn.0254-5071.2015.07.005.
[5] 朱培, 莫蓓红, 刘振民. 乳清生物技术处理研究进展[J]. 食品工业科技, 2014, 35(9): 355-359.
[6] 和劲松, 于勇, 木泰华. 高压诱导乳清分离蛋白质凝胶化中相分离过程的动力学研究[C]//中国食品科学技术学会第七届年会论文摘要集. 北京: 中国食品科学技术学会年会, 2010: 123-124.
[7] 何莲君, 任艳, 董文明, 等. 乳清分离蛋白凝胶释放特性的研究[C].中国食品科学技术学会第十一届年会论文摘要集. 杭州: 中国食品科学技术学会年会, 2014: 169.
[8] de WIT J N. Nutritional and functional characteristics of whey proteins in food products[J]. Journal of Dairy Science, 1998, 81(3): 597-608. DOI:10.3168/jds.S0022-0302(98)75613-9.
[9] SANTIAGO L G, GONZ☒LEZ R J, REMONDETTO G E. Emulsifying ability of proteins evaluated by response surface methodology[J]. LWT-Food Science and Technology, 1998, 31(3): 259-264. DOI:10.1006/fstl.1997.0351.
[10] 张久龙, 孟祥晨, 桂仕林. 乳清分离蛋白冷凝胶形成机理的研究进展[J]. 食品科学, 2008, 29(10): 641-644.
[11] HE J S, MU T H. Application of an artificial neural network for predicting the texture of whey protein gel induced by high hydrostatic pressure[M]. CoBerlin: Springer, 118-125. DOI:10.9734/ BJAST/2012/641.
[12] 胡国华. 功能性食品胶[M]. 2版. 北京: 化学工业出版社, 2004: 196-210.
[13] QIU Y, PARK K. Environment-sensitive hydro gels for drug delivery[J]. Advanced Drug Delivery Reviews, 2001, 53: 321-339.
[14] CHEN L Y, REMONDETTO G E, SUBIRADE M. Food proteinbased materials as nutraceutical delivery systems[J]. Trends in Food Science & Technology, 2006, 17(5): 272-283. DOI:10.1016/ j.tifs.2005.12.011.
[15] HE J S, MU T H, WANG J. A comparative in vitro study of the digestibility of heat- and high pressure-induced gels prepared from industrial milk whey proteins[J]. High Pressure Research, 2013, 33(2): 328-335. DOI:10.1080/08957959.2013.780056.
[16] HE J S, NORIHIRO A, HAGIWARA T. Effects of sugars on the cross-linking formation and phase separation of high-pressure induced gel of whey protein from bovine milk[J]. Bioscience, Biotechnology,and Biochemistry, 2006, 70(3): 615-625. DOI:10.1271/bbb.70.615.
[17] 谭龙飞, 文毓, 黄永杰, 等. 以壳聚糖、麦芽糊精和蔗糖为壁材制备肉桂醛微胶囊[J]. 食品科学, 2006, 27(1): 115-118. DOI:10.3321/ j.issn:1002-6630.2006.01.025.
[18] 刘飞, 杜秉健, 张春月. 乳清分离蛋白胶体物化特性的应用研究进展[J]. 食品安全质量检测学报, 2014, 5(6): 1577-1582.
[19] RAJESHWAIR K V, BALAKRISHNAN M, KANSAL A. State-of-theart of anaerobic digestion technology for industrial waster treatment[J]. Renewable & Sustainable Energy Reviews, 2000, 4(2): 135-156.
[20] 张晓彤, 梁俊虎, 任创. 功能化SBA-15在药物阿司匹林释放的动力学模型[J]. 石油化工高等学校学报, 2012, 25(2): 1-4.
[21] 季兴敏. 环境敏感水凝胶的溶胀动力学理论及药物释放动力学研究[D]. 武汉: 武汉理工大学, 2007: 37-45.
[22] WANG Z C, XU X D, CHEN C S. Study on novel hydrogels based on thermosensitive PNIPAAm with pH sensitive PDMAEAM grafts[J]. Biomaterials, 2008, 23(67): 245-252. DOI:10.1016/ j.colsurfb.2008.09.002.
[23] GEORGE M, ABRAHAM T E. pH sensitive alginate-guar gum hydrogel forthe controlled delivery of protein drugs[J]. International Journal of Pharmaceutics, 2007, 35(33): 123-129. DOI:10.1016/ j.ijpharm.2006.11.009.
[24] KUMAR A, SITANSHU S L, HARPAL S. Developmen t of PEGDMA: MAA based hydrogel microparticles for oral insulin delivery[J]. International Journal of Pharmaceutics, 2006, 323(1): 117-124. DOI:10.1016/j.ijpharm.2006.05.050.
[25] 王杨云. 环境刺激响应性聚醚氨酯的设计合成及其性能研究[D].天津: 南开大学, 2013: 93-95.
[26] 杨桔. PLGA微球/P(NIPAAm-co-AAm)水凝胶复合体系的构建及药物释放性能研究[D]. 重庆: 重庆大学, 2011: 55-56.
[27] 潘婷婷. 温度和pH双重响应性水凝胶的制备及其药物控制释放研究[D]. 合肥: 中国科学技术大学, 2011: 44-48.
[28] LO Y L, HSU C Y, LIN H R. pH-and thermo-sensitive pluronic/ poly(acrylic acid) in situ hydrogels for sustained release of an anticancer drug[J]. Journal of Drug Targeting, 2013, 21(1): 54-66. DOI:10.3109/1061186X.2012.725406.
[29] ZHANG X Z, WU D Q, CHU C C. Synthesis and characterization of partially biodegradable, temperature and pH sensitive Dex-MA/ PNIPAAm hydrogels[J]. Biomaterials, 2004, 43(25): 4719-4730. DOI:10.1016/j.biomaterials.2003.11.040.
[30] JALIL R, FERDOUS A J. Effect of viscosity increasing agent and electrolyte concentration on the release rate of theophylline from a hpmc based sustained release capsules[J]. Drug Development and Industrial Pharmacy, 1993, 19(19): 2637-2643. DOI:10.3109/03639049309047206.
[31] TSUNEO H, DENJI S, YOU Y. Factors affecting dissolution rate of sulpiride from tablets coated with polyvinylacetal diethylaminoacetate,a gastric-fiuid-soiuble polymer. I. Effect of ionic strength of gastrointestinal fluids[J]. Chemical and Pharmaceutical Bulletin, 1995,43(7): 1204-1211. DOI:10.1021/bm070237.
[32] 张瑜, 侯世祥. 释放介质pH和离子强度对羧甲基魔芋胶小丸体外释药的影响[J]. 中成药, 2008, 30(10): 1446-1450.
[33] 杜伏玲. 卡拉胶为基质载药微球的制备及释药行为研究[D]. 广州:广东药学院, 2009: 122-125.
[34] 崔园园, 陈红, 周丰. 海藻酸钠-胰蛋白酶微球的制备及药物释放性能[J]. 复合材料学报, 2011, 28(2): 117-122. DOI:10.13801/j.cnki. fhclxb.2011.02.010.
[35] 李近. 可生物降解载药微球的制备和释药动力学的研究[D]. 北京:清华大学, 2008: 77-79.
Kinetics of Sugar Release from Whey Protein Isolate Gel
REN Yan, LI Juan, HE Lianjun, DONG Wenming, HE Jinsong*
(College of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China)
In this research, the kinetic mechanism of sucrose release from whey protein isolate gels was studied. For this purpose, sucrose as a food flavor component was encapsulated in whey protein gels to investigate the effects of pH,temperature, drug loading, and ion concentration on the kinetics of sucrose release. The results showed that the releasing process of sucrose from whey protein isolate gels could be described by the Korsmeyer-Peppas model, with a fitting correlation coefficient R2between 0.95-0.99. The diffusion constant n was less than 0.45, which is consistent with the Fick diffusion mechanism. With the increase of pH, temperature or ion concentration in the range of 0.05-0.10 mol/L, the kinetic constant K (i.e., release rate) increased, while it decreased with the increase of drug loading. Whey protein isolate gel exhibited environmental responses, and the release of entrapped sucrose from it could be influenced by pH, temperature,drug loading, ion concentration and other factors. Therefore, the purpose of control ling the release of entrapped contents from the carrier could be achieved by adjusting pH, temperature, drug concentration and ion concentration.
whey protein isolate; gel; release characteristics; kinetics
10.7506/spkx1002-6630-201615003
TS252.1
A
1002-6630(2016)15-0013-06引文格式:
2015-11-24
国家自然科学基金面上项目(31371875);云南省教育厅科学研究基金重点项目(2014Z081)作者简介:任艳(1991—),女,硕士研究生,研究方向为食品科学。E-mail:377100734@qq.com
和劲松(1970—),男,副教授,博士,研究方向为食品蛋白凝胶化理论与功能凝胶开发。
E-mail:hejinsong@mail.tsinghua.edu.cn

