仿刺参体壁中抗菌肽的分离及抑菌活性
孟春英,王茂剑,张 健,,王共明,刘 昕,井月欣,王 婷
(1.上海海洋大学食品学院,上海 200000;2.山东省海洋资源与环境研究院,山东 烟台 264006;3.山东省海洋生态修复重点实验室,山东 烟台 264006)
MENG Chunying1,2, WANG Maojian2,3, ZHANG Jian2,3,*, WANG Gongming2, LIU Xin2, JING Yuexin2, WANG Ting1,2(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 200000, China; 2. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China; 3. Shandong Provincial Key Laboratory of Restoration for Marine Ecology, Yantai 264006, China)
仿刺参体壁中抗菌肽的分离及抑菌活性
孟春英1,2,王茂剑2,3,张 健2,3,*,王共明2,刘 昕2,井月欣2,王 婷1,2
(1.上海海洋大学食品学院,上海 200000;2.山东省海洋资源与环境研究院,山东 烟台 264006;3.山东省海洋生态修复重点实验室,山东 烟台 264006)
从仿刺参体壁中分离纯化出抗菌肽并研究其抑菌活性。以鲜活仿刺参体壁为原料,采用5%乙酸浸提法进行粗提,以抑菌活性为指标进行分离。经超滤系统超滤,大孔吸附树脂柱层析分离纯化,采用酶标仪比浊法检测各组分对大肠埃希氏菌(Escherichia coli)、肠炎沙门氏菌(Salmonella eternitidis)、金黄色葡萄球菌(Staphylococcus aureus)和枯草芽孢杆菌(Bacillus subtilis)的抑菌活性。采用Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis,Tricine-SDS-PAGE)检测抗菌肽分子质量。结果表明:通过超滤分离,分别得到分子质量<1、1~5 kD和5~10 kD组分,其中分子质量<1 kD组分的抑菌活性最高,选用该组分继续进行大孔吸附树脂柱层析分离,得抑菌活性最高的组分,其Tricine-SDS-PAGE结果表现为单一条带,分子质量约为4.35 kD。
仿刺参体壁;抗菌肽;分离纯化;抑菌活性;酶标仪比浊法
抗菌肽是指具有抵御外界微生物侵害、清除体内突变细胞能力的一类小分子肽,广泛存在于生物体内,抑菌活性高,对部分病毒也有抑制作用,对真核细胞几乎无影响[1-2]。天然抗菌肽通常是由小于50 个氨基酸残基组成的碱性小分子肽,水溶性好,大多具有较强的热稳定性[3]。从20世纪80年代在天蚕中首次分离出抗菌肽以来,现已发现800余种抗菌肽[3]。目前,所发现的海洋生物抗菌肽主要来源于鱼类和海洋无脊椎动物,其中海洋无脊椎动物包括刺胞动物、环节动物、软体动物、甲壳动物、棘皮动物、原索动物[4]。Beauregard等[5]从大西洋海参(Cucumaria frondosa)中分离得到一种分子质量约为6 kD的抗菌肽。
仿刺参蛋白含量高,糖类丰富,不含胆固醇,具有极高的营养和药用价值,是我国北方近海养殖中非常重要的经济品种之一。研究表明海参体壁真皮结缔组织、体腔、内腺管及内脏中均含有生物活性物质,并具有药理活性,如抗凝血、抗肿瘤、抗血栓、降血脂,降血黏度,免疫调节及促进细胞生长等作用[6-7]。近年来,由于种质的退化和养殖环境的恶化,仿刺参养殖病害问题不断发生[8]。目前流行病学研究报告,仿刺参的主要病害是以细菌性疾病为主,并且传播范围广、危害性大[9],其中口围肿胀症、腐皮综合征均是仿刺参养殖中较常见的疾病,致死率达30%以上[8,10-12]。由于仿刺参生活在含菌较多的底质中,其机体内具有很强的抗感染能力[12]。有关仿刺参体内抗菌活性物质的研究报道目前较少[13]。以仿刺参体壁为原材料,研究仿刺参体壁抗菌肽的分离纯化方法及抗菌特性,了解仿刺参的先天免疫系统作用机制,是通过免疫方法合理预防和治疗仿刺参细菌病害的基础。将为仿刺参体内抗菌活性物质、生物学特性的深入研究积累数据。
1 材料与方法
1.1 材料与试剂
仿刺参(Apostichopus japonicas),健康无伤,体质量80~100 g,购买自烟台山水海产有限公司。
大肠埃希氏菌(Escherichia coli)ATCC 25922、肠炎沙门氏菌(Salmonella enteritidis)ATCC 13076、金黄色葡萄球菌(Staphylococcus aureus)ATCC 6538、枯草芽孢杆菌(Bacillus subtilis)ATCC 11774均由农业部渔业产品质量监督检测中心(烟台)提供。
大孔吸附树脂DA201-C 郑州勤实科技有限公司;平板计数琼脂(PCA) 北京陆桥技术股份有限公司;营养肉汤 青岛高科因博海生物技术有限公司;冰乙酸、乙醇均为分析纯。
1.2 仪器与设备
TGL-16M台式高速冷冻离心机 湖南湘仪仪器有限公司;Pall Minimate切向流超滤系统及膜包 美国PALL公司;电子天平 美国Ohaus公司;TU-1810SPC紫外-可见分光光度计 北京普析通用仪器有限公司;DS-1高速组织捣碎机 上海标本模型厂;T18高速分散器、RV8旋转蒸发仪 德国IKA公司;生化培养箱 天津市泰斯特仪器有限公司;微孔板分光光度计 美国MARK公司;JMF-365胶体磨 上海科劳机械设备有限公司。
1.3 方法
1.3.1 仿刺参体壁抗菌肽的分离
1.3.1.1 材料预处理
鲜活仿刺参用过滤海水冲洗后,去肠道,称质量,剪碎,用胶体磨磨碎,再用高速组织捣碎机捣碎3 次,每次3 min,备用。
1.3.1.2 提取方法
采用乙酸浸提法[14],将捣碎后的仿刺参体壁组织按体积比1∶1加入5%的乙酸,用高速分散器混匀,置于4 ℃冰箱浸提24 h。然后将混合物放入高速冷冻离心机,4 ℃、8 000 r/min条件下离心20 min,取上清液,4 ℃保存。沉淀物按体积比1∶1加入5%的乙酸,再次4 ℃浸提24 h,重复上述离心过程,取上清液。合并2 次上清液,过0.45 µm滤膜除去杂质,减压旋蒸后真空冷冻干燥,得粗提物。
1.3.2 仿刺参体壁抗菌肽的纯化
1.3.2.1 超滤工艺分离粗提物[15-17]
将冷冻干燥后的粗提物用蒸馏水复溶后,分别过0.45、0.22 µm的微孔滤膜除杂质除菌后,用Pall Minimate超滤系统进行超滤。依次选用截留分子质量为10、5、1 kD的切向流膜包,压力12 Pa的条件下开始超滤,当超滤杯中液体的体积剩余1/5时,停止超滤,收集滤过液,超滤杯中用蒸馏水补充至原体积,再次超滤。重复5 次。收集每次的滤过液和截留液,用双缩脲法测定截留液和滤过液中蛋白质或多肽含量。
1.3.2.2 大孔吸附树脂柱层析
大孔吸附树脂的分离机理为吸附原理和分子筛原理。它主要通过分子间作用力如范德华力或氢键等进行吸附,吸附剂表面的亲水性或疏水性决定了其具有不同的吸附特性;同时,本身的多孔性结构亦决定其具有一定的分子筛作用[18]。
大孔吸附树脂经无水乙醇浸泡24 h后,用去离子水洗至无醇味。采用湿法装柱[19],实验条件:DA201-C大孔吸附树脂;层次柱规格:1.5 cmh30 cm;样品质量浓度:10 mg/mL;检测波长:214 nm。将样品溶液以1 BV/h流速流经层析柱,上样结束后,用去离子水以1 BV/h的流速洗涤层析柱至无吸收峰[20],之后分别用25%、50%、75%和95%的乙醇以2 BV/h的流速流经层析柱,收集各洗脱峰,经真空旋蒸浓缩后真空冷冻干燥得到各组分。
1.3.3 抗菌肽抑菌活性的检测
1.3.3.1 超滤后各组分抑菌活性的检测
以大肠埃希氏菌、肠炎沙门氏菌、金黄色葡萄球菌、枯草芽孢杆菌为受试菌。将加热融化的PCA培养基15 mL注入无菌平皿中,待凝固后,用接种环刮取保存在斜面培养基上的单菌落,划线培养,37 ℃培养24 h。然后再取单菌落接入营养肉汤培养基中,37 ℃摇床培养20 h。用平板计数法确定菌液浓度,根据菌液浓度将菌液稀释至104CFU/mL。
采用酶标仪比浊法[21-22]检测抗菌肽的抑菌活性。取真空冷冻干燥后的各组分,加无菌蒸馏水配制成质量浓度为16 000 µg/mL样品溶液。将菌液浓度调整至104CFU/mL。利用无菌96 孔细胞培养板,向2~12孔中加入100 μL无菌营养肉汤,取已配好的样品溶液加入孔1孔2各100 μL,混匀孔2,然后从中吸取100 μL加入孔3,依次采用梯度稀释的方法稀释,混匀至孔11,最后从孔11中吸出100 μL弃除。然后,向每孔中接入备用菌液100 μL,使每孔中样品的最终质量浓度依次为8 000、4 000、2 000、1 000、500 3.9、0 µg/mL。每个样品做3 个平行,利用酶标仪中测定其初始OD630nm值。然后置于37 ℃恒温培养箱中培养,间隔2 h测一次OD630nm值。样品抑菌活性用培养前后OD630nm差值表示,差值越小,表明培养后细菌数越少,样品的抑菌作用越强。
1.3.3.2 大孔吸附树脂柱层析后各峰抑菌活性的检测
取柱层析后所得各峰的真空冷冻干燥组分,用无菌蒸馏水稀释至质量浓度为8 000 µg/mL。其余步骤同1.3.3.1节。
1.3.3.3 各峰处组分最低抑菌质量浓度的测定
按1.3.3.1节方法制作96 孔平板,利用酶标仪在630 nm波长处测光密度(OD)值后,37 ℃恒温恒湿培养24 h后,再次测定96 孔平板各孔吸光度,计算各孔培养前后的OD630nm差值。培养前后OD630nm差值小于0.05的各峰组分溶液,结合肉眼观察澄清者[20-23],即可判定为最低抑菌质量浓度(minimun inhibitory concentration,MIC)。
1.3.3.4 各峰半数抑制浓度(half maximal inhibitory concentration,IC50)的测定
IC50指在用药后存活的细胞数量减少一半时所需的药物浓度。选用SPSS 22.0软件计算各峰的IC50。
1.3.4 Tricine-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis,Tricine-SDS-PAGE)检测
分离胶和浓缩胶的制备与一般SDS-PAGE制胶方法相同,分离胶和浓缩胶的配制见表1。

表1 分离胶和浓缩胶的组成Table 1 Composition of separating and stacking gels
将冷冻干燥后的样品用适量蒸馏水溶解,与等体积的上样缓冲液混合,100 ℃水浴加热10 min后,冷却至室温。在内槽中倒入阴极缓冲液,外槽中倒入阳极缓冲液,在50 V恒压电泳1 h,当样品进入分离胶时,电压升到100 V(约1.5 h时)染料前沿迁移至距硅胶橡胶框底边1~1.5 cm处,停止电泳。将凝胶放入固定液中固定20 min,45 ℃染色30 min,脱色,直至条带清晰。
以标准蛋白质的相对迁移率为横坐标,标准蛋白质相对分子质量的对数为纵坐标作图,可得到一条标准曲线,根据未知抗菌肽的相对迁移率计算出其分子质量。
1.4 数据处理
实验数据处理均采用Microsoft Excel软件计算及绘图。
2 结果与分析
2.1 超滤结果分析
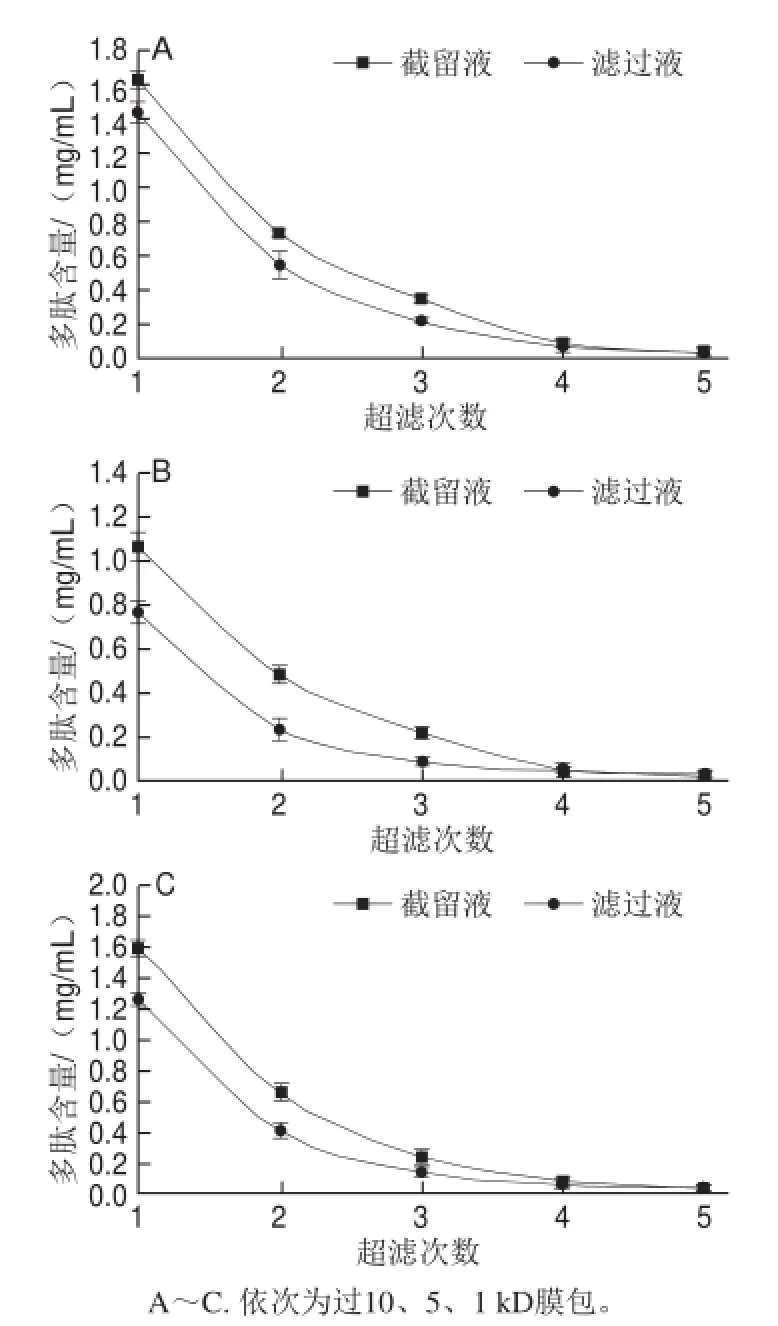
图1 超滤次数与多肽含量的关系Fig.1 Relationship between number of ultrafiltration cycles and peptide concentration
由图1A可知,粗提物复溶液通过10 kD膜包时,截留液和滤过液中蛋白质及多肽含量随超滤次数的增加逐渐下降[24],超滤3 次后,其含量趋于稳定,即分子质量大于10 kD的多糖及蛋白质等留在截留液中,小于10 kD的多肽绝大部分已通过膜包,达到初步分离的目的。取通过截留分子质量10 kD膜包的滤过液过5 kD膜包,同理取通过5 kD膜包的滤过液过1 kD膜包。由图1B、C可知,截留液和滤过液中蛋白及多肽含量随超滤次数的增加逐渐降低,超滤4 次后趋于稳定,初步分离出分子质量小于5 kD和1 kD的组分,最后得到各组分的分子质量分别是5~10、1~5 kD及<1 kD。
2.2 超滤后各组分抑菌活性检测结果及分析
采用酶标仪比浊法测各组分的OD630nm值,再计算得到样品抑菌的OD630nm差值,结果见图2。

图2 各组分对4 种菌株生长的影响Fig.2 Effects of various ultra-filtration components on the growth of four kinds of bacteria
由图2可知,分子质量在5~10 kD的多肽组分对大肠埃希氏菌、肠炎沙门氏菌和金黄色葡萄球菌无抑制作用,反而促进其生长,对枯草芽孢杆菌有微弱的抑制作用,说明分子质量在5~10 kD的组分抗菌肽含量很少,而且大部分组分可能是大分子蛋白,给细菌的生长提供了营养物质。分子质量在1~5 kD的多肽组分对肠炎沙门氏菌的抑菌活性最高,但对金黄色葡萄球菌的生长无抑制作用,分子质量<1 kD对除肠炎沙门氏菌外的其他3 种菌株的抑菌活性最强。因此,综合考虑,选用分子质量<1 kD的多肽组分进行下一步大孔吸附树脂柱层析实验。
2.3 大孔吸附树脂层析结果分析
取分子质量<1 kD的组分10 mg,加1 mL蒸馏水复溶,离心上样。依次选用体积分数25%、50%、75%和95%的乙醇做洗脱剂,各自得到一个洗脱峰,分别记为F1、F2、F3和F4。由于25%、50%、75%和95%乙醇的吸光度依次增大,所以F1、F2、F3和F4的基线依次增高,结果如图3所示。

图3 大孔吸附树脂柱层析分离结果Fig.3 Chromatographic separation of antimicrobial peptides on macroporous resin column
2.4 酶标仪比浊法测抑菌活性结果分析
采用酶标仪比浊法检测各峰的OD630nm值,计算样品抑菌的OD630nm差值、MIC、IC50,结果分别见图4、表2及表3。
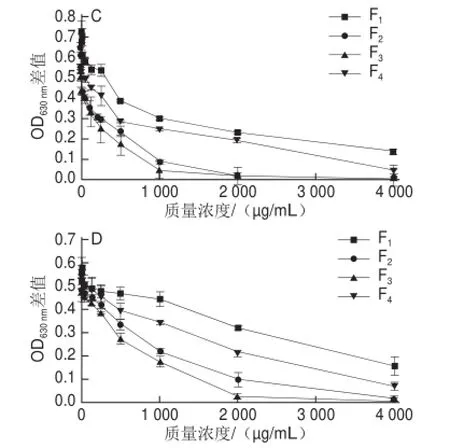
图4 各峰组分对4 种菌株的抑菌活性Fig.4 Antibacterial activity of various components of the < 1 kD fraction on four kinds of bacteria

表2 F1、F2、F3和F4组分对4 种菌株的MICTable 2 MICs of various components of the<1 kD fraction against four kinds of bacteriaµg/mL
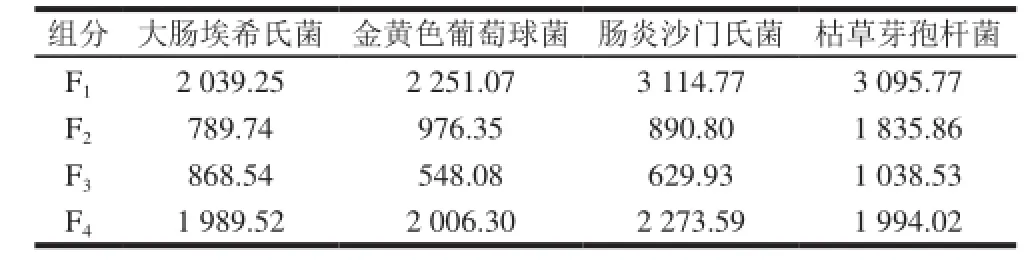
表3 F1、F2、F3和F4组分对4 种菌株的IC50Table 3 IC50values of various components of the<1 kD fraction against four kinds of bacteriaµg/mL
由图4可知,低质量浓度时,F1、F2、F3和F4组分对4 种菌株均无抑菌活性,随样品质量浓度的增加OD630nm差值逐渐减小,抑菌活性逐渐增强,当质量浓度达到2 000 µg/mL时,F3的OD630nm差值接近0,说明在此质量浓度下,F3组分可完全抑制4 种菌株的生长。F1组分对4种菌株的抑菌活性最差,F4组分次之。F2组分和F3组分对大肠埃希氏菌的抑制作用相差不大,F3组分对其余3 种菌株的抑菌活性高于F2组分。周祥敏等[25]采用大孔吸附树脂法纯化菝葜中皂苷类成分,用蒸馏水、30%乙醇和70%乙醇依次洗脱,发现抑菌活性部位菝葜皂苷富集于70%乙醇洗脱液中。傅勇等[26]研究无患子皂苷及其抑菌活性发现,抑菌活性部位无患子皂苷富集于70%乙醇洗脱液中。本实验中F3组分是由75%的乙醇洗脱得到的峰,其抑菌活性最强,与前人的研究结果一致。由不同体积分数乙醇洗脱得到的峰具有不同的疏水性,乙醇体积分数越高得到的峰疏水性越强。因此,各洗脱组分疏水性大小顺序为F4>F3>F2>F1。过振宇[20]研究家蝇抗菌肽时,考察了15%、35%、55%乙醇洗脱组分抑菌活性与其疏水性的关系,结果表明随洗脱组分疏水性的增加,抑菌活性增强。不同物种来源的抗菌肽一级结构具有相似之处,C端含较多疏水残基,N端富含亲水氨基酸,具有双亲结构[3]。F4组分疏水性过大,可能含亲水性氨基酸较少,且F4组分的水溶性较F2和F3组分差,所以F4组分的抑菌活性比F2、F3组分差。由表2可知,F3组分对金黄色葡萄球菌的抑菌效果最好。由表3可知,F3组分对金黄色葡萄球菌、肠炎沙门氏菌及枯草芽孢杆菌的IC50均比F2组分的小,因此,综合来说F3组分的抑菌活性最强。
十八大报告明确指出:“加大非公有制经济组织、社会组织党建工作力度”“扩大党组织和党的工作覆盖面”“创新基层党建工作,夯实党执政的组织基础”。因此,正确把握新形势下非公有制经济组织党组织建设现状,分析其面临的新情况新特点,及时跟进党组织设置,加大在非公有制经济组织中党建工作的力度,仍然是当前各级党委面临的重要课题。
2.5 Tricine-SDS-PAGE检测结果
将F3组分进行Tricine-SDS-PAGE,并根据所得标准曲线计算其分子质量。

图5 F3组分的Tricine-SDS-PAGE图Fig.5 Tricine-SDS-PAGE of F3separated from the < 1 kD fraction
由图5可知,F3组分在分离胶上表现为单一条带,以标准蛋白质的相对迁移率为横坐标,标准蛋白质分子质量的对数为纵坐标绘制标准曲线,得回归方程:y=-0.742 2x+1.257 6(R2=0.988 5),计算出仿刺参体壁抗菌肽的分子质量为4.35 kD。由于多肽多呈现为线性结构在膜附近自身的可变形范围较大,再加上跨膜压力的驱动作用,从而使部分高于理论截留分子质量的多肽进入滤过液[27]。所以滤过液部分组分的分子质量大于截留分子质量。
3 结 论
抗菌肽多为碱性小分子多肽,且具有分子质量小、抗菌谱广等特点。提取小分子活性多肽的方法主要有:有机溶剂浸提法、水浸提法、有机酸浸提法等。由于大多数抗菌肽含正电荷氨基酸,是阳离子型,采用5%乙酸浸提,既可避免强酸,强碱对其的破坏,又可以获得较高含量的抗菌肽粗提物[28]。王斌等[8]研究了仿刺参不同组织液的抗菌活性,发现仿刺参体腔液、体腔液上清液和体腔细胞悬液对哈氏孤菌(Vibrio harveyi H06091)、白色葡萄球菌(Staphylococcus)和迟钝爱德华菌(Edwardsiella tarda)均无明显抑制作用,而体壁组织匀浆液对3 种菌均有抑制作用。丛聪等[13]发现仿刺参体腔液在自然状态下的抗菌能力有限,而体壁内皮组织等在直接抑菌、抗菌应答中扮演十分重要角色。在本实验中从仿刺参体壁组织匀浆液中分离得到的抗菌肽对大肠埃希氏菌、肠炎沙门氏菌、金黄色葡萄球菌和枯草芽孢杆菌均有较强的抑制作用,与上述研究结果一致。此外,在其他种类的海参中也分离得到了抗菌肽。如:Haug等[29]研究Cucumaria frondosa的多处组织和细胞中含抗菌活性物质,但体壁组织提取物和体腔细胞中的抗菌活性物质含量最高。Beauregard等[5]从Cucumaria frondosa中分离得到1 种分子质量约为6 kD的抗菌肽,此外,还发现在Cucumaria frondosa中存在更小分子的多肽,可抑制金黄色葡萄球菌和绿脓杆菌的生长。Li等[30]从绿球海胆中发现2 种阳离子抗菌肽,对金黄色葡萄球菌、大肠杆菌和棒状杆菌具有较强的抑制作用。
[1] HANCOCK R E W, LEHRER R. Cationic peptides: a new source of antibiotics[J]. Trends in Biotechnology, 1998, 16(2): 82-88. DOI:10.1016/S0167-7799(97)01156-6.
[2] JAYNES J M, BURTON C R, BARR S B, et al. In vitro cytocidal effect of novel lytic peptides on plasmodium falciparum and trypanosome cruzi[J]. The FASEB Journal, 1988, 2(13): 2878-2883.
[3] 李勇, 蔡杨. 肽营养学[M]. 北京: 北京大学医学出版社, 2007: 36-37.
[4] 丁云超, 张士璀. 海洋动物抗菌肽研究进展[J]. 中国海洋药物, 2012, 32(6): 87-96. DOI:10.13400/j.cnki.cjmd.2013.06.003.
[5] BEAUREGARD K A, TRUONG N T, ZHANG H, et al. The detection and isolation of a novel antimicrobial peptide from the echinoderm, Cucumaria frondosa[J]. Advances in Experimental Medicine and Biology, 2001, 484: 55-62.
[6] 樊绘曾. 海参: 海中人参-关于海参及其成分保健医疗功能的研究与开发[J]. 中国海洋药物, 2001, 20(4): 37-44. DOI:10.3969/ j.issn.1002-3461.2001.04.010.
[7] 李丹彤, 常亚青, 陈炜, 等. 獐子岛野生刺参体壁营养成分的分析[J]. 大连水产学院学报, 2006, 21(3): 278-282. DOI:10.3969/ j.issn.1000-9957.2006.03.017.
[8] 王斌, 胡亮, 程振远, 等. 仿刺参不同组织液的抗菌活性[J]. 大连海洋大学学报, 2010, 12(6): 523-527. DOI:10.3969/j.issn.1000-9957.2010.06.009.
[9] 王印庚, 宋小军, 张春云. 养殖海参主要疾病及防治技术[J]. 海洋科学, 2005, 29(3): 1-7. DOI:10.3969/j.issn.1000-3096.2005.03.001.
[10] LEHRER R I. Defensins: antimicrobial and cytotoxic peptides of mammalian cells[J]. Annual Review of Immunology, 1993, 11: 105-128.
[11] 王印庚, 孙素凤, 宋小军. 仿刺参幼体烂胃病及其致病菌原鉴定[J].中国水产科学, 2006, 13(6): 908-916.
[12] 马悦欣, 徐高蓉, 张恩鹏, 等. 仿刺参幼参急性口围肿胀症的细菌性病原[J]. 水产学报, 2006, 30(3): 377-382. DOI:10.3321/ j.issn:1000-0615.2006.03.015.
[13] 丛聪, 蒋经伟, 董颖, 等. 仿刺参体腔液的抗菌特性[J]. 水产学报, 2014, 38(9): 1548-1554. DOI:10.3724/SP.J.1231.2014.49350.
[14] 苏建明, 雷红宇, 黄平, 等. 草鱼肠道抗菌肽的提取及体外抑菌效果初步研究[J]. 湖南农业大学学报(自然科学版), 2009, 4(2): 162-165. DOI:10.13331/j.cnki.jhau.2009.02.021.
[15] 苏春燕, 朱科学, 周惠明, 等. 超滤法分离富集谷朊粉抗氧化活性肽[J].食品与生物技术学报, 2011, 30(1): 44-48.
[16] 刘军海. 超滤法提取茶多糖研究[J]. 食品工业科技, 2007, 28(9): 124-129. DOI:10.13386/j.issn1002-0306.2007.09.004.
[17] 张会翠, 唐琳, 杨庆利, 等. 超滤法分离花生肽及其抗氧化活性的研究[J]. 花生学报, 2012, 41(1): 1-5. DOI:10.14001/ j.issn.1002-4093.2012.01.002.
[18] 任清, 张晓平, 赵世锋, 等. 利用大孔吸附树脂DA201-CⅡ对燕麦蛋白水解液脱盐的研究[J]. 食品科学, 2009, 30(10): 118-122.
[19] 张丰香, 李清华, 张莉莉. 大孔吸附树脂对鱼鳞多肽的分离及吸附特性研究[J]. 食品工业科技, 2014, 35(13): 107-111. DOI:10.13386/ j.issn1002-0306.2014.13.014.
[20] 过振宇. 大孔吸附树脂吸附分离家蝇抗菌肽的研究[D]. 无锡: 江南大学, 2008: 17-18.
[21] 翁佩芳, 江华珍, 冯凤琴, 等. 酶标仪比浊法评价月桂酸单甘油酯对肉葡萄球菌的抑菌活性[J]. 中国食品学报, 2012, 12(5): 187-194 .
[22] 张恩广, 乔慧, 王光建, 等. 微孔比浊法测定牛黄上清片的抗菌效价[J]. 中药药理与临床, 2012, 28(3): 23-25. DOI:10.13412/j.cnki. zyyl.2012.03.019.
[23] 石圆圆, 许培雅, 裘娟萍. 吊瓜皮提取物抑菌活性的研究[J]. 食品工业科技, 2009, 30(12): 82-85. DOI:10.13386/j.issn1002-0306.2009.12.113.
[24] AMADO I R, VAZQUEZ J A, GONZALEZ M P, et al. Production of antihypertensive and antioxidant activities by enzymatic hydrolysis of protein concentrates recovered by ultrafiltration from cuttlefish processing wastewaters[J]. Biochemical Engineering Journal, 2013, 76: 43-54. DOI:10.1016/j.bej.2013.04.009.
[25] 周祥敏, 张辉, 张毅. 大孔吸附树脂法纯化菝葜中皂苷类成分及抑菌活性表征研究[J]. 食品与药品, 2012, 14(1): 38-42. DOI:10.3969/ j.issn.1672-979X.2012.01.011.
[26] 傅勇, 雷鹏, 韩玉梅, 等. 大孔吸附树脂法制备无患子皂苷及其抑菌活性表征[J]. 中药材, 2010, 33(2): 267-272. DOI:10.13863/ j.issn1001-4454.2010.02.039.
[27] FILNN J. Membrane science and technology[M]. New York: Plenum Press, 1970: 47-97.
[28] 董晓庆, 张东鸣, 曲桂娟, 等. 大口黑鲈不同组织中抗菌肽粗提及抑菌活性测定[J]. 中国兽药杂志, 2014, 48(6): 8-11.
[29] HAUG T, KJUUL A K, STYRVOLD O B, et al. Antibacterial activity in Strongylocentrotus droebachiensis (Echinoidea), Cucumaria Frondosa (Holothuroidea), and Asteriasrubens (Asteroidea)[J]. Journal of Invertebrate Pathology, 2002, 81(2): 94-102. DOI:10.1016/ S0022-2011(02)00153-2.
[30] LI C, HUANG T, STYRVOLD O B, et al. Strongylocins, novel antimicrobial peptides from the green sea urchin, Strongylocentrotus droebachiensis[J]. Developmental & Comparative Immunology, 2008, 32(12): 1430-1440. DOI:10.1016/j.dci.2008.06.013.
[31] 赵建乐, 李引乾, 陈琛, 等. 牛抗菌肽及其基因工程的研究进展[J].中国兽医科学, 2010, 40(8): 873-879.
Isolation and Activity of Antimicrobial Peptide from Body Wall of Apostichopus japonicas
The antimicrobial peptide was obtained from the body wall of Apostichopus japonicas and its activity was evaluated. The crude peptide was extracted from the body wall with 5% acetic acid and subjected to bioassay-guided fractionation for antimicrobial activity. The purification was completed by ultra-filtration and chromatographic separation with macroporous resin. A turbidimetric method was applied to evaluate the inhibitory activity of each sample against bacteria including Escherichia coli, Salmonella eternitidis, Staphylococcus aureus and Bacillus subtilis. By using Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis (Tricine-SDS-PAGE), the molecular weight of the purified antimicrobial peptide was measured. The results showed that three components with different molecular weights < 1 kD, 1–5 kD and 5–10 kD were obtained after ultra-filtration. The component with molecular weight of < 1 kD had the strongest antibacterial activity, and then it was chosen for further chromatographic separation with macroporous resin column. The subcomponent F3 with the highest antimicrobial activity was obtained and its molecular weight was identified as 4.35 kD.
Apostichopus japonicas body wall; antimicrobial peptides; separation and purification; antimicrobial activity;turbidimetric method
MENG Chunying1,2, WANG Maojian2,3, ZHANG Jian2,3,*, WANG Gongming2, LIU Xin2, JING Yuexin2, WANG Ting1,2
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 200000, China; 2. Shandong Marine Resource and Environment Research Institute, Yantai 264006, China; 3. Shandong Provincial Key Laboratory of Restoration for Marine Ecology, Yantai 264006, China)
10.7506/spkx1002-6630-201607007
TS254.1
A
1002-6630(2016)07-0033-06
孟春英, 王茂剑, 张健, 等. 仿刺参体壁中抗菌肽的分离及抑菌活性[J]. 食品科学, 2016, 37(7): 33-38. DOI:10.7506/ spkx1002-6630-201607007. http://www.spkx.net.cn
MENG Chunying, WANG Maojian, ZHANG Jian, et al. Isolation and activity of antimicrobial peptide from body wall of Apostichopus japonicas[J]. Food Science, 2016, 37(7): 33-38. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201607007. http://www.spkx.net.cn
2015-06-04
国家海洋局海洋公益性行业科研专项(201205027;201105029);山东省现代农业产业技术体系刺参产业创新团队建设项目(SDAIT-08);山东省2014年农业重大应用技术创新项目;烟台市科技发展计划项目(2014ZH081);水生动物营养与饲料泰山学者岗位经费资助项目(TS 200651036);山东省自然科学基金培养基金项目(ZR2014CP030)
孟春英 (1991—),女,硕士研究生,研究方向为食品科学与工程。E-mail:1181401663@qq.com
*通信作者:张健(1980—),男,助理研究员,博士,研究方向为海洋食品科学。E-mail:zjsd408@163.com

