贵州省东南部地区常见森林类型植物叶片N、P化学计量学特征
李世杰
(贵州省林业调查规划院 贵阳 550003)
贵州省东南部地区常见森林类型植物叶片N、P化学计量学特征
李世杰
(贵州省林业调查规划院 贵阳 550003)
通过对贵州东南部地区常见马尾松纯林、杉木纯林、马尾松针阔混交林、杉木针阔混交林、马尾松杉木针阔混交林、阔叶林(树种类型)等6种森林类型的植物叶片的N、P化学计量学特征分析,结果显示:叶片N含量的算数平均数分别为13.1503g·kg-1;叶片P含量的几何平均数为1.2410g·kg-1;叶片N:P的算数平均数分别为15.8096;针叶林和阔叶林与针阔混交林的叶片N、P含量及N:P存在显著差异,针叶林和阔叶林的N含量远远高于针阔混交林,而针阔混交林P含量远远大于针叶林和阔叶林;不同生活型(乔木、灌木、草本)叶片N、P含量及N:P差异不明显。
生态化学计量学;N;P;限制元素;森林类型;贵州省东南部
生态化学计量学(Ecological stoichiometry)是研究生物系统能量平衡和多重化学元素(主要是C、N、P)平衡的科学以及元素平衡对生态交互作用影响的一种理论,这一研究领域使得生物学科不同层次(分子、细胞、有机体、种群、生物系统和全球尺度)的研究理论能够有机地统一起来[1~4]。国外在生态化学计量学的研究起步比国内早,主要开展了生态系统分析、消费者驱动的养分循环、生物养分的限制、森林演替与退化以及全球氮磷生物地球化学循环等领域的研究,并已取得了丰富的成果[4]。
植物根、茎、叶中的养分含量来自于土壤养分供应和植被养分需求间的动态平衡,在特定区域植被养分会趋向于一个固定值。N、P作为植物生长的必需矿物元素和生态系统常见的限制元素,在植物体内存在功能上的联系,二者之间具有重要的交互作用,通过对植被体内氮磷的化学计量学研究,可以用来判断有机体生长、发育或繁殖的元素类型[4]。植被N:P的指示意义在于确定植物生产受到哪种元素的限制作用.在P素相对稀缺、N素相对丰富的生境中,植物体的N:P相对较高;相反,在N素稀缺、P素丰富的生境中,植物体的P含量会显著升高,从而降低了植被的N/P[5]。
贵州省东南部是我省的主要木材产区,也是全国28个重点木材产区之一,素有“森林之州”的美誉,也是我省林业产业化发展较为成功的区域之一。本文选择贵州省东南部常见的马尾松林、人工杉木林、马尾松阔叶混交林、杉木阔叶混交林、马尾松杉木阔叶混交林和阔叶林6种森林类型,进行养分含量分析,比较不同森林类型和不同生活型植物叶片的N、P元素的计量分布格局及响应特征,探讨贵州省东南部树木生长受N、P元素限制情况,并探讨生长型及系统发育对植物化学计量学特征的影响,为深入揭示不同森林类型生态化学计量学特性的调控机理和植物养分适应策略等提供参考。
1 材料和方法
1.1 研究区概况
研究区域包括贵州省黔东南苗族侗族自治州的16个县和黔南布依族苗族自治州的三都县。地理坐标为107°18′~109°36′,北纬25°19′~20°32′。西部、西北部主要为丘陵状低中山,向东为低中山、低山和丘陵,平均海拔772米。最高海拔2179米,位于雷山县雷公山主峰;最低海拔148米,位于黎平县地坪乡水口河出省界处。气候属亚热带温暖湿润季风气候,年降雨量1200mm左右,年平均无霜期270~330天之间,年平均气温16℃,冬无严寒,夏无酷暑,气候资源较为优越。森林以人工马尾松林和杉木林所占面积最大,其余为针阔叶混交林、常绿阔叶林、落叶阔叶林等。
共设置样地67个,样地大小根据立地条件和地形限制分别设置20m× 30m或20m× 20m。各森林类型样地数量根据分布面积、代表性和可达性确定:马尾松人工林6个,杉木人工林15个,阔叶次生林27个,针阔混交林19个。
1.2 样地布设及采样
样地布设:针对本次研究选择的马尾松、杉木及常见阔叶林森林群落,在具有代表性地段布设样地标准样地(10m×10m)。天然林样地对DBH≥5cm的乔木树种进行每木检尺,次生或人工幼龄林样地对DBH ≥2cm的乔木树种进行每木检尺。
乔木叶片样本采集:对样地内的优势树种按大、中、小径级进行分类,共选择3~5株样木,然后伐倒标准木,将标准木树冠3等分后,分别上、中、下3部分选择标准枝,采集叶片样品,每个样品鲜重300g。
灌木叶片样本采集:在样地内部选择代表性区域设置3个2m × 2 m的样方,将样方内所有灌木全部采割后,把所有叶片全部混合,取约300g代表性样本。
草本叶片样本采集:在灌木调查的样方(2m × 2m)内,围取1个1m × 1m的代表性小方框,将方框内所有植物全部收获后,将地上部分混合取300g代表性样本。
1.3 样品室内测定、处理和化学分析方法
所有植物样品现地密封在塑料封口袋内运回实验室,在烘箱内110 ℃杀青30min,然后在65 ℃烘至恒重后粉碎,过0.1 mm筛,装瓶,贮存。分析项目为植物叶片的全氮、全磷含量,全N用凯氏定氮法测定,全P用硝酸-高氯酸消煮-钼锑抗分光光度法测定[6]。
1.4 统计分析
利用Excel 2003和用SPSS 13.0 统计分析软件进行数据统计。对植物叶片的N、P含量和元素计量比进行K-S正态分布检验。如符合正态分布,则用算术平均数表示总体的大小;如不符合,则通过对数转换以改善数据的正态性, 并用几何平均数表示总体的大小[7],并计算叶片各养分含量间的相关性。采用单因素方差分析方法分别分析不同森林类型及不同生长型(乔木、灌木、草本)之间植物叶片N、P化学计量学特征的差异.分析前将不同林分、不同生活型的植物N、P含量和N/P均取常用对数,以满足数据正态分布的要求[7]。
2 结果与分析
2.1 植物叶片的养分特征
由于植物叶片的P含量和和N:P不符合正态分布(K-S检验,p<0.05),故用几何平均数反映样本的统计特征;植物叶片N含量符合正态分布(K-S检验,p>0.05),算术平均数和几何平均数均可表示统计特征。统计结果标明,植物叶片N含量的算术平均数分别为13.1503g·kg-1;叶片P含量的几何平均数为1.2410g·kg-1;植物叶片N:P的几何平均数为7.6213(表1)。
植物叶片N含量与P含量有极显著的负相关关系(P<0.01);叶片N含量与N:P有极显著的正相关关系(P<0.01),叶片P含量与N:P有极显著的负相关关系(P<0.01)(表2)。

表1 贵州省东南部植物叶片养分的统计特征
A.M.,算术平均数;SD,标准偏差;CV,变异系数;G.M.,几何平均数;MAX,最大值;MIN,最小值;p,K-S 检验p值;SD,标准偏差;**,p < 0.01; *,p < 0.05。

表2 叶片N、P和N:P的相关性(n=67)
**, p < 0.01; *, p <0.05。
2.2 不同森林类型植物叶片N、P化学计量特征
单因素方差分析表明,马尾松林、杉木林和阔叶林植物叶片N含量分别与马尾松阔叶混交林、杉木阔叶混交林、杉木马尾松阔叶混交林的N含量存在显著(p<0.05)或极显著差异(p<0.01);杉木马尾松阔叶混交林植物叶片N含量与马尾松林、杉木林、马尾松阔叶混交林、杉木阔叶混交林阔叶林植物叶片的N含量均存在显著(p<0.05)或极显著差异(p<0.01);其它森林类型植物叶片的N含量差异不显著(p>0.05)。不同森林类型植物叶片N含量依次为:阔叶林>杉木林>马尾松林>杉木马尾松阔叶混交林>马尾松阔叶混交林>杉木阔叶混交林。
马尾松阔叶混交林、杉木阔叶混交林植物叶片的P含量分别与马尾松林、杉木林、杉木马尾松阔叶混交林、阔叶林植物叶片的P含量存在极显著差异(p<0.01);杉木马尾松阔叶混交林与阔叶林植物叶片的P含量存在显著差异(p<0.05);其它森林类型植物叶片的N含量差异不显著(p>0.05)。不同森林类型植物叶片P含量依次为:马尾松阔叶混交林>杉木阔叶混交林>杉木马尾松阔叶混交林>杉木林>马尾松林>阔叶林。
马尾松阔叶混交林、杉木阔叶混交林植物叶片的N:P分别与马尾松林、杉木林、杉木马尾松阔叶混交林、阔叶林植物叶片的N:P存在极显著差异(p<0.01);杉木林和杉木马尾松阔叶混交林的植物叶片的N:P存在极显著差异(p<0.01);其它森林类型植物叶片的N含量差异不显著(p>0.05)。不同森林类型植物叶片N:P依次为:阔叶林>杉木林>马尾松林>杉木马尾松阔叶混交林>杉木阔叶混交林>马尾松阔叶混交林。(表3)

表3 不同森林类型植物叶片N、P含量和N:P
A.M.,算术平均数;CV,变异系数;G.M.,几何平均数;n,样品数;不同字母表示平均值间差异显著。
2.3 不同生活型植物叶片N、P化学计量特征
单因素方差分析标明,不同生活型(乔木、灌木、草本)植物叶片N、P含量及N:P差异不显著(p<0.05)。灌木植物叶片N、P含量及N:P最高,其N含量算术平均数为16.0532g·kg-1,P含量的几何平均数为1.421 g·kg-1,N:P的几何平均数为8.1944;草本植物叶片N、P含量最小,其N含量的算术平均数为9.9960g·kg-1, P含量的几何平均数为0.9617g·kg-1;乔木和草本植物叶片N:P略低于灌木植物叶片N:P,分别为7.2599 g·kg-1、7.5102 g·kg-1(表4)。
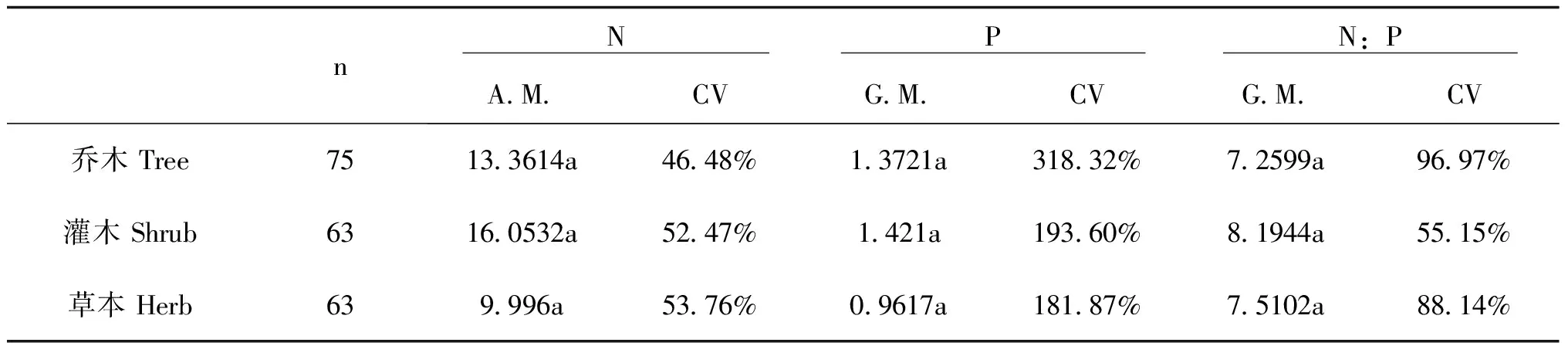
表4 不同生活类型植物叶片N、P含量和N:P
A.M.,算术平均数;CV,变异系数;G.M.,几何平均数;n,样品数;不同字母表示平均值间差异显著。
3 讨论
3.1 植物叶片的养分特征
与以往研究结果(表5)相比,本研究结果的植物叶片N含量的算术平均数低于全国的平均水平20.24g·kg-1[8],也低于全球平均水平18.34 g·kg-1[9]或17.66 g·kg-1[10];植物叶片P含量的几何平均数微高于全国平均水平1.21g·kg-1[8],但低于全球平均水平1.42 g·kg-1[9]或1.58 g·kg-1[10];植物叶片N:P的几何平均数明显低于全国的平均水平14.4g·kg-1[8]以及全球平均水平13.28g·kg-1[9]或12.90 g·kg-1[10]。以往研究表明,在全球尺度或全国尺度上,植物叶片N含量随纬度降低(或者年均温增加)而呈现减少的趋势[10,11]。与大尺度的研究相比,贵州省东南部叶片N含量的值偏低,可能与本研究区域所处纬度偏低有关。以往陆生植物和草原植物研究表明,植物叶片P含量与土壤P含量显著相关[11,12]。贵州省东南部区域气候高温多雨,土壤富铝化作用强烈,淋溶严重,闭蓄态磷所占比例高,此区域的全P含量相
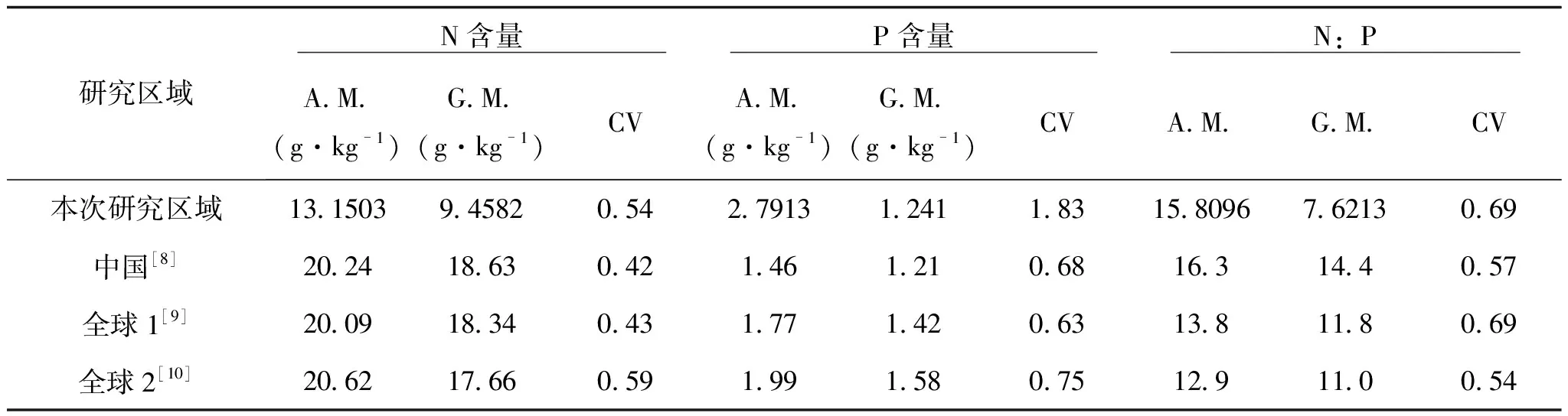
表5 贵州省东南部和其他研究区域的植物叶片N、P及N/P计量比较
A.M., 算术平均数; G.M., 几何平均数; CV, 变异系数。
对较低,这可能是贵州省东南部地区植物叶片P含量和N:P相对较低的原因。
从植物个体到生态系统的各个层次上,C、N、P都是相互作用的[13],因而植物叶片N、P含量有很好的相关性。本研究结果的植物叶片N含量与P含量呈极显著负相关关系,而植物叶片的N、P含量分别与N:P呈极显著正相关关系和极显著负相关关系(表2),从这个意义上来说,N:P比的变化同时受植物叶片N、P含量的影响。
根据植物叶片氮磷比判断土壤营养状况是生态化学计量学应用的一个重要方面[3]。然而,研究区域、生长阶段及植物种类的差异都会影响氮磷比临界值的变化[3,15]。当N:P低时,意味着植物生长受N限制,N:P高时表示受P限制,然而N:P的阈值至今还没有明确的界定[15]。在水生和湿地生态系统中,人们常以N:P为14和16作为评判的标准,小于前者则认为N是限制性元素,大于后者则认为P是限制性元素。有关陆生生态系统的养分限制性研究则不统一,差异很大。Güsewell在综述了大量研究结果后提出:N/P < 10时,增加N的输入可以提高植被的生物量; N/P > 20时,增加P的输入可以提高植被的生物量;当比值处于两者之间时,则关系不明显,即认为受到N、P的共同限制[14]。按照此阈值进行分析,本研究植物的生长受N限制较大。
3.2 不同森林类型植物叶片N、P含量及N:P
马尾松林、杉木林和阔叶林植物叶片的N、P含量及N:P之间无显著差异,但是与马尾松阔叶混交林、杉木阔叶混交林和马尾松杉木阔叶混交林均表现出了显著的差异。马尾松林、杉木林和阔叶林植物叶片的N含量及N:P远远高于马尾松阔叶混交林、杉木阔叶混交林和马尾松杉木阔叶混交林,而马尾松林、杉木林和阔叶林植物叶片的P含量又远远低于马尾松阔叶混交林、杉木阔叶混交林和马尾松杉木阔叶混交林。说明针阔混交林改变了单一纯林植物叶片N、P含量及N:P,从而改变了植物生长的受控特征,体现了叶片属性间的经济策略[15],但是针阔混交林怎样改变叶片N、P含量及N:P,需要对不同树种混交、不同的混交方式和不同的混交比例等进行广泛的、更深层次的研究。
3.3 不同生活类型植物叶片N、P含量及N:P
本研究结果表明,不同生活类型(即乔木、灌木、草本)植物叶片N、P含量及N:P差异不明显,说明影响植物叶片N、P和N:P的因素非常复杂,一方面依赖于利用价值较高的营养元素的浓度;另一方面,在物种之间和营养物质匮乏的地区其响应过程有所不同[10]。草本植物的叶片N、P含量低于乔木与灌木的植物叶片N、P含量,而乔木与灌木的植物叶片N、P含量差别不大。说明森林内的草本植物吸收同等单位养分产生的生物量低于乔木与灌木,即木本植物具有较高的养分利用效率[16]。
[1]Stemer R W,Elser J J. Ecological Stoichiometry:the biology of elements from molecules to the biosphere[M]. Princeton:Princeton University Press,2002.
[2] Zhang LX, Bai YF, Han XG (2003). Application of N : P stoichiometry to ecology studies[J]. Acta Botanica Sinica,45,1009~1018.
[3]曾德慧,陈广生.生态化学计量学:复杂生命系统奥秘的探索[J].植物生态学报,2005,29(6):1007~1019.
[4]王绍强,于贵瑞.生态系统碳氮磷元素的生态化学计量学特征[J].生态学报,2008,28(8):3937~3947.
[5] 王晶苑,王绍强,李纫兰,等.中国四种森林类型主要优势植物的C:N:P化学计量学特征[J].植物生态学报,2011,35(6):87~595.
[6] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科学技术出版社,2000.
[7] 任书杰,于贵瑞,陶波,等.中国东部南北样带654种植物叶片氮和磷的化学计量学特征研究[J].环境科学,2007,28(12):2665~2673.
[8]Han W X,Fang J Y,Guo D L,et al.Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China[J].New Phytdngist,2005,168:377~385.
[9]Reich P B,Oleksyn J.Global patterns of plant leaf N and P in relation to temperature and latitude[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101:11001~11006.
[10]Elser JJ,Fagan W F,Denno R F,et al. Nutritional constraints in terrestrial and freshwater food webs[J].Nature,2000,408:578~580.
[11]Han W X,Fang J Y,Guo D L,et al.Leaf nitrogen and phosphorus stoichiometry across 753 terrestrial plant species in China[J].New Phytdngist,2005,168:377~385.
[12]He JS, Wang L, Flynn DFB, Wang XP, Ma WH, Fang JY (2008). Leaf nitrogen: phosphorus stoichiometry across Chinese grassland biomes. Oecologia,155,301~310.
[13]贺金生,韩兴国.生态化学计量学:探索从个体到生态系统的统一化理论[J].植物生态学报,2010,34(1):2~6.
[14]Güsewell S (2004). N : P ratios in terrestrial plants: variation and functional significance. New Phytologist,164,243~266.
[15]Wright IJ,Reich PB,Westoby M,Ackerly DD,Baruch Z,Bongers F,Cavender-Bares J,Chapin T,Cornelissen JHC,Diemer M,Flexas J,Garnier E,Groom PK,Gulias J,Hikosaka K,Lamont BB,Lee T,Lee W,Lusk C,Midgley JJ,Navas M,Niinemets ü,Oleksyn J,Osada N,Poorter H,Poot P,Prior L,Pyankov VI, Roumet C,Thomas SC,Tjoelker MG,Veneklaas EJ,Villar R (2004). The worldwide leaf economics spectrum. Nature,428,821~827.[16] 阎恩荣,王希华,郭明,等.浙江天童常绿阔叶林、常绿针叶林与落叶阔叶林的C:N:P化学计量特征[J].植物生态学报,2010,34(1):48~57.
Leaf Nitrogen and Phosphorus Stoichiometry Characteristics of Common Forest Typesin Southeastern Guizhou,China
LI Shi-Jie
( Forestry Survey and Planning Institute of Guizhou province,, Guiyang ,Guizhou 550003)
The leaf N and P stoichiometry characteristics of 6 common forest types including pure Pinus massoniana, pure Chinese Fir, Pinus massoniana and broad-leaved mixed forest,Chinese Fir and broad-leaved mixed forest, Pinus massoniana and Chinese Fir and other broad-leaved mixed forest in Southeastern Guizhou was analyzed. The results showed that: the arithmetic mean of leaf nitrogen was 13.1503 g·kg-1, the geometric mean of leaf phosphorus was 1.2410g·kg-1,and the arithmetic mean of N:P was 15.8096; There were both significant differences between coniferous forest and coniferous mixed forest, and broad-leaved forest and coniferous mixed forest for leaf N,P and N:P mass ratio. Leaf N content in coniferous forest and broad-leaved forest was much higher than that in conifer and broad-leaved mixed forest, while leaf P content in conifer and broad-leaved mixed forest was far greater than that in coniferous forest and broad-leaved forest. There were not obvious differences in three life-forms (trees, shrubs, and herbs) for N, P and N: P mass ratio.
Stoichiometry; N; P; Limitative nutrient; Forest type; Southeastern Guizhou
2016-07-09
李世杰(1971~),贵州仁怀,高级工程师。E-mail:361421397@qq.com。
中国科学院战略性先导科技专项(XDA05050205)
S718.43
B

