高效毛细管电泳用于检测黄花菜中4 种活性物质
郭芳芳,冯 锋,白云峰,刘荔贞,陈泽忠,周静清,曹雨迪(山西大同大学化学与环境工程学院,山西 大同 037009)
高效毛细管电泳用于检测黄花菜中4 种活性物质
郭芳芳,冯 锋*,白云峰,刘荔贞,陈泽忠,周静清,曹雨迪
(山西大同大学化学与环境工程学院,山西 大同 037009)
使用高效毛细管电泳法,对黄花菜中活性化合物芦荟大黄素、山柰酚、绿原酸和槲皮素进行检测。在最佳电泳条件为10 mmol/L Na2B4O7-H3BO3缓冲溶液、pH 9.15、紫外检测波长224 nm、30 kV的外加电压条件下进样5 s,4 种物质在6 min内实现了分离,4 种物质的线性范围分别为0.02~0.21、0.01~0.90、0.01~0.99、0.01~0.90 mg/mL,线性相关系数在0.997 6~0.999 6之间,检出限分别为2.45×10-5、1.41×10-5、1.78×10-5、8.63×10-6mg/mL(RSN=3),平均回收率在97.5%~101.2%之间,相对标准偏差不大于4.76%。实验结果表明该方法快速准确,适合用于黄花菜中活性物质的检测。
高效毛细管电泳;黄花菜;槲皮素
郭芳芳, 冯锋, 白云峰, 等. 高效毛细管电泳用于检测黄花菜中4 种活性物质[J]. 食品科学, 2016, 37(4): 73-76. DOI:10.7506/spkx1002-6630-201604013. http://www.spkx.net.cn
GUO Fangfang, FENG Feng, BAI Yunfeng, et al. Determination of four active compounds in nightlily (Hemerocallis citrina) flowers by high performance capillary electrophoresis[J]. Food Science, 2016, 37(4): 73-76. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201604013. http://www.spkx.net.cn
黄花菜是一种百合科萱草属的多年生草本植物,又名“金针菜”、“忘忧草”、“萱草”[1],黄花菜营养丰富,是一种常见的食疗食品。研究[2]发现,黄花菜中含有蒽醌类、多酚类、萜类、内酰胺类、生物碱类、甾体皂苷等活性成分。其中,芦荟大黄素是黄花菜中主要的蒽醌类化合物之一,具有健胃、抗炎抗菌等功效[3-5]。同时,黄花菜中还含有包括山柰酚、绿原酸和槲皮素等多酚类化合物。据报道,这些化合物具有一定的药理作用,能够起到抗氧化[6-9]、降血糖[10-12]、降血脂[13-15]、软化血管[16]、抗敏[17]、抗癌[18-20]、抗炎[21-24]等多种作用。
赵二劳等[25]采用分光光度法测定了黄花菜中总黄酮;陈晖等[26]采用高效液相色谱法对甘肃省不同产地萱草花蕾中芦丁、槲皮素、山柰酚进行了测定。但鲜见使用高效毛细管电泳法对黄花菜中活性成分测定的报道。本实验采用高效毛细管电泳法对山西省大同县黄花菜中芦荟大黄素、山柰酚、绿原酸以及槲皮素进行测定,以期为黄花菜的质量控制和评价提供数据参考。
1 材料与方法
1.1 材料与试剂
干制黄花菜 市购;硼砂(分析纯) 天津化学试剂三厂;氢氧化钠(分析纯) 天津市化学试剂批发公司;芦荟大黄素、绿原酸、山柰酚、槲皮素对照品美国阿拉丁试剂公司;实验用水均为二次蒸馏水。
1.2 仪器与设备
P/ACETMMDQ高效毛细管电泳仪(配有紫外检测器以及32Karat软件) 美国Beckman公司;内径75 μm未涂层石英毛细管 邯郸鑫诺光纤色谱有限公司;TDL-16B型离心机 上海安亭科学仪器厂;PSH-2C型精密酸度计 上海大普仪器有限公司;0.22 μm一次性针孔过滤器 天津津腾实验设备有限公司;Lambda35紫外-可见分光光度计 美国PerkinEimer公司;KQ5200DA型数控超声波清洗器 昆山市超声仪器有限公司;AP250D分析天平 美国Ohaus公司。
1.3 方法
1.3.1 溶液的制备
精密称取2.148 mg芦荟大黄素、9.68 mg山柰酚、9.88 mg绿原酸和8.96 mg槲皮素于4 个10 mL容量瓶中,用甲醇溶解后定容成相应质量浓度的标准储备液。
1.3.2 样品处理
取适量黄花菜,在真空干燥器中烘干,后将其研成粉末,精密称取1 g于50 mL的锥形瓶中,加入20 mL体积分数75%甲醇溶液并封口,超声提取60 min,再用体积分数75%甲醇溶液补足20 mL,将萃取所得溶液转移至离心管中,以8 000 r/min离心10 min,将上层清液去除,用0.22 μm一次性针孔过滤器过滤2 次,置于4 ℃的冰箱中保存备用。
1.3.3 操作条件
在25 psi条件下,分别用0.1 mol/L NaOH溶液、二次蒸馏水和缓冲溶液各冲洗30 min实现新毛细管的活化;实验中2 次进样间分别用0.1 mol/L NaOH溶液、二次蒸馏水和缓冲溶液冲洗5 min。检测波长224 nm;分离电压30 kV;进样时间5 s;缓冲溶液:10 mmol/L Na2B4O7-H3BO3,pH 9.15。
2 结果与分析
2.1 电泳条件的确定
2.1.1 检测波长的选择
配制一定质量浓度的芦荟大黄素、山柰酚、绿原酸和槲皮素的标准溶液,用甲醇做空白,在波长200~450 nm范围内对其进行紫外扫描,确定4 种活性物质在波长224 nm处均有较大吸收,故将波长224 nm作为最佳检测波长。
2.1.2 缓冲溶液pH值的选择
缓冲溶液pH值通过影响电渗流的大小和分析物的解离情况,进而影响分析物的分离情况,考察pH值分别在9.05、9.15、9.25、9.35时对4 种分析物分离情况的影响,如图1所示。结果表明,当pH值为9.05时,绿原酸和槲皮素两峰分离情况较差;pH值为9.15时,4 种分析物完全分离;随着pH值增大到9.25时,山柰酚和绿原酸两峰分离度下降,当pH值为9.35时,山柰酚和绿原酸两峰部分重合,分离不完全,因此实验中选择9.15做为最佳pH值。
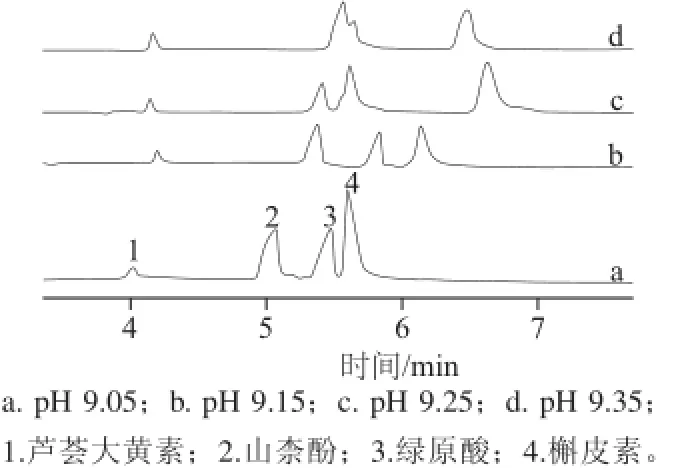
图1 pH值对4 种化合物分离的影响Fig.1 Effect of running buffer pH on the separation of four compounds
2.1.3 缓冲溶液浓度的影响
缓冲溶液浓度会引起Zeta电势、溶液黏度以及电渗流的变化,进而造成分析物迁移时间和分离情况的变化。考察Na2B4O7-H3BO3缓冲溶液在不同浓度(10、20、30、40、50 mmol/L)时,4 种分析物迁移时间的变化,如图2所示。随着缓冲溶液浓度增大,电流不断增大,分析物迁移时间变长,分析物之间分离度变大。综合考虑,本实验选择最佳的缓冲溶液为10 mmol/L Na2B4O7-H3BO3。

图2 缓冲溶液浓度对4 种化合物分离的影响Fig.2 Effect of running buffer concentration on the separation of four compounds
2.1.4 外加电压对分离的影响
外加电压会对分析物的迁移速率以及电渗流的大小产生影响,进而影响分析物的分离情况。外加电压较低时,迁移时间延长,峰形展宽,当外加电压增大时,样品迁移速率增大,迁移时间缩短,但是产生的焦耳热也会增加,基线噪音增大,不利于分析物的分离。考察外加电压分别为15、20、25、30 kV时,4 种黄酮类化合物的分离情况,如图3所示。外加电压为15 kV时,分析物可以完全分离,但是所需时间长,随着外加电压的升高,分析时间不断缩短;外加电压为30 kV时,4 种化合物分离时间最短,且仍能得到良好的分离。综合考虑,选择30 kV作为最佳外加电压。

图3 分离电压对4 种化合物分离的影响Fig.3 Effect of applied voltages on the separation of four compounds
2.1.5 进样时间对分离的影响
进样时间对分离效果也会产生一定的影响,进样时间短,峰面积小,分析误差大;随着进样时间变长,峰面积大,但是会引起峰形展宽,分析物分离效率下降。考察进样时间为3、4、5、6 s时分析物的分离情况,如图4所示。随着进样时间变长,峰面积不断变大,分析时间有所缩短,但是当进样时间为6 s时,有2 个峰发生重合,分离效果受到影响。综合考虑,选择5 s作为最佳进样时间。

图4 进样时间对4 种化合物分离的影响Fig.4 Effect of injection duration on the separation of four compounds
2.2 标准曲线及检出限
用甲醇对标样进行稀释,配制4 种分析物的系列溶液,在最佳电泳条件下进行测定,以峰面积对质量浓度作图,得到线性方程、线性相关系数(0.997 6~0.999 6)、线性范围和各物质的检出限(RSN=3),如表1所示,线性关系良好,检出限为8.63×10-6mg/mL。

表1 4 种化合物的线性方程及检出限Table 1 Standard curves and limits of detection for determination of four compounds by HPCE
2.3 精密度实验结果
通过考察4 种被分析物迁移时间以及峰面积的日内、日间相对标准偏差,对方法的精密度进行评估。4 种标样各取50 μL混合均匀,在最优电泳条件下日内、日间连续进样3 次,根据所得数据计算4 种被分析物迁移时间和峰面积的相对标准偏差,得到日间、日内精密度,结果见表2。日内精密度相对标准偏差不大于2.27%,日间精密度相对标准偏差不大于4.90%,表明该方法精密度良好。

表2 精密度实验结果Table 2 Results of precision test
2.4 回收率实验结果
在最佳电泳条件下进行回收率实验,通过向黄花菜提取液中分别加入一定量(3 个水平)的被分析化合物,测定回收率,结果如表3所示,平均回收率范围在97.5%~101.2%之间,相对标准偏差在1.04%~4.76%之间,表明该方法准确可靠。
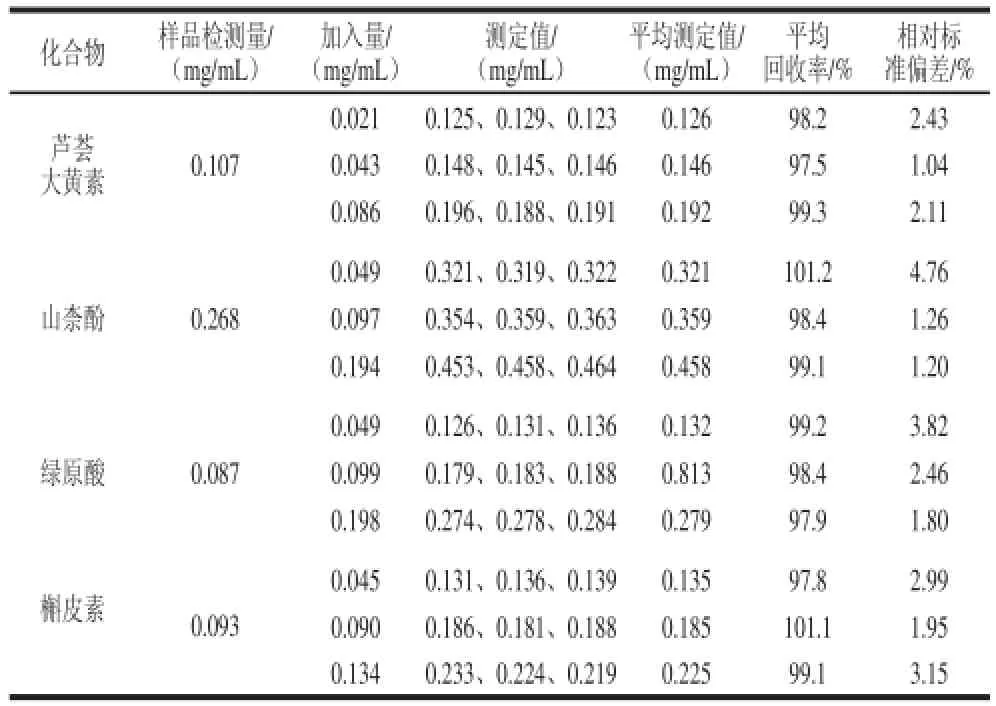
表3 回收率实验结果(n=3)Table 3 Results of recovery test (n= 3)
2.5 实际样品的测定结果
按照1.3.2节方法对大同县黄花菜处理,在最佳电泳条件下对提取液芦荟大黄素、山柰酚、绿原酸和槲皮素进行测定,如图5所示,黄花菜中芦荟大黄素、山柰酚、绿原酸以及槲皮素含量分别为2.14、5.36、1.74、1.86 mg/g。

图5 毛细管电泳谱图Fig.5 Capillary electrophoresis chromatograms
3 结 论
使用高效毛细管电泳-紫外检测法对黄花菜中芦荟大黄素、山柰酚、绿原酸和槲皮素4 种活性化合物进行了测定,在最佳电泳条件下,4 种被分析化合物在6 min内实现了分离,线性范围分别为0.02~0.21、0.01~0.90、0.01~0.99、0.01~0.90 mg/mL,检出限分别为2.45×10-5、1.41×10-5、1.78×10-5、8.36× 10-6mg/mL(RSN=3),线性相关系数在0.997 6~0.999 6之间,平均回收率为97.5%~101.2%,相对标准偏差不大于4.76%。实验结果表明该方法快速准确,适合用于黄花菜中活性物质的检测。
[1] 许国宁, 张卫明, 孙晓明, 等. 黄花菜的采后生理与保鲜技术研究进展[J]. 中国野生植物资源, 2011, 30(3): 9-13. DOI:10.3969/ j.issn.1006-9690.2011.03.003.
[2] 傅茂润, 茅林春. 黄花菜的保健功效及化学成分研究进展[J]. 食品与发酵工业, 2006, 32(10): 108-112. DOI:10.3321/j.issn:0253-990X.2006.10.027.
[3] 刘桂花, 何承辉, 邢建国, 等. HPLC法同时测定复方苏润江滴丸中秋水仙碱、芦荟苷及芦荟大黄素的含量[J]. 药品分析杂志, 2013(3): 409-413.
[4] LI S W, YANG T C, LAI C C, et al. Antiviral activity of aloe-emodin against influenza a virus via galectin-3 up-regulation[J]. European Journal of Pharmacology, 2014, 28(5): 125-132. DOI:10.1016/ j.ejphar.2014.05.028.
[5] HU B Y, ZHANG H, MENG X L, et al. Aloe-emodin from rhubarb (Rheum rhabarbarum) inhibits lipopolysaccharide-induced inflammatory responses in RAW264.7 macrophages[J]. Journal of Ethnopharmacology, 2014, 59(3): 846-853. DOI:10.1016/ j.jep.2014.03.059.
[6] 白雪松, 张晶莹, 李善姬. 萱草总黄酮体外抗氧化研究[J]. 食品研究与开发, 2013, 34(21): 19-22. DOI:10.3969/j.issn.1005-6521.2013.21.006.
[7] 关炳峰, 谭军, 周志娣. 金银花提取物的抗氧化作用与其绿原酸含量的相关性研究[J]. 食品工业科技, 2007, 28(10): 127-129. DOI:10.3969/j.issn.1002-0306.2007.10.037.
[8] 刘英, 王之盛, 周安国, 等. 橙皮苷和绿原酸的体内外抗氧化效应研究[J]. 食品科学, 2009, 30(23): 196-199.
[9] AlAMDI N, MULLEN W, CROZIER A. Tea prepared from Anastatica hirerochuntica seeds contains a diversity of antioxidant flavonoids, chlorogenic acids and phenolic compounds[J]. Phytochemistry, 2010, 17(11): 248-254. DOI:10.1016/j.phytochem.2010.11.017.
[10] ZHANG Y L, LIU D M. Flavonol kaempferol improves chronic hyperglycemia-impaired pancreatic beta-cell viability and insulin secretory function[J]. European Journal of Pharmacology, 2011, 670(1): 325-332. DOI:10.1016/j.ejphar.2011.08.011.
[11] FANG X K, GAO J, ZHU D N. Kaempferol and quercetin isolated from Euonymus alatus improve glucose uptake of 3T3-L1 cells without adipogenesis activity[J]. Life Sciences, 2008, 82(11/12): 615-622. DOI:10.1016/j.ifs.2007.12.021.
[12] RODRIGUEZ P, GONZALEZ-MUJICA F, BERMUDEZ J, et al. Inhibition of glucose intestinal absorption by kaempferol 3-O-αrhamnoside purified from Bauhinia megalandra leaves[J]. Fitoterapia, 2010, 81(8): 1220-1223. DOI:10.1016/j.fitote.2010.08.007.
[13] LARSON A, WITMAN A H, GUO Y, et al. Acute, quercetin-induced reductions in blood pressure in hypertensive individuals are not secondary to lower plasma angiotensin-converting enzyme activity or endothelin-1: nitric oxide[J]. Nutrition Research, 2012, 32(8): 557-564. DOI:10.1016/j.nutres.2012.06.018.
[14] CHO A S, JEON S M, KIM M J, et al. Chlorogenic acid exhibits anti-obesity property and improves lipid metabolism in high-fat dietinduced-obese mice[J]. Food and Chemical Toxicology, 2010, 3(1): 937-943. DOI:10.1016/j.fct.2010.01.003.
[15] LI S Y, CHANG C Q, MA F Y, et al. Modulating effects of chlorogenic acid on lipids and glucose metabolism and expression of hepatic peroxisome proliferator-activated receptor-α in golden hamsters fed on high fat diet[J]. Biomedical and Environmental Sciences, 2009, 22(2): 122-129. DOI:10.1016/S0895-3988(09)60034-9.
[16] XIAO H B, LU X Y, SUN Z L, et al. Kaempferol regulates OPNCD44 pathway to inhibit the atherogenesis of apolipoprotein E deficient mice[J]. Toxicology and Applied Pharmacology, 2011, 257(3): 405-411. DOI:10.1016/j.taap.2011.09.024.
[17] MEDEIROS F O K C P, FAUSTINO L, BORDUCHI E, et al. Preventive and curative glycoside kaempferol treatments attenuate the TH2-driven allergic airway disease[J]. International Immunopharmacology, 2009, 9(13/14): 1540-1548. DOI:10.1016/ j.intimp.2009.09.005.
[18] LUO H T, GARY O, LI Z L, et al. Kaempferol induces apoptosis in ovarian cancer cells through activating p53 in the intrinsic pathway[J]. Food Chemistry, 2011, 128(2): 513-519. DOI:10.1016/ j.foodchem.2011.03.073.
[19] CHEN A Y, CHEN Y C. A review of the dietary flavonoid, kaempferol on human health and cancer chemoprevention[J]. Food Chemistry, 2013, 138(4): 2099-2107. DOI:10.1016/j.foodchem.2012.11.139.
[20] YOSHIDA T, KONISHI M, HORINAKA M, et al. Kaempferol sensitizes colon cancer cells to TRAIL-induced apoptosis[J]. Biochemical and Biophysical Research Communications, 2008, 375(1): 129-133. DOI:10.1016/j.bbrc.2008.07.131.
[21] RAJENDRANA P, RENGARAJANA T, NANDAKUMA R N, et al. Kaempferol, a potential cytostatic and cure for inflammatory disorders[J]. European Journal of Medicinal Chemistry, 2014, 86(2): 103-112. DOI:10.1016/j.ejmech.2014.08.011.
[22] SHINA H S, SAISU H, BEA M J, et al. Anti-inflammatory effect of chlorogenic acid on the IL-8 production in Caco-2 cells and the dextran sulphate sodium-induced colitis symptoms in C57BL/6 mice[J]. Food Chemistry, 2015, 168(1): 167-175. DOI:10.1016/ j.foodchem.204.06.100.
[23] XIAO J, SUN G B, SUN B, et al. Kaempferol protects against doxorubicin-induced cardiotoxicity in vivo and in vitro[J]. Toxicology, 2012, 292(1): 53-62. DOI:10.1016/j.tox.2011.11.018.
[24] KIM T H, KU S K, BAE J S. Inhibitory effects of kaempferol-3-O-sophoroside on HMGB1-mediated proinflammatory responses[J]. Food and Chemical Toxicology, 2012, 50(3/4): 1118-1123. DOI:10/1016/ j.fct.2011.12.004.
[25] 赵二劳, 段晋峰. 分光光度法测定黄花菜中总黄酮[J]. 分析试验室, 2008, 27(9): 94-96. DOI:10.3969/j.issn.1000-0720.2008.09.025.
[26] 陈晖, 黄燕, 瞿继兰. 甘肃不同产地萱草花蕾中芦丁、槲皮素、山柰酚的测定[J]. 药物分析杂志, 2012(9): 1574-1577.
Determination of Four Active Compounds in Nightlily (Hemerocallis citrina) Flowers by High Performance Capillary Electrophoresis
GUO Fangfang, FENG Feng*, BAI Yunfeng, LIU Lizhen, CHEN Zezhong, ZHOU Jingqing, CAO Yudi
(College of Chemical and Environmental Engineering, Shanxi Datong University, Datong 037009, China)
An efficient high performance capillary electrophoresis (HPCE) method was developed for the determination of aloe-emodin, kaempferol, chlorogenic and quercetin in nightlily flowers (Hemerocallis citrina). Sample injection was carried out by hydrodynamic injection for 5 s at 30 kV. The running buffer was 10 mmol/L Na2B4O7-H3BO3(pH 9.15), and the detection wavelength was set at 224 nm. Four target compounds were separated in 6 min. Under these optimal conditions, the linear ranges for the above four compounds were 0.02–0.21, 0.01–0.90, 0.01–0.99, and 0.01–0.90 mg/mL with correlation coefficients between 0.997 6 and 0.999 6, and the limits of detection were 2.45 × 10-5, 1.41 × 10-5, 1.78 × 10-5and 8.63 × 10-6mg/mL (RSN= 3), respectively. The average recoveries were 97.5% to 101.2%, with a relative standard deviation (RSD) less than 4.76%. This method is fast, accurate and suitable for the detection of these active compounds in H. citrine flowers.
high performance capillary electrophoresis (HPCE); Hemerocallis citrina; quercetin
10.7506/spkx1002-6630-201604013
TS207.3
A
2015-06-20
国家自然科学基金面上项目(21375083)
郭芳芳(1989—),女,硕士研究生,主要从事毛细管电泳研究。E-mail:13546046121@163.com
*通信作者:冯锋(1964—),男,教授,博士,主要从事光分析化学研究。E-mail:feng-feng64@263.net

