无斑鹞鲼蛋白质对大鼠胆固醇代谢的影响
丁 琳,王 丹,薛 勇,薛长湖,王玉明*
无斑鹞鲼蛋白质对大鼠胆固醇代谢的影响
丁 琳,王 丹,薛 勇,薛长湖,王玉明*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
目的:探讨无斑鹞鲼蛋白(Aetobatus fl agelum protein,AFP)对高胆固醇模型大鼠胆固醇代谢的影响,并对其可能的作用机制加以研究。方法:5 周龄雄性Sprague-Dawley(SD)大鼠,适应性饲养1 周后,按体质量随机分为酪蛋白对照组、5% AFP组、10% AFP组,分别给予高胆固醇饲料及分别添加5%和10% AFP的高胆固醇饲料。28 d后测定大鼠血清总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平,肝脏TC、游离胆固醇水平,粪便中胆汁酸和中性固醇含量以及肝脏3-羟基-3-甲基戊二酸单酰辅酶A(3-hydroxy-3-methyl glutaryl coenzyme A reductase,HMG-CoA)、胆固醇酰基转移酶2(acyl coenzyme A-cholesterol acyltransferase 2,ACAT2)、胆固醇7α-羟化酶1(cholesterol 7α-hydroxylase 1,CYP7A1)的mRNA表达量。结果:与酪蛋白对照组相比,无斑鹞鲼蛋白可显著降低大鼠血清和肝脏中的TC含量(P<0.05),明显增加血清HDL-C含量(P<0.05),极显著降低大鼠动脉粥样硬化指数(P<0.01)。此外,无斑鹞鲼蛋白可明显增加大鼠粪便中胆汁酸和中性固醇的排出量(P<0.05),并可降低大鼠肝脏中ACAT2 mRNA的表达量(P<0.05),增加CYP7A1 mRNA的表达量(P<0.05),而对HMG-CoA mRNA的作用不显著。结论:无斑鹞鲼蛋白可明显降低大鼠血清和肝脏中的TC含量,降低大鼠血清动脉粥样硬化指数,其作用机制主要与增加肝脏内胆固醇的分解代谢以及促进粪便中性固醇和胆汁酸的排出有关。
无斑鹞鲼蛋白;胆固醇代谢;作用机制
越来越多的研究证明,心血管疾病与高胆固醇饮食密切相关,并且其发病机理主要与非高密度脂蛋白胆固醇以及胆固醇分解合成相关酶的表达量有关[1-2]。目前已有大量动物实验证明硬骨鱼类具有调节胆固醇代谢的作用[3-4],但关于软骨鱼类的类似作用鲜少报道。
无斑鹞鲼(Aetobatus fl agelum)属软骨鱼亚纲,鲼形目,鹞鲼科暖水性底层鱼类。无斑鹞鲼主要摄食贝类和甲壳动物,一般体长为90~160 cm、体质量较大者可达25~30 kg。无斑鹞鲼主要分布于印度洋和太平洋西部,我国东海和南海均可以捕获[5]。无斑鹞鲼一般被加工成干品或用于生产鱼粉,利用价值较低。为了充分有效地利用天然水产资源,开发调节脂肪代谢的新产品,提高低值水产品的利用价值,本课题组对无斑鹞鲼蛋白的血脂调节功能进行了初步研究,结果表明无斑鹞鲼蛋白可降低大鼠血液和肝脏中甘油三酯(triglyceride,TG)水平,对高TG血症具有预防作用,同时还发现,喂食大鼠不含胆固醇饲料时,无斑鹞鲼蛋白可降低大鼠肝脏胆固醇水平,但是却不影响血清总胆固醇和高密度脂蛋白胆固醇水平[6]。本实验在大鼠饲料中添加外源性胆固醇,形成膳食致高胆固醇血症大鼠模型,在此条件下探讨无斑鹞鲼蛋白对大鼠胆固醇代谢的影响。
1 材料与方法
1.1 材料、动物与试剂
无斑鹞鲼购自石岛港,-20 ℃保存。
SPF级5 周龄雄性Spague-Dawley(SD)大鼠,体质量190~200 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2007-0001。
总胆固醇(total cholesterol,TC)试剂盒、高密度脂蛋白(high density lipoprotein cholesterol,HDL-C)试剂盒 北京中生生物工程高技术公司;游离胆固醇(free cholesterol,FC)测定试剂盒、总胆汁酸测定试剂盒日本和光纯药株式会社;Trizol试剂、各种聚合酶链式反应(polymerase chain reaction,PCR)产品(Assayson-Demand Gene Expression Products和Taq Man MGB Gene Expression Kits) 美国Invitrogen公司;Taq Man RT reagent试剂盒、Taq Man Universal PCR Master Mix试剂盒 美国Applied Biosystems公司;其他生化试剂均为分析纯。
1.2 仪器与设备
UV-2550分光光度计、GC-14AH气相色谱仪 日本岛津公司;TC-5色谱柱(30 m×0.25 mm,0.25 μm)日本GL Science公司;ABI Prism 7000实时荧光PCR序列检测系统 美国Applied Biosystems公司。
1.3 方法
1.3.1 无斑鹞鲼肌肉的制备
取新鲜无斑鹞鲼背部两侧肌肉,去除软骨并切碎匀浆,经冷冻干燥后粉碎作为样品无斑鹞鲼蛋白(Aetobatus flagelum protein,AFP)。经凯氏定氮法测得AFP的粗蛋白含量为98.1%,氨基酸组成同文献[6]测定结果一致。索氏提取法测得AFP的总脂质含量为0.6%,采用气相色谱法[7]测得AFP总脂质的脂肪酸组成,结果如表1所示。
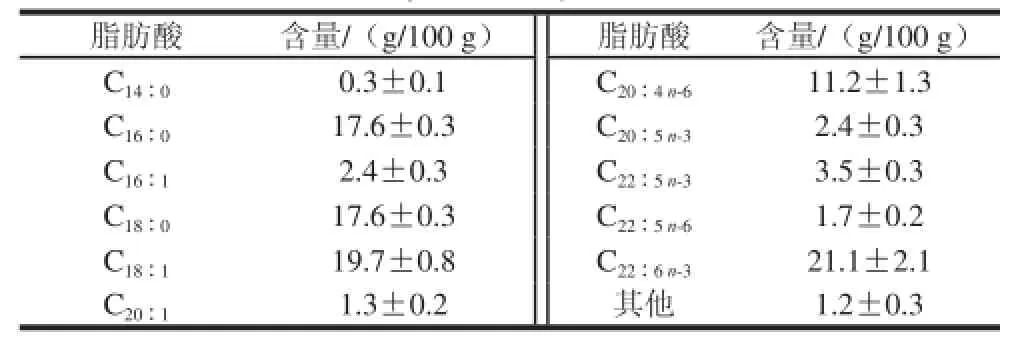
表1 AFP总脂质的脂肪酸组成Table 1 Fatty acid composition of AFP fat
1.3.2 动物分组与饲养
5 周龄雄性SD大鼠,体质量190~200 g,动物饲育室内适应性饲养1 周后按体质量随机分为两组,每组7 只。大鼠配合饲料脂肪含量为5%玉米油和5%猪油,并添加1%胆固醇和0.25%胆酸钠,其他成分按AIN-76配方配制。酪蛋白对照组大鼠喂食基本配合饲料,两个受试组大鼠饲料中分别添加5%和10%的AFP(5% AFP组、10% AFP组),蛋白质不足部分加入酪蛋白使之与酪蛋白对照组大鼠的蛋白摄取量相同。将每只大鼠放入钢丝笼内饲养,室温(23±2) ℃,7:00—19:00照明,饲料和水自由摄食。喂食4 周后,10 h断食不断水,在08:00—10:00乙醚麻醉下取动脉全血处死大鼠,取出肝脏于-80 ℃存放待用。
1.3.3 大鼠血清和肝脏内胆固醇含量测定
血液室温放置30 min后3 000 r/min离心获得血清,按照试剂盒说明书方法测定TC、HDL-C水平,动脉粥样硬化指数(atherosclerosis index,AI)测定按下式进行。肝脏脂质按Folch等[8]的方法抽提后浓缩,TC、FC含量采用试剂盒测定,操作严格按照说明书步骤进行。
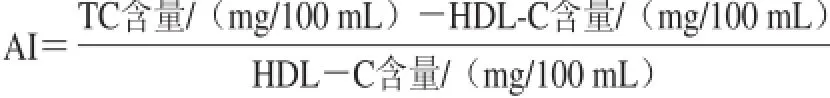
1.3.4 大鼠粪便中胆汁酸和中性固醇含量的测定[9]
连续2 d取大鼠粪便(大鼠处死前2 d),冻干后称质量。磨碎后取100 mg加入适量内标物5α-胆甾醇,再加乙醇反复抽提3 次,减压蒸干。加适量NaOH,于120 ℃加热6 h使结合型胆汁酸游离。冷却至室温后加入乙醚抽提3 次获得总固醇类样品,剩余溶液加适量盐酸调至酸性,再用乙醚抽提3 次作为总胆汁酸样品。总胆汁酸含量采用试剂盒测定。总固醇类含量用气相色谱法测定,进样口温度300 ℃,检测口温度300 ℃,色谱柱温度280 ℃,进行恒温分析。
1.3.5 大鼠肝脏胆固醇代谢相关酶基因表达的测定
肝脏胆固醇代谢相关酶mRNA定量采用实时荧光PCR法。肝脏总RNA提取使用Trizol试剂盒,操作按照说明书方法进行。反转录反应使用Taq Man RT reagent试剂盒、PCR反应使用Taq Man Universal PCR Master Mix试剂盒,按照说明书步骤操作。各种PCR引物见表2。大鼠肝脏胆固醇代谢相关酶mRNA表达量以其与18S rRNA量的比值表示,并规定对照组为100%[10]。
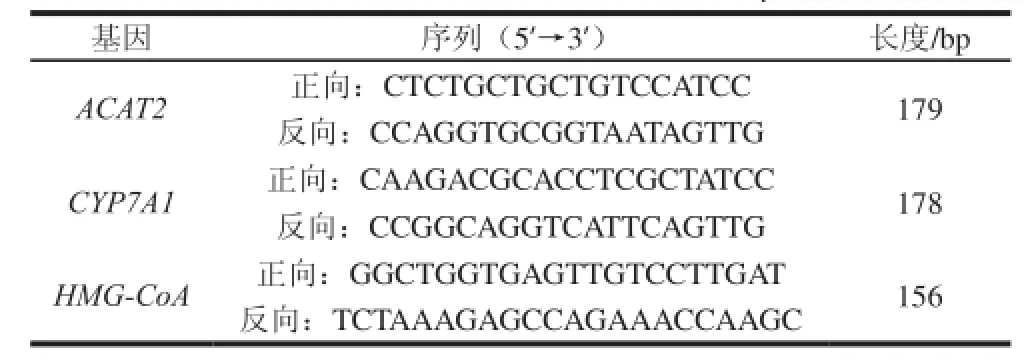
表2 所需引物序列Table 2 Primers used in this study
1.4 数据统计处理
数据以±s表示,3 组间采用Duncan’s多重比较分析,以P<0.05为差异显著,两组之间采用t检验法处理。
2 结果与分析
2.1 AFP对大鼠生长指标的影响
如表3所示,不同处理组大鼠在28 d实验期内的初体质量、终体质量及每天的摄食量基本相同,无显著差异。实验结束时,与酪蛋白对照组大鼠相比,5% AFP组、10% AFP组大鼠的肝脏质量明显降低。
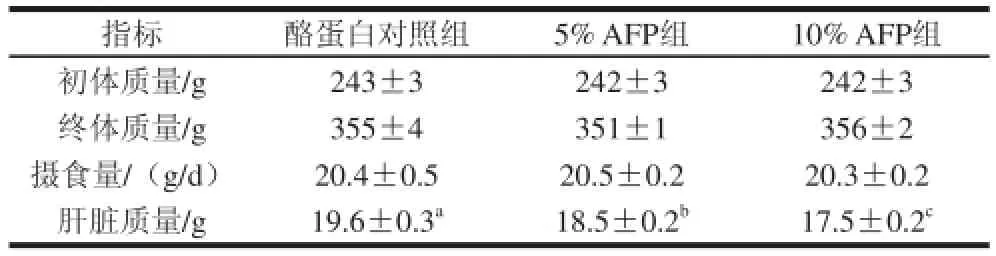
表3 AFP对大鼠生长指标的影响 (x± s, n= 7)Table 3 Effect of Aetobatus flfl agelum protein on the growth parameters in rats (x± s, n= 7)
2.2 AFP对大鼠血脂水平的影响

表4 AFP对大鼠血清脂质水平的影响 (x± s, n= 7)Table 4 Effect of Aetobatus flfl agelum protein on concentrations of serum lipids in SD rats (x± s, n= 7)
由表4可知,摄食AFP后,大鼠血清中TC水平明显低于酪蛋白对照组,而HDL-C水平高于酪蛋白对照组,与酪蛋白对照组相比,5% AFP组、10% AFP组大鼠血清中TC水平分别降低了35.4%和42.5%,HDL-C水平分别升高了21.0%和36.9%,摄食AFP的大鼠AI明显低于酪蛋白对照组。
2.3 AFP对大鼠肝脏胆固醇水平的影响

表5 AFP对大鼠肝脏脂质含量的影响(x±s,n =7)Table 5 Effect of Aetobatus flfl agelum protein on concentrations of hepatic cholesterol in SD rats (x±s,n = 7)
由表5可知,摄食5%、10% AFP后,大鼠肝脏TC含量显著降低,较酪蛋白对照组分别降低了20.7%和34.8%,其中10% AFP组的效果最佳。进一步测定大鼠肝脏组织中FC和胆固醇酯发现,摄食AFP后大鼠肝脏组织中FC含量虽然降低,但与酪蛋白对照组相比差异不显著,而胆固醇酯含量显著下降。以上结果表明,食用AFP可以减少胆固醇在大鼠肝脏内的蓄积。
2.4 AFP对大鼠粪便中胆汁酸和中性固醇排泄量的影响

表6 AFP对大鼠粪便中胆汁酸和中性固醇排泄量的影响(x± s, n=7)Table 6 Effect of Aetobatus flfl agelum protein on fecal bile acid and neutral steroid in SD rats (x± s, n= 7)
由表6可知,实验期间在相同时间内所采集5%、10% AFP组和酪蛋白对照组大鼠的粪便质量相等,而在此基础上,5%、10% AFP组大鼠粪便的中性固醇、胆汁酸含量显著高于酪蛋白对照组(P<0.05),尤其以10% AFP组明显。以上结果表明,摄食AFP可明显促进大鼠排泄胆固醇和胆汁酸。
2.5 AFP对大鼠肝脏胆固醇代谢相关酶mRNA表达量的影响
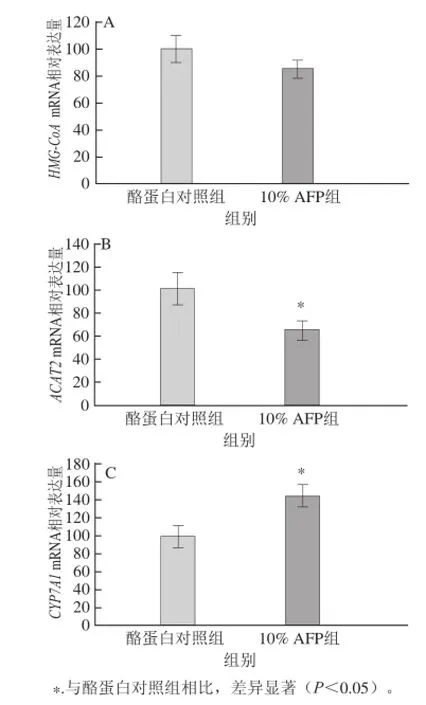
图1 AFP对大鼠肝脏胆固醇代谢相关酶mRNA表达量的影响Fig.1 Effect of Aetobatus fl agelum ptotein on mRNA expression of hepatic enzymes involved in cholesterol metabolism in SD rats
如图1所示,与酪蛋白对照组相比,10% AFP组大鼠肝脏胆固醇合成限速酶HMG-CoA mRNA的表达量降低,但没有显著差异;ACAT2是肝脏内催化游离胆固醇与长链脂肪酸连接形成胆固醇酯的关键酶,摄食AFP后,大鼠肝脏的ACAT2 mRNA表达量显著降低,表明AFP能够抑制胆固醇酯的合成;同时,摄食AFP能够增加大鼠肝脏的CYP7A1 mRNA表达量,从而增强大鼠肝脏胆固醇的异化代谢。
3 讨 论
研究表明,不同来源蛋白质对动物胆固醇代谢的调节作用不同,例如与酪蛋白相比,大豆蛋白可上调CYP7A1 mRNA的表达量,提高CYP7A1的活性,促进胆固醇转化成胆汁酸,从而降低血清胆固醇水平[11]。不同水产鱼肉蛋白对于胆固醇代谢的调节作用也有所不同,Wergedahl等[12]发现,大马哈鱼蛋白水解物能明显降低大鼠血清TC、TG及肝脏总脂水平,Zhang Xizhong等[13]研究表明,欧蝶鱼蛋白比鳕鱼蛋白有更为明显的降胆固醇效果。Shukla等[14]发现阿拉斯加鳕鱼蛋白可显著降低Wistar大鼠血清TC、TG浓度,但肝脏TC含量却明显增多,而Hosomi等[4]研究发现阿拉斯加狭鳕能够降低大鼠血清胆固醇含量,并且能够抑制胆固醇和胆汁酸的吸收。本实验发现,摄食AFP可显著改善大鼠胆固醇代谢状况。
肝脏是胆固醇合成代谢的主要器官,直接影响血清TC含量。本实验结果显示,在摄入蛋白质含量一致的条件下,AFP可明显降低大鼠血清TC含量,并且肝脏内胆固醇水平明显降低,提示肝脏胆固醇水平降低可能是血清TC含量降低的原因之一。肝脏主要通过调节胆固醇的合成、 吸收、酯化及向消化道内排泄和重吸收(肝肠循环)等途径以维持正常的胆固醇代谢水平。在胆固醇代谢过程中存在许多调控代谢的关键酶类、载脂蛋白、蛋白受体等胆固醇代谢的重要调控位点,对这些调控因子的研究可以准确把握机体胆固醇代谢的调控路径[15-17]。HMG-CoA是胆固醇合成的限速酶[18-19],本实验结果显示,摄食AFP对大鼠肝脏HMG-CoA mRNA表达量无显著影响,说明其对肝脏内TC含量的降低作用与胆固醇合成抑制无关。ACAT2可催化FC与长链脂肪酸连接形成胆固醇酯,进而组装成脂蛋白,以脂蛋白的形式由肝脏向血液中分泌,为外周组织所利用,从而维持胆固醇在肝脏内的代谢平衡[20]。本实验结果显示,无斑鹞鲼蛋白可显著减少ACAT2 mRNA的表达量,表明无斑鹞鲼蛋白的摄入可能降低了肝脏内胆固醇的酯化过程,影响了其向血液中的分泌,从而降低了血液中胆固醇的水平。CYP7A1是胆固醇降解为胆汁酸的关键酶[21],肝细胞内胆固醇在CYP7A1的催化下脱氢生成7α-羟化胆固醇,经多个酶促反应步骤生成胆汁酸排出体外,已经有研究证明,胆汁酸对CYP7A1具有负反馈调节作用[22-24]。本研究发现,AFP的摄入显著提高了肝脏CYP7A1基因的表达量,该结果提示AFP的摄入可能促进了肝内胆固醇向胆汁酸的转化,降低肝内胆固醇含量。
为了进一步明确肝脏内胆固醇代谢变化的原因,本实验对大鼠粪便中胆汁酸和中性固醇的排出量进行了测定,结果显示AFP摄入组大鼠粪便的中性固醇以及胆汁酸含量均显著高于酪蛋白对照组,表明AFP可以明显增加大鼠中性固醇和胆汁酸的排泄。大鼠肝肠循环受阻,胆汁酸排泄量增加[25-26],这可能也是导致大鼠肝脏内CYP7A1 mRNA表达量升高的原因。
综上所述,AFP可明显降低大鼠血清和肝脏中TC水平,降低大鼠血清AI,其 作用机制主要与增加肝脏内胆固醇的分解代谢以及促进粪便中性固醇和胆汁酸排出有关。
[1] SILBERNAGEL G, CHAPMAN M J, GENSER B, et al. High intestinal cholesterol absorption is associated with cardiovascular disease and risk alleles in ABCG8 and ABO: evidence from the LURIC and YFS cohorts and from a meta-analysis[J]. Journal of the American College of Cardiology, 2013, 62(4): 291-299. DOI:10.1016/ j.jacc.2013.01.100.
[2] 贺嘉. 结晶体对人THP-1单核细胞ABCA1表达及胆固醇流出的影响[D]. 长沙: 中南大学, 2013: 1-47.
[3] HOSOMI R, FUKUNAGA K, ARAI H, et al. Fish protein hydrolysates affect cholesterol metabolism in rats fed non-cholesterol and highcholesterol diets[J]. Journal of Medicinal Food, 2012, 15(3): 299-306. DOI:10.1089/jmf.2011.1620.
[4] HOSOMI R, FUKUNAGA K, ARAI H, et al. Fish protein decreases serum cholesterol in rats by inhibition of cholesterol and bile acid absorption[J]. Journal of Food Science, 2011, 76(4): H116-H121. DOI:10.1111/j.1750-3841.2011.02130.x.
[5] 李明德. 鱼类分类学[M]. 北京: 海洋出版社, 1998: 48-49.
[6] 王玉明, 胡晓倩, 任兵兴, 等. 无斑鹞鲼肉对大鼠脂质代谢的影响[J].食品科学, 2010, 31(7): 251-255.
[7] 刘艳青, 李兆杰, 楼乔明, 等. 皱纹盘鲍内脏脂质分析[J]. 水产学报, 2012, 36(6): 989-992. DOI:10.3724/SP.J.1231.2012.27832.
[8] FOLCH J, LEES M, SLOANE-STANLEY G H. A simple method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[9] KISHIDA T, NOGAMI H, OGAWA H, et al. The hypocholesterolemic effect of high amylose cornstarch in rats is mediated by an enlarged bile acid pool and increased fecal bile acid excretion, not by cecal fermented products[J]. Journal of Nutrition, 2002, 132(9): 2519-2524. [10] WANG Y, NAGAO K, INOUE N, et al. Isomer-specific anti-obese and hypolipidemic properties of conjugated linoleic acid in obese OLETF rats[J]. Bioscience, Biotechnology, and Biochemistry, 2006, 70(2): 355-362. DOI:10.1271/bbb.70.355.
[11] 郭连莹. 大豆蛋白对高胆固醇血症大鼠胆固醇代谢相关基因表达的影响[D]. 沈阳: 中国医科大学, 2005: 1-40.
[12] WERGEDAHL H, LIASET B, GUDBRANDSEN O A, et al. Fish protein hydrolysate reduces plasma total cholesterol, increases the proportion of HDL cholesterol, and lowers acyl-CoA: cholesterol acyltransferase activity in liver of Zucker rats[J]. Journal of Nutrition, 2004, 134(6): 1320-1327.
[13] ZHANG X Z, BEYNEN A C. Influence of dietary fish proteins on plasma and liver cholesterol concentrations in rats[J]. British Journal of Nutrition, 1993, 69(3): 767-777. DOI:http://dx.doi.org/10.1079/ BJN19930077.
[14] SHUKLA A, BETTZIECHE A, HIRCHE F, et al. Dietary fish protein alters blood lipid concentrations and hepatic genes involved in cholesterol homeostasis in the rat model[J]. British Journal of Nutrition, 2006, 96(4): 674-682. DOI:http://dx.doi.org/10.1079/ BJN20061895.
[15] ASTAPOVA I, RAMADOSS P, COSTA-E-SOUSA R H, et al. Hepatic nuclear corepressor 1 regulates cholesterol absorption through a TRβ1-governed pathway[J]. Journal of Clinical Investigation, 2014, 124(5): 1976. DOI:10.1172/JCI73419.
[16] LI T, FRANCL J M, BOEHME S, et al. Regulation of cholesterol and bile acid homeostasis by the cholesterol 7α-hydroxylase/steroid response element-binding protein 2/microRNA-33a axis in mice[J]. Hepatology, 2013, 58(3): 1111-1121. DOI:10.1002/hep.26427.
[17] 彭雪. 大米蛋白调控胆固醇代谢关键因子的研究[D]. 哈尔滨: 哈尔滨工业大学, 2012: 1-89.
[18] VALLETT S M, SANCHEZ H B, ROSENFELD J M, et al. A direct role for sterol regulatory element binding protein in activation of 3-hydroxy-3-methylglutaryl coenzyme A reductase gene[J]. Journal of Biological Chemistry, 1996, 271(21): 12247-12253. DOI:10.1074/ jbc.271.21.12247.
[19] FRIESEN J A, RODWELL V W. The 3-hydroxy-3-methylglutaryl coenzyme-A (HMG-CoA) reductases[J]. Genome Biology, 2004, 5(11): 248. DOI:10.1186/gb-2004-5-11-248.
[20] 葛晶. 胰岛素对人酰基辅酶A: 胆固醇酰基转移酶1基因转录调控机制研究[D]. 武汉: 华中科技大学, 2007: 1-131.
[21] CHEN J, COOPER A D, LEVY-WILSON B. Hepatocyte nuclear factor 1 binds to and transactivates the human but not the rat CYP7A1 promoter[J]. Biochemical and Biophysical Research Communications, 1999, 260(3): 829-834.
[22] LEFEBVRE P, CARIOU B, LIEN F, et al. Role of bile acids and bile acid receptors in metabolic regulation[J]. Physiological Reviews, 2009, 89(1): 147-191. DOI:10.1152/physrev.00010.2008.
[23] OSBORNE T F, ESPENSHADE P J. Evolutionary conservation and adaptation in the mechanism that regulates SREBP action: what a long, strange tRIP it’s been[J]. Genes & Development, 2009, 23(22): 2578-2591. DOI:10.1101/gad.1854309.
[24] JONES R D, REPA J J, RUSSELL D W, et al. Delineation of biochemical, molecular, and physiological changes accompanying bile acid pool size restoration in CYP7A1−/−mice fed low levels of cholic acid[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2012, 303(2): G263-G274. DOI:10.1152/ ajpgi.00111.2012.
[25] TEMEL R E, BROWN J M. Biliary and non-biliary contributions to reverse cholesterol transport[J]. Current Opinion in Lipidology, 2012, 23(2): 85-90. DOI:10.1097/MOL.0b013e3283508c21.
[26] ZHANG Y, BREEVOORT S R, ANGDISEN J, et al. Liver LXRα expression is crucial for whole body cholesterol homeostasis and reverse cholesterol transport in mice[J]. Journal of Clinical Investigation, 2012, 122(5): 1688-1699. DOI:10.1172/JCI59817.
Effect of Dietary Protein from Aetobatus fl agelum on Cholesterol Metabolism in Rats
DING Lin, WANG Dan, XUE Yong, XUE Changhu, WANG Yuming*
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Objective: To investigate the effect of dietary Aetobatus fl agelum protein (AFP) on cholesterol metabolism in high cholesterol diet-fed rats and to explore the possible mechanism involved. Methods: Twenty-one male SD rats were randomly divided into 3 groups, including normal control group (casein), 5% AFP-treated group (containing 5% AFP), 10% AFP-treated group (containing 10% AFP). After 28 days of consecutive administration, serum total cholesterol (TC), high density lipoprotein cholesterol (HDL-C), hepatic cholesterol concentrations (TC and free cholesterol), and fecal bile acid and neutral steroid were determined. The mRNA expression of key enzymes related to cholesterol metabolism, such as HMG-CoA reductase, acyl-CoA-cholesterol acyltrasferase 2 (ACAT2), and cholesterol 7α-hydroxylase 1 (CYP7A1), was also determined. Results: The levels of serum and hepatic TC were significantly decreased in rats fed AFP compared with the control group (P < 0.05), while the concentration of serum HDL-C was increased and consequently the atherogenic index was very significantly decreased in the AFP groups compared with in control group (P < 0.01). Moreover, dietary Aetobatus fl agelum protein significantly aggrandized the concentrations of fecal bile acid and neutral steroid (P < 0.05). The activity of ACAT2 in liver was inhibited by dietary AFP, whereas the activity of hepatic HMG-CoA was not affected. On the other hand, the mRNA expression of the CYP7A1 gene was significantly decreased (P < 0.05). Conclusion: Aetobatus fl agelum protein could significantly decrease serum and hepatic cholesterol accumulation, and lead to a decrease in serum atherogenic index, mainly through promoting the metabolism of cholesterol and the excretion of fecal bile acid and neutral steroid.
Aetobatus fl agelum protein; cholesterol metabolism; mechanism
10.7506/spkx1002-6630-201601033
TS218
A
1002-6630(2016)01-0189-05
丁琳, 王丹, 薛勇, 等. 无斑鹞鲼蛋白质对大鼠胆固醇代谢的影响[J]. 食品科学, 2016, 37(1): 189-193. DOI:10.7506/ spkx1002-6630-201601033. http://www.spkx.net.cn
DING Lin, WANG Dan, XUE Yong, et al. Effect of dietary protein from Aetobatus fl agelum on cholesterol metabolism in rats[J]. Food Science, 2016, 37(1): 189-193. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601033. http://www.spkx.net.cn
2015-03-04
教育部“新世纪优秀人才支持计划”项目(NCET-13-0534);“泰山学者”建设工程专项
丁琳(1992—),女,硕士研究生,研究方向为水产化学与分子营养学。E-mail:dinglin_ouc@163.com
*通信作者:王玉明(1973—),男,教授,博士,研究方向为食品营养学。E-mail:wangyuming@ouc.edu.cn

