水溶性大豆多糖的分子表征和溶液流变学性质
杨慧娇,蔡志祥,张洪斌,*,常忠义*
水溶性大豆多糖的分子表征和溶液流变学性质
杨慧娇1,2,蔡志祥1,张洪斌1,*,常忠义2,*
(1.上海交通大学化学化工学院高分子科学与工程系,流变学研究所,上海 200240;2.华东师范大学生命科学院生物化学与分子生物学系,上海 200241)
采用核磁共振方法和凝胶渗透色谱(gel permeation chromatography,GPC)技术测定了水溶性大豆多糖(soluble soybean polysaccharides,SSPS)的酯化度和分子质量,并研究了SSPS在水溶液中的分子构象和流变学性质。结果表明,核磁共振方法可以快速准确地测定SSPS的酯化度,水溶液中SSPS呈紧密的无规线团构象,具有很低的本征黏度,SSPS水溶液表现出很强的剪切变稀行为,并具有明显的触变性。
水溶性大豆多糖;酯化度;分子参数;构象;流变特性
水溶性大豆多糖(soluble soybean polysaccharides,SSPS)是从已经提取过大豆油和大豆蛋白的剩余物中,分离提取出来的一种高度支化的天然聚阴离子多糖,其结构类似果胶,均含有部分甲酯化的半乳糖醛酸[1-4]。SSPS除具有膳食纤维所具有的功能特性[5]以外,还具有诸如乳化性、酸性条件下对蛋白颗粒的稳定作用、抗黏结性、抗氧化性、成膜性能及泡沫稳定性等特性[6-12],是一种应用广泛的功能性食品添加剂。
SSPS的性质和多重功能性在很大程度上依赖于其分子质量、支化度和酯化度[13-15]。其中酯化度(degreeof esterification,DE)是指分子链上甲酯化的半乳糖醛酸残基占总半乳糖醛酸残基数量的百分比值[16]。有研究表明,酯化度的不同对SSPS的性质和功能有重要的影响[17]。就多糖酯化度的测定而言,最早被应用和公认的测定方法是酸碱滴定法,如《美国食品化学法典》和《美国药典》所述的方法[18-19]。该方法的优点是实验条件简单,不需要使用复杂的仪器,但测试繁琐耗时、样品量需求也较大,特别是由滴定终点的判断引起的误差大,结果的重复性差。目前核磁共振技术已经广泛应用于天然产物的结构确定,如通过该方法可确定SSPS的分子骨架组成[20]。但采用核磁共振法(nuelear magnetic resonance,NMR)确定SSPS的酯化度尚未见报道。核磁共振方法则能很好地解决滴定法存在的问题,所需的样品量少,且快速、精度高。
除酯化度外,分子质量、本征黏度、溶液流变学性质也是SSPS重要的功能性指标。本实验结合SSPS分子具有支化结构的特点,对不同酯化度的SSPS进行了分子参数表征,并讨论了SSPS在水溶液中的分子构象和流变学性质,以期对SSPS的生产以及功能性应用提供基础理论数据和指导。
1 材料与方法
1.1 材料与试剂
豆渣 金晶生物科技有限公司提供;SSPS 上海交通大学实验室和华东师范大学实验室自制。
氘代水(D2O)、氘代硫酸(D2SO4) 美国Sigma公司;硝酸钠、氢氧化钠、盐酸、蒸馏水等试剂均为国产分析纯。
1.2 仪器与设备
Avance Ⅲ 400 MHz核磁共振波谱仪 瑞典Bruker公司;凝胶渗透色谱(Viscotek 270 GPC) 英国Malvern仪器有限公司;A6000M凝胶色谱柱 Pharmacia生物科技有限公司;AR-G2旋转流变仪 美国TA仪器有限公司;Avanti J-25超速离心机 美国Beckman Coulter公司;FE20KPlus酸度计 梅特勒-托利多仪器(上海)有限公司;DZKW-S-4电热恒温水浴锅 北京光明医疗仪器厂;FA1004精密电子天平 上海天平仪器公司。
1.3 方法
1.3.1 SSPS提取的基本流程
将脱除蛋白和脂肪后粉碎干燥的豆渣进行酸解提取,然后离心过滤后进行脱酯化处理,随后将料液中和,取离心后上清液进行浓缩,所得浓缩液用乙醇沉淀,最后将沉淀物真空干燥即得产物。
1.3.2 不同脱酯化程度SSPS的制备
按照1.3.1节的方法进行,在脱酯化处理的反应阶段,针对脱酯化反应的3 个影响因素,pH值、反应温度和脱酯化时间分别进行单因素试验。将酸解提取,离心过滤后的上清液用NaOH调至一定pH值,待升温至一定温度后,将上清液置于水浴锅或高压灭菌锅中进行脱酯化反应,即得脱酯化程度不同的产物。
1.3.3 酯化度的测定
酯化度测定分别采用核磁共振法[21-22]和酸碱滴定法[23]。核磁共振法中,待测多糖样品以质量比为3∶1的D2O和D2SO4混合溶液作为溶剂,配制成质量分数为6.5%的溶液。测试温度为80 ℃,以四甲基硅烷(tetramethylsilane,TMS)作为内标,扫描64 次。
1.3.4 分子质量和本征黏度的测定
多糖样品分子质量和本征黏度的测定采用Viscotek TDAmax多检测器凝胶色谱系统,所用检测器分别为光散射检测器、浓度检测器和黏度检测器,色谱柱为2 根A6000M柱子串联使用。测试样品的质量浓度为2 mg/mL,进样体积为150 μL,流动相为0.1 mol/L的NaNO3溶液,流速为0.8 mL/min,柱温40 ℃。
1.3.5 溶液流变学性质的测定
取适量SSPS粉末溶于蒸馏水中,搅拌使其充分水合溶解,配制成一定质量浓度(5、10、15、20 g/100 mL)的多糖溶液,采用AR-G2流变仪进行流变性质的测定。实验夹具为直径60 mm的锥板,锥角2°1′8″,间距58 μm。测试温度为25 ℃。稳态剪切黏度曲线测试中,剪切速率由0.01 s-1升至1 000 s-1再回扫降至0.01 s-1。以扭矩值变化在3 个连续取样周期(20 s)小于5%为达到稳态。为了解预剪切对样品流变学性质的影响,将样品在100 s-1的剪切速率下预剪切5 min,然后进行动态时间扫描测试,测定其随时间变化的储能模量(G’)。测试频率为1 Hz,应力为0.01 Pa。
2 结果与分析
2.1 脱酯化程度的主要影响因素和脱酯化条件
未脱酯化处理样品的酯化度为60.5%。由图1可知,脱酯化pH值处理后,样品的酯化度值与未作处理的对照组发生了显著的降低,并随着脱酯化pH值的升高,可溶性大豆多糖的酯化度大幅度降低。由于反应溶液中的糖类和所含少量的蛋白类物质会发生美拉德反应,使产物颜色加深变黑,因此,脱酯化pH值的变化会影响可溶性大豆多糖的外观色泽。当pH≥11时,美拉德反应加速进行,提取干燥后的可溶性大豆多糖的颜色已接近深褐色。因此,在实际脱酯化过程中一般选定的pH值介于9~10之间。
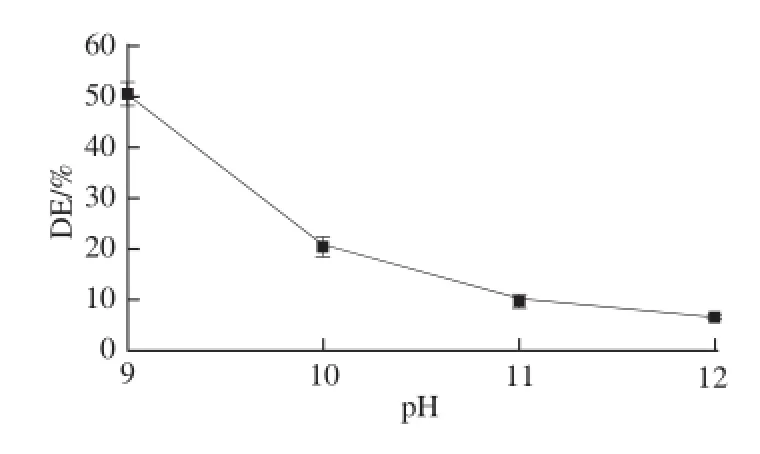
图1 不同脱酯化pH值对酯化度的影响(100 ℃,90 min)Fig.1 Influence of pH on the degree of esterification of SSPS at 100 ℃for 90 min
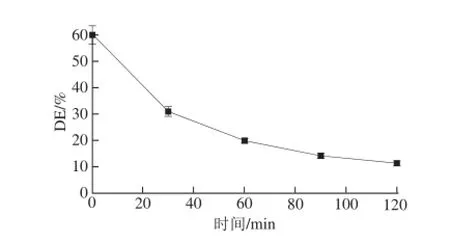
图2 不同脱酯化时间对酯化度的影响(pH 10,100 ℃)Fig.2 Influence of de-esterification time (at 100 ℃ and pH 10) on degree of esterification of SSPS
由图2可知,随着脱酯化处理时间的增加,可溶性大豆多糖的酯化度都有不同程度的降低,当反应时间超过90 min后,酯化度的下降趋缓,反应时间达到120 min时,酯化度可达10%或以下。但是,处理时间超过100 min,同样会由于美拉德反应,使所得可溶性大豆多糖颜色加深而影响使用。因此,脱酯化时间以不大于90 min为佳。
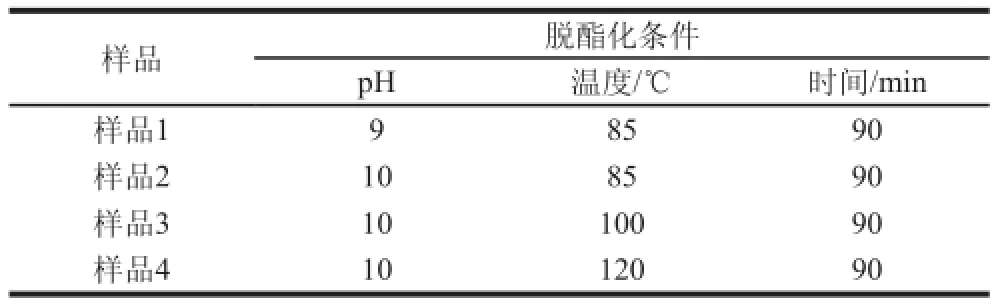
表1 脱酯化程度不同样品的制备条件Table 1 Preparation conditions for SSPS samples with different degrees of de-esterification
2.2 核磁共振法测得的酯化度及其与酸碱滴定法的比较
水溶性多糖在氘代试剂D2O中得到的氢峰常互相重叠在一起,而采用D2O-D2SO4混合液作为溶剂可使糖单元之间的糖苷键断裂以提高峰形分辨率[22]。研究表明,选择质量比为3∶1的D2O-D2SO4混合液作为氘代试剂可以有效地提高峰形分辨率,进而计算SSPS的酯化度。将SSPS在氘代试剂中80 ℃条件下溶解15 min,常温下测试可获得SSPS的氢谱(见图4,样品2)。结合图5中SSPS骨架结构式可知,图4中,化学位移δ=4.68~4.70处为羧基旁的H-5峰(相应的峰面积ICOO-),δ=4.99~5.01处为酯基旁边的H-5峰(峰面积ICOOMe),δ=5.01~5.02处为半乳糖醛酸头碳氢H-1峰(峰面积IH-1)。通过δ=4.68~4.70(峰面积ICOO-)和δ=4.99~5.01(峰面积ICOOMe)处2 个峰面积可以计算SSPS的酯化度,计算公式为:

但由于化学位移δ=4.99~5.02处酯基旁边的H-5峰(ICOOMe)和H-1峰(IH-1)相重叠,难以分开,因此可以把H-1和酯基旁的H-5峰结合在一起,通过方程变换[22],采用下式计算SSPS酯化度:
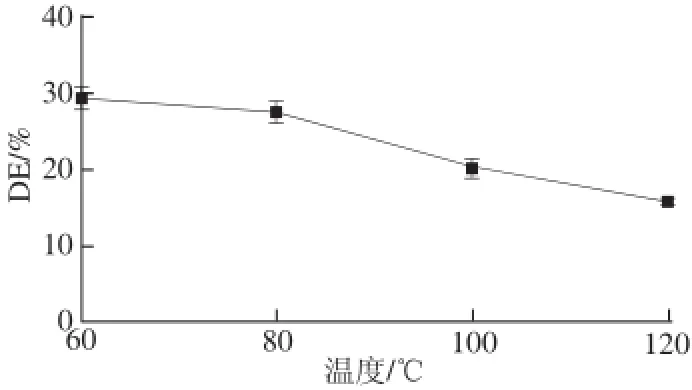
图3 脱酯化温度对酯化度的影响(pH 10,90 min)Fig.3 Influence of de-esterification temperature (at pH 10 for 90 min) on degree of esterification of SSPS
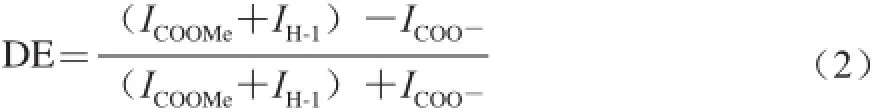
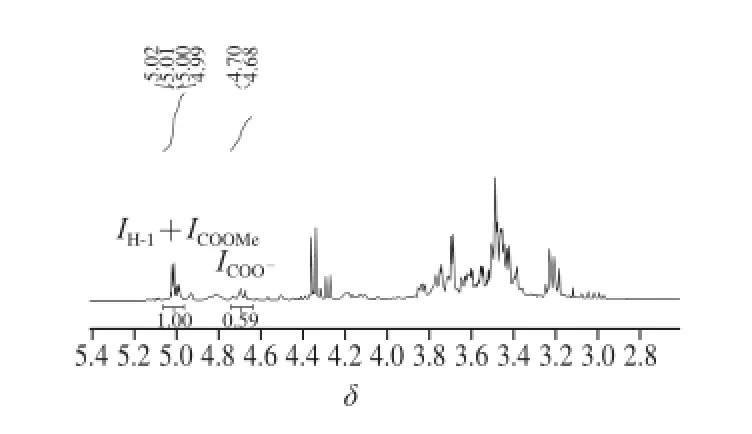
图4 SSPS的氢谱图Fig.41H-NMR spectrum of SSPS in D2O-D2SO4
由图3可知,随着脱酯化处理温度的提高,脱酯化反应速率加快,酯化度也逐渐降低。
综上,SSPS脱酯化程度随pH值和反应温度的升高以及脱酯化时间的延长而下降。本研究根据不同pH值、反应温度和脱酯化时间分别得到了4 种脱酯化程度不同的样品,其制备条件见表1。
由核磁氢谱所得不同脱酯化SSPS样品的酯化度与参考果胶酯化度酸碱滴定测定法[23]测得的酯化度比较见图6。图中每个酯化度值为3 个平行样品的平均值。可以看到,两类方法所得酯化度值非常吻合,反映出核磁共振法能快捷、准确地测得SSPS酯化度。
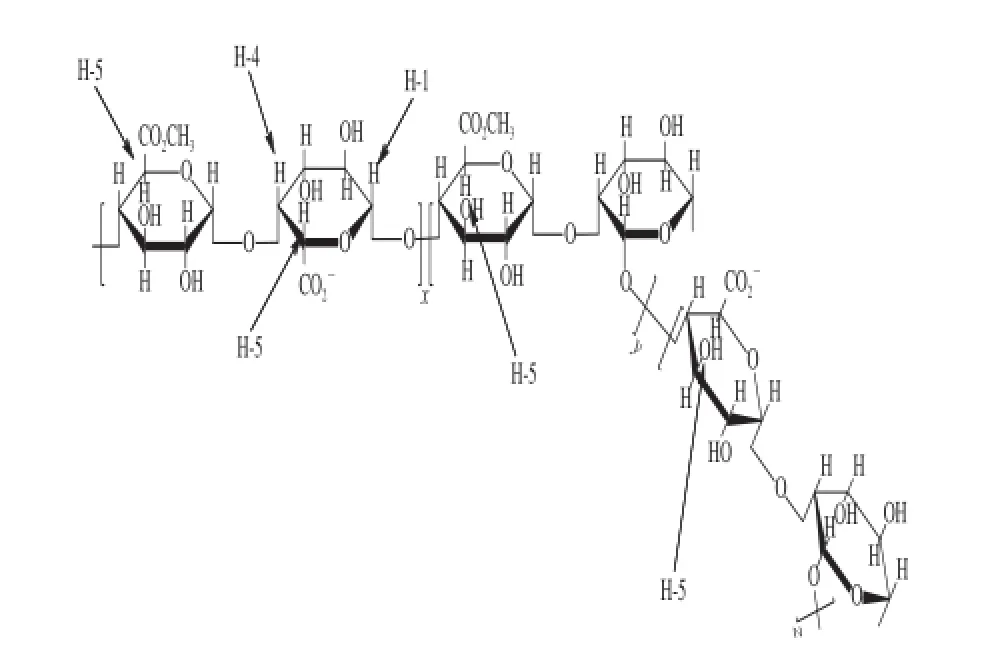
图5 SSPS骨架结构式Fig.5 Structure of SSPS
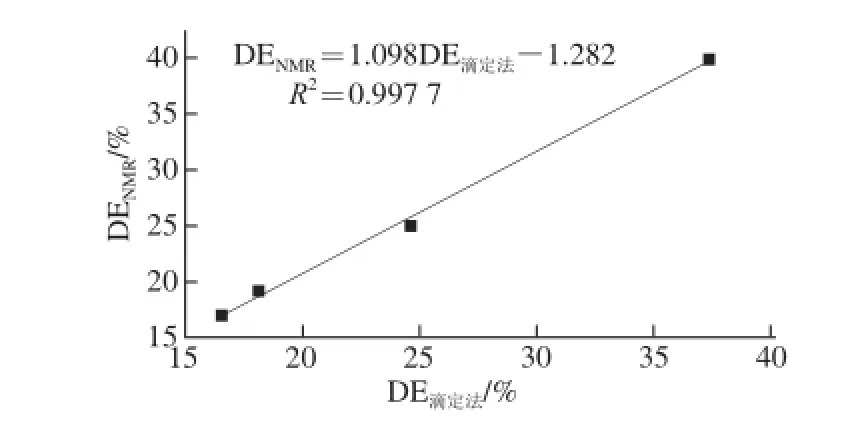
图6 SSPS核磁共振氢谱法与酸碱滴定法测得酯化度的相关性Fig.6 Linear relationship between degrees of esterification determined using1H-NMR spect roscopy and D2O-D2SO4for SSPS
2.3 分子质量测定和分子构象
Mark-Houwink方程给出了聚合物溶液的本征黏度([η]/(dL/g))和聚合物分子质量(M)之间的关系:

式中:K和α为Mark-Houwink参数,与聚合物和溶剂的种类以及测试温度有关。
对于给定温度下的某种聚合物溶液,在一定分子质量范围内,K和α是与分子质量无关的常数。参数α被认为是一个有关高分子链形状的系数[24],它与聚合物在溶剂中所呈的构象有关。当α值在0~0.1之间时,聚合物在溶剂中为球状构象,当α在0.35~0.8之间时,聚合物在溶剂中呈现无规线团构象,并且α值越接近0.8,其聚合物线团越为伸展,而当α≥1,此时聚合物在溶剂中呈刚性线团状。
图7所示为在25 ℃条件下SSPS分子质量(Mw)和本征黏度([η])的测定结果。结合Mark-Houwink方程可以得出如下关系式:

式中:α值为0.42,与文献[20]报道值(0.47)较为一致。该值表明,SSPS在水溶液中呈不太伸展的无规线团构象。这种构象与其具有高度支化的结构有关,不同于能伸展的线型高分子,而与另一高支化多糖玉米纤维胶(α=0.471)类似[25]。这两种高度支化多糖的α值均小于呈伸展构象的线型高分子透明质酸多糖的α值(约为0.6)[25]。
SSPS的这种构象也与其具有低的本征黏度相吻合。SSPS的本征黏度很低,即使是高分子质量(5.65×105D)的样品4,也仅为0.417 dL/g,该值远低于分子质量仅为3.33×105D的玉米纤维胶的本征黏度(1.482 dL/g),而分子质量为3.56×105D的透明质酸,其本征黏度高达8.784 dL/g[25]。这表明SSPS较玉米纤维胶具有更加紧密的构象结构。
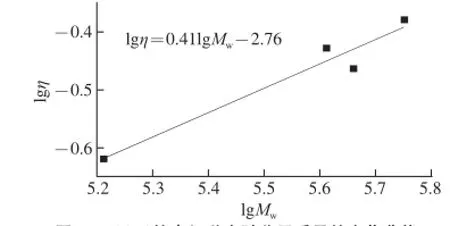
图7 SSPS的本征黏度随分子质量的变化曲线Fig.7 Plot of [η] versus Mwfor SSPS in aqueous solution
2.4 流变学性质
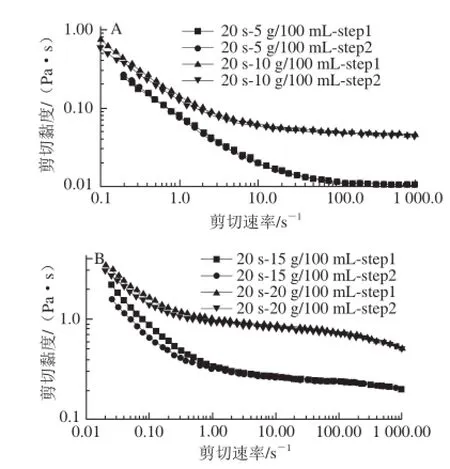
图8 剪切速率升降过程中不同质量浓度SSPS溶液黏度与剪切速率的关系Fig.8 Steady shear viscosity SSPS solutions as a function of shear rate upon increasing shear rate
SSPS这种紧密的构象结构和低本征黏度还与其流变学性质完全相符。图8为不同质量浓度的SSPS(样品4)溶液的流动曲线。可以看到,与阿拉伯胶溶液[25]和玉米纤维胶溶液[25]类似,尽管分子质量很高、水溶性很好,但SSPS溶液在质量浓度很高的情况下,仍具有低黏度的特性(20 g/100 mL的溶液在剪切速率为1 s-1时,黏度仅约为1 Pa·s)。SSPS溶液黏度与剪切速率的关系,也与阿拉伯胶溶液非常类似,在低剪切速率区不能观测到牛顿区,且剪切变稀现象非常明显。此外,在剪切速率由低到高,再由高到低回扫过程中,两条黏度曲线并不重合,特别是较高质量浓度的大豆多糖水溶液在低剪切速率区。图9为预剪切后该溶液弹性模量G’随时间的变化。可观察到预剪切后溶液弹性模量随时间延长快速上升直至达某一平衡值。这些流变学性质反映出,SSPS溶液如同阿拉伯胶溶液[26]一样,由于大分子间存在相互作用,在溶液中形成微结构,使体系具有明显的触变性。
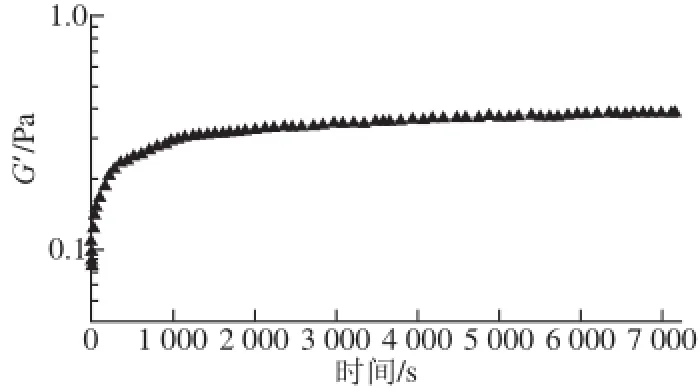
图9 预剪切(1000 ss-1,5 min)后5 g/100 mL SSPS溶液弹性模量G’随时间的变化Fig.9 G’ as a function of time for 5 g/10000 mmLL SSPS solution after per-shearing at 100 s-1for 5 min
3 结 论
采用核磁共振法,利用1H-NMR谱,可以准确、快捷测定SSPS的酯化度;25 ℃水溶剂中,SSPS溶液的Mark-Houwink方程为[η]=1.51×10-3Mw0.42;SSPS在水溶液中呈紧密的无规线团构象,尽管分子质量较高,但本征黏度远低于其他水溶性多糖;SSPS水溶液具有高质量浓度时黏度低的流变学特性,并具有明显的触变性。
[1] NAKAMURA A, FURUTA H, MAEDA H, et al. Structural studies by stepwise enzymatic degradation of the main backbone of soybean soluble polysaccharides consisting of galacturonan and rhamnogalacturonan[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(6): 1301-1313. DOI:10.1271/bbb.66.1301.
[2] NAKAMURA A, FURUTA H, MAEDA H, et al. Analysis of structural components and molecular construction of soybean soluble polysaccharides by stepwise enzymatic degradation[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(10): 2249-2258. DOI:10.1271/bbb.65.2249.
[3] MAEDA H, PHILLIPS G O, WILLIAMS P A. Soluble soybean polysaccharide[M]//PHILLIPS G O, WILLIAMS P A. Handbook of hydrocolloids. England: Woodhead Publishing Ltd., 2000: 309-320.
[4] 张洪斌. 多糖及其改性材料[M]. 北京: 化学工业出版社, 2014: 189-221.
[5] YAO X Q, OUYANG J M, PENG H, et al. Inhibition on calcium oxalate crystallization and repair on injured renal epithelial cells of degraded soybean polysaccharide[J]. Carbohydrate Polymers, 2012, 90(1): 392-398. DOI:10.1016/j.carbpol.2012.05.056.
[6] WU J, LIN J, ZHONG Q X. Physical and antimicrobial characteristics of thyme oil emulsified with soluble soybean polysaccharide[J]. Food Hydrocolloids, 2014, 39(2): 144-150. DOI:10.1016/ j.foodhyd.2013.12.029.
[7] TRAN T, ROUSSEAU D. Stabilization of acidic soy proteinbased dispersions and emulsions by soy soluble polysaccharides[J]. Food Hydrocolloids, 2013, 30(1): 382-392. DOI:10.1016/ j.foodhyd.2012.06.001.
[8] MATSUMURA Y, EGAMI M, SATAKE C, et al. Inhibitory effects of peptide-bound polysaccharides on lipid oxidation in emulsions[J]. Food Chemistry, 2003, 83(1): 107-119. DOI:10.1016/S0308-8146(03)00057-8.
[9] TAJIK S, MAGHSOUDLOU Y, KHODAIYAN F, et al. Soluble soybean polysaccharide: a new carbohydrate to make a biodegradable fi lm for sustainable green packaging[J]. Carbohydrate Polymers, 2013, 97(2): 817-824. DOI:10.1016/j.carbpol.2013.05.037.
[10] KIKUCHI S, FANG X, SHIMA M, et al. Oxidation of arachidonoyl glycerols encapsulated with saccharides[J]. Food Science and Technology Research, 2006, 12(4): 247-251. DOI:10.3136/fstr.12.247.
[11] FURUTA H, NAKAMURA A, ASHIDA H, et al. Properties of rice cooked wi th commercial water-soluble soybean p olysaccharides extracted under weakly acidic conditions from soybean cotyledons[J]. Bioscience, Biotechnology, and Biochemistry, 2003, 67(4): 677-683. DOI:10.1271/bbb.67.677.
[12] 矢野博子, 岩野瑞. 含酒精碳酸饮料用的碳酸保持剂: 201280014112.1[P]. 2013-12-04.
[13] FANG X, WATANABE Y, ADACHI S, et al. Microencapsulation of linoleic acid with low-and high-molecular-weight components of soluble soybean polysaccharide and its oxidation process[J]. Bioscience, Biotechnology, and Biochemistry, 2003, 67(9): 18 64-1869. DOI:10.1271/bbb.67.1864.
[14] LI J, MATSUMOTO S, NAKAMURA A, et al. Characterization and functional properties of sub-fractions of soluble soybean polysaccharides[J]. Bioscience, Biotechnology, and Biochemistry, 2009, 73(12): 2568-2575. DOI:10.1271/bbb.70799.
[15] IKEDA S, FUNAMI T, ZHANG G. Visualizing surface active hydrocolloids by atomic force microscopy[J]. Carbohydrate Polymers, 2005, 62(2): 192-196. DOI:10.1016/j.carbpol.2005.07.020.
[16] WALTER R H. Analytical and graphical methods for pectin. In the chemistry and technology of pectin[M]. San Diago: Academic Press, 1991: 189-225.
[17] XIONG X H, ZHAO L P, CHEN Y M, et al. Effects of alkali treatment and subsequent acidic extraction on the properties of soybean soluble polysaccharides[J]. Food and Bioproducts Processing, 2015, 94: 239-247. DOI:10.1016/j.fbp.2014.03.001.
[18] National Academy of Sciences. Food Chemicals Codex[S]. 3rd ed. Washington, DC: The National Academies Press, 1981: 215-217.
[19] USP 26 NF 21. The United States pharmacopeia-The National Formulary. United States Pharmacopeial Convention[S]. Rockville: The United States Pharmacopeial Convention Inc., 2003: 1401-1402.
[20] CHIVERO P, GOHTANI S, IKEDA S, et al. The structure of soy soluble polysaccharide in aqueous solution[J]. Food Hydrocolloids, 2014, 35(1): 279-286. DOI:10.1016/j.foodhyd.2013.06.006.
[21] HO F F L, KLOSIEWICZ D W. Proton nuclear ma gnetic resonance spectrometry for deteminztion of substituents and their distribution in carboxymethylcellulose[J]. Analytical Chemistry, 1980, 52(6): 913-916. DOI:10.1021/ac50056a032.
[22] ROSENBOHM C, LUNDT I, CHRISTENSEN T I, et al. Chemically methylated and reduced pectins: preparation, characterisation by1H-NMR spectroscopy, enzymatic degradation, and gelling properties[J]. Carbohydrate Research, 2003, 338(7): 637-649. DOI:10.1016/S0008-6215(02)00440-8.
[23] 卫生部政策法规司. GB 25533—2010 食品安全国家标准 食品添加剂果胶[S]. 北 京: 中国标准出版社, 2010.
[24] SEYMOUR R B, CARRAHER C E, Jr. Polymer chemistry: an introduction[M]. 2nd ed. New York: Marcel Dekker Inc, 1988: 54-82.
[25] ZHANG F, LUAN T, KANG D, et al. Viscosifying properties of corn fi ber gum with various polysaccharides[J]. Food Hydrocolloids, 2015, 43: 218-227. DOI:10.1016/j.foodhyd.2014.05.018.
[26] LI X B, FANG Y P, AL-ASSAF S, et al. Rhe ological study of gum arabic solutions: interpretation based on molecular self-association[J]. Food Hydrocolloids, 200 9, 23: 2394-2402. DOI:10.1016/ j.foodhyd.2009.06.018.
Molecular Characterization of Soluble Soybean Polysaccharide and Rheological Properties of Its Aqueous Solution
YANG Huijiao1,2, CAI Zhixiang1, ZHANG Hongbin1,*, CHANG Zhongyi2,*
(1. Advanced Rheology Institute, Department of Polymer Science and Engineering, School of Chemistry and Chemical Engineering, Shanghai Jiao Tong University, Shanghai 200240, China; 2. Department of Biochemistry and Molecular Biology, School of Life Science, East China Normal University, Shanghai 200241, China)
The degree of esterifi cation and molecular weight of soluble soybean polysaccharide (SSPS) were measured by1H-NMR spectroscopy and gel permeation chromatography (GPC), respectively, and the conformation of SSPS in water and the rheological properties of aqueous SSPS solution were investigated. It was found that the degree of esterifi cation of SSPS could be determined by using1H-NMR accurately and rapidly. The experimental results also showed that SSPS chains exhibited random coils with compact conformation in water, and that SSPS aqueous solutions possessed a very low intrinsic viscosity, signifi cant shear thinning behavior and thixotropy.
soluble soybean polysaccharides (SSPS); degree of esterifi cation (DE); molecular parameter; conformation; rheological property
10.7506/spkx1002-6630-201601001
TS201.7
A
1002-6630(2016)01-0001-05
杨慧娇, 蔡志祥, 张洪斌, 等. 水溶性大豆多糖的分子表征和溶液流变学性质[J]. 食品科学, 2016, 37(1): 1-5.
DOI:10.7506/spkx1002-6630-201601001. http://www.spkx.net.cn
YANG Huijiao, CAI Zhixiang, ZHANG Hongbin, et al. Molecular characterization of soluble soybean polysaccharide and rheological properties of its aqueous solution[J]. Food Science, 2016, 37(1): 1-5. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201601001. http://www.spkx.net.cn
2015-02-13
国家自然科学基金面上项目(21274090);上海市重点学科建设项目(B202)
杨慧娇(1989—),女,硕士研究生,研究方向为天然产物提取。E-mail:yhj_890330@126.com
*通信作者:张洪斌(1965—),男,研究员,博士,研究方向为天然产物和食品亲水胶体功能化及其应用。
E-mail:hbzhang@sjtu.edu.cn
常忠义(1968—),男,副教授,博士,研究方向为微生物与食品生物化学。E-mail:zychang@bio.ecnu.edu.cn

