6 种东北地区红树莓果渣提取物的抗氧化活性差异
旷 慧,王金玲,姚丽敏,宁玮钰
6 种东北地区红树莓果渣提取物的抗氧化活性差异
旷 慧,王金玲*,姚丽敏,宁玮钰
(东北林业大学林学院,黑龙江 哈尔滨 150040)
以东北地区6 种红树莓果实加工后的果渣提取物为实验材料,研究其总酚、总黄酮、原花青素、花色苷含量和体外抗氧化活性的差异。结果表明:宝石红果渣提取物中总酚、总黄酮和原花青素含量最高,分别为14.18、3.71、15.28 mg/g;哈瑞太兹果渣提取物中花色苷含量最高,为0.68 mg/g;菲尔杜德和野生果果渣提取物的总还原能力与VC接近;除哈瑞太兹外,其他品种红树莓果渣提取物对(1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-二氮-双(3-乙基苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azino-bis (3-ethylbenzthiazoline-6-sulfonic acid) radical,ABTS+·)的清除率均大于VC。相关性分析结果表明红树莓果渣提取物的总还原能力与总黄酮、原花青素含量的相关性较大;对DPPH自由基的清除率与原花青素、花色苷含量的相关性较大;而对ABTS+·的清除率与总酚和总黄酮含量的相关性较大。在6 个红树莓品种中,菲尔杜德和野生果果渣提取物具有较强的抗氧化活性。
红树莓果渣;提取物;活性成分;抗氧化活性
红树莓(Rubus ideaus L.)为蔷薇科浆果,俗名托盘、覆盆子、马林等,它作为第三代保健型水果,在世界上享有“黄金水果”的声誉[1]。红树莓成熟后极易腐烂,贮藏、运输困难,据统计95%以上的红树莓果实用于加工成果汁、果酱、果酒等,而加工后的残渣仅见制成饲料[2],或直接废弃,并未得到充分利用。研究表明水果加工后的果渣中除了含有油脂、有机酸、水分、纤维素、粗蛋白之外,还含有活性成分如黄酮、原花青素、花色苷(anthocyanin)等[3],这些活性成分具有抑制脂质过氧化、清除体内氧自由基、提高免疫力、抗肿瘤、保护肝脏等医疗和保健功能[4],应进一步综合开发利用。
但目前国内外对红树莓果渣的研究较少,Cetojevic-Simin等[5]研究结果表明Meeker和Willamette红树莓(美国)果渣提取物具有较强的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率(IC50值分别为0.072、0.042 mg/mL),能抑制癌细胞的增殖、促进肿瘤细胞凋亡、抗菌等作用。为进一步利用与开发树莓资源,本研究对东北地区不同品种红树莓加工后的果渣提取物的抗氧化活性进行系统研究,旨在促进树莓产业的发展,提高树莓产品的附加值,延长树莓产业链。
1 材料与方法
1.1 材料与试剂
菲尔杜德(Fertod Zamatos)、欧洲红(European red raspberry)、宝石红(U.S. Raspberry)、哈瑞太兹(Heritage)、秋福(Autumn Bliss)、野生果(Wild red raspberry)6 种红树莓采自黑龙江省尚志市,速冻处理后运回东北林业大学食品科学与工程实验室冻藏。通过直接干燥法[6]测定6 种红树莓果实和果渣中的水分含量分别为:84.97%、85.58%、83.04%、83.66%、87.64%、84.73%和70.57%、69.71%、71.97%、70.40%、72.63%、69.35%。
芦丁、儿茶素、2,4,6-三(2-吡啶)-1,3,5-三嗪(2,4,6-Tri(2-pyridyl)-1,3,5-triazine,TPTZ)、2,2’-二氮-双(3-乙基苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS) 上海源叶生物科技有限公司;没食子酸、Folin-酚试剂、DPPH美国Sigma公司;水杨酸钠、硫酸亚铁、磷酸氢二钠、三氯化铁等 天津市东丽区天大化学试剂厂;抗坏血酸、酒石酸钾钠、甲醇、硝酸铝、香草醛、过硫酸钾等 天津市天力化学试剂有限公司;以上试剂均为分析纯。
1.2 仪器与设备
DHG-9240型电热恒温鼓风干燥箱 上海一恒科技有限公司;ALC-1104电子天平 北京赛多利斯仪器系统有限公司;TDL-5-W台式低速离心机 湖南星科科学仪器有限公司;FA2004电子天平 上海天平仪器厂;722S可见分光光度计 上海精密科学仪器有限公司。
1.3 方法
1.3.1 红树莓果渣中活性成分的提取
工艺流程为:速冻红树莓→室温解冻→打浆→纱布过滤→离心滤渣→果渣计量→60%乙醇密封振荡提取(40 ℃,4 h)→抽滤→重复浸提滤渣→合并滤液→真空旋转浓缩(40 ℃,0.1 MPa)→提取液→蒸馏水定容→4 ℃保存[7]。
1.3.2 红树莓果渣中活性成分含量的测定
1.3.2.1 Folin-酚法测定总酚的含量
参考Pantelidis等[8]方法测定。以没食子酸标准溶液质量浓度(mg/mL)为横坐标,溶液吸光度为纵坐标,绘制标准曲线,得到回归方程为:y=8.348 7x+0.038 3(R2=0.997 1)。红树莓果渣中总酚含量根据果渣含水量折算成每克红树莓果渣(干质量)中总酚的毫克数。
1.3.2.2 硝酸铝比色法测定总黄酮的含量
参考Zhang等[9]方法测定。以芦丁的标准溶液质量浓度(mg/mL)为横坐标,溶液吸光度为纵坐标,绘制标准曲线,得到回归方程为:y=1.955 1x+0.011 8(R2=0.995 2)。红树莓果渣中总黄酮含量根据果渣含水量折算成每克红树莓果渣(干质量)中总黄酮的毫克数。
1.3.2.3 香草醛-浓硫酸法测定原花青素的含量
参考王新伟等[10]方法测定。以儿茶素的标准溶液质量浓度(mg/mL)为横坐标,溶液吸光度为纵坐标,绘制标准曲线,得到回归方程为:y=0.895 3x+0.001 1(R2=0.996 4)。红树莓果渣中原花青素含量根据果渣含水量折算成每克红树莓果渣(干质量)中原花青素的毫克数。
1.3.2.4 pH值示差法测定花色苷的含量
参考陈亮等[11]方法测定。花色苷含量(以矢车菊色素-3-葡萄糖苷计)按式(1)计算。

式中:C为花色苷含量/(mg/g);A =(A510nm-A700nm)pH1.0-(A510nm-A700nm)pH4.5; Mw为矢车菊色素-3-葡萄糖苷的相对分子质量;DF为稀释倍数;V为样液总体积/mL;26 900为矢车菊色素-3-葡萄糖苷的消光系数/(mL/(cm·mg));L为光程,此处为1 cm;m为样品质量(根据果渣含水量折算成干质量)/g。
1.3.3 红树莓果渣提取物的抗氧化活性测定
1.3.3.1 铁还原力(ferric reducing antioxidant potential assay,FRAP)法测定提取物的总还原能力
参考Lu等[12]方法测定,以VC作为阳性对照。果渣提取物采用恒质量法确定样品的质量浓度并进行适当稀释(下同)。通过比较不同品种红树莓果渣提取物中加入FRAP工作液反应后的吸光度大小,分析其总还原能力的强弱。
1.3.3.2 提取物清除DPPH自由基能力的测定
参考高畅等[13]方法,反应体系中试剂体积略作改动。在96 孔板中依次加入不同质量浓度的样液100 μL、1×10-4mo1/L DPPH溶液100 μL,避光放置30 min后,在517 nm波长处分别测定其吸光度(A1)。以等体积的蒸馏水代替DPPH溶液,其他操作相同,测定吸光度(A2)。以等体积的无水乙醇代替样液,其他操作相同,测定吸光度(A3)。VC为阳性对照。根据式(2)计算DPPH自由基清除率。
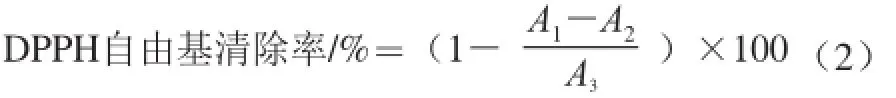
1.3.3.3 提取物清除ABTS+·能力的测定
参考王振宇等[14]方法,反应体系中试剂体积略作改动。在96 孔板中依次加入不同质量浓度的样液250 μL及ABTS溶液50 μL,避光放置6 min后,在734 nm波长处分别测定其吸光度(Ai)。以等体积的蒸馏水代替ABTS溶液,其他操作相同,测定吸光度(Aj)。以等体积的无水乙醇代替样液,其他操作相同,测定吸光度(A0)。VC为阳性对照。根据式(3)计算ABTS+·清除率。
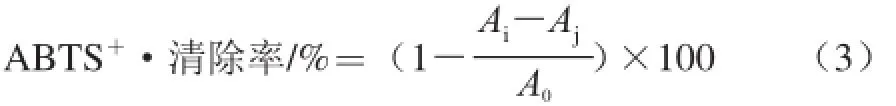
1.3.4 红树莓果渣提取物的抗氧化活性与活性成分含量的相关性分析
采用Pearson’s相关系数进行相关性分析。
1.4 数据分析
每个实验3 次重复,数据以±s显示,数据采用Excel、SPSS软件进行分析处理并作图。
2 结果与分析
2.1 红树莓果渣提取物中活性成分分析
2.1.1 总酚含量分析
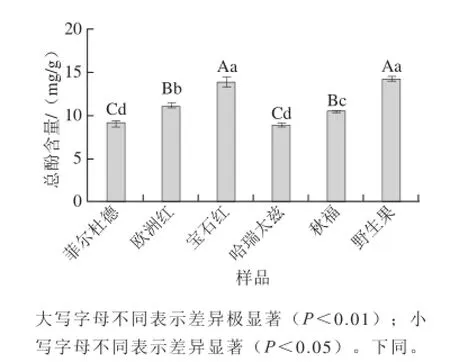
图1 红树莓果渣提取物的总酚含量Fig.1 Contents of total phenols in red raspberry pomace extracts
由图1可知,6 种红树莓果渣提取物中总酚含量在8.91~14.18 mg/g。野生果和宝石红果渣提取物中总酚含量最高,差异不显著,分别为14.18、13.85 mg/g,是蓝莓果实中总酚含量的1.46~1.50 倍[15];总酚含量最低的是哈瑞太兹和菲尔杜德果渣,分别为8.91、9.11 mg/g。
2.1.2 总黄酮含量分析
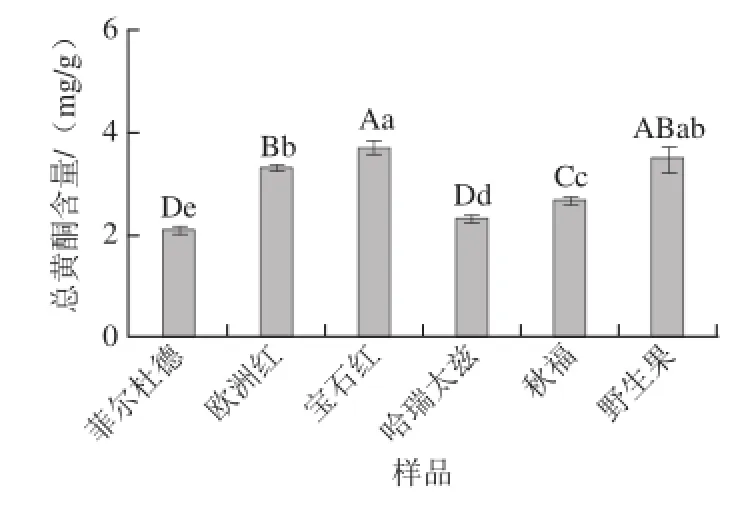
图2 红树莓果渣提取物的总黄酮含量Fig.2 Contents of flavonoids in red raspberry pomace extracts
由图2可知,6 种红树莓果渣提取物中总黄酮含量在2.11~3.71 mg/g之间。宝石红和野生果果渣提取物中总黄酮含量无显著差异,分别为3.71、3.50 mg/g。菲尔杜德和哈瑞太兹果渣提取物中总黄酮含量较低,分别为2.11、2.34 mg/g,与其他4 个品种存在极显著差异。
2.1.3 原花青素含量分析
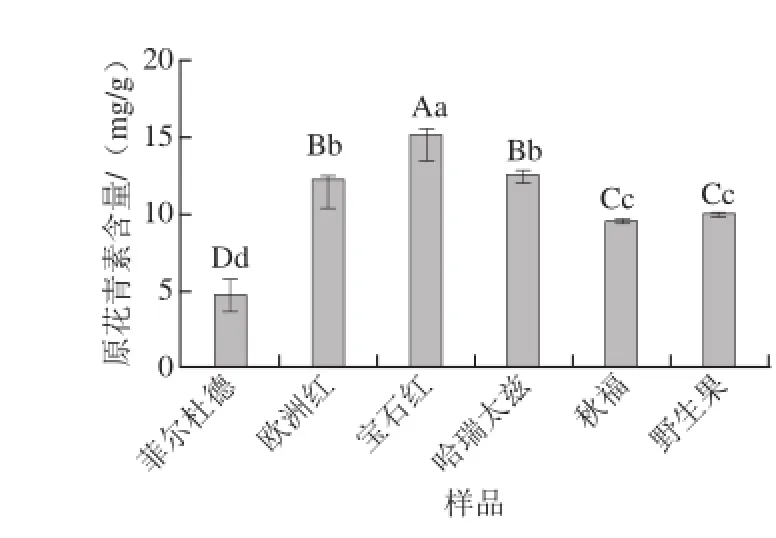
图3 红树莓果渣提取物的原花青素含量Fig.3 Contents of proanthocyanidins in red raspberry pomace extracts
由图3可知,6 种红树莓果渣提取物中原花青素含量在4.66~15.28 mg/g之间。宝石红果渣提取物中原花青素含量最高,为15.28 mg/g。哈瑞太兹与欧洲红果渣提取物中原花青素含量无显著差异,分别为12.64、12.38 mg/g。菲尔杜德果渣提取物中原花青素含量最低,为4.66 mg/g,与枸杞中原花青素含量一致[16]。
2.1.4 花色苷含量分析
由图4可知,6 种红树莓果渣提取物中花色苷含量在0.05~0.68 mg/g之间,品种间差异较大。菲尔杜德果渣提取物中花色苷含量最低,哈瑞太兹果渣提取物中花色苷含量最高,是菲尔杜德的13.6 倍,差异极显著。
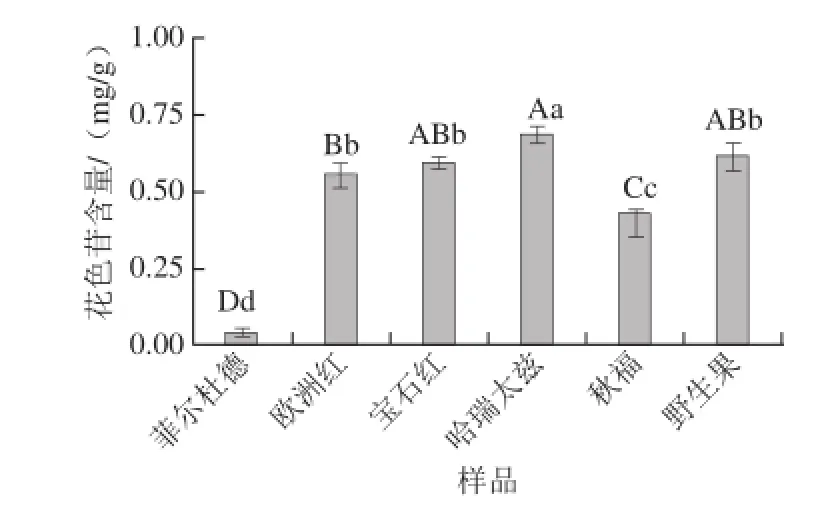
图4 红树莓果渣提取物的花色苷含量Fig.4 Contents of anthocyanins in red raspberry pomace extracts
2.2 红树莓果渣提取物的抗氧化活性分析
2.2.1 总还原能力分析
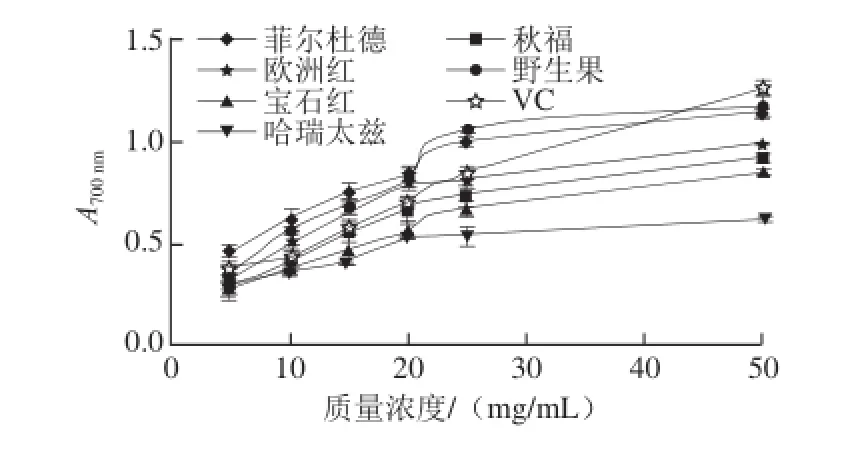
图5 红树莓果渣提取物的总还原能力Fig.5 Total reducing capacity of red raspberry pomace extracts
由图5可知,红树莓果渣提取物的总还原能力与样品质量浓度呈良好的量效关系。当质量浓度大于25 mg/mL时,野生果果渣提取物的总还原能力大于栽培红树莓。与VC对照组相比,野生果和菲尔杜德果渣提取物的总还原能力较强,而宝石红和哈瑞太兹果渣提取物的总还原能力较弱。以不同浓度(mmol/L)FeSO4溶液为横坐标,吸光度为纵坐标,得到曲线方程为:y=6.927 9x+ 0.126 9(R2=0.999 2),样品的FRAP值见表1。

表1 红树莓果渣提取物的总还原能力Table 1 FRAP values for evaluating the total reducing capacity of red raspberry pomace extracts
由表1可知,野生果和菲尔杜德果渣提取物的FRAP值稍低于VC,其抗氧化活性与VC接近。6 种红树莓果渣提取物的总还原能力大小为:野生果>菲尔杜德>欧洲红>秋福>宝石红>哈瑞太兹。
2.2.2 清除DPPH自由基能力分析
由图6可知,当样品质量浓度在1~10 mg/mL之间时,红树莓果渣提取物清除DPPH自由基的能力随着其质量浓度的增大而增强;当质量浓度大于10 mg/mL时,变化趋势平缓。在质量浓度为20 mg/mL时,菲尔杜德和野生果果渣提取物对DPPH自由基的清除率分别达到92.22%、93.53%,显著高于哈瑞太兹果渣和VC处理组。不同品种红树莓果渣提取物清除DPPH自由基的IC50值见表2。
针对蚂蚁在返程路径上对食物源及遭遇的6种信息反馈情况,假设:(1)蚂蚁A和蚂蚁B视为无差异性的单位蚂蚁,亦可认定为单一组团蚂蚁(无离散情况且每一组团数量相同);(2)蚂蚁在寻觅发现食物源后,基于蚂蚁物种生物思维特性——即时反馈信息(具有寻觅食物源任务的先锋蚂蚁),返程途中发现其它蚂蚁后概率性选择返程或继续前行(不存在静止状态,且可以任意路径探索新食物源);(3)同质蚂蚁巢穴个体间不存在因食物存量问题发生争斗而折损情况;(4)蚂蚁A(组团A)和B(组团B)的ATA触角传递时间无损耗;(5)信息素的迹在理想模式下不挥发;(6)食物源包含2种类型,即利于携带和不利于携带.
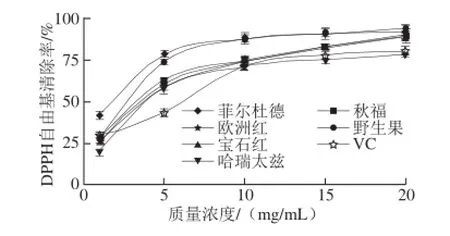
图6 红树莓果渣提取物清除DPPH自由基的能力Fig.6 DPPH radical scavenging capacity of red raspberry pomace extracts

表2 红树莓果渣提取物清除DPPH自由基的IC50值Table 2 IC50 values for DPPH radical scavenging capacity of red raspberry pomace extracts
由表2可知,除哈瑞太兹外,其他品种红树莓果渣提取物清除DPPH自由基的IC50值均小于VC,表明它们具有较强的清除DPPH自由基能力。6 种红树莓果渣提取物对DPPH自由基的清除能力由大到小依次为:菲尔杜德>野生果>宝石红>欧洲红>秋福>哈瑞太兹。
2.2.3 清除ABTS+·能力分析
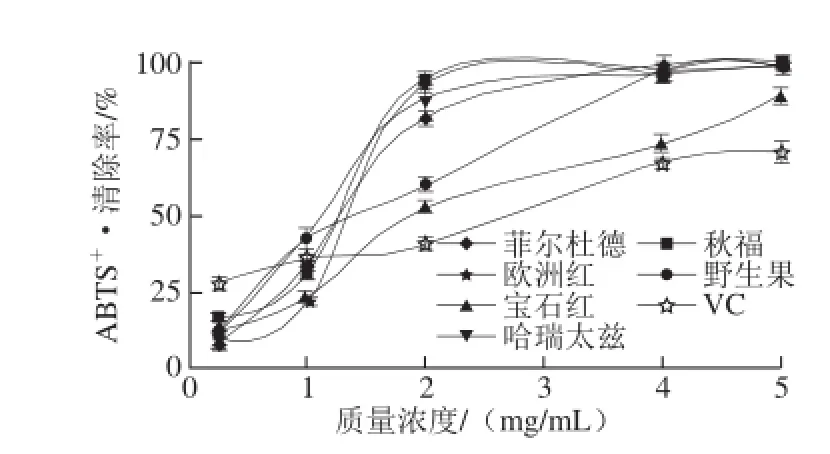
图7 红树莓果渣提取物清除ABBTTSS+·的能力Fig.7 ABTS+radical scavenging capacity of red raspberry pomace extracts
由图7可知,当样品质量浓度在0.25~4 mg/mL之间时,红树莓果渣提取物清除ABTS+·的能力随着其质量浓度的增大而增强;当质量浓度大于4 mg/mL时,变化趋势平缓。当质量浓度大于2 mg/mL时,6 种红树莓果渣提取物清除ABTS+·的能力均大于VC。当质量浓度大于4 mg/mL时,除宝石红外,其他品种红树莓果渣提取物对ABTS+·的清除率均大于96%,显著高于VC。不同品种红树莓果渣提取物清除ABTS+·的IC50值见表3。

表3 红树莓果渣提取物清除ABTS+的IC50Table 3 IC50 values for ABTS+radical scavenging capacity of red raspberry pomace extracts
由表3可知,不同品种红树莓果渣提取物清除ABTS+·的IC50值都小于VC,即红树莓果渣提取物对ABTS+·的清除能力大于VC。6 种红树莓果渣提取物对ABTS+·的清除能力由大到小依次为:秋福>哈瑞太兹>菲尔杜德>野生果>欧洲红>宝石红。
2.3 红树莓果渣提取物的抗氧化活性与活性成分含量的相关性分析

表4 红树莓果渣提取物的抗氧化活性与活性成分含量的相关性Table 4 Correlation analysis between antioxidant activities and contents of active components in red raspberry pomace extracts
由表4可知,红树莓果渣提取物的总还原能力与总黄酮含量有较大的正相关关系(r=0.727,P>0.05),与总酚的相关性较小(r=0.361,P>0.05),而原花青素和花色苷含量与总还原能力成负相关。红树莓果渣提取物对DPPH自由基的清除率与原花青素、花色苷含量的相关性较大(相关系数分别为r=0.713,P>0.05;r=0.755,P>0.05),但总酚和总黄酮含量对其清除DPPH自由基的贡献率很小;ABTS+·的清除率与总酚、总黄酮含量的相关性相对较大(相关系数分别为r=0.669,P>0.05;r=0.686,P>0.05),其次与原花青素含量也有一定的正相关关系,但花色苷含量对其清除ABTS+·的贡献率很小(r=0.149,P>0.05)。目前国内外对红树莓的抗氧化活性研究有不同的报道。王睿婷[17]和王友升[18]等研究发现红树莓果对DPPH自由基和ABTS+·的清除率与总多酚和总黄酮含量成显著相关,与花色苷含量的相关性较小。Golmohamadi等[19]研究结果表明红树莓果中花色苷含量越高,对DPPH自由基的清除率越高,两者相关性显著;花色苷是影响树莓色泽的重要因素,色泽较深的树莓品种(如Heritage)抗氧化活性更强。Maksimovic等[20]发现秋福果实的抗氧化活性(对ABTS+·的清除能力)与总酚含量和原花青素含量成极显著相关(相关系数分别为r=0.999 9,P<0.01;r=0.993 9,P<0.05),同时多酚氧化酶和过氧化物酶的活性与树莓的抗氧化活性也有一定的联系。红树莓提取物表现出复杂的抗氧化活性,具有抗氧化活性的主要物质还需进一步研究。
3 讨 论
在本研究中,6 种红树莓果渣中各种活性成分平均含量由大到小的排列顺序为:总酚>原花青素>总黄酮>花色苷,与Fu等[21]对红树莓果实中活性成分的研究结果一致。样品的总还原能力越强、对自由基的清除率越高,其抗氧化性越强。综合比较发现,菲尔杜德和野生果果渣提取物的抗氧化活性较强,宝石红和哈瑞太兹的抗氧化活性相对较弱。
国内外对红树莓果渣提取物的抗氧化活性研究较少,其复杂的抗氧化活性可能与活性成分之间的相互协同或拮抗作用的相关性更大。同时本实验所用的红树莓果渣是由果皮、果肉和树莓籽构成的混合体系,多组分成分使其抗氧化的机理更加复杂。因此,需要对红树莓果渣中组分成分进行深入研究,以期明确其活性成分的组成和结构、抗氧化机理、抗氧化活性与活性成分及其含量的关系。
[1] 张成涛, 万国盛, 赵余庆, 等. 红树莓果实中鞣花酸和树莓酮的含量测定[J]. 中国实验方剂学杂志, 2013, 19(19): 140-143. DOI:10.11653/syfj2013190140.
[2] ISIK E, SAHIN S, DEMIR C, et al. Determination of total phenolic content of raspberry and blackberry cultivars by immobilized horserdish peroxidase bioreactor[J]. Journal of Food Composition and Analysis, 2011, 24(7): 944-949. DOI:10.1016/j.jfca.2011.01.016.
[3] GONZÁLEZ E A, AGRASAR A T, CASTRO L M P, et al. Solidstate fermentation of red raspberry (Rubus ideaus L.) and arbutus berry (Arbutus unedo L.) and characterization of their distillates[J]. Food Research International, 2011, 44(5): 1419-1426. DOI:10.1016/ j.foodres.2011.02.032.
[4] GOD J, TATE P L, LARAM L L. Red raspberries have antioxidant effects that play a minor role in the killing of stomach and colon cancer cells[J]. Nutrition Research, 2010, 30(11): 777-782. DOI:10.1016/ j.nutres.2010.10.004.
[5] CETOJEVIC-SIMIN D, VELICANSKI A S, CVETKOVIC D D, et al. Bioactivity of Meeker and Willamette raspberry (Rubus idaeus L.) pomace extracts[J]. Food Chemistry, 2015, 166(1): 407-413. DOI:10.1016/j.foodchem.2014.06.063.
[6] 中华人民共和国国家标准. GB/T 5009.3—2010 食品中水分的测定[S].北京: 中国标准出版社, 2010: 1-8.
[7] 冯进, 曾晓雄, 李春阳. 响应面法优化蓝莓叶多酚提取工艺[J]. 食品科学, 2013, 34(4): 59-64.
[8] PANTELIDIS G E, VASILAKAKIS M, MANGANARIS G A, et al. Antioxidant capacity, phenol, anthocyanin and ascorbic acid contents in raspberries, blackberries, red currants, gooseberries and Cornelian cherries[J]. Food Chemistry, 2007, 102(3): 777-783. DOI:10.1016/ j.foodchem.2006.06.021.
[9] ZHANG G W, HE L, HU M M. Optimized ultrasonic-assisted extraction of flavonoids from Prunella vnlgaris L. and evaluation of antioxidant activities in vitro[J]. Innovative Food Science and Emerging Technologies, 2011, 12(1): 18-25. DOI:10.1016/ j.ifset.2010.12.003.
[10] 王新伟, 赵滢, 沈育杰. 山葡萄籽中原花青素提取工艺优化[J]. 食品科学, 2011, 32(10): 21-24.
[11] 陈亮, 辛秀兰, 王彦辉, 等. 红树莓花色苷含量测定及成分分析[J].食品与发酵工业, 2011, 37(5): 166-169.
[12] LU X N, WANG J, AI-QADIRI H M, et al. Determination of total phenolic content and antioxidant capacity of onion (Allium cepa) and shallot (Allium oschaninii) using infrared spectroscopy[J]. Food Chemistry, 2011, 129(2): 637-644. DOI:10.1016/ j.foodchem.2011.04.105.
[13] 高畅, 程大海, 高欣, 等. 蓝莓果渣提取物总酚含量及抗氧化活性研究[J]. 植物研究, 2010, 30(2): 253-256.
[14] 王振宇, 刘奕琳. 蓝靛果乙醇洗脱物的抗氧化活性研究[J]. 食品工业科技, 2012, 33(9): 163-165.
[15] 阎海青, 陈相艳, 程安玮, 等. 超声微波联用技术提取蓝莓多酚的工艺优化[J]. 中国食品添加剂, 2014(1): 88-94. DOI:10.3969/ j.issn.1006-2513.2014.01.006.
[16] 孙楠, 杜连平, 孙悦宁, 等. 黑果枸杞、枸杞、黑加仑中原花青素含量对比研究[J]. 食品与药品, 2013, 15(4): 275-277. DOI:10.3969/ j.issn.1672-979X.2013.04.022.
[17] 王睿婷, 王鑫, 张富敏, 等. 树莓的抗氧化活性与主要化学成分的相关分析[J]. 沈阳药科大学学报, 2013, 30(11): 901-904.
[18] 王友升, 谷组臣, 张帆. 不同品种和成熟度树莓和黑莓果实的氧化和抗氧化活性比较[J]. 食品科学, 2012, 33(9): 81-86.
[19] GOLMOHAMADI A, MOLLER G, POWERS J, et al. Effect of ultrasound frequency on antioxidant activity, total phenolic and anthocyanin content of red raspberry puree[J]. Ultrasonics Sonochemistry, 2013, 20(5): 1316-1323. DOI:10.1016/ j.ultsonch.2013.01.020.
[20] MAKSIMOVIC J J D, MILIVOJEVIC J M, POLEDICA M M, et al. Profiling antioxidant activity of two primocane fruiting red raspberry cultivars (Autumn bliss and Polka)[J]. Journal of Food Composition and Analysis, 2013, 31(2): 173-179. DOI:10.1016/j.jfca.2013.05.008.
[21] FU Y, ZHOU X Z, CHEN S G, et al. Chemical composition and antioxidant activity of Chinese wild raspberry (Rubus hirsutus Thunb.)[J]. LWT-Food Science and Technology, 2015, 60(2): 1262-1268. DOI:10.1016/ j.lwt.2014.09.002.
[22] BOBINAITE R, VISKELIS P, VENSKUTONIS P R. Variation of total phenolics, anthocyanins, ellagic acid and radical scavenging capacity in various raspberry (Rubus spp.) cultivars[J]. Food Chemistry, 2012, 132(3): 1495-1501. DOI:10.1016/j.foodchem.2011.11.137.
[23] AGUIRRE M J, CHEN Y Y, ISAACS M, et al. Electrochemical behavioru and antioxidant capacity of anthocyanins from Chilean red wine, grape and raspberry[J]. Food Chemistry, 2010, 121(1): 44-48. DOI:10.1016/j.foodchem.2009.11.088.
Antioxidant Capacities of Six Varieties of Red Raspberry Pomace Extracts in Northeast China
KUANG Hui, WANG Jinling*, YAO Limin, NING Weiyu
(School of Forestry, Northeast Forestry University, Harbin 150040, China)
The antioxidant capacities of ethanolic extracts from six different varieties of red raspberry pomace in Northeast China were evaluated. Results showed that the highest contents of total phenols, flavonoids and proanthocyanidins were determined in red raspberry pomace extracts from the U.S. Raspberry variety, which were up to 14.18, 3.71, and 15.28 mg/g, respectively. The highest content (0.68 mg/g) of anthocyanins was detected in Heritage red raspberry pomace extracts. The total reducing capacities of pomace extracts from the Fertod Zamatos variety and wild red raspberry were close to that of VC. Pomace extracts from all varieties except Heritage had stronger scavenging capacities against DPPH and ABTS+radicals than VC. The results of correlation analysis showed that there were significant correlations between the contents of flavonoids or proanthocyanidins and total reducing capacity, between the contents of proanthocyanidins or anthocyanins and DPPH scavenging capacity, and between the contents of total phenols or flavonoids and ABTS+radical scavenging capacity in red raspberry pomace extracts. The results of this study implied that red raspberry pomace extracts from the Fertod Zamatos variety and wild red raspberry have stronger antioxidant activities.
red raspberry pomace; extracts; active components; antioxidant capacities
10.7506/spkx1002-6630-201601012
S663.2;TS201.2
A
1002-6630(2016)01-0063-06
旷慧, 王金玲, 姚丽敏, 等. 6 种东北地区红树莓果渣提取物的抗氧化活性差异[J]. 食品科学, 2016, 37(1): 63-68.
DOI:10.7506/spkx1002-6630-201601012. http://www.spkx.net.cn
KUANG Hui, WANG Jinling, YAO Limin, et al. Antioxidant capacities of six varieties of red raspberry pomace extracts in Northeast China[J]. Food Science, 2016, 37(1): 63-68. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201601012. http://www.spkx.net.cn
2015-01-26
中央高校基本科研业务费专项资金项目(2572014CA14)
旷慧(1992—),女,硕士研究生,主要从事植物源活性物质研究。E-mail:belonghui2010@163.com
*通信作者:王金玲(1975—),女,副教授,博士,主要从事植物源活性物质研究。E-mail:wangjinling08@163.com

