固定化大鼠小肠组织制备生物传感器对白藜芦醇的检测
刘婷婷,乔立新,庞广昌*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 30013 4)
固定化大鼠小肠组织制备生物传感器对白藜芦醇的检测
刘婷婷,乔立新,庞广昌*
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 30013 4)
以海藻酸钠-淀粉凝胶作固定剂,将Sprague-Dawley(SD)大鼠的小肠回肠组织固定到两片核微孔膜中间制成“三明治”式传感膜,然后将其固定到玻碳电极上制成生物传感电极,通过电化学工作站测定出不同浓度白藜芦醇刺激其相应受体后的响应电流。结果表明:该传感器对白藜芦醇的最低检测限为1×10-13mol/L,在其浓度为8.5×10-12mol/L时电流变化率达到最大值,说明此时白藜芦醇的受体已经被饱和。用Origin软件对白藜芦醇与其受体的作用曲线进行双曲线拟合(R2=0.988 7),然后用双倒数法作图求出白藜芦醇与其受体的结合常数和解离常数分别为1.207×10-11和1.118×10-12。由此可以估测出,平均每个细胞的受体数约为85 个。通过将白藜芦醇固定化小肠上皮组织所制成的生物传感器的响应值和白藜芦醇与裸电极作用的响应值比较可知,小肠组织细胞对白藜芦醇的响应值显然得到了细胞内信号传递系统的放大作用,其放大倍数为100 倍。与此同时,细胞受体明显赋予该生物传感器的可饱和性特征,表现为类似于酶促反应动力学-米氏方程的典型特征。通过该传感器第一次定量化测定了白藜芦醇与受体互作并向机体内传递信号的动力学规律,这将为白藜芦醇受体分析、分离与纯化、信号传递及其生物功能评价与研究提供新的方法。
生物传感器;白藜芦醇;固定化;小肠
白藜芦醇(resveratrol)是含有芪类结构的非黄酮类多酚化合物,最早在1940年由日本人从一种植物白藜芦(Veratrum grandiflorum)的根部分离得到。后来发现其广泛存在于葡萄、虎杖、决明子和花生等天然植物或果实当中[1-3],并且是植物遭受胁迫时产生的一种能提高植物抵抗病原性攻击和环境恶化的植物抗毒素[4]。近些年来,国内外很多学者对白藜芦醇的生物学功能进行了深层研究,结果表明白藜芦醇具有抗癌、抗心血管疾病、抗突变、抗菌、抗炎、抗氧化、诱导细胞凋亡及雌激素调节等多方面有益人类健康的生物药理活性[5-9],因此它受到生物医学界的广泛重视。白藜芦醇作为一种植物雌性激素添加剂添加到药物或食品中,可防止女性在绝经期后体内雌性激素分泌不足而引起的一系列疾病[10]。此外,白藜芦醇可以被用作添加剂加到酒类或化妆品中,作为一种新型美容保健品以延缓衰老、保持肌肤水分、祛除疮类、黄褐斑等[11]。虽然现在白藜芦醇作为保健品已被人们所使用,但是有关白藜芦醇受体的研究未见报道。研究白藜芦醇和其受体的相关规律,有助于白藜芦醇对于机体的作用机理的研究并且能更好地发挥白藜芦醇的保健作用,造福人类。
小肠上皮组织作为肠道内外环境的媒介及机体免疫屏障的重要组成部分,具有消化、吸收、分泌等多种生物学功能。此外,肠上皮细胞还可作为抗原提呈细胞表达多种与抗原提呈相关的分子[12]。因此本课题组推测白藜芦醇可能正是通过和小肠上皮组织上的受体相互作用,向机体内传递调节信号发挥健康功能。本研究首先研制出以大鼠的小肠回肠组织为敏感元件,亦即:将小肠组织固定到两片核微孔膜之间,然后与玻碳电极相连接(玻碳电极与电脑连接)制成生物传感电极,当白藜芦醇溶液与小肠组织接触后,会引起小肠细胞超极化产生电化学变化,所以可以通过电化学工作站表征其性能和定量化测定其信号变化[13]。
传统对配体受体作用规律的研究方法大多是将受体单独纯化出来进行研究,但是纯化受体的过程不仅困难,而且当受体离开细胞膜之后往往失去了膜的锚定作用和一些胞内辅助因子的作用,不能真正反映受体在细胞膜上实际构象及其与配体的作用规律[14-16],而以小肠组织作为感受器的生物传感器,能够很好地保持白藜芦醇中固有受体细胞及其生物微环境,并能通过与其配基-白藜芦醇互作,激活并传递生理与电化学信号。该传感器不仅能够真实地反映大鼠小肠感受白藜芦醇的过程,而且充分利用了小肠上皮细胞通过受体所激活的细胞内的信号放大作用,更准确地模拟了白藜芦醇发挥生理作用过程和规律。除此之外,通过电流变化率可以获得白藜芦醇的浓度与受体作用曲线,间接求出配体-受体的结合常数和解离常数,进而对其动力学进行研究[17-18],这将为以后对配体受体的研究提供一种新的思路和方法。
1 材料与方法
1.1 材料与试剂
可溶性淀粉 天津市赢达稀贵化学试剂厂;海藻酸钠 天津市光复精细化工研究所;CaCl2、白藜芦醇 美国Sigma公司;戊二醛 天津博迪化工股份有限公司;核微孔膜 英国Whatman公司;水为超纯水。
1.2 仪器与设备
分析天平 上海精密科学仪器有限公司;Millipore Milli-Q纯水 上海雅荣生化设备仪器有限公司;KQ 3200B型超声波清洗器 昆山市超声仪器有限公司;LRH-70生化培养箱 上海一恒科技有限公司;CHI600E电化学工作站、三电极系统(玻碳电极(GCE Φ=3 mm)、参比电极-Ag/AgCl电极、对电极-铂丝电极) 上海辰华仪器有限公司。
1.3 动物
8~10 周龄的Sprague Dawley(SD)大鼠,体质量240~270 g,由天津市翔天科技有限公司提供。
1.4 方法
1.4.1 小肠组织的制备
取大鼠小肠中间1 cm的回肠段,洗净内容物,用刀片将小肠段剖开为平面,取0.25 cm2的小肠平面置于生理盐水中待用。
1.4.2 电化学生物传感器的制备
将可溶性淀粉溶解于含1%戊二醛的水溶液中,80 ℃水浴加热并搅拌30 min,配成一定质量浓度的淀粉溶液室温下放置过夜,使淀粉与戊二醛得到充分的交联获到醛基化淀粉胶溶液。醛基化淀粉胶溶液再与一定质量浓度的海藻酸钠溶液以1∶1体积比混合[19-21]。取上述溶液10 μL均匀涂抹于2 张直径为25 mm、孔径为0.22 μm的聚碳酸酯微孔膜上,将准备好的0.25 cm2的小肠组织放置于一张微孔膜的圆心上,然后将另一张覆盖上制成三明治结构的味觉测定膜。
将制成的小肠组织膜浸入质量分数5%的CaCl2溶液中10 s后取出,使海藻酸钠与CaCl2发生离子交换反应形成稳定的螯合物,使海藻酸钠溶液凝胶化成良好的固定剂[22-23]。然后用生理盐水冲洗(去除膜上存留的Cl-、Ca2+等)味觉测定膜。最后,用皮套将膜固定在玻碳电极头的表面使得小肠组织与表征完的电极芯重合,则此生物传感器便已制成。该传感器的制作原理如图1所示,就是当白藜芦醇与其受体结合之后,会引发小肠细胞去极化和Ca2+释放并产生动作电位,该生物传感器则是模拟生物体通过电极将电信号传到电脑中,来显示白藜芦醇配体与受体的作用规律。
1.4.3 电化学生物传感器对大鼠小肠的测定方法
采用三电极系统,以固定好大鼠小肠测定膜的玻碳电极为工作电极,Ag/AgCl电极作为参比电极,铂丝电极作为对电极,以生理盐水为测试底液,在一定的电压下通过电流-时间测定法测定10-13~10-3mol/L白藜芦醇的响应电流,以响应电流的变化率作为检测指标,当测试底液的响应电流值与被测溶液的响应电流值之差接近于零时,此时的被测物质浓度为它的最低检测限,每一浓度下平行测定3 次。计算响应电流的变化率的公式为:

式中:I1及I2分别表示白藜芦醇被测定前后同一时间点的稳态电流值/A。
2 结果与分析
2.1 电流-时间测定法的电位优化
制备好的传感器在不同电位下(测试底液为生理盐水)用电流-时间法进行测定,以加入10-5mol/L的白藜芦醇前后稳态电流差来衡量不同电位对传感器电化学响应效果的影响,以电位的相反数(-E)为横坐标、电流差值为纵坐标作图。如图2所示,结果表明在-0.38 V条件下电流的变化值最大,故选定-0.38 V为恒电位进行生物传感器对白藜芦醇响应特性的研究。
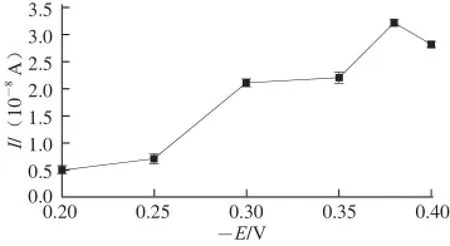
图2 电位对微生物传感器响应效果的影响Fig.2 Effect of response potential on response efficiency of microorganism sensors
2.2 白藜芦醇与其受体的作用曲线
将固定小肠组织的生物传感器置于不同浓度的白藜芦醇溶液中,从低浓度到高浓度做时间-电流法扫描,扫描电位选择-0.38 V,静置时间10 s,使受体和配基充分结合后,选择第60秒电流值作为稳态电流,以电流在受体-配基结合前后电流的变化率ΔI与配基的浓度作图。因为白藜芦醇的检测浓度范围很宽,不易作图,所以将其浓度重新定义。

式中:pCa为重新定义后的白藜芦醇的浓度;c为定义前的浓度。此式表示当pCa=1时,白藜芦醇的检测浓度最小为1×10-13mol/L。以白藜芦醇浓度的对数值为横坐标,其响应电流的电流变化率为纵坐标作图,如图3曲线a所示。

图3 白藜芦醇的检测浓度范围Fig.3 Detection range of resveratrol
由于电化学生物传感器的特性,裸电极在不同浓度的白藜芦醇溶液中也会产生电流的变化,裸电极在白藜芦醇溶液中的检测浓度最小为1×10-15mol/L。为了更准确地说明白藜芦醇与其受体的作用规律需要排除电极对不同浓度白藜芦醇溶液的影响。因此需要用裸电极测定10-13~10-3mol/L白藜芦醇的电流变化率。以白藜芦醇浓度的对数值为横坐标,其响应电流的电流变化率为纵坐标作图如图3曲线c所示。裸电极测定不同浓度白藜芦醇的电流变化率呈现出良好的线性关系。
为了明确白藜芦醇与受体的作用规律,如图3曲线b(图3曲线a与图3曲线c相同浓度白藜芦醇的电流变化率相减所得)所示,曲线具有可饱和性,说明回肠组织上具有白藜芦醇的受体。比较图3中的曲线a和c可知,白藜芦醇通过和肠上皮组织细胞上相应受体的相互作用,通过细胞信号传递与放大作用,使其响应电流大大提高,并呈现明显的双曲线性质,其信号被放大了100 倍。当其浓度为1×10-11mol/L时电流变化率达到最大值,说明此时受体已经被配体饱和,当浓度再增大时电流变化率明显下降,说明小肠组织受到反馈抑制。
2.3 白藜芦醇受体的饱和浓度
由图3可知,白藜芦醇在10-13~10-11mol/L的浓度范围内,电流的变化率呈现良好的线性关系。因此,在白藜芦醇浓度为10-13~10-11mol/L的浓度范围内,将白藜芦醇的检测浓度进一步细分为20 个梯度即0.1、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0 pmol/L,以白藜芦醇的浓度指数为横坐标、电流的变化率为纵坐标作图,由图4可知,白藜芦醇的浓度在8.5 pmol/L电流变化率达到最大值,说明受体已经被配基饱和。
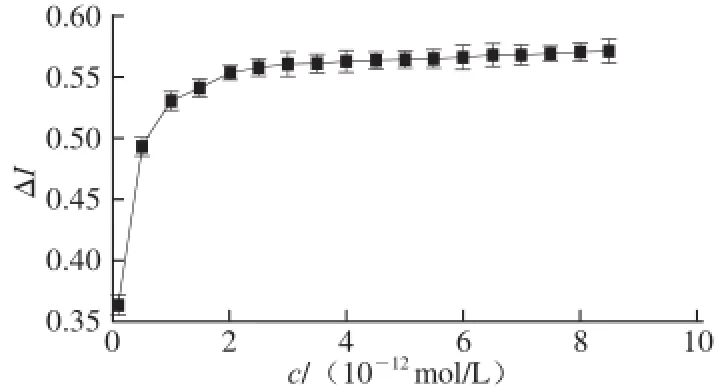
图4 白藜芦醇在其浓度为1×1100-1133~11×1100-1111mol/L的线性关系Fig.4 Linear relationship for resveratrol and its receptor in the concentration range from 1 × 10-13mol/L to 1 × 10-11mol/L
用Origin软件对图4的曲线进行双曲线拟合所得曲线如图5,在0.1~8.5 pmol/L白藜芦醇浓度下,响应电流值差值逐渐递增,双曲线拟合R2=0.988 7,可知相关性很高,和酶与底物催化作用动力学(米氏方程)规律相似。在低浓度范围0.1~1 pmol/L,电流变化值呈线性增长,说明配基的分子数远远小于相应的受体数,后一部分呈曲线说明受体被逐渐饱和。其饱和浓度为:8.5 pmol/L。由白藜芦醇最低检测限和最大饱和浓度可以推测平均细胞上的受体数的估测值为85 个。拟合公式为:

式中:0.571 0是最大电流变化率;0.108 9是反应达到最大电流变化率(ΔI)一半时的白藜芦醇的浓度。

图5 白藜芦醇与其受体的作用规律Fig.5 Law of interaction between resveratrol and its receptor
2.4 白藜芦醇与其受体的结合常数和解离常数
通过1.3.3节的方法组装电极,然后将白藜芦醇的测试浓度在1.0×10-13~8.5×10-12mol/L范围内以递增的趋势设置浓度梯度,每增加一个浓度测定一次相应的稳态电流值,根据公式(1)计算每一个浓度下响应电流的电流变化率,然后以白藜芦醇浓度的倒数为x轴、以固定小肠测定白藜芦醇的电流变化率减去裸电极的电流变化率的数值的倒数为y轴作图(双倒数法作图),即图6,此直线的线性回归方程为:

根据此方程可求出白藜芦醇与其受体相互作用的结合常数Ka=1.207×10-11。

图6 白藜芦醇与其受体结合常数的测量曲线Fig.6 Curve for the measurement of binding constant between resveratrol and its receptor
然后设置相同的浓度,按照从高到底的顺序依次测定此浓度下响应电流的稳态电流值,求出电流变化率,用相同的方法作图,即图7,此直线的线性回归方程为:

根据此方程可求出白藜芦醇与其受体相互作用的解离常数Kd=1.118×10-12。

图7 白藜芦醇与其受体解离常数的测量曲线Fig.7 Curve for the measurement of dissociation constant between resveratrol and its receptor
2.5 固定化大鼠小肠组织生物传感器的稳定性及重现性
将制成的生物传感器在同一浓度的白藜芦醇溶液中连续测定10 次,结果相对标准偏差(relative standard deviation,RSD)为7.34%,表明该电化学生物传感器稳定性能良好[24],将该传感器保存在4 ℃生理盐水中。
在4 ℃生理盐水中保存该组织传感器,每天对同一浓度的白藜芦醇溶液进行测定,前3 d该传感器响应电流变化率基本恒定,第4天其电流变化率是初始电流变化率的95.1%,第5天其电流变化率仅为初始电流变化率的75.62%。表明该组织传感器至少可稳定保存3 d。
取不同批次制备的电化学型组织传感器5 支,对同一浓度的白藜芦醇溶液进行检测,电流响应结果如表1所示,响应电流的RSD为7.966%,表明该白藜芦醇生物传感器重现性能良好。
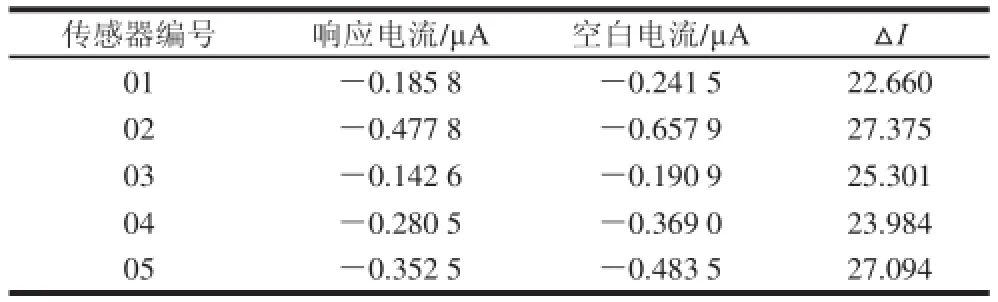
表1 传感器重现性实验结果Table1 Reproducibility of response current measurements using the sensors
3 结 论
通过固定化大鼠小肠组织制备的生物传感器,第一次定量化测定了白藜芦醇与其受体的作用规律,检测限为1×10-13mol/L,白藜芦醇与裸电极的作用检测限为1×10-15mol/L,拟合的双曲线模型说明回肠组织上有白藜芦醇的受体。通过对不同浓度白藜芦醇的测定,可知在8.5×10-12mol/L的浓度时白藜芦醇的电流变化率达到最大值,说明此时白藜芦醇的受体已经被饱和,通过双倒数作图法求出白藜芦醇的 结合常数和解离常数分别为1.207×10-11和1.118×10-12。白藜芦醇与其受体的作用规律和酶与底物催化作用动力学(米氏方程)规律相似,由此可以估测出,平均每个细胞的受体数约为:85 个。通过将白藜芦醇固定化小肠上皮组织所制成的生物传感器的响应值和白藜芦醇与裸电极作用的响应值比较可知,小肠组织细胞对白藜芦醇的响应值显然得到了细胞内信号传递系统的放大作用,其放大倍数为100 倍。与此同时细胞受体明显赋予该生物传感器的可饱和性特征,表现为类似于酶促反应动力学-米氏方程的典型特征。
该传感器通过固定化大鼠回肠组织,模拟小肠组织的信号传导过程,成功地实现了白藜芦醇的定量化测定,探讨了它与相应受体的相互作用规律,为研究受体与配体(配基)的作用规律提供了一条新的思路。与此同时该生物传感器的稳定性和重现性良好,增加了实验的准确性和可信度。但是,小肠组织的固定化是否依然对其受体和配体(配基)相互作用有影响?小肠组织经过固定化以后的信号传导过程是否仍能真实反映小肠生理过程尚需进一步深入研究。
[1] 陈镇泉, 林娇健, 陈君琛, 等. 科学新发现与葡萄新品种[J]. 葡萄栽培与酿酒, 1997(3): 54-56.
[2] JANG M, CAI L, UDEANI G O, et al. Cancer chemopreventive activity of resveratrol natural product derived from grapes[J]. Science, 1997, 275: 218-200.
[3] JEANDET P, BESSIS R, GAUTHERON B. The production of resveratrol (3, 5, 4’-trihydroxystilbene) bygrape berries in different developmental stages[J]. American Journal of Enology and Viticulture, 1991, 42: 41-46.
[4] INGHAM J L. 3,5,4’-Trihydroxy stibene as a phytoalexin from groundnuts (Arachis hypogaea)[J]. Phytochemistry, 1976, 15(11): 1791-1793.
[5] 金婉冰, 田景鸣. 白藜芦醇对人卵巢癌细胞株A2780凋亡及Bcl-2及Bax蛋白表达的影响[J]. 中医药通报, 2010, 9(4): 60-62. DOI:10.3969/j.issn.1671-2749.2010.04.021.
[6] 孟德萍, 许晓群, 王郡甫. 白藜芦醇的抗肿瘤效应机制[J]. 国际肿瘤学杂志, 2011, 38(7): 489-492. DOI:10.3760/cma.j.issn.1673-422X.2011.07.003.
[7] FREMONT L. Biological effects of resveratrol[J]. Life Sciences, 2000, 66(8): 663-673.
[8] 周美娟, 朱春燕. 白藜芦醇生物学活性研究进展[J]. 现代生物医学进展, 2009, 8(11): 2140-2142.
[9] MARK L, NIKFARDJAM M S, AVAR P, et al. A validated HPLC method for the quantitative analysis of trans-resveratrol and transpiceid in Hungarian wines[J]. Journal of Chromatographic Science, 2005, 43(9): 445-449.
[10] GEHM B D, McANDREWS J M, CHIEN P M. et al. Resveratrol, a polyphenolic compound found in and grapes wine, is an agonist for the estrogen receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94: 14138-14143.
[11] ZHANG Mei, YANG Lin. Research progression on the biological role of resveratrol[J]. Journal of North China Coal Medical College, 2007, 9(3): 333-335.
[12] 周维英, 张卫军. 肠道黏膜免疫系统抗原提呈细胞研究进展[J]. 免疫学杂志, 2009, 25(2): 225-228.
[13] QIAO Lixin, JIAO Lihua, PANG Guangchang, et al. A novel pungency biosensor prepared with fixing taste-bud tissue of rats[J]. Biosensors and Bioelectronics, 2015, 68: 454-461. DOI:10.1016/ j.bios.2015.01.032.
[14] 胡笑克. 实验核医学和核药学[J]. 中国核医学杂志, 2000, 20(1): 34-35.
[15] 孔爱英, 乔晋萍, 武仙英, 等. 受体-配体结合的质谱分析方法研究进展[J]. 中国药学杂志, 2013, 48(15): 244-1248.
[16] CHANDRASHEKAR J, HOON M A, RYBA ZUKER C S. The receptors and cells formammalian taste[J]. Nature, 2006, 444: 288-294.
[17] SARA N, JENNIFER V, CHRIS G, et al. Target-drug interactions: first principles and their application to drug discovery[J]. Drug Discovery Today, 2012, 17: 10-22. DOI:10.1016/j.drudis.2011.06.013.
[18] TRAVIS S, HUGHES M J, CHALMERS S N, et al. Ligand and receptor dynamics contribute to the mechanism of graded PPARγ agonism[J]. Structure, 2012, 20: 139-150. DOI:10.1016/ j.str.2011.10.018.
[19] GOMBOTZ W R, WEE S F. Protein release from alginate matrices[J]. Advanced Drug Delivery Reviews, 1998, 31: 267-285. DOI:10.1016/ S0169-409X(97)00124-5.
[20] ZACTITI E M, KIECKBUSCH T G. Release of potassium sorbate from active films of sodium alginate c rosslinked with calcium chloride[J]. Packaging Technology and Science, 2009, 22(6): 349-358. DOI:10.1590/S0104-14282011005 000034.
[21] REISS M, HEIBGES A, METZGER J, et al. Determination of BOD-values of starch-containing waste water by a BOD-b iosensor[J]. Biosensors and Bioelectronics, 1998, 13: 1083-1090.
[22] BIERHALZ A C K, da SILVA M A, BRAGA M E M, et al. Effect of calcium and/or barium crosslinking on the physical and antimicrobial properties of natamycin-loaded alginate films[J]. LWT-Food Science and Technology, 2014, 57: 494-501. DOI:10.1016/j.lwt.2014.02.021.
[23] RHIM J. P hysical and mechanical properties of water resistant sodium alginate films[J]. LWT-Food Science and Technology, 2004, 37: 323-330. DOI:10.1016/j.lwt.2003.09.008.
[24] SHUM S C K, NEDDERSEN R. Measuremen to felemental speciation by liquid chrom atography inductively coupled plasma mass spectrometry with the direct injection nebulizer(DIN)[J]. Analyst, 1992, 117(3): 577-582.
Development of Biosensor Based on Immobilized Rat Small Intestine Tissues for Detecting Resveratrol
LIU Tingting, QIAO Lixin, PANG Guangchang*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Using sodium alginate-starch gel as a fixing agent, small intestine tissues of Sprague-Dawley rats were fixed between two nuclear micro porous membranes, forming a sandwich-type membrane, and then fixed to a glassy carbon electrode to make a biosensor electrode. By using electrochemical workstation for the detection of the response current from receptor stimulation by different resveratrol concentrations, the results showed that the lowest limit of detection of this biosensor for resveratrol was 1 × 10-13mol/L and the highest rate of change in response current w as found at the concentration of 8.5 × 10-12mol/L, indicating that the resveratrol receptor was saturated at this point. The role of resveratrol and its receptor was fitted to a hyperbolic curve with Origin software (R2= 0.988 7). It showed that the correlation is high. The binding constant and dissociation constant of resveratrol and its receptor evaluated by the double-reciprocal plot method were 1.207 × 10-11and 1.118 × 10-12, respectively. Thus the number of receptors to every cell is estimated to be about 85. By comparing response values of resveratrol biosensor immobilized on rat intestinal epithelial tissue to the interaction of resveratrol with the bare electrode, the response value of the small intestine tissue to resveratrol clearly gained amplified function of intracellular signaling system with a magnification rate of up to 100. Meanwhile, the cell receptors obviously rendered the biosensor saturabile and the typical characteristic was similar to the enzymatic reaction kinetic equation. This study for the fi rst time accomplished the quantitative determination of the interactions between resveratrol and receptors and the dynamic law of signal transmission in the body through biosensors. This will provide new methods for resveratrol receptor analysis, separation and purifi cation, signal transmission and biological function evaluation.
biosensor; resveratrol; immobilization; small intestine
10.7506/spkx1002-6630-201603022
TS202.3
A
1002-6630(2016)03-0114-06
刘婷婷, 乔立新, 庞广昌. 固定化大鼠小肠组织制备生物传感器对白藜芦醇的检测[J]. 食品科学, 2016, 37(3): 114-119. DOI:10.7506/spkx1002-6630-201603022. http://www.spkx.net.cn
LIU Tingting, QIAO Lixin, PANG Guangchang. Development of biosensor based on immobilized rat small intestine tissues for detecting resveratrol[J]. Food Science, 2016, 37(3): 114-119. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201603022. http://www.spkx.net.cn
2015-06-05
国家自然科学基金面上项目(31371773)
刘婷婷(1990—),女,硕士研究生,研究方向为发酵工程。E-mail:1215934682@qq.com
*通信作者:庞广昌(1956—),男,教授,博士,研究方向为食品生物技术。E-mail:pgc@tjcu.edu.cn

