miRNA21抑制剂对食管癌细胞凋亡的影响
李红霞,李玉芝,高峻峰,刘思涵,葛 磊,鲍扬漪,汪正广
miRNA21抑制剂对食管癌细胞凋亡的影响
李红霞1,李玉芝1,高峻峰1,刘思涵1,葛 磊1,鲍扬漪1,汪正广2
目的 探讨miRNA21抑制剂对食管癌细胞EC109凋亡的影响。方法 实时荧光定量PCR法检测20例食管癌及癌旁组织中miRNA21的表达。转染miRNA21抑制剂入人食管癌细胞株EC109,Caspase 3活性检测试剂盒分析Caspase 3活性变化,DNA片段检测试剂盒分析DNA片段变化,Western blot法检测Caspase 3及BCL-2表达。结果 相对癌旁组织,食管癌组织中miRNA21表达明显升高;miRNA21抑制剂能显著增加EC109细胞凋亡;同时miRNA21抑制剂促进食管癌细胞EC109 Caspase 3的表达上调,Bcl-2的表达下调。结论 食管癌的发生可能与miRNA21的高表达有关,miRNA21抑制剂可能通过下调Bcl-2的表达诱导人食管癌细胞EC109的凋亡。
食管癌;细胞凋亡;miRNA21;Bcl-2
食管癌是常见的消化道肿瘤之一[1],在我国食管癌的发病率和死亡率位于前列[2]。手术切除术是目前治疗食管癌的主要方法,但手术切除对患者有严格的要求,如已呈恶病质、发生远端转移等的患者均不能行根治性手术治疗。因此,寻找食管癌进展及转移等病变的特异性指标对其治疗及提高患者的生存率具有重要的理论和实际意义。microRNA(miRNA)是一类广泛存在于真核细胞中,长度一般为21~23个核苷酸的RNA分子[3]。研究[4]显示,miRNA对真核细胞的基因表达具有调控作用。miRNA通过与靶标基因转录的mRNA分子的3′端非编码区域互补结合,阻断蛋白质翻译的过程从而发挥对靶标的调控。miRNA在肿瘤的发生发展过程中的作用已有相关报道[5],但在食管癌中研究较少。该实验在研究食管癌组织标本中miRNA21表达变化的基础上,在人食管癌细胞EC109中转染miRNA21抑制剂,探讨其对食管癌细胞凋亡的影响及其可能的作用机制。
1 材料与方法
1.1 组织、细胞及主要试剂 标本来自安徽医科大学第三附属医院胸外科手术切除并经病例证实的食管癌及癌旁组织;人食管癌细胞株EC109(中国科学院上海细胞库);miRNA荧光定量PCR试剂盒(HG SYBR Green RNU6B,AP01501,中国北国海基生物科技有限公司);小鼠抗人Bcl-2及Caspase 3单克隆抗体(美国Santa Cruz公司);小鼠抗人GAPDH单克隆抗体(北京中杉金桥生物技术有限公司);RNA抽提试剂盒(美国Gibco-BRL公司);Caspase 3活性检测试剂盒(美国BIOMOL Research Laboratories公司);DNA片段检测试剂盒(瑞士Roche Applied Science公司)。
1.2 方法
1.2.1 RNA的制备 取食管癌及癌旁组织标本于匀浆器中匀浆。加入1 ml TRIzol试剂后冰上放置5 min,加0.2 ml氯仿,震荡混匀后静置3 min,14 000 r/min离心15 min。上层水相移至离心管加异丙醇,放10 min,14 000 r/mim离心15 min,弃上清液,加75%乙醇洗涤。弃乙醇干燥10 min,沉淀重悬于无RNA酶的水中。
1.2.2 miRNA21的检测 miRNA检测试剂盒分析miRNA21的表达(参考试剂盒说明书)。
1.2.3 细胞培养及转染 食管癌EC109细胞于RPMI 1640的培养基中培养(含20%胎牛血清),EC109细胞呈单层后消化细胞,接种至6孔板中(细胞计数每孔约5×105个,48 h后用RPMI 1640培养液洗涤3次(不含血清),分别转染miRNA21抑制剂和miRNA阴性对照,半小时后加入脂质体Lipofectamine2000 10 μl/孔,转染6 h后更换培养基,进行后续实验。
1.2.4 Caspase 3活性检测 Caspase 3活性检测试剂盒分析其活性。方法如下:待EC109细胞密度长到80%~90%时,PBS洗3遍,加入1 ml胰酶,37℃消化3 min,吹打细胞液至单细胞悬液。将Lipfectamine2000与miRNA21抑制剂及对照的混合液加入不同的培养板中孵育48 h。离心2 min,PBS洗涤2次,加入100 μl裂解缓冲液,冰上放置15 min,涡旋振荡15 s,离心5 min。取10 μl蛋白上清液,加入90 μl检测缓冲液中,加入10 μl Ac-LEHD-pNA,避光反应1~2 h后检测结果。
1.2.5 DNA片段检测 DNA片段检测试剂盒分析其变化(参考试剂盒说明书)。待EC109细胞密度长到80%~90%,用PBS洗3遍,加入1 ml胰酶,37℃消化3 min,吹打细胞液至单细胞悬液。将Lipfectamine2000与miRNA21抑制剂及对照的混合液加入不同的培养板中孵育48 h。离心2 min,PBS洗涤2次,加BrdU至终浓度为10 mmol/L。培养过夜。去培养基,PBS洗2次。加入过氧化物酶结合的BrdU抗体,450 nm检测吸光度。
1.2.6 Western blot法检测 待EC109细胞密度长到80%~90%,用PBS洗3遍,加入蛋白裂解液以裂解细胞,BAC法检测蛋白浓度。配制SDS-PAGE凝胶后行蛋白电泳后将凝胶中蛋白转移至PVDF膜,5%脱脂奶粉封闭3 h,分别加入相应的抗体Bcl-2、Caspase 3及GAPDH,孵育过夜后PBS洗涤3次,每次10 min,加二抗,孵育3 h后PBS洗涤3次,每次10 min,ECL法显色。
1.3 统计学处理 采用SPSS 16.0软件进行分析,符合正态分布的定量变量以±s表示。多组计量资料的比较采用单因素方差分析,多组之间的两两比较采用LSD-t检验的方法,两独立样本均数比较采用成组设计的t检验。
2 结果
2.1 miRNA21在食管癌中的表达 实时荧光定量PCR结果显示:相对于癌旁组织,食管癌组织中miRNA21表达明显升高(t=2.645,P<0.05),达到230%(图1)。

图1 食管癌中miRNA21含量的变化
2.2 miRNA21抑制剂对食管癌EC109细胞Caspase 3活性的影响 将miRNA阴性对照、miRNA21抑制剂用Lipofeetamine2000转染EC109细胞,接种于6孔板中。Caspase 3检测结果显示:相对于正常对照组及miRNA阴性对照组,miRNA21抑制剂组Caspase 3活性明显升高(F=64.78,P<0.05)。提示miRNA21能显著诱导EC109细胞凋亡。见图2。
2.3 miRNA21抑制剂对食管癌EC109细胞DNA片段的影响 将miRNA阴性对照、miRNA21抑制剂用Lipofeetamine2000转染EC109细胞,接种于6孔板中。DNA片段检测试剂盒结果显示:相对于正常对照组及miRNA阴性对照组,miRNA21抑制剂组DNA片段出现明显增加(F=12.80,P<0.05)。提示miRNA21抑制剂能显著诱导EC109细胞凋亡。见图3。
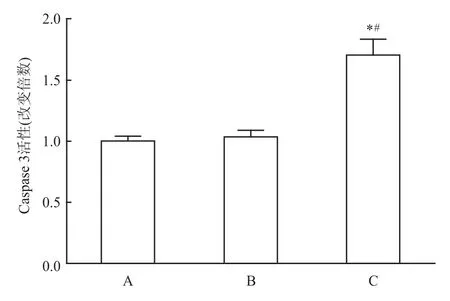
图2 miRNA21抑制剂对食管癌EC109细胞Caspase 3活性的影响

图3 miRNA21抑制剂对食管癌EC109细胞DNA片段的影响
2.4 miRNA21抑制剂对食管癌EC109细胞Caspase 3表达的影响 Western blot结果显示:相对于正常对照组及miRNA阴性对照组,miRNA21抑制剂能显著促进Caspase 3表达(F=34.56,P<0.05)。见图4。
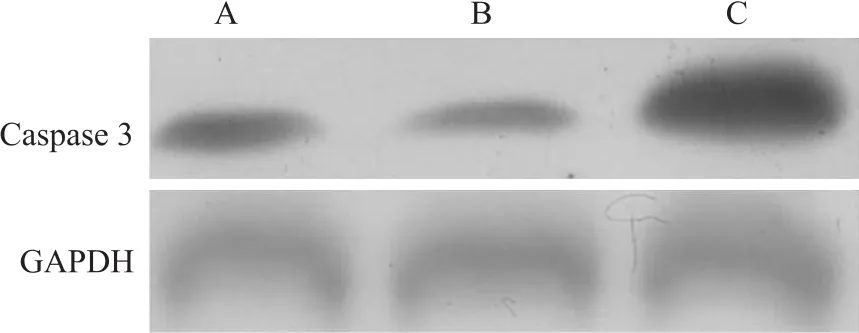
图4 miRNA21抑制剂对食管癌EC109细胞Caspase 3表达的影响
2.5 miRNA21抑制剂对食管癌EC109细胞Bcl-2表达的影响 Western blot结果显示:相对于正常对照组及miRNA阴性对照组,miRNA21抑制剂能显著抑制Bcl-2表达(F=25.31,P<0.05)。见图5。
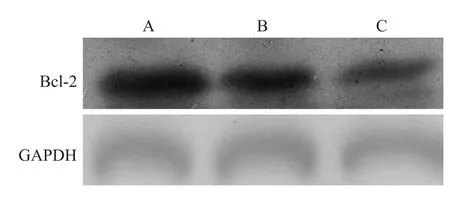
图5 miRNA21抑制剂对食管癌EC109细胞Bcl-2表达表达的影响
3 讨论
食管癌是我国乃至世界范围内的恶性肿瘤,尽管手术切除术及放化疗法在临床上广泛应用,得到了很大的发展,但是患者的预后并不理想。因调节秀丽线虫发育作用,使得Lin-4成为首个发现的miRNA[6]。而在对慢性淋巴细胞白血病的研究[7]显示miRNA与肿瘤发生发展及诊断治疗之间具有重要的相关性,在此之后人们开始关注并进行了大量广泛的研究。研究[8-9]表明,肿瘤的发生和发展与miRNA的异常表达(包括上调和下调)密切相关,miRNA作为调控基因表达的一类小分子RNA,主要通过与下游靶基因mRNA的相互作用,调控着肿瘤的发生发展,扮演着非常重要的角色。研究[10-11]表明,miRNA与肿瘤的发生发展、诊断治疗有重要的相关性,而在食管癌与miRNA方面研究的相对较少。
miRNA21被广泛用于结直肠癌研究。研究[12]显示其可以下调肿瘤抑制基因和诱导细胞增殖。研究[13]表明miRNA21可以作为结直肠癌的一个生物标记物。在食管癌中是否具有一定的生物学作用,目前仍不清楚。本实验结果显示相对癌旁组织,在食管癌标本中miRNA21表达明显升高,提示miRNA21起了癌基因的作用,在食管癌的发生发展中发挥一定的作用。为证实miRNA21的功能,本研究进一步用miRNA21抑制剂处理食管癌EC109细胞,观察miRNA21抑制剂是否对细胞的凋亡产生影响,结果显示miRNA21抑制剂处理后的EC109细胞,其Caspase 3活性、DNA片段等反映细胞凋亡指标发生显著的变化。进一步研究显示抗凋亡蛋白Bcl-2的表达出现了明显的降低。以上结果提示miRNA21抑制剂可能通过抑制Bcl-2的表达促进EC109细胞的凋亡。
本实验结果表明miRNA21抑制剂能明显诱导食管癌EC109细胞的凋亡,为食管癌的诊断、治疗及预防提供了一定的实验基础,但miRNA21抑制剂是否直接通过靶向Bcl-2进而调节食管癌EC109细胞的凋亡,目前并不清楚。下一步将利用生物信息学的方法对miRNA21的靶标进行预测,并利用相关实验法对miRNA21潜在靶标进行验证,为治疗食管癌提供新的靶点。
[1] Andrici J,Hu S X,Eslick G D.Facial flushing response to alcohol and the risk of esophageal squamous cell carcinoma:A comprehensive systematic review and meta-analysis[J].Cancer Epidemiol,2015,40:31-8.
[2] Gao Q Y,Fang J Y.Early esophageal cancer screening in China[J].Best Pract Res Clin Gastroenterol,2015,29(6):885-93.
[3] Crea F,Clermont P L,Parolia A,et al.The non-coding transcriptome as a dynamic regulator of cancer metastasis[J].Cancer Metastasis Rev,2014,33(1):1-16.
[4] Cheng Q,Yi B,Wang A,et al.Exploring and exploiting the fundamental role of microRNAs in tumor pathogenesis[J].Onco Targets Ther,2013,6:1675-84.
[5] Sethi S,Ali S,Kong D,et al.Clinical implication of microRNAs in molecular pathology[J].Clin Lab Med,2013,33(4):773-86.
[6] Wightman B,Ha I,Ruvkun G.Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C.elegans[J].Cell,1993,75(5):855-62.
[7] Calin G A,Dumitru C D,Shimizu M,et al.Frequent deletions and down-regulation of micro-RNA genes miR15 and miR16 at 13q14 in chronic lymphocytic leukemia[J].Proc Natl Acad Sci USA,2002,99(24):15524-9.
[8] Rana T M.Illuminating the silence:understanding the structure and function of small RNAs[J].Nat Rev Mol Cell Biol,2007,8(1):23-36.
[9] Dalmay T,Edwards D R.MicroRNAs and the hallmarks of cancer[J].Oncogene,2006,25(46):6170-5.
[10]Winter J,Jung S,Keller S,et al.Many roads to maturity:microRNA biogenesis pathways and their regulation[J].Nat Cell Biol,2009,11(3):228-34.
[11]晋志远,黄 强,刘臣海,等.microRNA-21对裸鼠人胆管癌细胞移植瘤EMT的影响[J].安徽医科大学学报,2015,50(10):1399-402.
[12]Asangani I A,Rasheed S A,Nikolova D A,et al.MicroRNA-21(miR-21)post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion,intravasation and metastasis in colorectal cancer[J].Oncogene,2008,27(15):2128-36.
[13]Kanaan Z,Rai S N,Eichenberger M R,et al.Plasma miR-21:A potential diagnostic marker of colorectal cancer[J].Ann Surg,2012,256(3):544-51.
Effect of miRNA21 inhibitor on the apoptosis of esophageal cancer cell line
Li Hongxia,Li Yuzhi,Gao Junfeng,et al
(Dept of Oncology,The Third Affiliated Hospital of Anhui Medical University,Hefei 230061)
Objective To investigate the effect of miRNA21 inhibitor on the apoptosis of esophageal cancer cell line EC109.Methods The expression of miRNA21 in 20 cases of esophageal cancer and adjacent tissues was detected by real-time fluorescence quantitative PCR.miRNA21 inhibitor was transfected into human esophageal cancer cell line EC109.Caspase 3 activity was analyzed by Caspase 3 activity test kit,DNA fragment changes were measured by DNA fragment detection kit.Western blot was used to detect Caspase 3 and Bcl-2 expression.Results Real-time fluorescence quantitative PCR results showed that compared with adjacent tissue to carcinoma,miRNA21 expression in esophageal cancer tissues increased significantly.Caspase 3 activity and DNA fragment analysis indicated that miRNA21 inhibitor could significantly increase the EC109 cells apoptosis.Western blot showed that Caspase 3 expression was significantly up-regulated and Bcl-2 expression was significantly down-regulated in esophagus cancer EC109 cells transfected with miRNA21 inhibitor.Conclusion The occurrence of esophageal carcinoma may be related to the high expression of miRNA21.miRNA21 inhibitor may induce apoptosis of human esophageal cancer cell EC109 by down regulating the expression of Bcl-2.
esophageal carcinoma;apoptosis;miRNA21;Bcl-2
R 735.1
A
1000-1492(2016)08-1124-04
时间:2016-6-22 14:44:58
http://www.cnki.net/kcms/detail/34.1065.R.20160622.1444.022.html
2016-05-04 接收
安徽省自然科学基金(编号:1608085MH182)
1安徽医科大学第三附属医院肿瘤科,合肥 230061
2安徽医科大学第一附属医院普外科,合肥 230022
李红霞,女,副主任医师;
鲍扬漪,女,主任医师,责任作者,E-mail:1262074653@qq. com

