生防菌Hhs.015防止苹果腐烂菌侵染寄主的组织学与细胞学研究
范东颖,赵玲云,黄丽丽,颜 霞
(西北农林科技大学 a 生命科学学院,b旱区作物逆境生物学国家重点实验室,c 植物保护学院,陕西 杨凌 712100)
生防菌Hhs.015防止苹果腐烂菌侵染寄主的组织学与细胞学研究
范东颖a,b,赵玲云a,b,黄丽丽b,c,颜霞a,b
(西北农林科技大学 a 生命科学学院,b旱区作物逆境生物学国家重点实验室,c 植物保护学院,陕西 杨凌 712100)
【目的】 对生防菌Hhs.015抑制苹果腐烂菌(Valsamali)在寄主中侵入、定殖、扩展的现象进行组织学与细胞学观察,阐释生防菌Hhs.015对苹果腐烂病的防治机理。【方法】 利用扫描电镜技术观察生防菌Hhs.015侵入寄主的方式,对Hhs.015作用下寄主体内的苹果腐烂菌亚细胞结构变化进行透射电镜观察,并用荧光显微镜观察寄主胼胝质的发生与积累情况。【结果】 Hhs.015通过树皮皮孔、毛孔等自然孔口侵入树皮,与苹果腐烂菌的侵入方式一致,可能在空间位点上与病原菌存在竞争作用; Hhs.015作用下寄主体内的苹果腐烂菌菌体细胞壁不均且加厚、质壁分离、细胞质凝缩固集并形成大液泡,还能够诱导寄主产生胼胝质积累等抗性反应,对苹果腐烂菌菌丝的生长与侵染扩展产生了明显的抑制作用。【结论】 生防菌Hhs.015可能通过竞争、抗生溶菌、诱导抗性等综合作用来防止苹果树腐烂病菌对寄主的侵染。
生防菌Hhs.015;苹果腐烂菌;空间位点竞争;抗菌作用;胼胝质积累
苹果树腐烂病主要由苹果腐烂菌(Valsamali)侵染果树枝干引起[1],轻者造成主枝、主干枯死, 重者全株枯死, 甚至毁园[2]。该病在我国各大苹果产区均有发生,全国平均病株率高达70%,对我国苹果产量和质量均造成了严重影响[3-4]。目前主要使用化学药剂对苹果树腐烂病进行防治[5],但随着人们对化学药剂残留、环境污染等问题的关注,生物防治因其无毒害、无污染、不易导致抗药性产生等优点,受到越来越多的重视与研究[6-7]。
生防机理主要有竞争作用、抗生溶菌作用、促进植物生长和诱导抗性等方面[8-9]。竞争作用,即生存空间和营养资源竞争,有些生防菌可以通过占领其合适的侵入定殖位点,吸收寄主营养物质,进而排斥病原菌的侵染定殖[10]。如郭荣君等[11]研究表明,芽孢杆菌BH1可以在大豆根部短期定殖,营养竞争是其抑制大豆根腐病的一个重要方面。对抗生溶菌作用的研究主要集中在放线菌上,因为放线菌能产生多种抗生素、胞外酶等天然产物来拮抗病原菌[12],如Barger等[13]研究发现Streptomycesssp.Mg1能使共培养的芽孢杆菌发生溶菌作用。诱导抗性是指植物在面对生物胁迫时会被诱导发生一系列的形态和结构变化,其中胼胝质积累是其防御病原菌入侵的初始反应之一[14]。
近些年来,利用植物内生放线菌防治植物病害在生物防治领域越来越受到重视[15-17],杨凌糖丝菌(Saccharothrixyanglingensis)Hhs.015是一株对苹果树腐烂病有很好防治效果的植物内生放线菌[18-19],其生防机理有待深入研究。前期研究表明Hhs.015菌体可以产生几丁质酶、蛋白酶和葡聚糖酶[20],皿内对峙条件下透射电镜观察发现苹果腐烂菌(V.mali)菌丝细胞壁破裂、细胞内线粒体膨大聚集并出现大液泡、细胞核降解等拮抗现象(未发表),但还没有对Hhs.015在寄主体内的侵入定殖、抑菌作用及诱导抗性进行系统研究。因此,本研究拟对Hhs.015在寄主体内的侵入定殖、Hhs.015作用下寄主体内的苹果腐烂菌亚细胞结构变化及其对寄主胼胝质积累的影响进行组织学与细胞学观察,从而进一步阐释杨凌糖丝菌Hhs.015对苹果树腐烂病的生防机理,为苹果树腐烂病的防治奠定理论与实践指导基础。
1 材料与方法
1.1材料
供试菌株:苹果腐烂菌(Valsamali)强致病力菌株03-8及杨凌糖丝菌Hhs.015的原始菌株,均由西北农林科技大学植物保护学院植物病害综合治理实验室提供。
供试植物:2年生富士苹果枝条取自陕西省杨凌区椒生村苹果果园的健康树体上。
1.2方法
1.2.1菌体活化与培养将保存在-80 ℃的03-8原始菌株接种在PDA平板上,30 ℃培养进行活化。在长好的菌落边缘打取直径7 mm的菌饼置于新的PDA平板上,30 ℃暗培养3 d,备用。将Hhs.015在高氏一号平板上划线,28 ℃暗培养5 d,在产孢充分处打取菌饼(直径7 mm),置于黄豆粉液体培养基中,6个菌饼/100 mL,28 ℃、150 r/min振荡培养5 d,备用。
1.2.2枝条处理将新采摘的粗细一致的2年生富士苹果枝条剪成30 cm长的小段,用自来水清洗干净后置于质量分数0.6%的次氯酸钠溶液中消毒30 min,用无菌水冲洗,晾干后用石蜡封住其形态学上端。再用电烙铁烫伤枝条树皮后在烫伤处接种03-8菌饼,在接种点上方2 cm处缠裹湿的无菌脱脂棉,并用保鲜膜密封保湿。将接种好的枝条插在提前灭过菌的湿沙土中,48 h后去除菌饼、脱脂棉及保鲜膜,于室温下培养使其充分发病。
1.2.3试验处理在枝条上形成的明显病斑处涂抹Hhs.015黄豆粉发酵液(试验组)和空白黄豆粉液体培养基(对照组)。于涂抹生防菌发酵液后10 h及4,6,7和9 d,分别在病健交界处取样用于扫描电镜观察,于涂抹生防菌发酵液后11,16,21 d分别在病健交界处取样用于透射电镜观察;另外将健康枝条用电烙铁烫伤后接种空白PDA培养基饼并涂抹空白黄豆粉液体培养基,在相同时间进行取样,设为阴性对照;将健康枝条用电烙铁烫伤后接种空白PDA培养基饼并涂抹Hhs.015黄豆粉发酵液,在相同时间进行取样,设为阳性对照。
1.2.4寄主中Hhs.015菌体及其作用下的苹果腐烂菌亚细胞结构观察将1.2.3中制备好的样品用半薄切片机(RM2265)切成1 μm厚的半薄切片,将其置于载玻片上用质量分数1%苯胺蓝染色,用普通光学显微镜观察是否切到病健交界处树皮样品中的苹果腐烂菌菌体。待切到菌体后用钻石刀切取超薄切片,并将超薄切片用醋酸双氧铀与柠檬酸铅进行双染色,在HT7700透射电镜下对Hhs.015菌体及其作用下苹果腐烂菌菌丝的亚细胞结构进行观察。
1.2.5寄主胼胝质积累的组织学观察将1.2.3中制备好的样品用半薄切片机(RM2265)切成700 nm厚的半薄切片,将其置于载玻片上用质量分数0.05%苯胺蓝染色后,用多功能显微镜(SZX-16型)在紫外光激发下观察胼胝质的积累情况。
1.2.6扫描电镜样品的制备将树皮样品置于质量分数4%戊二醛中,4 ℃过夜固定,用0.1 mol/L PBS漂洗5~6次后依次用乙醇、丙酮进行梯度脱水,再用乙酸异戊酯置换2次,CO2干燥喷金后用扫描电子显微镜(JSM6360)观察。
1.2.7透射电镜样品的制备参照康振生等[21]的方法制备透射电镜样品。
2 结果与分析
2.1生防菌Hhs.015在寄主体内的侵入定殖
苹果树腐烂病病斑涂抹Hhs.015黄豆粉发酵液10 h后,在树皮自然孔口处可以看到Hhs.015菌丝堆积,但不能看出其生长延伸(图1-B)。涂抹生防发酵液4~9 d后,在树皮自然孔口处有大量菌丝聚集,并有明显的菌丝生长及向树皮内部延伸的现象(图1-C、E、F、G箭头所示)。即Hhs.015能够快速吸附在树皮表面,并通过树皮皮孔、毛孔等自然孔口侵入。

图 1 生防菌Hhs.015菌丝侵入树皮表面的方式 A.对照组皮孔;B-C,E-G为试验组,分别为涂抹Hhs.015黄豆粉发酵液10 h及4,6,7,9 d后的样品; D.对照组树皮毛孔。白色箭头所示为Hhs.015菌丝侵入树皮位点Fig.1 Invasion through bark by hyphae of biocontrol strain Hhs.015 A.Normal lenticel;B-C and E-G.Treated for 10 h,4 d,6 d,7 d,9 d after fermentation broth of Hhs.015 smeared, respectively;D.Normal pores.The sites of bark were invaded by Hhs.015,as indicated by white arrows
2.2Hhs.015作用下的苹果腐烂菌亚细胞结构观察
由图2可见,病健交界处树皮样品中的苹果腐烂菌菌体细胞壁厚度均匀,细胞质成分均一,线粒体与细胞核等细胞器形态正常,菌体多位于寄主细胞内部或已将寄主细胞分解(图2-B、C)。涂抹Hhs.015发酵液后,苹果腐烂菌菌体细胞壁不均且出现加厚现象,细胞质凝缩固集,形成许多大的空液泡,未见线粒体与细胞核等细胞器(图2-D、F),菌体多出现在寄主细胞间隙,并且与菌体紧邻的寄主细胞壁出现明显的分层现象(图2-E)。
2.3寄主胼胝质积累发生现象的观察
由图3可以看出,树皮样品中的胼胝质主要位于筛管部位。涂抹Hhs.015黄豆粉发酵液11 d后,与对照组(图3-A)相比,筛管部位的胼胝质无增加与积累现象(图3-B);涂抹Hhs.015黄豆粉发酵液16 d后,在水平方向上筛管细胞横切面相邻处出现明显的荧光增强现象,即胼胝质积累增强(图3-D);涂抹Hhs.015黄豆粉发酵液21 d后,只在筛管横切面的个别细胞边缘处出现荧光增强现象(图3-G),比16 d的胼胝质积累现象明显减弱。该胼胝质的积累发生和消减现象与前期对胼胝质合成酶相关基因的定量检测结果(未发表)一致。因此选择涂抹Hhs.015黄豆粉发酵液16 d后的树皮样品进行进一步观察。
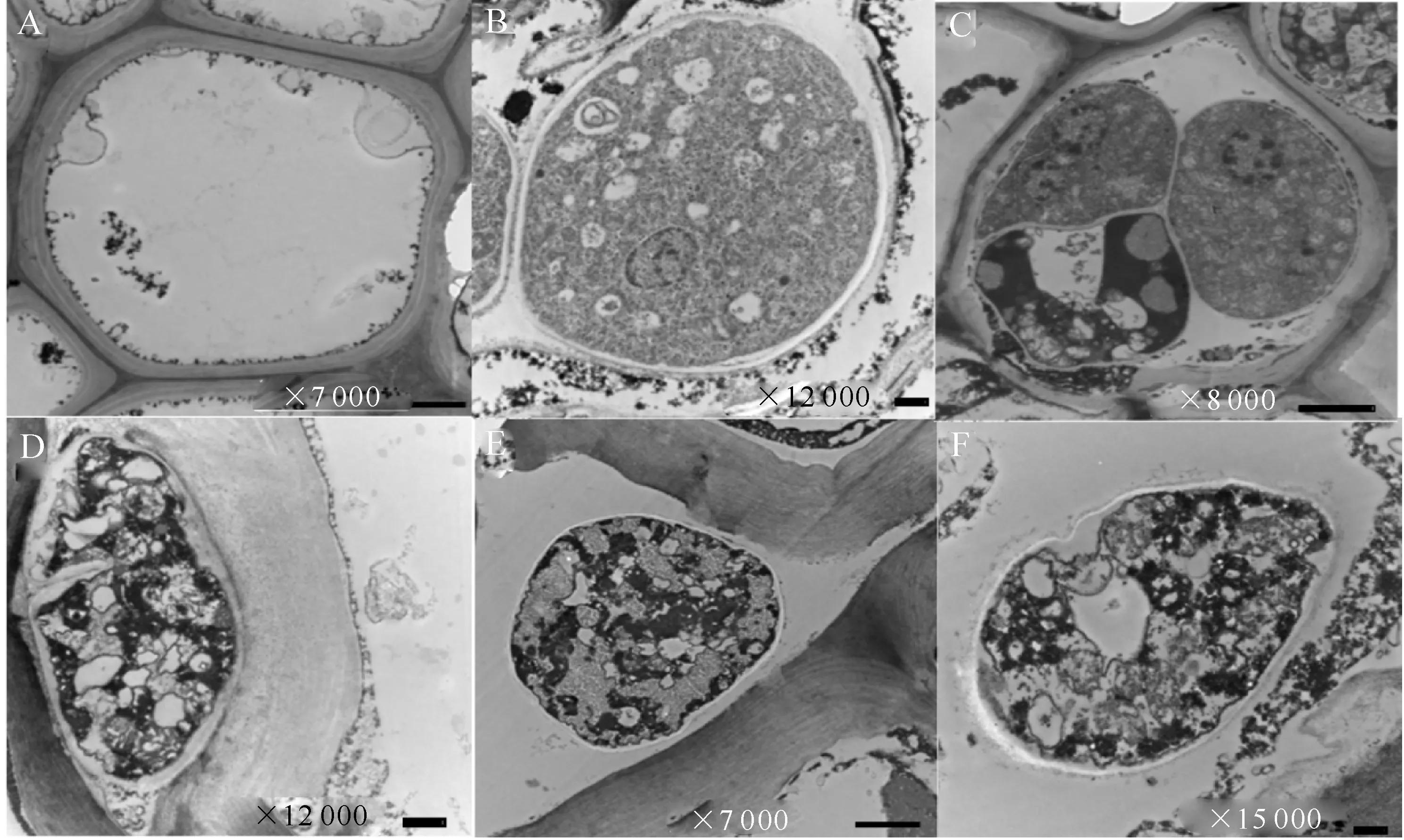
图 2Hhs.015作用下的苹果腐烂菌(Valsamali)亚细胞结构变化
A-C是对照组,A是未被苹果腐烂菌侵染的韧皮部正常细胞,B-C是定殖在寄主细胞内的苹果腐烂菌正常菌体;D-F是试验组位于韧皮部细胞间隙的苹果腐烂菌菌体。A、C、E.Bar=2 μm;B、D、F.Bar=500 nm
Fig.2Change of subcellular structure ofValsamaliunder effect of Hhs.015 in host
A-C. Normal,A.The normal cell of phloem without infection ofValsamali,B-C.The colonization of normalValsamaliwithin the host cell;D-F.Treatment,the colonization of aberrantValsamaliin intercellular space of the host.A,C,E.Bar=2 μm;B,D,F.Bar=500 nm
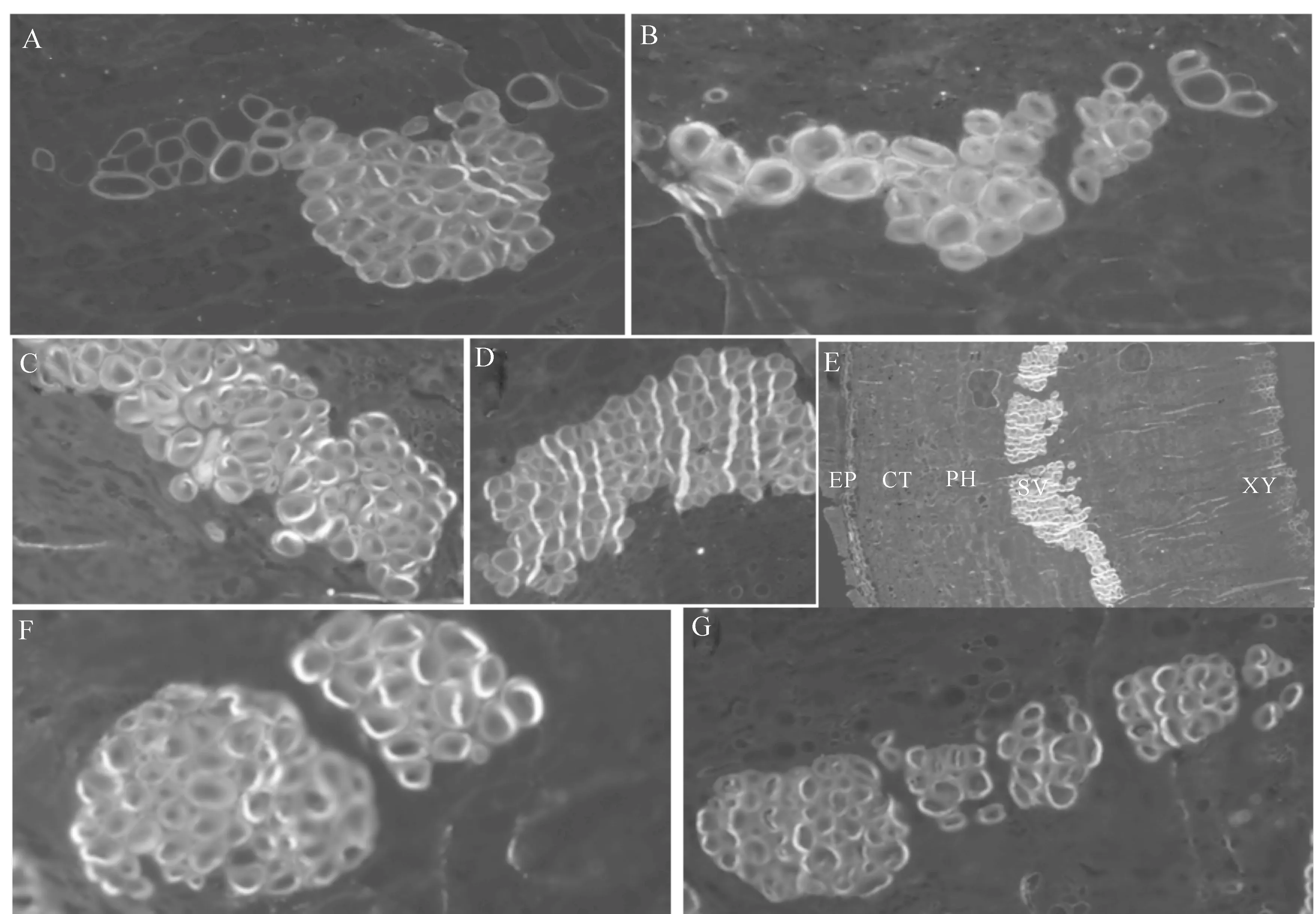
图 3 寄主韧皮部胼胝质的积累现象观察(A-D,F-G.×200;E.×100) A-B,C-E,F-G.分别为处理11,16,21 d的样品,A、C、F为对照,B、D、E、G为试验组;EP.表皮;CT.皮层;PH.韧皮部;SV.筛管;XY.木质部Fig.3 Accumulation of callose in phloem of host(A-D,F-G.×200;E.×100) A-B,C-E,F-G.11,16,21 d after fermentation broth of Hhs.015 smeared resepectively.A,C,F.Normal; B,D,E,G.Treatment.EP.Epidermis;CT.Cortex;PH.Phloem;SV.Sieve tube;XY.Xylem
2.4生防菌及病原菌对寄主胼胝质积累形成的影响
未接种苹果腐烂菌也未涂抹Hhs.015黄豆粉发酵液的健康树皮,其筛管部位的胼胝质只在管壁均匀分布(图4-A和图4-B)。只涂抹Hhs.015黄豆粉发酵液的树皮,16 d后筛管管壁及横切面的荧光均增强(图4-C),其纵切面荧光强烈(图4-D),即胼胝质在筛管壁及筛板上均出现积累增强现象。只接种苹果腐烂菌的树皮中,只在筛管壁有均匀荧光(图4-E、F),与健康树皮相比,并未出现明显的胼胝质积累现象。对接种苹果腐烂菌发病后的枝条涂抹Hhs.015黄豆粉发酵液16 d后,在筛管管壁及其横切面上的荧光增强,且在水平方向上相邻筛管处形成强烈荧光,与只涂抹Hhs.015黄豆粉发酵液的样品(图4-C)相比,其纵切面与横切面的荧光强度均明显增强(图4-G、H),即筛管部位出现强烈的胼胝质积累现象。
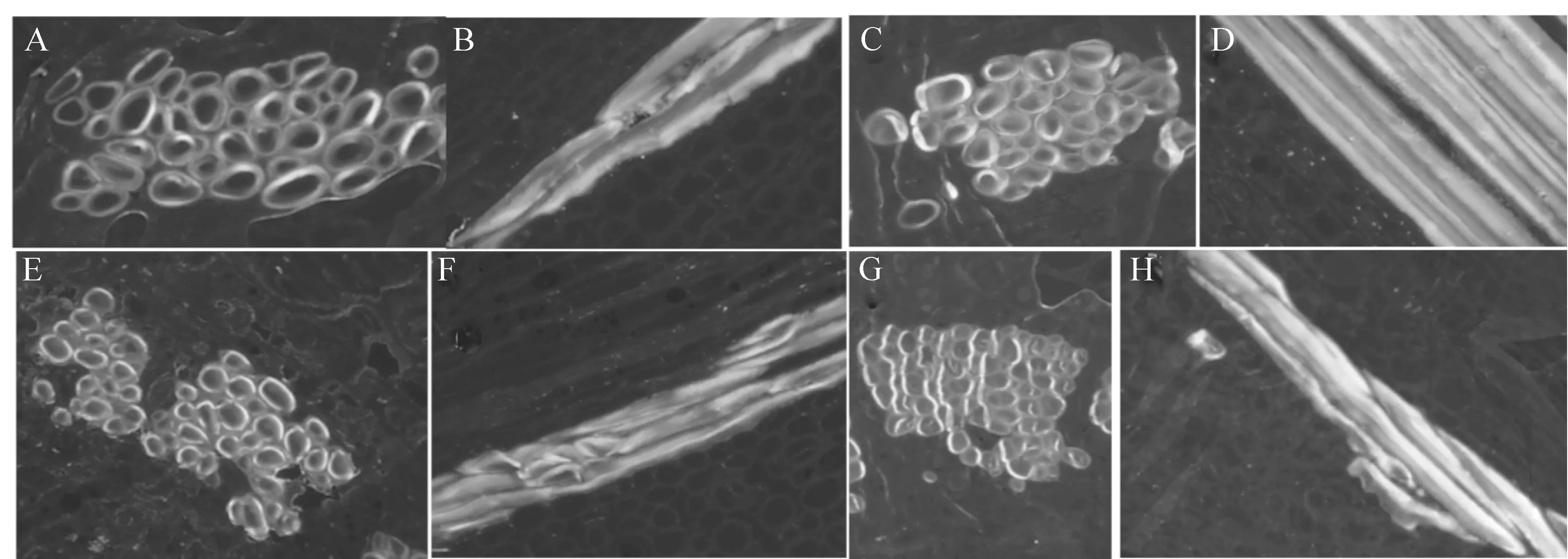
图 4 涂抹Hhs.015发酵液16 d后生防菌及病原菌对寄主筛管中胼胝质积累的影响(×200) A与B是既未接种苹果腐烂菌也未涂抹Hhs.015发酵液的样品;C与D是只涂抹Hhs.015发酵液的样品; E与F是只接种苹果腐烂菌的样品;G与H是既接种苹果腐烂菌也涂抹Hhs.015发酵液的样品。 A、C、E、G是筛管的横切面观察结果,B、D、F、H是筛管的纵切面观察结果。曝光时间均为863.5 msFig.4 Influence of biocontrol bacterium and pathogen on accumulation of callosein sieve tube at 16 d after fermentation broth of Hhs.015 smeared (×200) A-B.Sample without inoculation of Valsa mali or fermentation broth of Hhs.015 smeared;C-D.Sample with fermentation broth of Hhs.015 smeared only;E-F.Sample with inoculation of Valsa mali only;G-H.Sample with inoculation ofValsa mali and fermentation broth of Hhs.015 smeared.A,C,E,G.Transverse section of sieve tube; B,D,F,H.Longitudinal section of sieve tube.The exposure time was 863.5 ms
3 讨 论
生防菌进入寄主植物的途径和方式与病原菌基本相似[10,22]。因此,当生防菌进入植物体时,可以优先占据病原菌的入侵位点,与病原菌竞争生存空间与营养物质,并可在入侵部位分泌产生抗菌物质,阻止病原菌的侵入[23]。苹果腐烂菌(V.mali)是寄生性很弱的兼性寄生菌,只能从苹果树的表皮伤口(如皮孔、叶痕等自然因素造成的伤口及修剪伤口、机械损伤等人为因素造成的伤口)入侵已经死亡的皮层组织[24]。本研究中,生防菌Hhs.015通过树皮皮孔、毛孔等自然孔口侵入树皮,与苹果腐烂菌的侵入方式一致,因此生防菌与病原菌可能在空间位点上存在竞争作用,至于二者是否存在营养竞争还需进一步试验验证。
生防菌能够通过分泌多种抗菌物质来降低病原菌的侵染和菌丝扩展[25]。前期研究结果表明,生防菌Hhs.015可以产生几丁质酶、蛋白酶和葡聚糖酶,但具体的抗菌物质目前还不清楚[20]。本研究中,涂抹生防菌Hhs.015发酵液后,Hhs.015产生的抗菌物质会使寄主内的苹果腐烂菌菌体出现畸变,从而可能使病菌的各项生理生化过程受到抑制,影响病菌的侵染速度,这也可能是Hhs.015发酵液处理后病健交界处组织中苹果腐烂菌菌体多位于寄主细胞间隙的原因。
胼胝质,即β-1,3-葡聚糖,在抵抗不利环境因素及个体发育不同阶段均起重要作用[26]。胼胝质与筛板筛孔的形成和关闭有关,而筛板位于筛管分子的端壁上,筛管分子通过筛板的筛孔上下相连,构成有机物质运输的通道[27]。本研究发现,接种苹果腐烂菌发病后的枝条经Hhs.015发酵液涂抹处理后,寄主胼胝质积累有明显的时空特异性。在空间上,只在筛管部位出现胼胝质积累,可能导致筛孔变小或关闭,可以在一定程度上阻止寄主营养物质及病菌毒素等次级代谢产物的运输,从而使寄主对病菌侵染定殖的抵抗能力增强。在时间上,涂抹Hhs.015发酵液16 d后寄主胼胝质积累最强,11与21 d时均较弱;这是因为:一方面,寄主产生抗性反应需要时间,所以涂抹Hhs.015发酵液11 d寄主胼胝质还未增强;另一方面,寄主抗性增强后可能会产生一些β-1,3-葡聚糖酶,并且Hhs.015本身也可以产生β-1,3-葡聚糖酶,因此涂抹Hhs.015发酵液21 d时,寄主胼胝质积累又减弱。在胼胝质合成酶与β-1,3-葡聚糖酶共同作用下,胼胝质积累程度在涂抹Hhs.015发酵液16 d后达到最大。
植物内生菌可以诱导植物产生系统抗性来抑制病原菌的侵染与生长,其机制包括诱导寄主细胞物理结构变化和生理生化反应变化两方面。其中物理结构变化主要包括诱导寄主植物在病原菌入侵的细胞前沿形成结构致密的保护层,或诱导寄主细胞壁的结构发生变化,从而阻止病菌入侵[23,28]。本研究中,对接种苹果腐烂菌发病后的枝条涂抹Hhs.015黄豆粉发酵液,在水平方向上相邻筛管处胼胝质显著积累,可以在一定程度上抵御病原菌向寄主韧皮部以内的组织扩展;另外,涂抹Hhs.015发酵液的病健交界处树皮中苹果腐烂菌菌体多出现在寄主细胞间隙,而未涂抹发酵液的病健交界处树皮样品中的苹果腐烂菌菌体多位于寄主细胞内部,可见Hhs.015可以通过诱导寄主抗性来阻碍病原菌的侵染与定殖。生理生化反应变化则主要包括提高寄主植物内植保素和一些次生代谢物质的合成,产生降解病原菌的水解酶和氧化酶等,Hhs.015的相关表现有待进一步研究。
[1]Wang X L,Zang R,Yin Z Y,et al.Delimiting cryptic pathogen species causing appleValsacanker with multilocus data [J].Ecology and Evolution,2014,4(8):1369-1380.
[2]臧睿,黄丽丽.苹果树腐烂病菌分生孢子萌发及其影响条件研究 [J].西北农业学报,2007,16(1):64-67.
Zang R,Huang L L.Study on the pycindiospore germination of apple treeValsacanker pathogen [J].Acta Agriculturae Boreali-occidentalis Sinica,2007,16(1):64-67.
[3]曹克强,国立耘,李保华,等.中国苹果树腐烂病发生和防治情况调查 [J].植物保护,2009,35(2):114-116.
Cao K Q,Guo L Y,Li B H,et al.Investigation on the occurrence and control of apple canker in China [J].Plant Protection,2009,35(2):114-116.
[4]桂腾茸,姬盼,杨毅娟,等.云南苹果腐烂病调查及发生规律初步研究 [J].云南农业大学学报,2014,29(3):458-462.
Gui T R,Ji P,Yang Y J,et al.Investigation and epidemic study on appleValsacanker in Yunnan [J].Journal of Yunnan Agricultural University,2014,29(3):458-462.
[5]王磊,郜佐鹏,黄丽丽,等.防治苹果树腐烂病杀菌剂的室内筛选 [J].植物病理学报,2009,39(5):549-554.
Wang L,Gao Z P,Huang L L,et al.Screening fungicide for pathogen inhibition and disease control of apple treeValsacanker [J].Acta Phytopathologica Sinica,2009,39(5):549-554.
[6]Compant S,Duffy B,Nowak J,et al.Use of plant growth-promotingbacteria for biocontrol of plant diseases:principles,mechanisms of action,and future prospects [J].Applied and Environmental Microbiology,2005,71(9):4951-4959.
[7]Miles L,Lopera C,González S,et al.Exploring the biocontrol potential of fungal endophytes from an Andean Colombian Paramo ecosystem [J].Bio Control,2012,57(5):697-710.
[8]Gajera H,Domadiya R,Patel S,et al.Molecular mechanism ofTrichodermaas bio-control agents against phytopathogen system:a review [J].Current Research in Microbiology and Biotechnology,2013,1(4):133-142.
[9]陈捷,朱洁伟,张婷,等.木霉菌生物防治作用机理与应用研究进展 [J].中国生物防治学报,2011,27(2):145-151.
Chen J,Zhu J W,Zhang T,et al.Progress on mechanism and applications ofTrichodermaas a biocontrol microbe [J].Chinese Journal of Biological Control,2011,27(2):145-151.
[10]何迎春,高必达.立枯丝核菌的生物防治 [J].中国生物防治,2000,16(1):31-34.
He Y C,Gao B D.Biological control ofRhizoctoniasolani[J].Chinese Journal of Biological Control,2000,16(1):31-34.
[11]郭荣君,刘杏忠,杨怀文,等.芽孢杆菌BH1防治大豆根腐病的效果及机制 [J].中国生物防治,2003,19(4):180-184.
Guo R J,Liu X Z,Yang H W,et al.Mechanism ofRhizobacteriaBH1(Bacillussp.) to suppress soybean root rot disease caused byFusariumspp. [J].Chinese Journal of Biological Control,2003,19(4):180-184.
[12]Xiong Z Q,Tu X R,Wei S J,et al.The mechanism of antifungal action of a new polyene macrolide antibiotic antifungalmycin 702 fromStreptomycespadanusJAU4234 on the rice sheath blight pathogenRhizoctoniasolani[J].PLoS One,2013,8(8):e73884.
[13]Barger S R,Hoefler B C,Cubillos-Ruiz A,et al.Imaging secondary metabolism ofStreptomycessp.Mg1 during cellular lysis and colony degradation of competingBacillussubtilis[J].Antonie van Leeuwenhoek,2012,102(3):435-445.
[14]Nishimura M T,Stein M,Hou B H,et al.Loss of a callose synthase results in salicylic acid-dependent disease resistance [J].Science,2003,301(5635):969-972.
[15]Schulz B,Boyle C,Draeger S,et al.Endophytic fungi:a source of novel biologically active secondary metabolites [J].Mycological Research,2002,106(9):996-1004.
[16]Mano H I,Morisaki H.Endophytic bacteria in the rice plant [J].Microbes and Environments,2008,23(2):109-117.
[17]Arora S,Patel P N,Vanza M J,et al.Isolation and characterization of endophytic bacteria colonizing halophyte and other salt tolerant plant species from coastal Gujarat [J].African Journal of Microbiology Research,2014,8(17):1779-1788.
[18]郜佐鹏,柯希望,韦洁玲,等.七株植物内生放线菌对苹果树腐烂病的防治作用 [J].植物保护学报,2009,36(5):410-416.
Gao Z P,Ke X W,Wei J L,et al.Biocontrol efficacy of apple tree canker by endophytic actinomycetes [J].Acta Phytophylacica Sinica,2009,36(5):410-416.
[19]李正鹏.杨凌糖丝菌 Hhs.015 对苹果树腐烂病的生物防治研究 [D].陕西杨凌:西北农林科技大学,2012.
Li Z P.Study on the biological control ofSaccharothrixyanglingensisHhs.015 [D].Yangling,Shaanxi:Northwest A&F University,2012.
[20]Yan X,Huang L L,Tu X,et al.Saccharothrixyanglingensissp.nov.,an antagonistic endophytic actinomycete isolated from cucumber plant [J].Antonie van Leeuwenhoek,2012,101(1):141-146.
[21]康振生,李振岐.小麦条锈菌吸器超微结构和细胞化学的研究 [J].真菌学报,1994,13(1):52-57.
Kang Z S,Li Z Q.Ultrastructure and cytochemistry of haustorium of wheat stripe rust [J].Acta Mycologica Sinica,1994,13(1):52-57.
[22]黎起秦, 叶云峰,王涛,等.内生枯草芽孢杆菌菌株入侵番茄的途径及其定殖部位 [J].中国生物防治,2008,24(2):133-137.
Li Q Q,Ye Y F,Wang T,et al.Entrance of endophyticBacillussubtilisstrain B47 into tomato plant and its colonization inside the plant [J].Chinese Journal of Biological Control,2008,24(2):133-137.
[23]郝晓娟.植物内生菌 [M].北京: 中国农业科学技术出版社,2010.
Hao X J.Endophyte [M].Beijing:Chinese Agriculture Science and Technology Press,2010.
[24]许志刚.普通植物病理学 [M].北京:中国农业出版社,1997.
Xu Z G.General phytopathology [M].Beijing:Chinese Agriculture Press,1997.
[25]Castillo U F,Strobel G A,Ford E J,et al.Munumbicins,wide-spectrum antibiotics produced byStreptomycesNRRL 30562, endophytic onKennedianigriscans[J].Microbiology,2002,148(9):2675-2685.
[26]Piršelová B,Matušíková I.Callose:the plant cell wall polysaccharide with multiple biological functions [J].Acta Physiology Plant,2013,35(3):635-644.
[27]Musetti R,Paolacci A,Ciaffi M,et al.Phloem cytochemical modification and gene expression followingthe recovery of apple plants from apple proliferation disease [J].Phytopathology,2010,100(4):390-399.
[28]陈捷.现代植物病理学研究方法 [M].北京:中国农业出版社,2007.
Chen J.Modern research methods on phytopathology [M].Beijing:Chinese Agriculture Press,2007.
Histological and cytological study on biocontrol stain Hhs.015 in preventingValsamalifrom infecting host
FAN Dongyinga,b,ZHAO Lingyuna,b,HUANG Lilib,c,YAN Xiaa,b
(aCollegeofLifeScience,bStateKeyLaboratoryofCropStressBiologyforAridAreas,cCollegeofPlantProtection,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 This study conducted histological and cytological observation on the invasion,colonization,and expansion ofSaccharothrixyanglingensisHhs.015 in host appleValsacanker to explore the control mechanism of Hhs.015 in preventingValsamalifrom infecting host.【Method】 The invasion and colonization of Hhs.015,the change of subcellular structure ofV.maliaffected by Hhs.015,and occurrence and accumulation of callose in host were observed by scan electron microscope,transmission electron microscope and fluorescence microscope.【Result】 Hhs.015 probably competed withV.malifor special sites to intrude host through lenticels and pores of bark,which was consistent withV.mali.V.malishowed unevenness and intensification in cell wall,plasmolysis,condensation of cytoplasm and formation of large vacuoles when treated with Hhs.015 in host.Hhs.015 also induced host to generate resistance response such as accumulation of callose.Therefore,growth and infection ofV.maliwas significantly controlled by Hhs.015.【Conclusion】 Hhs.015 could preventV.malifrom infecting host by the comprehensive effects of competition,antifungal activity and induced resistance.
SaccharothrixyanglingensisHhs.015;Valsamali;special competition;antifungal activity;callose accumulation
时间:2016-09-0709:03DOI:10.13207/j.cnki.jnwafu.2016.10.018
2015-03-13
国家自然科学基金项目(31101476,31171796);陕西省科学技术研究发展计划项目(2013K01-45);杨凌示范区科技计划项目(2014NY-41)
范东颖(1990―),女,河南虞城人,在读硕士,主要从事微生物遗传学研究。E-mail:dyfanfan@163.com
颜霞(1974―),女,山东泰安人,副教授,硕士生导师,主要从事微生物资源开发利用研究。
E-mail:yanxia@nwsuaf.edu.cn
S436.611.1+1;S476.8
A
1671-9387(2016)10-0126-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0903.036.html

