金纹细蛾Hsp90基因片段的克隆及其表达模式分析
王冠华,李 鑫,郭长宁,于建光,侯 茜,辛 文
(西北农林科技大学 植物保护学院,应用昆虫学重点实验室,陕西 杨凌 712100)
金纹细蛾Hsp90基因片段的克隆及其表达模式分析
王冠华,李鑫,郭长宁,于建光,侯茜,辛文
(西北农林科技大学 植物保护学院,应用昆虫学重点实验室,陕西 杨凌 712100)
【目的】 对金纹细蛾Hsp90基因进行生物信息学和表达模式分析,为深入研究金纹细蛾PrHsp90与生长发育和抗逆行为的关系奠定基础。【方法】 利用分子克隆技术获得金纹细蛾Hsp90基因片段,并对其进行生物信息学分析。同时利用RT-qPCR技术检测Hsp90在金纹细蛾不同组织、不同生长发育阶段和高温胁迫后的表达情况。【结果】 获得了金纹细蛾Hsp90基因的一条长度为942 bp的片段序列,命名为PrHsp90,登录号为KP671600。序列分析显示,其对应的氨基酸序列与其他昆虫的相似性很高,与棉铃虫(ADP37710.1)、斜纹夜蛾(ADK55516.1)、烟夜蛾(ADM26742.1)等鳞翅目昆虫的同源性在98%以上,表明Hsp90基因家族具有高度保守性。实时荧光定量结果表明,PrHsp90在金纹细蛾翅中的相对表达量显著高于头、胸、腹和足;金纹细蛾各个生长发育阶段都有PrHsp90表达,但其在成虫体内的相对表达量显著高于蛹期和幼虫期。高温胁迫下PrHsp90的表达水平随着温度的升高而升高,且经过35,38,41和44 ℃处理后的金纹细蛾,其体内PrHsp90相对表达量均显著提高,约为对照处理表达量的3~15倍。【结论】 金纹细蛾PrHsp90的表达具有组织特异性,且在其生长发育的各个阶段和温度胁迫中均可能起重要作用。
金纹细蛾;热激蛋白;生长发育;高温胁迫
热激蛋白(heat shock proteins,HSPs)或称热休克蛋白,是机体在应激情况下细胞内迅速合成的一组蛋白质。热激蛋白的诱导表达是昆虫机体抵抗高温胁迫的重要形式之一,在昆虫的抗逆反应中起着十分重要的作用[1]。HSPs可以分为5类,包括HSP100、HSP90、HSP70、HSP60和sHSPs[2]。HSP90家族是真核生物必不可少的一类高分子量分子伴侣。热激蛋白的功能较多,已经报道的有分子伴侣、耐热性、耐冷性以及在昆虫发育过程和细胞代谢中起生化作用的特殊功能等[3]。在低温、高温、氨基酸类似物、低氧、脱落酸(ABA)、2,4-二氯苯氧乙酸等环境下,会有热休克蛋白的生成。温度(例如高温)是影响昆虫生存、发育和繁殖的最主要因素之一。在长期进化的过程中,昆虫已经演化出很多行为和生理上的策略来应对和避免温度造成的损伤,例如通过调节体内热激蛋白(HSPs)的表达来抵抗不良温度[4]。
金纹细蛾(Phyllonorycterringoniella)属鳞翅目细蛾科,是苹果等果树上一种常见的潜叶性害虫,为东亚特有种[5]。金纹细蛾每年6月开始在果园大量出现,一直到10月其种群数量都在持续增长,即使在三伏天,果园的高温高湿环境也难以阻止该虫的持续发生。因此,探索该虫的耐热性机理,明确其在恶劣天气下生存与发展的情况,对其防治管理有一定指导意义。前人主要从其发生规律、空间分布、天敌、综合防治等方面进行了研究[5-9],从分子生物学角度仅见对金纹细蛾几丁质酶基因克隆的报道[10],而对于金纹细蛾热激蛋白基因的研究尚未见相关报道。
为了从分子水平上了解金纹细蛾对高温环境的适应性,明确Hsp90基因在金纹细蛾抵抗高温胁迫中的作用,本研究利用分子克隆技术获得金纹细蛾Hsp90基因片段,并对其进行生物信息学分析,同时利用RT-PCR技术检测Hsp90在金纹细蛾不同组织、不同生长发育阶段和高温胁迫后的表达情况,以期为深入研究金纹细蛾的温度耐受性机制奠定基础,并为进一步科学合理地制定该虫的综合防治策略提供理论依据。
1 材料与方法
1.1供试虫源
金纹细蛾1~5龄幼虫、蛹和成虫均采自西北农林科技大学应用昆虫学重点实验室温室。饲养条件为(26±1) ℃、光周期为16 h光/8 h暗、相对湿度(70±10)%。2014年7月,收集健康虫源制备样品。
1.2样品制备
根据试验设计共制备3组样品,每组样品均重复3次。第1组样品为:金纹细蛾成虫不同组织样品。选取羽化后2日龄的金纹细蛾成虫,解剖头、胸、腹、足和翅5种组织后放入RNA保存液内保存,以备后续使用。第2组样品为:金纹细蛾不同发育阶段的样品。选取1~5龄金纹细蛾幼虫、蛹和刚羽化的成虫,每个阶段取个体35个用于试验。第3组样品为:热激处理后的样品。每个处理选取4龄金纹细蛾幼虫各30头,转移至1.5 mL的离心管中,然后将离心管放入水浴锅内进行高温热激诱导,于29,32,35,38,41和44 ℃下分别处理1 h,26 ℃下恢复1 h,然后用液氮处理后置于-80 ℃冰箱中备用,以常温26 ℃下的金纹细蛾4龄幼虫为对照。
1.3金纹细蛾Hsp90基因的克隆与鉴定
利用GenBank数据库下载近源昆虫的Hsp90序列,ClustalW比对后,在保守结构域设计简并引物F1、R1(表1)。根据Trizol reagent kit试剂盒说明书提取金纹细蛾成虫的总RNA。总RNA的品质和浓度在Maestro-NANO UV spectrophotometer核酸仪上用分光光度法测定。用SMARTerTMRACE cDNA (Clontech,美国)反转录试剂盒合成第一链cDNA。以cDNA为模板构建普通PCR反应体系,扩增金纹细蛾Hsp90目的基因片段。获得目的片段,再设计3′端特异性引物(表1),构建普通PCR反应体系,获得目的基因全长。试验中获得的PCR产物均由上海生物工程有限公司测序。
PCR反应体系(25 μL):12.5 μL 2×Mixture,cDNA及上、下游引物(10 μmol /L)各1 μL,9.5 μL ddH2O。PCR反应程序:94 ℃ 5 min;94 ℃ 40 s,55 ℃ 50 s,72 ℃ 60 s,36个循环;最后72 ℃延伸10 min,4 ℃保存。PCR扩增产物用12 g/L琼脂糖凝胶进行电泳检测。

表 1 Hsp90基因片段扩增和实时荧光定量PCR所用到的引物序列Table 1 Primer sequences used for partial cDNA cloning of Hsp90 and real-time quantitative PCR
1.4序列分析和系统发育树的构建
采用NCBI中的ORF finder (http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)工具,分析Hsp90可能的开放阅读框并翻译为氨基酸。用NCBI的Blastx比较Hsp90与其他昆虫Hsp90基因的同源性,同时对其进行系统发育分析。从NCBI蛋白数据库下载其他不同物种的Hsp90氨基酸序列,利用ClastalW软件对所有下载的Hsp90氨基酸序列和金纹细蛾的氨基酸序列进行比对,然后用Mega 5.02分析其演化关系,采用Neighbor-joining算法构建进化树,置信度设置为1 000[11]。
1.5总RNA的提取和cDNA第一链的合成
根据试验设计,本次试验共制备了3组样品(见1.2节)。对于每个样品,均用Trizol reagent kit提取总RNA。总RNA的品质和浓度在Maestro-NANO UV spectrophotometer核酸仪上用分光光度法测定。合成第一链cDNA时各取每个样品1 μg的RNA构建20 μL的反应体系,使用Oligo (dT)18引物和Moloney Murine Leukemia virus (M-MLV)反转录酶进行(TIANGEN公司)合成。
1.6Hsp90的RT-qPCR(实时荧光定量)表达分析
在完成每个样品第一链cDNA的合成后,采用RT-qPCR技术在Bio-rad IQ5仪器上测定Hsp90的表达量。染料选用SYBR Green Mix (CWBIO,北京)。根据实验室前期对内参基因的筛选结果[12],内参基因选用β-actin(引物见表1)。每对定量引物通过5×稀释的模板建立标准曲线。
RT-qPCR反应体系为25 μL:12.5 μL 2×UltraSYBR Mixture,1 μL cDNA,上、下游引物各1 μL,9.5 μL RNase-Free water。反应条件:95 ℃ 3 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,50个循环。65~95 ℃时每摄氏度保持10 s用于记录熔解曲线,以确定扩增条带的特异性。
1.7数据分析
试验数据采用相对定量法(2-ΔΔCt)[13]计算。对金纹细蛾Hsp90在不同组织和各发育阶段的相对表达量进行分析时,分别以Hsp90在不同组织和各发育阶段内的表达量最低值作为参照;对不同温度胁迫下Hsp90的相对表达量进行分析时,以常温26 ℃下的表达量为参照,设为1。试验结果以“平均值±标准差”表示。数据采用SPSS 19.0数据处理软件进行单因素方差分析(ANOVA),显著性差异分析采用Tukey’s法,最后用Origin 8.5软件制图。
2 结果与分析
2.1金纹细蛾Hsp90基因的克隆与序列分析
通过测序和序列拼接,得到1条长度为942 bp的cDNA序列,在NCBI中通过Blastx比对,发现该序列属于Hsp90家族。将翻译所得的氨基酸序列在该数据库中进行同源性搜索,发现其与棉铃虫(ADP37710.1)、斜纹夜蛾(ADK55516.1)、烟夜蛾(ADM26742.1)等鳞翅目昆虫的同源性在98%以上。可见,所得序列正是金纹细蛾Hsp90基因序列,将其命名为PrHsp90。该基因序列已提交至GenBank,获得登录号为KP671600。对金纹细蛾Hsp90序列的分析结果(图1)表明,其对应编码211个氨基酸。

图 1 PrHsp90基因的cDNA序列及其推导的氨基酸序列 金纹细蛾Hsp90基因C末端保守区域(MEEVD)用下划线标出, polyA尾的加尾信号序列(AATAAA)用方框标出,终止密码子用“*”号标出Fig.1 Nucleotide sequence of PrHsp90 and its predicted amino acid sequence The cytoplasm Hsp90 C-terminal region (MEEVD) is underlined.A possible consensus signal sequence for ployadenylation (AATAAA) is indicated with box. The asterisk indicates the translational termination codon
2.2金纹细蛾Hsp90氨基酸的系统发育分析
系统发育分析结果(图2)表明,所选取物种的Hsp90氨基酸序列在进化树上分为2个独立的进化支,即昆虫和脊椎动物。鳞翅目(Lepidoptera)、鞘翅目(Coleoptera)、双翅目(Diptera)、同翅目(Homoptera)物种的Hsp90氨基酸序列各自聚成一类,并共属于昆虫纲。从目以下的分类单元看,鳞翅目夜蛾科、菜蛾科、粉蝶科能各自聚成一族,枯叶蛾科的油松毛虫与夜蛾科的棉铃虫、斜纹夜蛾先聚为一支,之后与金纹细蛾以平行的方式汇入一支。说明金纹细蛾的Hsp90基因与鳞翅目中同属夜蛾科的棉铃虫、斜纹夜蛾和枯叶蛾科粘虫的基因遗传距离最近,与鞘翅目(Coleoptera)、双翅目(Diptera)、同翅目(Homoptera)物种的Hsp90基因遗传距离较近,而与脊椎动物进化支中的智人、小家鼠的Hsp90基因遗传距离较远。
2.3Hsp90在金纹细蛾不同组织和各发育阶段的表达
利用RT-qPCR技术研究了PrHsp90基因在金纹细蛾头、胸、腹、足和翅5种组织中的表达水平,结果见图3-A。由图3-A可知,PrHsp90在所有检测的组织中均有表达,但是其相对表达量在不同组织中差别较大,并表现出一定的特异性。PrHsp90在翅中的相对表达量最高,约是足中的842倍,且远远高于其他组织,并在统计学上与其他组织内的相对表达量差异显著。PrHsp90在头、胸、腹和足中的相对表达量相差不大,在统计学上差异不显著。

图 2 昆虫Hsp90氨基酸序列的系统进化树 分支间的数值是基于bootstrap验证的自展检验值(1 000次重复);刻度标尺表示0.02%的进化差异Fig.2 Phylogenetic tree of amino acid sequence of Hsp90 constructed by neighbor-joining The bootstrap test (1 000 replicates) is shown next to branch.The scale bar represents the 0.02% estimated phylogenetic divergence

图 3 Hsp90基因在金纹细蛾不同组织和不同发育阶段的表达情况 1st-5th代表1~5龄幼虫。柱上不同字母表示差异显著(P<0.05,Tukey’s多重比较检验)Fig.3 Relative expression levels of PrHsp90 gene in different tissues and at different life stages 1st-5th.1st-5th lava.Different letters above bars represent significant difference (P<0.05,Tukey’s multiple comparison test)
采用RT-qPCR方法研究PrHsp90基因在金纹细蛾1~5龄幼虫、蛹和刚羽化成虫中的表达情况,结果见图3-B。由图3-B可见,在金纹细蛾的各个发育阶段都有PrHsp90的表达,但是其在刚羽化成虫体内的相对表达量显著高于蛹期和幼虫期,约是蛹期的203倍,约是表达量最低的2龄幼虫期的5 785倍。PrHsp90在蛹期的表达低于成虫期,高于幼虫期,但与幼虫期的相对表达量在统计学上差异不显著。PrHsp90在幼虫期各龄期的表达相对稳定,相互之间差异均不显著。
2.4PrHsp90 mRNA的高温诱导表达
由图4可以看出,高温胁迫对金纹细蛾4龄幼虫PrHsp90表达具有明显的诱导作用。PrHsp90在常温26 ℃(对照)下的相对表达量最低,在29和32 ℃下处理后相对表达量未显著提高,但随着处理温度的提高,4龄幼虫在35,38,41和44 ℃下处理后,其体内PrHsp90相对表达量显著提高,约为对照处理的3~15倍。其中44 ℃下处理后幼虫体内PrHsp90相对表达量最高,41 ℃次之,且均显著高于其他温度处理。不同温度处理下的PrHsp90表达水平随着温度的升高而升高的现象充分表明,PrHsp90为热诱导型的热激基因,且表达量与胁迫程度呈正相关。
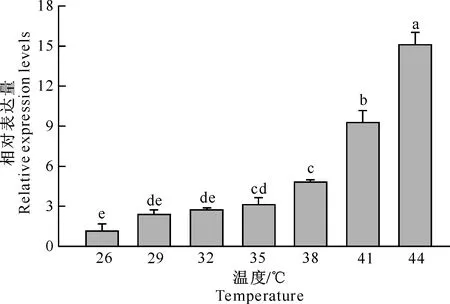
图 4 PrHsp90在不同温度胁迫下的相对表达量Fig.4 Relative expression levels of PrHsp90 mRNA
3 讨 论
热激蛋白是进化上高度保守的蛋白[14]。本研究以家蚕、斜纹夜蛾、粘虫等物种HSP90的保守结构域设计简并引物,成功克隆了金纹细蛾PrHsp90 cDNA片段,经 NCBI 比对后发现其cDNA序列、氨基酸序列均与其他昆虫的Hsp基因序列具有很高的同源性,与棉铃虫(ADP37710.1)、斜纹夜蛾(ADK55516.1)、烟夜蛾(ADM26742.1)等鳞翅目昆虫的同源性在98%以上,更加证实了Hsp90基因家族的高度保守性。克隆得到的金纹细蛾PrHsp90氨基酸片段C末端还具有Hsp90基因特有的MEEVD保守序列,表明此片段就是金纹细蛾的一条Hsp90基因。
系统发育分析显示,金纹细蛾的Hsp90与同为鳞翅目的夜蛾科Hsp90遗传距离最近,与昆虫纲中鞘翅目(Coleoptera)、双翅目(Diptera)、同翅目(Homoptera)物种的遗传距离较近,而与脊椎动物(Vertebrates)进化支中的智人、小家鼠的遗传距离较远。每个目类昆虫的Hsp90都能很好地聚在一起,说明Hsp90可以用来研究物种的系统分化。
金纹细蛾Hsp90基因在其不同组织中表达的研究结果显示,PrHsp90在头、胸、腹、足、翅中均有表达,但其表达丰度在不同组织中差别较大,并表现出一定的组织特异性,其中PrHsp90在翅中的相对表达量最高,约是足中的842倍,且远远高于其他组织,在头、胸、腹和足中的相对表达量差异不显著。依据PrHsp90基因在翅中的大量表达,推测热激蛋白基因可能与昆虫的飞行能力、生殖等行为相关。而且昆虫作为无脊椎动物中唯一有翅的生物,飞行使其在觅食、求偶、避敌和扩大分布范围等方面都比陆地动物要技高一筹,并成为昆虫纲繁荣兴旺的基础。热激蛋白与昆虫的飞行能力、生殖等行为的具体相关性还需进一步研究。PrHsp90基因在金纹细蛾不同生长发育阶段均有表达,但是其在成虫体内的相对表达量显著高于蛹期和幼虫期,在蛹期的表达仅高于幼虫期。PrHsp90在成虫期和蛹期的显著表达,可能与昆虫生长发育变化相关,也是其对不良环境的一种适应机制。前期研究表明,PrHsp90基因不仅在对抗外界压力中起作用,而且在昆虫的生长发育分化,甚至在生殖上均可能起作用[15-20]。
本研究结果显示,高温胁迫对金纹细蛾4龄幼虫PrHsp90表达具有明显的诱导作用。PrHsp90表达水平随温度升高而升高的现象充分表明,PrHsp90为热诱导型的热激基因,且表达量与胁迫程度呈正相关。大量研究证明,HSPs的合成与生物体耐热性的获得呈正相关。例如,苹果蠹蛾Hsp90 mRNA的相对表达量在32~44 ℃高温胁迫下随温度升高而显著升高,证实CpHsp90是诱导型热激基因,且mRNA相对表达量与胁迫程度呈正相关[21]。还有研究证明,在较低温度下热激处理诱导生物体内HSPs合成,会使得生物体在更高温度下的存活率上升,如非洲蝗虫在50 ℃热激处理2 h后全部死亡,但在39~45 ℃预处理后,可以增加其在更高温度下的存活率[22]。在PrHsp90的表达模式中,温度预处理是否会影响金纹细蛾的存活率,温度与PrHsp90的表达量有何关系,有待进一步研究。
本研究通过分子克隆技术得到了金纹细蛾Hsp90的片段序列,进行了序列分析和系统发育分析,并测定了PrHsp90在不同组织、不同生长发育阶段和高温胁迫刺激下的表达情况,为下一步深入研究金纹细蛾Hsp90与其生长发育和抗逆行为的相互关系奠定了基础。
[1]Liu Q N,Zhu B J,Dai L S,et al.Overexpression of small heat shock protein 21 protects the Chinese oak silkwormAntheraeapernyiagainst thermal stress [J].Journal of Insect Physiology,2013,59(8):848-854.
[2]Frank L H,Cheung H K,Cohen R S.Identification and characterization ofDrosophilafemalegerm line transcriptional control elements [J].Development,1992,114(2):481-491.
[3]张永强,王进军,丁伟,等.昆虫热休克蛋白的研究概况 [J].昆虫知识,2004,40(1):16-19.
Zhang Y Q,Wang J J,Ding W,et al.Heat shock proteins in insects [J].Entomological Knowledge, 2004, 40(1): 16-19.
[4]张珂,翁群芳,付昊昊.昆虫热激蛋白90的研究进展 [J].生物技术通报,2014(2):15-23.
Zhang K,Weng Q F,Fu H H.Research progress on heat shock protein 90 of insects [J].Biotechnology Bulletin,2014(2):15-23.
[5]曹春玲,李鑫,吴素蓉,等.苹果园金纹细蛾种群动态及空间分布 [J].西北农业学报,2014,23(2):169-175.
Cao C L,Li X,Wu S R,et al.The population dynamics and spatial distribution ofPhyllonorycterringoniellain apple orchards [J].Acta Agriculturae Boreali-Occidentalis Sinica,2014,23(2):169-175.
[6]王洪涛,刘学卿,王丽丽,等.山东苹果主产区金纹细蛾对4种杀虫剂的抗药性测定 [J].果树学报,2014(4):673-678.
Wang H T,Liu X Q,Wang L L,et al.Resistance of apple leafminer,Lithocolletisringoniella(Lepidoptera:Gracillariidae) to four insecticides in apple production areas of Shandong China [J].Journal of Fruit Science,2014(4):673-678.
[7]张金钰,李鑫,吴素蓉,等.果园生境对金纹细蛾寄生蜂发生影响及优势寄生蜂空间分布研究 [J].中国生物防治学报,2012,28(3):326-333.
Zhang J Y,Li X,Wu S R,et al.Influence of habitats on occurrence and spatial distribution of parasitoids ofLithocolletisringoniellain apple orchard [J].Chinese Journal of Biological Control,2012,28(3):326-333.
[8]孟芳,李鑫,张金钰,等.金纹细蛾及其优势寄生蜂主要行为的研究 [J].西北农林科技大学学报(自然科学版),2010,38(5):93-100.
Meng F,Li X,Zhang J Y,et al.Behaviors of the asiatic apple leaf-miner,Phyllonorycterringoniellaand its dominant parasitic wasps [J].Journal of Northwest A&F University (Natural Science Edition),2010,38(5):93-100.
[9]石勇强,郭小侠,陈川,等.金纹细蛾发生与防治研究进展 [J].中国农学通报,2009,25(18):356-359.
Shi Y Q,Guo X X,Chen C,et al.The general research of occurrence regularity and control ofPhyllonorycterringoniella[J].Chinese Agricultural Science Bulletin,2009,25(18):356-359.
[10]范晓军,宋志芳,仙笑笑,等.金纹细蛾几丁质酶基因生物信息学分析 [J].基因组学与应用生物学,2013,32(1):91-96.
Fan X J,Song Z F,Xian X X,et al.Bioinformatical analysis of chitinase gene fromPhyllonorycterringoniella[J].Genomics and Applied Biology,2013,32(1):91-96.
[11]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods [J].Mol Biol Evol,2011,28:2371-2379.
[12]郭长宁.金纹细蛾内参基因克隆分析及稳定性评价 [D].陕西杨凌:西北农林科技大学,2014.
Guo C N.Cloning and stability analysis of reference gene fromPhyllonorycterringoniella[D].Yangling,Shaanxi:Northwest A&F University,2014.
[13]Livak K J,Schmittgen T D.Analysis or relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod [J].Methods,2001,25:402-408.
[14]Chen H,Xu X L,Li Y P,et al.Characterization of heat shock protein 90,70 and their transcriptional expression patterns on high temperature in adult ofGrapholitamolesta(Busck) [J].Insect Sci,2014,21(4):439-448.
[15]蒋健,李祥瑞,张云慧,等.马铃薯甲虫热激蛋白基因Ld-Hsp90的克隆及温度胁迫下的表达 [J].植物保护学报,2013,40(5):399-406.
Jiang J,Li X R,Zhang Y H,et al.cDNA cloning of heat shock protein 90(Ld-Hsp90) inLeptinotarsadecemlineata(Coleoptera:Chrysomelidae) and its expression under temperature stress [J].Acta Phyophylacica Sinica,2013,40(5):399-406.
[16]Li J Y,Yang H J,Lan T Y,et al.Expression profiling and regulation of genes related to silkworm posterior silk gland development and fibroin synthesis [J].Journal of Proteome Research,2011,10(8):3551-3564.
[17]Shen Y,Gu J,Huang L H,et al.Cloning and expression analysis of six small heat shock protein genes in the common cutworm,Spodopteralitura[J].Journal of Insect Physiology,2011,57(7):908-914.
[18]余昊,万方浩.B型烟粉虱和温室白粉虱热激蛋白90基因(Hsp90)的全长cDNA克隆与系统发育分析 [J].昆虫学报,2009,52(4):363-371.
Yu H,Wan F H.cDNA cloning and phylogenetic analysis of the heat shock protein 90 gene(Hsp90) in two whiteflies,Bemisiatabaci(Gennadius) biotype B andTrialeurodesvaporariorum(Westwood) (Homoptera:Aleyrodidae) [J].Acta Entomologica Sinica,2009,52(4):363-371.
[19]崔旭红,谢明,万方浩.高温胁迫下B型烟粉虱热激蛋白基因hsp70表达量的变化 [J].昆虫学报,2007,50(11):1087-1091.
Cui X H,Xie M,Wan F H.Changes in expression level of heat shock protein 70 inBemisiatobaciB-biotype (Homoptera:Aleyrodidae) under high temperature stress [J].Acta Entomologica Sinica,2007,50(11):1087-1091.
[20]夏晓峰,林海兰,郑丹丹,等.小菜蛾热休克蛋白基因的鉴定及其表达模式分析 [J].昆虫学报,2013,56(5):457-464.
Xia X F,Lin H L,Zheng D D,et al.Identification and expression patterns of heat shock protein genes in the diamondback moth,Plutellaxylostella(Lepidoptera:Yponomeutidae) [J].Acta Entomologica Sinica,2013,56(5):457-464.
[21]申建茹,李明福,陈乃中,等.苹果蠹蛾热激蛋白Hsp90基因的克隆及热胁迫下的表达分析 [J].昆虫学报,2011,54(11):1236-1248.
Shen J R,Li M F,Chen N Z,et al.Cloning and analysis of the expression characteristics under heat stress of Hsp90 gene in the codling moth,Cydiapomonella(Lepidoptera:Tortricidae) [J].Acta Entomologica Sinica,2011,54(11):1236-1248.
[22]Verne S,Jaquish B,White R,et al.Global transcriptome analysis of constitutive resistance to the white pine weevil in spruce [J].Genome Biology and Evolution,2011,3:851-867.
Cloning and expression analysis ofHsp90 gene fragment fromPhyllonorycterringoniella(Lepidoptera:Gracilariidae)
WANG Guanhua,LI Xin,GUO Changning,YU Jianguang,HOU Qian,XIN Wen
(CollegeofPlantProtection,KeyLaboratoryofAppliedEntomology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 The fragment ofHsp90 gene fromPhyllonorycterringoniellawas cloned and its biological information and expression patterns under different treatments were analyzed to provide basis for further study about the relationships betweenPrHsp90 and the development and heat resistance ofP.ringoniella.【Method】 TheHsp90 fragment was cloned using RACE-PCR technology.The expression patterns ofHsp90 in different tissues at developmental stages under different heat treatments were analyzed using RT-qPCR.【Result】 TheHsp90 gene fragment with length of 942 bp was obtained,which was namedPrHsp90 and the access number in GenBank was KP671600.Sequence analysis showed that its amino acid sequence shared high homology with Hsp90 from other insects.It had 98% and higher homology with Hsp90 fromHeliothisarmigera(ADP37710.1),Spodopteralitura(ADK55516.1) andHelicoverpaassulta(ADM26742.1).Expression analysis ofPrHsp90 in different tissues indicated its expression level was significantly higher in wing than in head,thorax,abdomen and foot.ThePrHsp90 transcript was detectable at all developmental stages with dramatically higher expression in adults than in larvae and pupae.Under heat treatments,the expression ofPrHsp90 increased with the increase of temperature.After heat treatments at 35,38,41 and 44 ℃,its expression increased significantly to 3-15 times of that in control.【Conclusion】 Expression ofPrHsp90 is tissue-specified and it plays key roles in development and heat resistance ofP.ringoniella.
Phyllonorycterringoniella;HSP;developmental stages;thermal stress
时间:2016-09-0709:03DOI:10.13207/j.cnki.jnwafu.2016.10.016
2015-03-27
陕西省农业厅重点农业科技示范推广项目(ZDKJ-2014-32)
王冠华(1990-),女,山东聊城人,硕士,主要从事园艺生态系统有害生物调控研究。E-mail:guanhuaplant@126.com
李鑫(1957-),男,陕西岐山人,教授,博士,硕士生导师,主要从事果树害虫管理与农业标准化研究。
E-mail:lixin57@hotmail.com
S436.611.2+9;Q78
A
1671-9387(2016)10-0114-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0903.032.html

