青杄类伸展蛋白基因PwELP1的克隆及表达分析
郜银涛,周燕妮,罗朝兵,张凌云,陈坤明
(1 西北农林科技大学 生命科学学院,陕西 杨凌 712100;2 北京林业大学 林学院,森林培育与保护教育部重点实验室,北京 100083)
青杄类伸展蛋白基因PwELP1的克隆及表达分析
郜银涛1,周燕妮2,罗朝兵2,张凌云2,陈坤明1
(1 西北农林科技大学 生命科学学院,陕西 杨凌 712100;2 北京林业大学 林学院,森林培育与保护教育部重点实验室,北京 100083)
【目的】 克隆青杄类伸展蛋白(extensin-like proteins,ELPs)基因PwELP1并分析该基因的表达特性,为研究ELP基因家族的功能奠定基础。【方法】 以青杄cDNA文库为模板,用RACE-PCR方法克隆青杄类伸展蛋白编码基因PwELP1的cDNA全长,利用DNAMAN确定PwELP1的编码框及蛋白氨基酸的翻译,运用clustalx软件与Espript工具进行多序列比对,利用MEGA 5软件的邻位相连法构建系统树,并对编码蛋白进行生物信息学分析;利用RT-qPCR检测PwELP1基因在青杄不同组织中表达的特异性、花粉和种子不同萌发时期及幼苗受到不同逆境处理时的表达差异,分析该基因的组织发育及逆境响应表达特点。【结果】PwELP1基因全长832 bp,其编码一个由159个氨基酸组成的蛋白,该蛋白的N端与C端均有比较保守的结构域;此蛋白二级结构由1个α-螺旋、5个β-折叠与3个β-转角结构构成,对其三级结构的预测印证了这一结果,同时发现该蛋白中还存在部分无规则卷曲。其分子质量为17.03 ku,理论等电点为5.81。PwELP1在青杄花粉中的表达量较高,且在花粉萌发后期(30~36 h)以及种子萌发初期(第2天)表达量高;PwELP1的表达不同程度地受低温、高温、茉莉酸甲酯(MeJA)、H2O2、脱水以及脱落酸(ABA)等非生物逆境胁迫处理的诱导,尤其是H2O2、高温和ABA,处理初期表达量就显著升高。【结论】PwELP1在青杄花粉和种子萌发过程中可能发挥重要功能,并可参与青杄对非生物逆境胁迫的响应过程。
青杄;类伸展蛋白;组织表达;非生物胁迫
类伸展蛋白(extensin-like proteins,ELPs)是一类结构和功能与伸展蛋白(extensin)相近的蛋白家族,是富含羟脯氨酸的糖蛋白,广泛存在于高等植物的细胞壁中,参与细胞壁松弛、细胞生长、花粉与根毛的生长发育、生物胁迫响应等一系列生理过程[1]。目前已经在多种植物中克隆了其基因并验证了相关功能,例如,对番茄的研究发现,植物凝集素(lectin)中含有比较丰富的类伸展蛋白结构域,这些蛋白可以参与植物防御生物胁迫的进程[2];番茄中类伸展素蛋白TC118157 与TC127619表达量的变化受木霉菌(Trichodermaspp.)的触发[3];有2个类伸展蛋白基因Dif10与Dif54主要在根毛中表达,并参与其生长的调控[4],而LeExt1基因则同时参与根毛生长与花粉萌发的调控[5]。又有研究表明,过表达番茄ELP(AJ133600)将增加其对番茄细菌性溃疡病菌(Clavibactermichiganensissubsp.michiganensis,Cmm)的抗性,反之,该基因沉默的植株对此病菌将更加敏感[6]。在烟草中的研究结果类似,将类伸展蛋白(TC13329)沉默后,植物体对Cmm处理更加敏感[7]。
在其他植物的研究中也有类伸展蛋白的报道。早在1994年,有研究发现了玉米花粉中富含类伸展蛋白基因Pexl(pollen extensin-like 1),该基因参与花粉管生长的调控[8]。在马铃薯的研究中发现,机械损伤导致类伸展蛋白基因StExt1的表达上调[9]。在拟南芥细胞壁中也发现有富含羟脯氨酸的类伸展蛋白,参与细胞壁的形态建成[10]。这些结果表明,类伸展蛋白参与到植物生长发育及逆境响应等多种生理过程中,同时,这个家族在分子大小、氨基酸组成及分子功能上存在多样化。大量研究表明,ELP蛋白在翻译后会进行羟基化修饰,脯氨酸羟基化酶(Proline hydroxylation enzyme)在其中起到重要作用,如在康乃馨中发现的P4Hs,能有效羟基化翻译后的ELPs及EXTs[11]。
综上可知,近年来关于类伸展蛋白的研究主要集中在番茄、烟草、马铃薯等作物上,在多年生木本植物中的研究相对较少。青杄(Piceawilsonii)是一种耐寒耐旱的多年生木本针叶植物,广泛分布于亚热带地区,是我国重要的经济林植物。本研究以青杄为材料,克隆得到青杄中一个ELP编码基因PwELP1,通过RACE-PCR得到其全长cDNA序列,再根据其核酸序列推导出蛋白氨基酸序列,对其序列进行生物信息学分析。利用RT-qPCR等技术鉴定其在不同组织及发育时期的表达量,将对进一步深入研究ELP基因家族的功能,特别是其生殖生长的机制提供理论基础,也可为筛选优质林木抗性基因提供依据。
1 材料与方法
1.1材料
1.1.1植物材料青杄花粉、种子均采集于中科院植物所。用于组织特异性表达试验的材料为3年生青杄幼苗的根、茎、针叶、花粉、种子。用于RT-qPCR的试验材料处理后于-80 ℃保存。青杄cDNA文库由Invitrogen公司利用Gateway技术构建。
1.1.2试剂青杄cDNA文库载体pDONR222购于美国Invitrogen公司,克隆载体pEASY-T1购自Transgene 公司。反转录试剂盒(RevertAidTMFirst Strand cDNA Synthesis Kit)购于美国Fermentas公司,PCRTaqMix、DNA Marker(DL2000)、荧光定量PCR试剂盒(SYBR Green SuperReal Premix)购自天根(北京)生化科技有限公司,植物RNA提取试剂盒购自北京Aidlab公司。所用激素购自Sigma公司,其他试剂均购于美国AMRESCO公司。
1.2方法
1.2.1RACE-PCR获取PwELP1的cDNA全长序列以青杄cDNA文库为模板,利用文库载体pDONR222接头序列与EST序列的特异保守序列设计引物,通过5-LP、5-RP扩增得到PwELP1的5′端序列,通过3-LP、3-RP扩增得到3′端序列,将所得的末端序列与EST序列进行拼接,得到PwELP1的cDNA全长序列。本试验所需引物序列详见表1。

表 1 PwELP1克隆及组织特异性表达试验所需要的引物Table 1 Primers for cloning PwELP1 and tissue-specific expression experiments
1.2.2PwELP1基因及编码蛋白序列的生物信息学分析运用NCBI(http://www.ncbi.nlm.nih.gov/)与TAIR(http://www.arabidopsis.org/)网站上的blastn与blastp工具,将得到的PwELP1核酸序列及氨基酸序列进行同源检索。利用DNAMAN确定PwELP1的编码框及蛋白氨基酸的翻译。运用clustalx软件与Espript工具进行多序列比对,同时用Espript对蛋白二级结构进行预测。系统树构建利用MEGA 5软件完成,构树方法为邻位相连法(Neighbor-joining)。利用Expasy(http://www.expasy.org)中的Compute pI/Mw工具计算蛋白的理论等电点与分子质量。利用Jpred进行蛋白二级结构预测,利用swiss-model进行蛋白三级结构预测。
1.2.3花粉萌发试验将保存于-80 ℃的青杄花粉取出,于-20 ℃中放置24 h,再于4 ℃中放2 h以复苏其活力,然后进行萌发试验。所用液体培养基由120 g/L蔗糖、0.1 g/L硼酸、0.3 g/L硝酸钙与5 mmol/L柠檬酸-磷酸缓冲液组成(pH 5.8)。取花粉在培养基中于28 ℃、200 r/min分别培养0,6,12,18,24,30,36 h,处理后保存于-80 ℃备测。
1.2.4种子萌发试验将青杄种子采集后于4 ℃冰箱贮藏1个月以上。萌发试验利用水培法催芽,将青杄种子放于培养皿中,置于25 ℃植物培养箱中(16 h光照,8 h黑暗),保持培养皿底部有适量水分。每隔2 d进行取样(至萌发第12天止),液氮速冻后立即于-80 ℃保存备测。
1.2.5幼苗逆境处理试验先将4 ℃冷藏1个月以上的青杄种子放于培养皿中,置于25 ℃光照培养箱中(16 h光照,8 h黑暗),保持培养皿底部适量水分。1周左右可看到胚芽长出,继续培养1周后将种子播入20 ℃温室土壤中育苗,6周之后青杄幼苗长至正常状态,然后进行各类逆境处理,包括低温(4 ℃)、高温(42 ℃)、脱水、H2O2及激素脱落酸(ABA)和茉莉酸甲酯(MeJA)处理。其中,低温(4 ℃)、脱水、H2O2及激素茉莉酸甲酯(MeJA)均分别处理0,1,3,6,12 h,高温(42 ℃)处理0,0.5,3,6,12 h,脱落酸(ABA)处理0,3,6,12,16,20,24 h,液氮速冻后于-80 ℃保存备用,以置于室温下正常培养的幼苗为对照。
1.2.6PwELP1基因表达特性的荧光定量PCR分析利用北京Aidlab公司植物RNA提取试剂盒,分别提取青杄根、茎、针叶、花粉、种子及萌发不同时间花粉、种子的总RNA,利用Fermentas公司的反转录试剂盒(RevertAidTMFirst Strand cDNA Synthesis Kit)合成PwELP1的第一链cDNA。以青杄EF-1α[12]为内参基因,利用天根公司的荧光定量PCR试剂盒(SYBR Green SuperReal Premix)在ABI StepOnePlus实时荧光定量PCR仪进行RT-qPCR试验,分析PwELP1的组织特异性表达及在不同激素和逆境等条件下的响应模式。其中,组织特异性表达试验均为未经任何处理的材料;花粉和种子不同萌发时期的基因表达试验中,所用为萌发培养不同时间的材料;幼苗逆境响应的基因表达试验中,采用各逆境条件下处理相应时间的材料。RT-qPCR试验结果均为3次试验的平均值。
2 结果与分析
2.1PwELP1的克隆
PwELP1的全长cDNA序列为832 bp,在101 bp处发现起始密码子ATG,在578 bp处发现终止密码子TGA,在812 bp处发现Poly(A)21尾巴,编码区序列共480 bp,编码159个氨基酸(图1)。经过Compute pI/Mw工具分析得出,编码蛋白理论等电点为5.81,分子质量为17.03 ku。根据编码区序列设计引物ELP-LP与ELP-RP,PCR后经过纯化回收,连接到pEASY-T1载体上,得到PwELP1的单克隆。

图 1 PwELP1的cDNA核酸序列及推导的氨基酸序列Fig.1 Full length cDNA sequence and the deduced amino acids of PwELP1
2.2PwELP1同源蛋白序列比对、二级结构预测及系统树构建
经过同源检索,得到了不同物种中的ELP1同源基因(表2)。利用clustalx工具对同源蛋白的氨基酸序列进行多序列比对,结果(图2)显示,不同物种类伸展蛋白序列的相似程度在50%以上,蛋白的N端与C端均有比较保守的结构域,N端存在较为保守的CDNCNAG氨基酸序列;利用Espript工具进行多序列比对后的蛋白二级结构预测结果,与用Jpred预测的蛋白二级结构结果相符,即PwELP1蛋白二级结构由1个α-螺旋、5个β-折叠与3个β-转角结构构成。
根据PwELP1的同源蛋白序列及其多序列比对结果,利用MEGA 5软件构建系统发育树,结果(图3)表明,北美云杉的PsELP蛋白与PwELP1蛋白高度同源,被归为同一簇。

表 2 PwELP1同源基因相关信息Table 2 Homological genes of PwELP1

图 2PwELP1同源蛋白序列比对及其二级结构预测
α.α-螺旋;β.β-折叠;TT.β-转角;Consensus代表同源序列;acc.Accessibility;各序列代表物种与表2同
Fig.2Multiple sequence alignment and secondary structure of PwELP1
α.α-helix;β.β-sheet;TT.β-turn;Consensus represents homologous sequence;acc.Accessibility;The information of sequences are identical with Table 2

图 3PwELP1蛋白序列的系统发育树
Fig.3Phylogenetic tree of PwELP1 protein sequence
2.3PwELP1蛋白的三级结构预测
利用swiss-model工具进行PwELP1蛋白的三级结构预测,结果显示,青杄PwELP1蛋白在空间上由数量不同的α-螺旋、β-折叠和β-转角构成,还存在部分无规则卷曲结构(图4),印证了二级结构的预测结果。
2.4PwELP1基因的表达分析
2.4.1青杄各组织RNA的提取利用RNA提取试剂盒,提取青杄根、茎、针叶、花粉和种子的RNA,琼脂糖凝胶电泳结果显示,青杄各组织总RNA的18S与28S条带清晰,表达量比较稳定,可以进行后续的RT-qPCR试验(图5)。

图 4 swiss-model预测的PwELP1三级结构Fig.4 Predicted tertiary structure of PwELP1 by swiss-model图 5 青杄各组织总RNA的提取 A.各组织RNA;B.萌发不同时间的花粉RNA; C.萌发不同时间的种子RNAFig.5 Total RNA extraction of different tissues of Picea wilsoniiA.Total RNA extraction of tissues;B.Total pollen RNA in different periods of germination;C.Total seeds RNA in different periods of germination
2.4.2PwELP1的组织特异性表达由图6可见,青杄PwELP1在花粉中的表达量最高,在其他组织中的表达量相对较低。
2.4.3在不同发育时期花粉中的表达由图7可见,青杄PwELP1在花粉萌发的0~24 h表达量较低且稳定,在发育后期(30~36 h)表达量逐步增加。

图 6PwELP1在青杄不同组织中的相对表达量
Fig.6Relative expression levels ofPwELP1 in different organs ofPiceawilsonii
图 7PwELP1在不同发育时期青杄花粉中的相对表达量
Fig.7Relative expression levels ofPwELP1 in different pollen germination stages ofPiceawilsonii
2.4.4在萌发不同时期种子中的表达PwELP1在萌发不同时期青杄种子中的相对表达量见图8。

图 8 PwELP1在萌发不同时期青杄种子中的相对表达量Fig.8 Relative expression levels of PwELP1 in various seed germination stages of Picea wilsonii
由图8可见,青杄PwELP1在种子萌发早期(吸胀期,第2天)表达量较高,在分化生长及营养生长阶段(4~12 d)表达量有所下降,并且维持相对稳定的水平。
2.4.5在不同逆境处理下幼苗中的表达由图9可见,在低温(4 ℃)、高温(42 ℃)、脱落酸(ABA)、茉莉酸甲酯(MeJA)、H2O2、脱水这几种逆境处理下,PwELP1表达量均表现出较为明显的起伏差异。其中,在低温(4 ℃)、茉莉酸甲酯(MeJA)、H2O2、脱水处理下,PwELP1表达量呈现出先上升后下降的趋势,在3 h左右达到最高值(图9-A-D);在高温(42 ℃)处理下,PwELP1表达量在0~3 h表现出明显的上升趋势,后期则急剧下降(图9-E);脱落酸(ABA)处理下,PwELP1表达量呈现出先上升后下降之后再微弱上升的趋势,最高值出现在6 h前后(图9-F)。
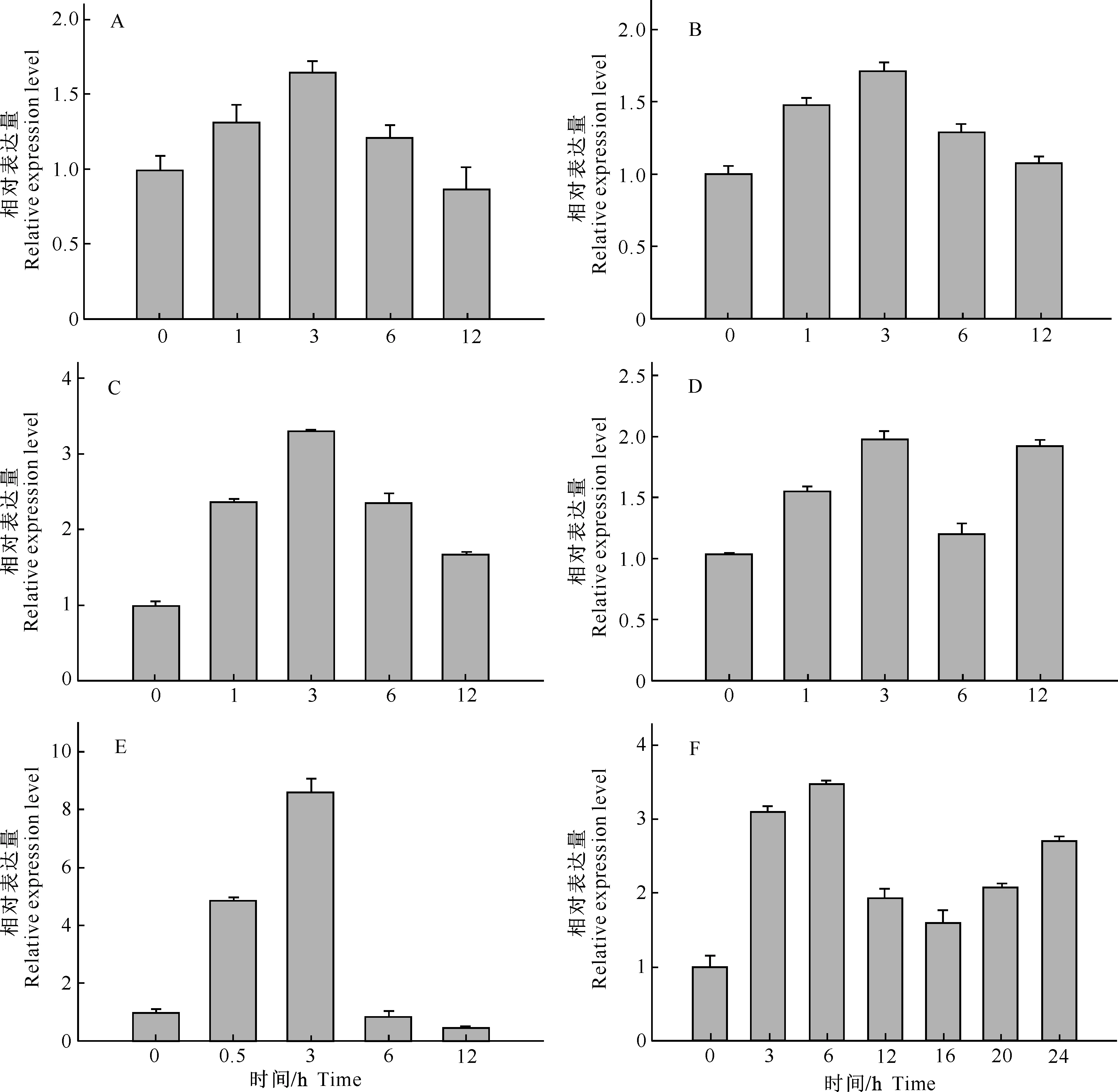
图 9 PwELP1在不同逆境处理下青杄幼苗中的相对表达量 A.低温(4 ℃);B.茉莉酸甲酯(MeJA);C.H2O2;D.脱水;E.高温(42 ℃);F.脱落酸(ABA)Fig.9 Relative expression patterns of PwELP1 in Picea wilsonii seedling under various tolerance treatment experiments A.Chilling (4 ℃);B.Methyl jasmonate (MeJA);C.Hydrogen peroxide (H2O2);D.Dehydration;E.Heat (42 ℃);F.Abscisic acid (ABA)
3 讨 论
类伸展蛋白在植物的多种生理进程中发挥重要作用,如花粉生长发育、生物胁迫响应等。本研究以青杄cDNA文库为模板,以ELP基因的EST序列设计引物,通过RACE-PCR得到了PwELP1的末端序列,经过序列拼接得到了PwELP1的全长cDNA序列,通过生物信息学检索可以发现,不同植物ELP蛋白的氨基酸构成具有多样性,通过系统发育树和多序列比对可以看出,北美云杉中的PsELP(HM201142)与PwELP1高度同源,由于北美云杉与青杄同属松科植物,两者在形态学上具有很高的相似性,因此推测两物种在进化上有相同的祖先。
细胞壁作为植物细胞的保护层,主要起到支撑细胞和抵抗病原体的作用[13],在细胞壁中存在大量的功能蛋白,如抵抗病原体的植物防卫素(plant defensin)[14]、参与植物果实生长的木糖酶类[15],以及在细胞壁形态建成及生物胁迫等生理过程中起到重要作用的阿拉伯半乳糖蛋白等[16]。从已有的研究来看,类伸展蛋白家族的种类和数量还不确定,且主要存在于植物的细胞壁中,预测不同的ELP蛋白可能参与不同的生理功能。值得注意的是,在人类精细胞蛋白组中也发现了拥有ELP结构域的蛋白,其主要定位在精细胞表面,通过与CABYR互作参与信号的转导[17]。类伸展蛋白功能的多样性也预示着PwELP1蛋白可能具有多重生理功能。GOR工具预测此蛋白包含18.24%的α-螺旋,55.35%的无规则卷曲结构[18]。ProtParam工具计算该蛋白的不稳定指数为48.96,说明此蛋白不稳定,预测蛋白会进一步被修饰,如糖基化、脯氨酸羟基化等[19],因此该蛋白很可能在不同生理条件下发生不同程度的修饰等,进而在多种生理活动中发挥功能。
本试验中,PwELP1在成年青杄花粉中表达量最高,说明PwELP1在花粉生长及发育过程中可能起到重要作用,进而说明其在青杄的生殖发育过程中发挥一定作用。为了验证不同时期青杄花粉萌发时PwELP1的表达量变化,利用RT-qPCR检测了花粉萌发不同时期的PwELP1表达量,结果发现,在花粉管生长的末期(30~36 h)PwELP1表达量达到最大值,此时,花粉管的生长已经趋于停止,预测PwELP1可能参与此生理过程。
本研究发现,PwELP1表达量在种子吸胀期上升,在这段时期,种子吸收大量水分后,细胞将急剧膨胀增大。有研究表明,伸展蛋白(extensin)具有限制细胞生长的作用[20],推测PwELP1蛋白也有类似的功能,而细胞进入分化、增殖阶段后,其表达量则保持相对稳定。
本研究发现,在低温(4 ℃)、茉莉酸甲酯(MeJA)、H2O2、脱水处理下,PwELP1表达量呈现出先上升后下降的趋势,在3 h左右达到最高值;在高温(42 ℃)处理下,PwELP1的表达量在0~3 h表现出明显的上升趋势,后期则急剧下降,表明PwELP1基因参与了高温胁迫的响应过程,处理后期下降则很可能是因为植物组织细胞受到高温胁迫而使细胞受到伤害所致;在脱落酸(ABA)处理下,PwELP1表达量呈现出先上升后下降之后再微弱上升的趋势,最高值出现在6 h左右,前期表达趋势与其他逆境条件一致,说明PwELP1基因可能参与ABA响应过程。在上述激素和非生物胁迫处理下,PwELP1表达量均在处理早期出现了表达量上调的现象,推测PwELP1能够在这些激素处理和非生物胁迫早期发挥作用。最近有研究证实,对甘蓝型油菜的保卫细胞原生质体进行脱落酸(ABA)和茉莉酸甲酯(MeJA)处理后,分别鉴定出了65和118个可能对这两种激素处理有响应的氧化还原敏感型蛋白,其中就各包含1种类伸展蛋白[21]。在本试验中,PwELP1对多种激素和非生物胁迫处理都出现了不同的响应,显示其在植物的生长发育和胁迫响应过程中发挥多种功能,尤其是PwELP1在种子和花粉萌发过程以及激素早期响应过程中的功能值得深入研究。
4 结 论
从青杄cDNA文库中克隆了类伸展蛋白基因PwELP1的cDNA全长,编码区序列长480 bp,编码159个氨基酸;编码蛋白理论等电点为5.81,分子质量为17.03 ku,在空间结构上由数量不同的α-螺旋、β-折叠和β-转角构成,还存在部分无规则卷曲结构。PwELP1在青杄种子和花粉萌发等多种生理过程中发挥作用,同时可能参与了青杄对低温、高温、茉莉酸甲酯(MeJA)、H2O2、脱水以及脱落酸(ABA)等非生物逆境胁迫的响应过程。
[1]Showalter A M,Keppler B,Lichtenberg J,et al.A bioinformatics approach to the identification,classification,and analysis of hydroxyproline-rich glycoproteins [J].Plant Physiol,2010,153(2):485-513.
[2]Oguri S,Amano K,Nakashita H,et al.Molecular structure and properties of lectin from tomato fruit [J].Biosci Biotechnol Biochem,2008,72(10):2640-2650.
[3]Alfano G,Ivey M L,Cakir C,et al.Systemic modulation of gene expression in tomato byTrichodermahamatum382 [J].Phytopathology,2007,97(4):429-437.
[4]Bucher M,Schroeer B,Willmitzer L,et al.Two genes encoding extensin-like proteins are predominantly expressed in tomato root hair cells [J].Plant Mol Biol,1997,35(4):497-508.
[5]Bucher M,Brunner S,Zimmermann P,et al.The expression of an extensin-like protein correlates with cellular tip growth in tomato [J].Plant Physiol,2002,128(3):911-923.
[6]Balaji V,Smart C D.Over-expression of snakin-2 and extensin-like protein genes restricts pathogen invasiveness and enhances tolerance toClavibactermichiganensissubsp.michiganensisin transgenic tomato (Solanumlycopersicum) [J].Transgenic Res,2012,21(1):23-37.
[7]Balaji V,Sessa G,Smart C D.Silencing of host basal defense response-related gene expression increases susceptibility ofNicotianabenthamianatoClavibactermichiganensissubsp.michiganensis[J].Phytopathology,2011,101(3):349-357.
[8]Rubinstein A L,Broadwater A H,Lowrey K B,et al.Pexl,a pollen-specfic gene with an extensin-like domain [J].Proc Natl Acad Sci,1994,92:3086-3090.
[9]Neubauer J D,Lulai E C,Thompson A L,et al.Wounding coordinately induces cell wall protein,cell cycle and pectin methyl esterase genes involved in tuber closing layer and wound periderm development [J].J Plant Physiol,2012,169(6):586-595.[10]Hijazi M,Durand J,Pichereaux C,et al.Characterization of the arabinogalactan protein 31 (AGP31) ofArabidopsisthaliana:new advances on the Hyp-O-glycosylation of the prorich domain [J].J Biol Chem,2012,287(12):9623-9632.
[11]Velasquez M,Salter J S,Dorosz J G,et al.Recent advances on the posttranslational modifications of EXTs and their roles in plant cell walls [J].Front Plant Sci,2012,3:93.
[12]Yu Y L,Li Y Z,Huang G X,et al.PwHAP5,a CCAAT-binding transcription factor,interacts with PwFKBP12 and plays a role in pollen tube growth orientation inPiceawilsonii[J].J Exp Bot,2011,62(14):4805-4817.
[13]Underwood W.The plant cell wall:a dynamic barrier against pathogen invasion [J].Front Plant Sci,2012,3:85.
[14]Thevissen K,de Mello Tavares P,Xu D M,et al.The plant defensin RsAFP2 induces cell wall stress,septin mislocalization and accumulation of ceramides inCandidaalbicans[J].Mol Microbiol,2012,84(1):166-180.
[15]Sampedro J,Gianzo C,Iglesias N,et al.AtBGAL10 is the main xyloglucan β-galactosidase inArabidopsis,and its absence results in unusual xyloglucan subunits and growth defects [J].Plant Physiol,2012,158(3):1146-1157.
[16]Zhang Y Z,Yang J,Showalter A M.AtAGP18 is localized at the plasma membrane and functions in plant growth and development [J].Planta,2011,233(4):675-683.
[17]Naaby-Hansen S.Functional and immunological analysis of the human sperm proteome [J].Dan Med J,2012,59(4):B4414.
[18]Garnier J,Gibrat J F,Robson B.GOR method for predicting protein secondary structure from amino acid sequence [J].Methods Enzymol,1996,266:540-553.
[19]Gasteiger E,Gattiker A,Hoogland C,et al.ExPASy:the proteomics server for in-depth protein knowledge and analysis [J].Nucleic Acids Res,2003,31(13):3784-3788.
[20]Kieliszewski M J,Lamport D T.Extensin:repetitive motifs,functional sites,post-translational codes,and phylogeny [J].Plant J,1994,5(2):157-172.
[21]Zhu M M,Zhu N,Song W Y,et al.Thiol-based redox proteins in abscisic acid and methyl jasmonate signaling inBrassicanapusguard cells [J].Plant J,2014,78(3):491-515.
Cloning and expression analysis ofPwELP1 gene inPiceawilsonii
GAO Yintao1,ZHOU Yanni2,LUO Chaobing2,ZHANG Lingyun2,CHEN Kunming1
(1CollegeofLifeScience,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2KeyLaboratoryofForestSilviCultureandConservationofMinistryofEducation,CollegeofForestry,BeijingForestryUniversity,Beijing100083,China)
【Objective】 This study cloned and conducted molecular characterization forPwELP1 gene fromPiceawilsoniito provide basis for investigating functions ofELPgene family.【Method】 The full length cDNA ofPwELP1 was obtained by RACE-PCR assays based on the cDNA library of grownPiceawilsonii.The ORF finding and the protein translation ofPwELP1 were done by DNAMAN.The multiple sequences alignment was done by clustalx and Espript.Phylogenetic tree was obtained by Neighbor-joining in MEGA 5.The calculation of theoretical isoelectric point and molecular weight of PwELP1 protein were completed by Compute pI/Mw tool in Expasy.The secondary and tertiary structure prediction of PwELP1 protein was completed by Jpred and swiss-model,respectively.The tissue-specific expressions,the differential expressions in different germination periods of pollen and seed,and the differential expressions of seedling under different abiotic stresses were investigated by RT-qPCR assays.【Result】PwELP1 encoded a protein with 159 amino acids,which had relatively conserved domain in both N-terminal and C-terminal.As the prediction of secondary structure,the protein consisted of one α-helix,five β-sheets,three β-turns,which was prove by protein tertiary structure prediction Furthermore,a few coils exsisted in the tertiary structure.The theoretical molecular weight of PwELP1 was 17.03 ku and the isoelectric point was 5.81.Tissue-specific expression experiments revealed that the expression level in pollen was the highest among all tissues ofPiceawilsonii.During pollen germination,PwELP1 was highly expressed at the end of germination process (30-36 h).The expression ofPwELP1 was up-regulated in inhibition period (2 days) in seed germination.Seedling tolerance treatment experiments suggested that the expression level ofPwELP1 was regulated under chilling,heat,methyl jasmonate,hydrogen peroxide, dehydration and abscisic acid (ABA) treatments, especially under hydrogen peroxide,heat and ABA treatments.【Conclusion】PwELP1 might have a potential function in pollen germination,seed germination and responding to a serious of abiotic stress processes.
Piceawilsonii;extension-like protein;tissue expression;abiotic stresses
时间:2016-09-0709:02DOI:10.13207/j.cnki.jnwafu.2016.10.012
2015-03-10
国家自然科学基金面上项目(31270663)
郜银涛(1988-),男,河南许昌人,硕士,主要从事植物逆境分子生物学研究。E-mail:yintaogao@126.com
陈坤明(1971-),男,甘肃天水人,博士,教授,主要从事植物逆境细胞分子生理机制及调控研究。
E-mail:kunmingchen@163.com
S791
A
1671-9387(2016)10-0083-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160907.0902.024.html

