羊驼呼吸系统疾病病例病原分析
覃勇,陶立,马春霞,李军,蒙振亩,
兰美益2,3,韦志锋2,3,陈泽祥2,3,杨威2,3
(1.百色市动物疫病预防控制中心,广西百色533000;2.广西兽医研究所,广西南宁5300012;3.广西畜禽疫苗新技术重点实验室,广西南宁530001)
羊驼呼吸系统疾病病例病原分析
覃勇1,陶立2,3,马春霞2,3,李军2,3,蒙振亩1,
兰美益2,3,韦志锋2,3,陈泽祥2,3,杨威2,3
(1.百色市动物疫病预防控制中心,广西百色533000;2.广西兽医研究所,广西南宁5300012;3.广西畜禽疫苗新技术重点实验室,广西南宁530001)
羊驼产于南美洲,是归属于偶蹄目骆驼科的一种野生动物,外形与绵羊有些相似,体重在55~65 Kg之间。由于羊驼的毛比一般羊毛更长,且更光亮和富有弹性,是高级毛织物的原材料,具有很高的经济价值,此外,羊驼外形憨厚,形态可爱,常被动物园作为观赏动物饲养。我国于2002年首次引进,并组建了繁育基地,现全国各地都有小规模的养殖,由于羊驼是外来品种,国内养殖历史短,在繁育问题解决的基础上,随之而来的是对羊驼疾病的认识和防控是羊驼养殖业将面临的主要问题。
2014年11月广西百色第五届园博园动物展馆饲养的4只6月龄羊驼,1只因流涕和严重呼吸困难等症状于次日死于栏舍内,为查明羊驼的死亡原因,笔者通过现场流行病学调查、临床剖检、病原分离鉴定与药敏试验,对病例病原进行分析,并据此提出综合防制措施指导防控,病情没有扩散,收到较好效果,现报道如下。
1材料与方法
1.1材料及试验动物病死羊驼肝脏、肺脏组织。20 g左右昆明系小鼠,购自广西医科大学实验动物中心。绵羊肺炎支原体(Movi)、丝状支原体山羊亚种(Mmc)和多杀性巴氏杆菌阳性分离株由广西兽医研究所细菌研究室分离鉴定保存。1.2试剂及仪器兔血琼脂平板由广西兽医研究所细菌研究室制备,TSA、TSB、麦康凯琼脂培养基,购自北京陆桥生物技术有限责任公司;PPLO肉汤,购自杭州百思生物技术有限公司;微量生化反应管及药敏试纸,购自杭州天和微生物制剂有限公司。病毒基因组DNA/RNA提取试剂盒、细菌基因组DNA提取试剂盒、PCR扩增、克隆所用试剂,均购自北京康为世纪生物科技有限公司;低温台式高速离心机,购自Beckman公司;YY2Ⅲ-8B稳压稳流型电泳仪,购自北京六一仪器厂;Pro Flex PCR System,购自Life Tech公司;721BR09310型凝胶成像系统,购自Bio-Rad公司;CO2培养箱,购自Thermo forma公司。
1.3方法
1.3.1临床症状与剖检病理观察现场了解发病经过,临床症状,剖检病死羊驼,肉眼观察记录各脏器形态。
1.3.2细菌的分离鉴定将肺和肝组织制作组织触片,固定,革兰染色,镜检观察;无菌取肺组织、肝组织分别划线接种兔血琼脂培养基平板、TSA平板,置37℃含5%CO2培养箱中培养24~48 h后观察细菌生长,取疑似菌落进一步鉴定。
1.3.2.1病原细菌分离株致病性试验将纯化的细菌分离株接种TSB液,用其24 h培养液进行小鼠致病性试验,试验组5只小鼠每只均腹腔接种0.4 mL(菌液浓度为2×109CFU/mL)菌悬液,对照组5只小鼠腹腔接种等量的TSB液作对照。
1.3.2.2病原细菌分离株的生化试验将病原细菌分离株经纯化后按照文献[1]的方法进行。
1.3.2.3细菌分离株16S rRNA基因PCR鉴定将分离纯化培养的单个菌落溶解到10 μL灭菌的生理盐水中,充分震荡混匀,取3 μL菌液作为模板利用细菌16S rRNA基因通用引物进行PCR扩增,反应体系为50 μL:模板3 μL,上、下游引物(10 μmol/L)各2 μL,2×Taq PCR Master Mix 26 μL,ddH2O补至50 μL。PCR反应条件:95℃预变性5 min;95℃变性60 s,60℃退火60 s,72℃延伸60 s,72℃终延伸10 min。扩增产物利用1.5%琼脂糖凝胶电泳检测。
1.3.2.4药敏试验和治疗药敏试验采用药敏试纸法,方法按秦若甫[2]等报道的方法进行,根据药敏试验结果对羊驼群采取相应治疗措施。
1.3.3支原体的分离鉴定无菌采取发病羊驼肺组织少许于研钵中剪碎,加适量PPLO支原体培养液充分研磨,4 000 r/min离心10 min,取上清液经0.45 μm一次性针式滤器过滤,将滤液按1∶10倍比稀释接种于PPLO支原体培养液中,倍比稀释的管数为10-1~10-5,置37℃含5%CO2培养箱中培养5~7 h、并连传3代观察培养液有无颜色变化。部分上清液作支原体PCR特异性检测,特异性引物见表1。
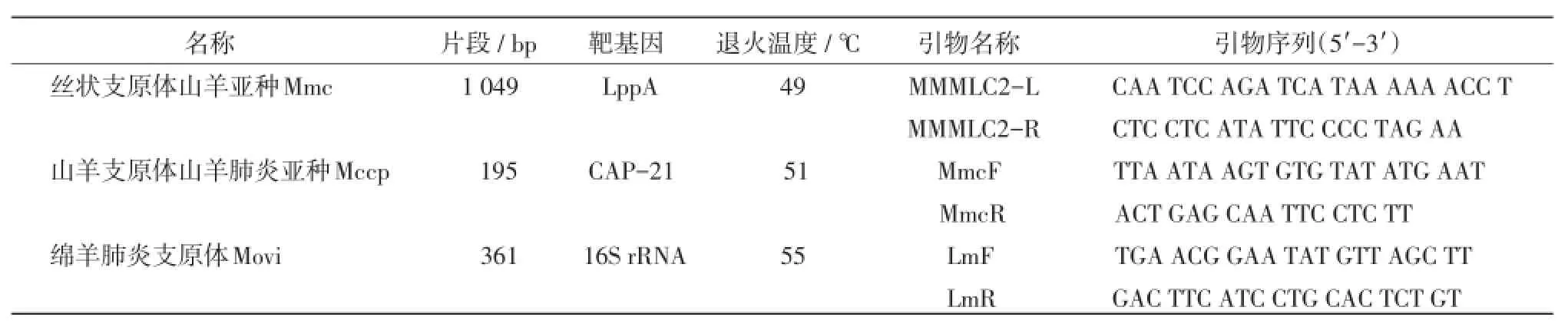
表1PCR扩增特异性引物名称和序列
1.3.4流感病毒的PCR检测取肺组织进行匀浆后,反复冻融3次,4 000 r/min离心5 min,取上清液,按照病毒基因组RNA/DNA共提试剂盒说明书,抽提肺组织上清液的病毒基因组RNA,然后进行反转录与PCR反扩增。扩增产物利用1.5%琼脂糖凝胶电泳检测。
2结果
2.1临床症状与病理变化2014年8月从深圳某羊驼训养场购进4只约6月龄羊驼,经隔离检疫合格后于9月对观众开放,并一直按原饲养方式饲养。11月3日发现1只羊驼精神状态欠佳,食欲减退,呼吸急促,鼻流清涕,嘴角流有少量白色泡沫,少动,喜卧,有轻微拉稀,饲养员按说明剂量投喂利巴韦林和清开灵颗粒,4日早上发现该羊驼死在栏舍内。
剖检发现腹腔和胸腔均有少量黄色清亮积液,肺部出血、肝变,切开有白色或粉红色泡沫,气管内充满大量白色泡沫,肺门淋巴结肿大、出血,心脏血液凝固不良,肝脏呈暗红色,胆囊肿胀充盈,胃内有大量草料、玉米颗粒、水样混合物,胃液pH值为4,胃黏膜脱落,胃底呈片状溃烂,十二指肠、大肠呈卡他性炎症,其他脏器没有肉眼可见病理变化。另外3只羊驼均未见病症。
2.2细菌的分离鉴定结果
2.2.1肝、肺组织触片染色镜检发现,肺组织中有革兰阴性的小杆菌,肝组织中未发现。
2.2.2从肺组织分离到1株革兰阴性小杆状或球杆状菌,该菌在TSA平板上生长良好,可生成圆形、灰色湿润、光滑致密、边缘整齐的菌落,在血平板上呈β溶血,在麦康凯培养基上菌落为圆形,凸起、茶色的小菌落,在TSB液中培养24 h均匀混浊。
2.2.3细菌分离株小鼠致病性试验结果接种分离菌后24~48 h,试验组小鼠全部死亡,死亡小鼠肺出血,肝肿大、出血,并从小鼠的肺肝中回收到接种菌。对照组小鼠无异常。
2.2.4分离菌株生化结果分离株不分解碳水化合物,M.R.、V-P和吲哚试验阴性,触酶、硝酸盐和尿素阳性,符合支气管败血波氏杆菌的生化特征(表2)[3]。

表2分离株生化特性试验结果
2.2.5分离菌株16S rRNA基因PCR鉴定结果PCR扩增获得约1 400 bp的目的片段(见图1)。将PCR产物经胶回收后送测序,测序结果与GenBank上登录的支气管败血波氏杆菌CLR2013-1株(登录号:KM079614)的核苷酸序列同源性达到98%,测序结果表明,病原菌为支气管败血波氏杆菌。2.2.6分离菌株的药敏试验药敏结果显示,分离菌株对阿奇霉素、氧氟沙星、强力霉素等11种抗菌药物敏感;对先锋V、利福平等7种抗菌药物耐药(表3)。
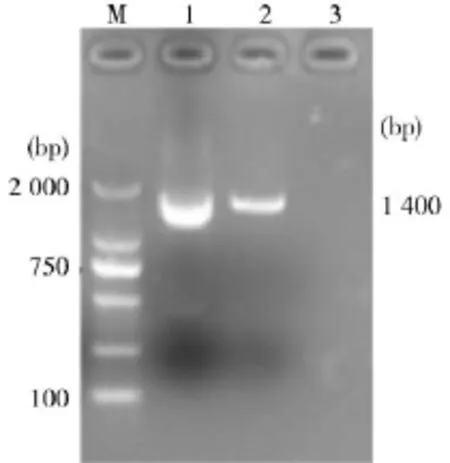
图1细菌16S rRNA PCR扩增结果
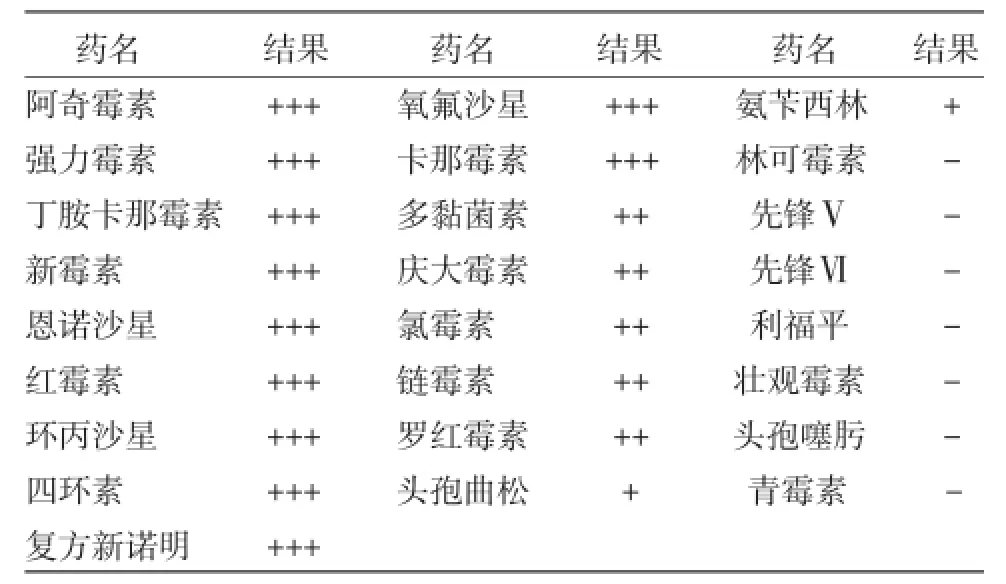
表3分离菌株药敏试验结果
2.3支原体的分离鉴定结果支原体的分离培养连传3代,PPLO支原体培养液未见颜色发生变化,说明没有支原体生长。但3种羊支原体特异性基因片段PCR检测结果发现绵羊肺炎支原体呈阳性见图2、图3。
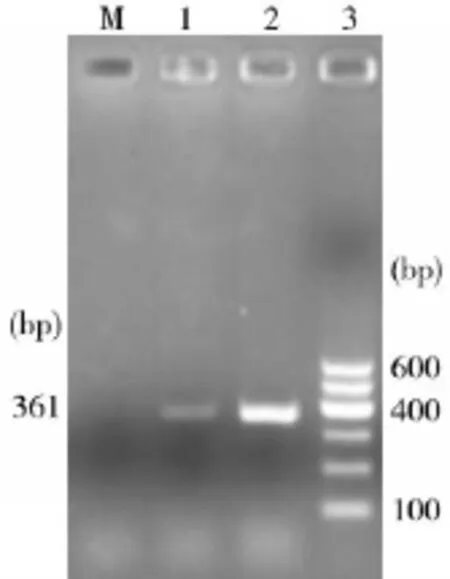
图2Movi PCR扩增结果
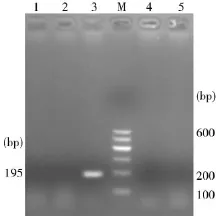
图3Mmc Mccp PCR扩增结果
2.4流感PCR检测结果阴性。
2.5治疗措施清扫整个栏舍,粪便堆积发酵处理,并用百毒杀消毒整个栏舍及其周边环境。选用高敏感药阿奇霉素对3只羊驼连续用药3~5 d,同时,加强管理,添加多维和微量元素,适当增加精料以提高抗应激和抗病的能力,3只羊驼未见发病。
3讨论
3.1从发病经过、临床症状与病理变化、病原分离鉴定等方法对病例病原进行分析,结果表明,从病死羊驼的肺组织中分离得1株革兰阴性的致病杆菌。从该菌的生化特性和16S rRNA基因PCR扩增测序检测结果表明,该致病菌是支气管败血波氏杆菌。用3种羊支原体和流感病毒的特异性PCR诊断引物对病死羊驼的肺组织进行检测,发现绵羊肺炎支原体为阳性,而丝状支原体山羊亚种、山羊支原体山羊肺炎亚种和流感病毒为阴性。采用支气管败血波氏杆菌和支原体高敏药物阿奇霉素对同栏的3只羊驼进行预防,未见发生新的病例。病原分析和药物治疗的结果证实引起本例羊驼呼吸道疾病病原有支气管败血波氏杆菌、绵羊肺炎支原体。
3.2绵羊肺炎支原体是引起山羊和绵羊支原体肺炎的重要病原之一,可导致山羊和绵羊肺的严重出血和肺间质增生,在国内山羊和绵羊感染带菌现象非常普遍,该病原菌可经空气传播。有资料表明,绵羊肺炎支原体除感染山羊和绵羊外,还可感染小反刍兽如麝牛、大角羊等[6-7],但未见感染羊驼的报道,至于绵羊肺炎支原体是否可引起羊驼的感染发病,还有待于动物回归致病试验。
3.3支原体体外培养条件要求苛刻,培养成功相对困难,这次用PPLO支原体培养基连续3次传代培养均为阴性,这可能与未及时送检有很大的关系。
[1]白文彬,于康震.动物传染病诊断学[M].北京:中国农业出版社,2002:84-96.
[2]秦若甫,李智红,韦志锋,等.二株绵羊肺炎支原体药物敏感性试验和临床治疗体会[J].广西畜牧兽医,2011,27(3):165-166.
[3]陆承平.兽医微生物学[M].4版.北京:中国农业出版社. 2008:158-160.
[4]Goodnow R A.Biology of Bordetella bronchiseptica[J].Microbiolgy Reviews,1980,44(4):722-738.
[5]裴洁,何华,赵战勤,等.支气管败血波氏杆菌的研究进展[J].畜牧兽医科技信息,2006,2:4-6.
[6]Handeland K,Tengs T,Kokotovic B,et al.Mycoplasma ovipneumoniae-a primary cause of severe pneumonia epizootics in the Norwegian Muskox(Ovibos moschatus)population[J].PLoS One,2014,9(9):e106116.
[7]Besser T E,Cassirer E F,Potter K A,et al.Epizootic pneumonia of bighorn sheep following experimental exposure to Mycoplasma ovipneumoniae[J].PLoS One,2014,9(10):e110039.
S829.9
B
0529-6005(2016)08-0049-03
2015-05-29
广西壮族自治区水产畜牧局科研项目(桂渔牧科072411,桂渔牧科08283-2)
覃勇(1974-),男,兽医师,本科,研究方向为动物疫病防控,E-mail:bsshouyi@163.com
陶立(1964-),男,高级兽医师,本科,研究方向为从事动物疫病的防制和研究,E-mail:gxlitao1223@163.com
注:陶立与覃勇对本文具有同等贡献
李军,E-mail:Jlee9981@163.com;杨威,E-mail:gxyangwei@163.com

