旋毛虫不同发育时期排泄分泌物抗原在免疫学诊断中的应用研究
吴秀萍,孙召金,翟铖铖刘晓雷,唐 斌,刘明远
(1. 中国疾病预防控制中心寄生虫病预防控制所,卫生部寄生虫与病原生物学重点实验室,世界卫生组织疟疾、血吸虫和丝虫病合作中心,上海 200025;2. 吉林大学人兽共患病研究所,人兽共患病教 育部重点实验室,吉林长春 130062)
旋毛虫不同发育时期排泄分泌物抗原在免疫学诊断中的应用研究
吴秀萍1,2,孙召金1,2,翟铖铖1,刘晓雷2,唐斌2,刘明远2
(1. 中国疾病预防控制中心寄生虫病预防控制所,卫生部寄生虫与病原生物学重点实验室,世界卫生组织疟疾、血吸虫和丝虫病合作中心,上海200025;2. 吉林大学人兽共患病研究所,人兽共患病教 育部重点实验室,吉林长春130062)
[目的]系统了解并比较旋毛虫不同发育时期排泄分泌物(ES)抗原的免疫学特性,探索可用于临床检测出栏猪旋毛虫感染的血清学诊断技术。[方法] 分别以旋毛虫肠道期10 h肌幼虫(10 h ML)、肠道期30 h成虫(30 h Ad)、3 d 成虫(Ad3)、6 d 成虫与新生幼虫混合(Ad6+NBL)以及肌幼虫(ML)五个不同发育时期的ES作为包被抗原,应用ELISA方法,检测感染不同剂量、不同天数的猪血清中的抗旋毛虫抗体IgM和IgG水平,绘制抗体消长规律曲线并进行数据分析。[结果]10 h ML ES和ML ES作为包被抗原适合检测不同感染剂量、感染35 d之前的猪抗旋毛虫IgM抗体,低剂量感染10 d左右可以检出,高剂量感染5 d也可以检出;Ad3 ES作为包被抗原对高剂量感染35 d之前的猪抗旋毛虫IgM抗体检测敏感;Ad3和ML的ES作为包被抗原可检测不同剂量、感染35 d之后的猪抗旋毛虫IgG抗体,其中Ad3 ES抗原检测低剂量感染的效果优于ML ES抗原。[结论] 肠道期肌幼虫、成虫和肌幼虫的ES抗原可用于检测旋毛虫的早期感染,成虫和肌幼虫的ES抗原可用于检测出栏猪的旋毛虫感染。本研究为进一步合理有效利用旋毛虫不同发育时期的ES抗原,建立更有效的检测屠宰动物旋毛虫感染的方法提供了重要理论基础和参考。
旋毛虫;排泄分泌物;猪血清;酶联免疫吸附试验
旋毛虫属线虫,是除南极洲外在世界广泛均有分布的人兽共患寄生虫[1],目前为止,至少被55个国家记录或报道[2-3]。人通过生食或半生食感染旋毛虫幼虫的猪肉、马肉、狗肉和野生动物肉(如野猪、熊、獾和海象)及肉类制品而被感染[3]。近年来,家养猪被认定为旋毛虫(T.spiralis)的主要宿主,猪肉被认定为人类旋毛虫病的主要感染源[4]。
旋毛虫的检测方法主要包括:镜检法、集样消化法和血清学检测。集样消化法是目前旋毛虫检验的金标准;血清学方法如ELISA,是目前检测旋毛虫最为敏感的方法。目前所采用的抗原主要来自旋毛虫肌幼虫的ES抗原。而ES抗原存在特异性及诊断盲区等弊端,使得ELISA检测无法纳入旋毛虫国际检测法规[5-7]。Boireau[8]、Kapel[9]等人证明旋毛虫ML、Ad和NBL抗原可被实验感染旋毛虫的猪抗体所识别,并研究了其作为抗原检测感染血清中IgG抗体消长情况。
本研究以中国长白猪为实验动物,利用实验室保存传代的中国河南猪旋毛虫分离株T1 (ISS534)感染长白猪,采用旋毛虫五个不同发育时期:肠道10 h肌幼虫期、肠道30 h成虫期、成虫期(Ad)、新生幼虫期和肌幼虫期(ML)分泌的不同抗原(ES)作为诊断抗原,采用ELISA检测实验猪感染旋毛虫2个月内不同天数的血清抗旋毛虫IgM和IgG抗体水平,分析了旋毛虫刺激宿主机体产生抗旋毛虫抗体的消长变化规律,为进一步合理利用旋毛虫不同发育时期的排泄分泌物抗原,建立快速、有效的检测屠宰动物旋毛虫感染的免疫学诊断方法提供重要的理论基础和科学依据。
1 材料
1.1实验动物
传代小鼠:实验室保存传代中国河南猪旋毛虫分离株的昆明小鼠;长白猪:3月龄,每头50 kg左右,共12头,购自吉林省惠昌畜牧科技有限公司;大鼠:6~8周龄的雄性Wistar大鼠,每只250 g,共80只,购自白求恩医学院。
1.2旋毛虫虫株
中国河南猪旋毛虫分离株T1(ISS534),由实验室保存传代。
1.3主要试剂和仪器
胃蛋白酶(1∶1 000和1∶3 000)购自 AMRESCO公司;烧杯、80目筛子、移液器、显色液TMB均购自北京天根生化科技有限公司;山羊抗小鼠 IgM或IgG二抗购自武汉博士德生物工程有限公司;酶标仪购自TECAN公司;ELISA板购自Corning公司;灌胃针、医用低温冰箱、电热恒温培养箱、恒温磁力搅拌器和显微镜等均购自上海医疗器械股份有限公司。
2 方法
2.1感染性实验
根据实验攻虫数量所需,取实验室保种传代的昆明小鼠或wistar大鼠,剖杀,通过消化法收集中国河南猪旋毛虫分离株T1(ISS534)肌幼虫。用绞肉机绞碎猪肉,混合面粉做成肉球,将虫体按不同实验剂量分别包裹在肉球中,投喂给12头实验猪。根据Boireau[8]、Kapel[9]等人的相关实验数据,本实验所需感染剂量如下:50条虫体(<1l pg)、375条虫体(≈1l pg)、150条虫体(>1l pg)和1 000条虫体(阳性对照),各感染3头长白猪,接种后每天观察其状况。
2.2感染猪血清的收集
将感染猪前腔静脉采血,分离血清放于-80℃冰箱保存。采血时间点分为感染前和感染后(5 dpi、8 dpi、11 dpi、14 dpi、17 dpi、21 dpi、26 dpi、35 dpi、45 dpi、60 dpi)。
2.3肠道期肌幼虫、肠道期成虫、成虫、新生幼虫和肌幼虫的培养与排泄分泌物收集
10 h肠道期肌幼虫(10 h ML)即对Wistar大鼠灌胃感染10 h后,剖杀、收集的肌幼虫,用于培养收集10 h ML的ES抗原;30 h肠道期成虫(30 h Ad)即为对Wistar大鼠灌胃感染30 h后,剖杀、收集的肠道期成虫,用于培养收集肠道30 h Ad的ES抗原;3 d 成虫(Ad3)即为感染后 3 d大鼠肠道内的成虫,用于培养收集Ad3的排泄分泌物ES抗原;6 d成虫(Ad6)即为感染后6 d大鼠肠道内的成虫,用于培养收集Ad6及新生幼虫(NBL)的混合排泄分泌物ES抗原;肌幼虫(ML),用于培养收集肌幼虫的排泄分泌物ES抗原。具体收集方法为:
剖杀实验室传代保种T1(ISS534)的Wistar大鼠1只,用自来水将其胴体冲洗干净后以绞肉机绞碎,放入含1%胃蛋白酶和1%盐酸的消化液中,37 ℃消化2 h;除去未消化的组织,将滤液倒入分液漏斗中,室温沉降2 h,收集肌幼虫。
将收集到的肌幼虫计数,一部分经口灌胃感染20只Wistar大鼠(约10 000条/只),剩余肌幼虫(ML)用加有双抗的无菌生理盐水反复清洗干净。将ML虫体分两个培养瓶培养,约5 000条/mL,每瓶加入约10 mL含双抗的1640培养液,置于37 ℃ 5%CO2培养箱中培养12 h,收集的培养液即为所要收集的ML的ES抗原,-80 ℃保存。对灌胃的20只Wistar大鼠在第10 小时扑杀,取小肠段,收集10 h肠道期旋毛虫肌幼虫,经1640培养液培养12 h,收集10 h肠道期肌幼虫的ES抗原,-80 ℃保存。30 h Ad、Ad3、Ad6+NBL的ES抗原收集方法同上。
超滤收集10 h、30 h、Ad3、Ad6+NEL和ML的ES抗原蛋白:将冻存于-80 ℃的10 h、30 h、Ad3、Ad6+NEL和ML的ES抗原在冰水混合物中融化,过滤后转移至超滤管中,用PBS反复洗涤超滤蛋白,至1640培养液颜色变为无色为止。然后分装至1.5 mL EP管中,测其蛋白浓度,标记后冻存于-80 ℃中备用。
2.4酶联免疫吸附试验(ELISA)检测血清中抗旋毛虫抗体
通过间接ELISA方法检测感染猪血清中特异性抗旋毛虫IgM和IgG抗体[10-11]。将10 h、30 h、Ad3、Ad6+NBL和ML的ES抗原稀释至10 µg/mL,以100 µL/孔包被酶标板,置 37 ℃温箱2 h后,移至4 ℃冰箱过夜。用洗液(PBS-T)洗涤板3次后,用封闭液封闭,200 µL/孔。将待检感染猪血清1∶50稀释后,加入到酶标板中,100 µL/孔,置37 ℃温箱孵育1 h。每个样本重复3次,以感染前相对应的血清作为阴性对照。以辣根过氧化物酶标记的山羊抗猪IgM或IgG作为二抗进行孵育。以TMB底物溶液为显色液,100 µL/孔。最后加入2 mol/L H2SO4100 µL/孔,终止显色。用ELISA自动酶标仪检测450 nm波长处吸光度值。待测样本P值≥阴性对照O值的2.1倍时确认为阳性。
2.5数据统计方法与分析
采用SPSS 13.0软件进行数据处理和统计分析,采用多个独立样本非参数检验。检验水准为a=0.05。采用Excel软件绘制不同包被抗原条件下感染猪血清IgM和IgG抗体消长规律曲线。
3 结果
3.1不同剂量感染猪血清中IgM抗体水平
分别利用旋毛虫5个发育时期的ES抗原,即10 h ML、30 h Ad、Ad3、Ad6+NBL和ML的ES抗原,检测旋毛虫4个不同感染剂量感染长白猪60 d内血清中IgM的变化情况。
3.1.110 h ES抗原检测结果。感染早期,抗体均呈“波峰波谷”态势变化。感染50条肌幼虫的猪血清,在感染后第14天、第17天和第26天,血清IgM抗体检测阳性,但在第14天和26天处于高峰,随后呈明显呈下降趋势,第35天后检测变为阴性,第21天处于阴性“波谷”。感染75条肌幼虫的猪血清,在感染后第8天、14天血清IgM抗体检测阳性,第17天后均为阴性,第45天处于阴性“波谷”。感染150条肌幼虫的猪血清,在感染后的前26 d均能检测出IgM抗体阳性,在第11天出现高峰,第14~21天出现阳性“波谷”,后呈下降趋势,第26天至第60天均为阴性。感染1 000条肌幼虫的猪血清,在感染后8~14 d内维持IgM抗体阳性水平,之后开始下降,至第17天出现阴性“波谷”,随后开始上升,至第21天检测为阳性,之后一直维持较高水平。具体变化曲线见图1。
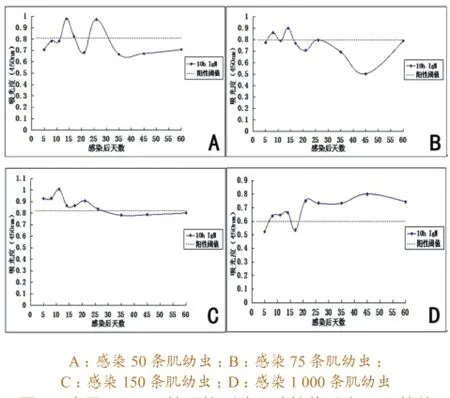
图1 应用10 h ES抗原检测猪血清抗旋毛虫IgM抗体
3.1.230 h ES抗原检测结果。感染50条肌幼虫的猪血清,检测结果全部呈阴性。感染75条肌幼虫的猪血清,在感染后第35天出现阳性“波峰”,第45天处于阴性“波谷”,之后开始上升,至第60天时,IgM阳性抗体处于较高水平。感染150条肌幼虫的猪血清,在感染45 d后,血清IgM抗体检测呈阳性,之前均为阴性。感染1 000条肌幼虫的猪血清,在感染后第11天检出阳性,在第17天出现阴性“波谷”,然后又开始上升,至第21天检测为阳性,之后维持在较高IgM抗体水平,至第45天出现阳性高峰。具体变化曲线见图2。

图2 应用30 h ES抗原检测猪血清抗旋毛虫IgM抗体
3.1.3Ad3 ES抗原检测结果。感染50条肌幼虫的猪血清,检测结果均为阴性。感染75条肌幼虫的猪血清,在感染后第8天、第14天和第21~26天,血清IgM抗体呈弱阳性,其余均为阴性。感染150条肌幼虫的猪血清,在感染后第5~8天,血清IgM抗体呈阳性,第11~14天血清IgM抗体水平处于阳性临界值边缘,第17天处于阴性“波谷”,第35天时呈弱阳性,第45天出现阴性“波谷”,在第60天又重新检测到较高水平的IgM抗体。感染1 000条肌幼虫的猪血清,感染后5~11 d即可检测到IgM抗体,且第5天处于高峰,之后下降,第14~17天为阴性,第21天出现阳性“波峰”,随后在第26天出现阴性“波谷”,其余时间均为弱阳性或阳性,且在第35天后血清IgM抗体水平呈上升趋势。具体变化曲线见图3。
3.1.4Ad6+NBL ES抗原检测结果。感染50条肌幼虫的猪血清,仅在感染后第45天血清IgM抗体水平略高于临界值。感染75条肌幼虫的猪血清,在感染后第8~14天血清IgM抗体呈弱阳性,第21天出现阴性“波谷”,第35天又处于阳性“波峰”,第45天又出现阴性“波谷”,随后呈上升趋势,直至第60天达到较高阳性水平。感染150条肌幼虫的猪血清,在感染后第14天血清IgM抗体呈弱阳性,第17天处于阴性“波谷”,第35天检测到阳性,第45天出现阳性高峰,之后下降,但在第60天血清中的IgM抗体仍为阳性。感染1 000条肌幼虫的猪血清,在感染后第8~11天和第21天血清IgM抗体呈弱阳性,第14天血清IgM抗体接近阳性临界值,第26天出现阴性“波谷”,第35天接近阳性临界值,第45~60天呈阳性且处于较高水平。具体变化曲线见图4。
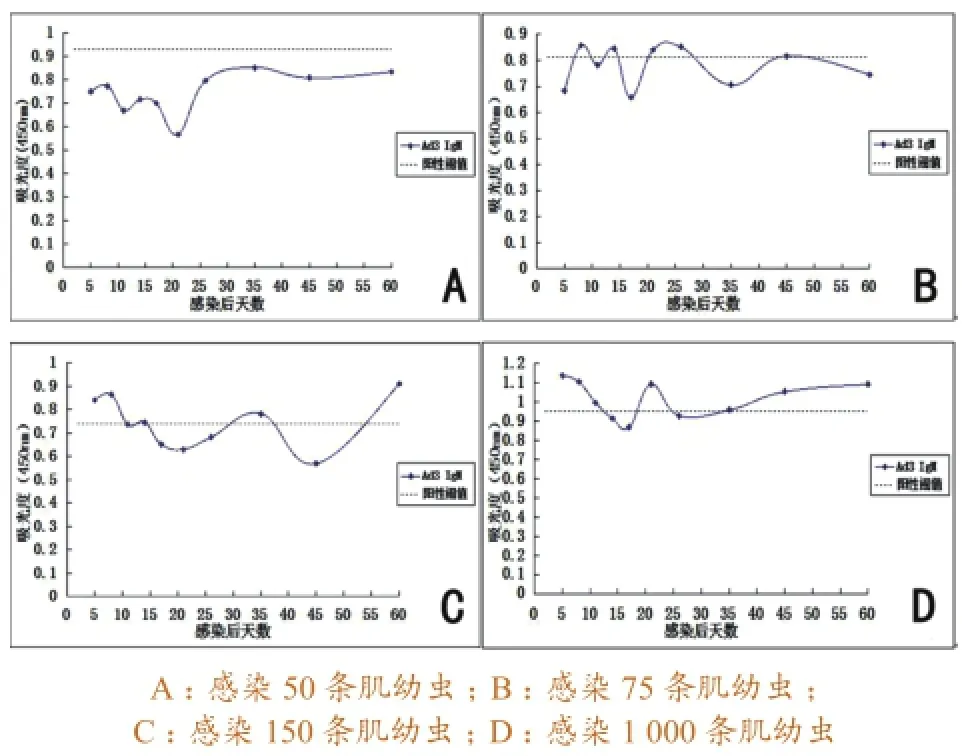
图3 应用Ad3 ES抗原检测猪血清抗旋毛虫IgM抗体
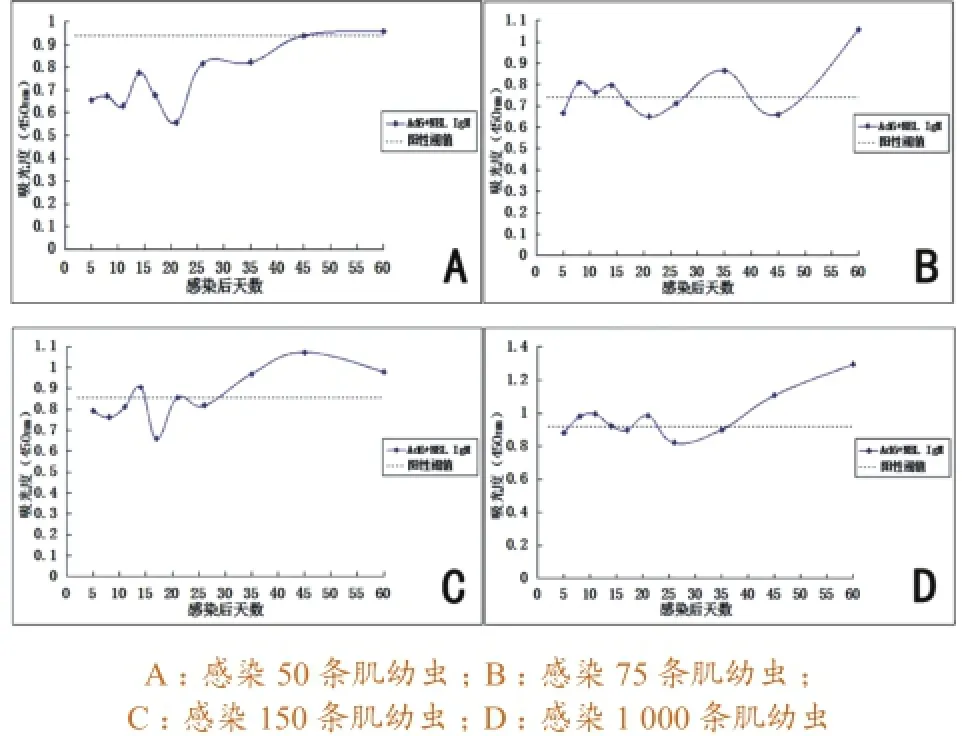
图4 应用Ad6+NBL ES抗原检测猪血清抗旋毛虫IgM抗体
3.1.5ML ES抗原检测结果。感染50条肌幼虫的猪血清,仅在感染后第14天和第26天检测到血清IgM抗体呈弱阳性,其余均为阴性。感染75条肌幼虫的猪血清,在感染后第5~8天检测出血清IgM抗体阳性,第14天呈弱阳性,第35天血清IgM水平接近阳性临界值,第45天处于阴性“波谷”,之后开始上升,第60天检测到较高水平的抗体阳性。感染150条肌幼虫的猪血清,在感染后第14天血清IgM抗体接近阳性临界值,然后开始下降,第17天出现阴性“波谷”,第21天接近阳性临界值,第26~45天血清IgM抗体呈阳性,推测在第40天左右出现阳性高峰,之后下降,第60天趋于阳性临界值。感染1 000条肌幼虫的猪血清,在感染后第5天、第21天和第35出现抗体阳性高峰,35天之后维持在原有的阳性水平,第8天、第17天和第26出现阴性“波谷”,第11~14天血清IgM抗体呈弱阳性或仅接近阳性临界值。具体变化曲线见图5。
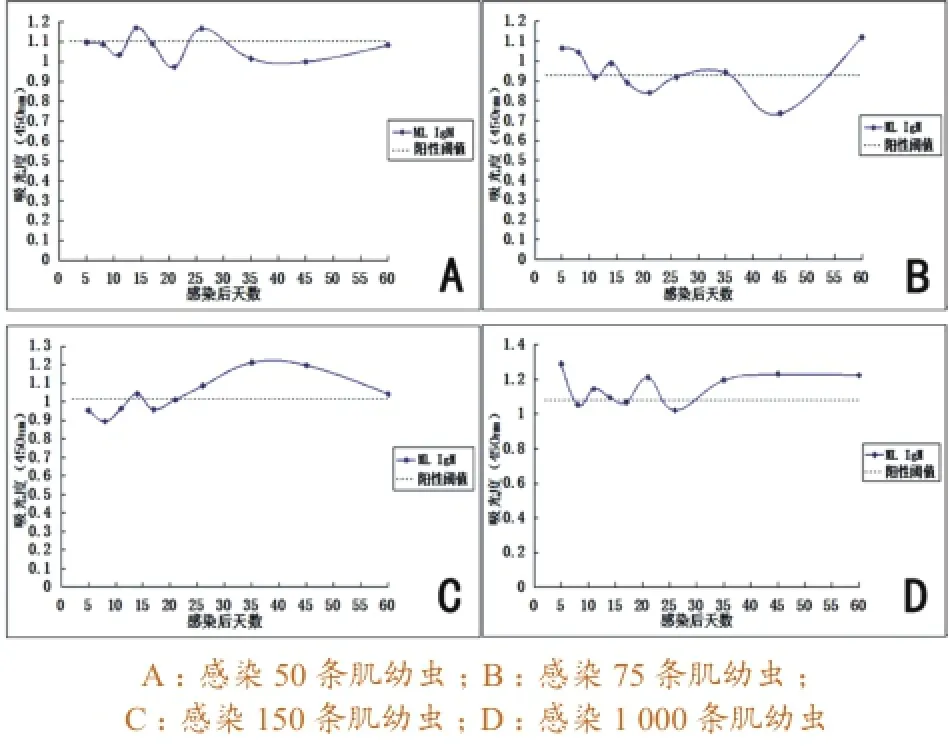
图5 应用ML ES抗原检测猪血清抗旋毛虫IgM抗体
3.2旋毛虫不同剂量感染猪血清中IgG抗体水平分别利用Ad3、Ad6+NBL和ML的ES抗原检测猪感染不同剂量旋毛虫至60天血清中IgG的变化情况。
3.2.1Ad3 ES抗原检测结果。感染50条肌幼虫的猪血清,在感染后第35天血清IgG抗体水平呈阳性,但高峰推测出现在第42天左右,之后下降,但至第60天仍为阳性。感染75条肌幼虫的猪血清,在感染后第35天血清IgG水平接近阳性临界值,第45~60天血清IgG抗体呈阳性,且持续上升。感染150条肌幼虫的猪血清,在感染后第8天和第14天血清IgG抗体接近阳性临界值,第35-60天血清IgG抗体呈阳性,且保持在较高水平。感染1 000条肌幼虫的猪血清,在感染后第26天IgG抗体呈弱阳性,然后缓慢上升,至第60天达到较高的IgG抗体水平。具体变化曲线见图6。
3.2.2Ad6+NBL ES抗原检测结果。感染50条和75条肌幼虫的猪血清,检测结果全部为阴性。感染150条肌幼虫的猪血清,在感染后第45天IgG抗体开始出现阳性,并持续上升,至第60天仍保持在较高的阳性水平。感染1 000条肌幼虫的猪血清,在感染后第35天IgG抗体略高于阳性临界值,然后持续上升,至第60天仍保持在较高的阳性水平。具体变化曲线见图7。

图6 应用Ad3 ES抗原检测猪血清抗旋毛虫IgG抗体

图7 应用Ad6+NBL ES抗原检测猪血清抗旋毛虫IgG抗体
3.2.3ML ES抗原检测结果。感染50条肌幼虫的猪血清,全部为阴性。感染75条肌幼虫的猪血清,在感染后第35天开始检测出IgG抗体阳性,后一直持续到第60天,且呈上升趋势。感染150条肌幼虫的猪血清,在感染后第45天开始出现IgG抗体阳性,并缓慢上升,至第60天仍保持在较高阳性水平。感染1 000条肌幼虫的猪血清,在感染后第35天出现IgG抗体阳性,至第60天仍保持在较高阳性水平,但呈缓慢下降趋势。具体变化曲线见图8。
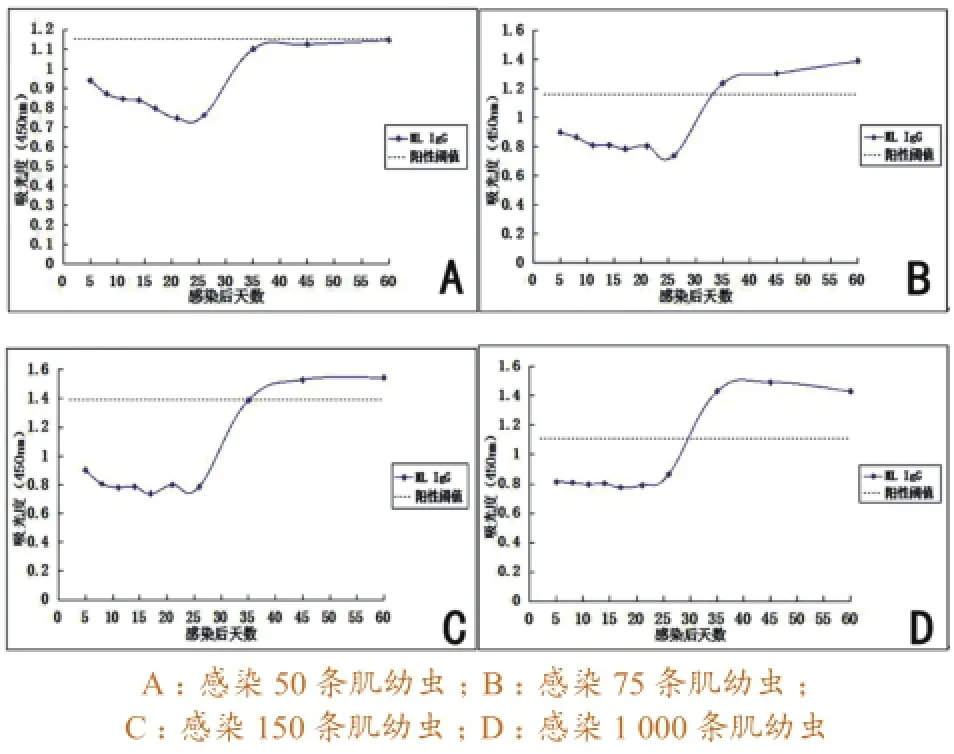
图8 应用ML ES抗原检测猪血清抗旋毛虫IgG抗体
4 讨论
我国是世界上受旋毛虫病危害最为严重的少数几个国家之一。旋毛虫病被列为重要的食源性人兽共患寄生虫病,而且也是进出口肉类、屠宰动物以及我国政府提出的“放心肉”首检和必检的食源性人兽共患病[11-12]。
在单宿主物种中,对于旋毛虫的生活周期而言,主要有ML、Ad、NBL三个抗原阶段[13]。它们表达多种免疫原性蛋白,这些蛋白可引起宿主的保护性反应,并且可用于诊断人和动物感染旋毛虫的诊断。目前研究显示使用SDS-PAGE和免疫印迹法[14-15],已确定旋毛虫ML、Ad和NBL抗原可被实验感染旋毛虫的猪的抗体所识别。
在本实验结束后,对所有感染猪进行剖杀,对每头猪胴体的18个不同部位分别取样(50g)镜检及用消化法检测,结果发现不同部位均存在不同数量的感染虫体,且猪只之间无显著个体差异。此结果表明本研究中的感染实验动物方法与感染剂量准确,实验结果可信。
本研究结果表明:对于低剂量感染(50条)的猪,可应用10 h ES检测感染后第14天和第26天的血清IgM抗体;对于感染75~150条旋毛虫体的猪,应用10 h、30 h和ML ES抗原的混合物进行检测效果较好(可检测出感染后第5~26天的血清IgM抗体);对于感染1 000条旋毛虫体的猪,早期10 h ES抗原除在感染后第5天和第17天外,其余时间均可检测出血清IgM阳性抗体。此研究为解决旋毛虫诊断盲区(感染后第14~19天)提供了重要的参考。而对于IgG检测,应用Ad3 ES抗原检测的效果相对较好。应用ML ES抗原检测血清IgM或IgG抗体水平,其吸光度值均非常高。
因此可利用旋毛虫不同发育时期的分泌物抗原混合物(至少3种ES:10 h、Ad3、ML)来检测旋毛虫感染。对于临床出栏猪的早期检测与诊断,应用10 h ES,以检测血清IgM抗体为主,辅之检测血清IgG抗体(IgG抗体持续时间长,且较稳定),效果较好。感染旋毛虫35天前,可混合应用肠道期10 h的肌幼虫、成虫和肌幼虫的ES抗原(即10 h ES+Ad3 ES+ML ES)来检测血清中的IgM抗体,包括诊断盲区(感染后第15~30天)的检测;感染旋毛虫35天后,混合应用成虫和肌幼虫的ES抗原(即Ad3 ES+ML ES)来检测血清中IgG抗体。由于单一时期的抗原敏感性不足,无法有效应用于旋毛虫的血清学检测,因此结合旋毛虫的生活史及其在宿主体内排泄分泌物的变化情况,需要联合应用至少2种以上抗原来提高检测敏感性,而不同种抗原如何配比检测旋毛虫的感染仍有待于进一步探索和研究。
[1] Pozio E,Zarlenga D S. New pieces of the Trichinella puzzle[J]. International journal for parasitology,2013,43(12/13):983-997.
[2] Pozio E. World distribution of Trichinella spp. infections in animals and humans[J]. Veterinary parasitology,2007,149(1/2):3-21.
[3] Murrell K D,Pozio E.Worldwide occurrence and impact of human trichinellosi,1986-2009[J]. Emerg.Infect.Dis.,2011,17:2194-2202.
[4] 刘明远. 我国的旋毛虫病及最新研究进展[J]. 食品与药品,2005,7(1):11-13.
[5] Gottstein B,Pozio E,Nockler K. Epidemiology,Diagnosis,Treatment,and Control of Trichinellosis[J]. Clin Microbiol Rev.,2009,22(1):127-145.
[6] SAdaow L,Intapan P M,Boonmars T,et al. Susceptibility of laboratory rodents to Trichinella papuae[J]. Korean J Parasitol,2013,51(6):629-632.
[7] 吴秀萍,王迪,李庶东,等. 消化法检验旋毛虫病最适条件的筛选[J].中国动物检疫,2015,32(3):62-65.
[8] Boireau P. Final Report Summary-v2[C]//Pascal Elisabeth Final Reportv2-L,2005.
[9] Kapel C M,Gamble H R. Infectivity,persistence,and antibody response to domestic and sylvatic Trichinella spp. in experimentally infected pigs[J]. Int J Parasitol,2000,30(2):215-221.
[10] 王洁,崔晶,王中全,等. 小鼠实验感染不同种旋毛虫后血清 IgG 抗体水平的变化[J]. 中国病原生物学杂志,2007,2(4):266-268.
[11] Cui J,Wang Z Q. An epidemiological overview of swine trichinellosis in China [J]. Veterinary journal,2011,190(3):323-328.
[12] 陈启军,尹继刚,刘明远. 重视人兽共患寄生虫病的研究[C]//中国畜牧兽医学会,中华预防医学会,中国微生物学会. 第二届全国人畜共患病学术研讨会论文集. 泰州:中国畜牧兽医学会,2008:34-42.
[13] Despommier D D. How does Trichinella spiralis make itself at home?[J]. Parasitology today(Personal ed),1998,14(8):318-323.
[14] Justyna B,WlAdyslaw C,Bozena M. Recognition of antigens of three different stages of the Trichinella spiralis by antibodies from pigs infected with T. spiralis[J]. Experimental Parasitology,2013,134:129-137.
[15] Fu B Q, Li W H, Gai W Y,et al. Detection of anti-Trichinella antibodies in serum of experimentallyinfected swine by immunochromatographic strip[J]. Vet Parasitol,2013,194(2/3/4):125-127. DOI:10.1016/ j.vetpar.2013.01.036.
(责任编辑:朱迪国)
Application Research for Trichinella spiralis Excretory-secretory Antigens from Different Growth Stages in Immunologic Diagnosis
Wu Xiuping1,2,Sun Zhaojin1,2,Zhai Chengcheng1,Liu Xiaolei2,Tang Bin2,Liu Mingyuan2
(1. National Institute of Parasitic Diseases,Chinese Center for Disease Control and Prevention,Laboratory of Parasite and Vector Biology,Ministry of Health,WHO Collaborating Center for Malaria,Schistosomiasis and Filariasis,Shanghai 200025;2. Institute of Zoonoses,Key Laboratory of Zoonoses of Ministry of Education,Jinlin University,Changchun,Jilin 130062)
[Objective]To systematically understand and compare the immunological characters of the Trichinella spiralis excretory-secretory(ES)antigens from different growth stages,so as to explore the serological diagnosis techniques which could be applied to slaughter pigs infected with Trichinella spiralis. [Methods]ES antigens from 10-hour muscle larvae at intestinal stage(10 h ML),30-hour adult at intestinal stage(30 h Ad),3-day adult at adult stage(Ad3),6-day adult and newborn larvae stage(Ad6+NBL),and muscle larvae(ML)of T.spiralis were used as coating antigen,then the serum of infected pigs in different days within two months was collected and the IgM and IgG antibodies against Trichinella were detected by ELISA. At last,dynamical change curves of antibodies were drawn and data analysis was made. [Results] 10 h ML and ML ES antigens could be used to detect the anti-TrichinellaIgM antibodies from serum of pigs injected by different doses within 35 days after infection,low-dose infection can be detected in about 10 days and the high-dose infection in about 5 days,and Ad3 ES antigens could be applied to detect IgM antibodies when the infection dose was high;ES antigens from Ad3 and ML can be used to detect the anti-Trichinella IgG antibodies from serum of pigs injected by different doses over 35 days after infection,it's worth noting that detection effect by Ad3 ES was better than that of ML ES. [Conclusion]The 10 h ML ES,Ad3 ES and ML ES can be used as coating antigens to detect early infection with Trichinella spiralis,Ad3 ES and ML ES antigens can be used to detect Trichinella spiralis infection in slaughter pigs. This study provided reference and theoretical basis for the suffi cient utilization of ES in different stages and for the establishment of a reasonable and effective method towards Trichinella spiralis detection.
Trichinella spiralis;excretory-secretory;pig serum;ELISA
1005-944X(2016)10-0079-07
10.3969/j.issn.1005-944X.2016.10.021
国家自然科学基金(NSFC31030064)
刘明远

