猪瘟兔化弱毒间接免疫荧光鉴定方法的建立
牛成明,姚 静,杨灵芝,杨 琴,马景霞,朱 杰
(1. 山东滨州沃华生物工程有限公司,山东滨州 256606;2. 山东省动物病原微生物工程实验室,山东滨州 256606;3. 滨州出入境检验检疫局,山东滨州 256603;4. 山东滨州市畜牧兽医局,山东滨州 256600)
猪瘟兔化弱毒间接免疫荧光鉴定方法的建立
牛成明1,2,姚静3,杨灵芝1,2,杨琴1,2,马景霞4,朱杰
(1. 山东滨州沃华生物工程有限公司,山东滨州256606;2. 山东省动物病原微生物工程实验室,山东滨州256606;3. 滨州出入境检验检疫局,山东滨州256603;4. 山东滨州市畜牧兽医局,山东滨州256600)
为快速有效测定猪瘟疫苗病毒含量,建立了猪瘟兔化弱毒(HCLV)间接免疫荧光试验(IFA)方法,并与兔体定型热试验方法进行了初步比较。试验结果表明,以冷甲醇固定ST细胞,将所选猪瘟活疫苗检验用阳性血清1∶40倍稀释、荧光二抗1∶32倍稀释时,IFA检测HCLV感染的ST细胞清晰、特异,检测猪伪狂犬病毒、猪流行性腹泻病毒、猪传染性胃肠炎病毒感染细胞阴性。对不同猪瘟疫苗半成品的检测结果显示,IFA测定半数组织感染量(TCID50)与兔体定型热试验测定兔体感染量(RID)具有较好的相关性,其拟合曲线为RID/mL=2.783TCID50/mL +110107.213。
猪瘟兔化弱毒(HCLV);间接免疫荧光试验;兔体感染量
猪瘟是由猪瘟病毒(Classical Swi ne Fever Virus,CSFV)引起的一种急性、高度接触性、致死性疾病,在世界许多国家、地区均有发生,给世界养猪业造成了巨大损失[1-2]。目前,控制和预 防猪瘟的主要手段仍然是疫苗免疫。我国的猪瘟兔化弱毒活疫苗(HCLV)是世界公认的、最好的猪瘟疫苗,对世界猪瘟的预防和控制起到了巨大作用[3]。许多国家和地区利用该疫苗消灭了猪瘟。猪瘟疫苗的质量是决定免疫效果,乃至猪瘟防控成效的关键因素。而疫苗中有效病毒含量,是决定疫苗质量的重要指标。传统的猪瘟疫苗病毒含量的测定方法为兔体定型热试验方法[4]。该法检测成本高、结果可重复性差、检验周期长,易受动物因素制约,且费时、费力,存在一定的局限性。因此,建立一种合理有效、快速准确的猪瘟疫苗检测方法,对于提高疫苗的检验水平,保证疫苗的质量尤为必要。针对上述问题,本研究建立了猪瘟兔化弱毒的间接免疫荧光试验方法(Indirect immunofl uorescence assay,IFA),用于猪瘟疫苗病毒含量的快速测定。
1 材料与方法
1.1材料
猪瘟兔化弱毒细胞毒:本实验室制备,PCR检测无外源病毒污染,-70 ℃保存;猪伪狂犬病毒(PRV Bathar-K61)、猪传染性胃肠炎病毒( TGEV华毒株)、猪流行性腹泻病毒(PEDV CV777):本试验 室扩繁保存;ST细胞:济南劲牛生物科技有限公司惠赠,本试验室扩繁冻存。
猪瘟活疫苗检验用阳性血清:购自中国兽医药品监察所;猪瘟单克隆抗体(A)、猪瘟高免血清(B)、猪 瘟特异性血清(C):本实验室保存;FITC标记兔抗猪IgG荧光二抗:购自Sigma公司, 利用PBS稀释32倍使用;FITC标记羊抗鼠荧光二抗:购自KPL公司,PBS稀释100倍使用;猪瘟专用新生牛血清:购自济南劲牛生物科技有限公司;MEM:购自北京清大天一科技有限公司;胰酶:购自Gibco公司。其它试剂:灭菌PBS、-20 ℃预冷的甲醇、-20 ℃预冷的丙酮等。
1.2猪瘟病毒培养(同步接毒法)
将长满单层的ST细胞消化,按照1∶3比例传代,同时按照1/10接毒剂量同步接毒,置37 ℃5% CO2培养箱,培养72~96 h。单层长满后,将细胞按1∶2比例带毒传代,铺96孔板,同时设不接毒对照,置37 ℃ 5% CO2培养箱,培养72 h。
1.3间接免疫荧光试验(IFA)
将96孔板已接毒ST细胞弃去培养液, PBS洗3次,-20 ℃预冷的有机溶剂2~8 ℃固定25 min,弃去有机溶剂,自然挥干。每孔滴加PBS稀释的猪瘟抗体,45 µL/孔,37 ℃温箱作用50 min,同时设阴性对照(非接毒ST细胞加一抗)、空白对照(接毒ST细胞加PBS)。PBS洗3次,每孔加PBS稀释的FITC标记的荧光二抗,40 µL/孔,37 ℃温箱避光作用40 min。PBS洗3次,荧光显微镜镜检。
1.4IFA试验条件优化
1.4.1不同有机溶剂的选择。参照文 献[5],分别选用-20 ℃预冷的甲醇、丙酮、80%丙酮溶液、6∶4的丙酮乙醇溶液、1∶1的甲醇丙酮溶液,对单层长满的接毒ST细胞4 ℃固定25 min,分别从使用的方便性、固定效果和IFA荧光染色亮度,对有机溶剂的细胞固定效果进行评价。
1.4.2IFA一抗的筛选。选取96孔板接毒ST细胞,按照1.4.1中优选的固定溶剂进行固定。将猪瘟单克隆抗体(A)、猪瘟高免血清(B)、猪瘟特异性血清(C)分别稀释50倍、100倍和50倍,将猪瘟活疫苗检验用阳性血清稀释2 0倍,分别加入到细胞板不同孔中,进行IFA试验,并设PBS空白对照,荧光显微镜下观察结果。
1.4.3猪瘟活疫苗检验用阳性血清最适工作浓度的确定。选取96孔板接毒ST细胞,按照1.4.1中优选的固定溶剂进行固定。将猪瘟阳性血清进行1∶20、1∶40、1∶80、1∶160、1∶320倍稀释,依次加入到细胞培养板,进行IFA试验。荧光二抗的浓度按照说明书,1∶32倍稀释使用。选取荧光清晰明亮的阳性血清最大稀释倍数作为最适工作浓度。同时,设阴性和空白对照。
1.4.4最佳染色时间确定。将长满单层的ST细胞按照1∶2传代,铺6块96孔板,同时按照10 µL/孔接毒剂量同步接毒,并设阴性对照。分别于接毒后24 h、36 h、48 h、60 h、72 h、96 h,对96孔板上ST细胞进行固定,并进行IFA染色,根据荧光斑大小和染色亮度进行结果判定。
1.5IFA特异性试验
1.5.1不同病毒抗原交叉反应试验。将96孔板上单层长至80%的ST细胞接种HCLV,接毒剂量为10 µL/孔;48 h后将未接种HCLV的细胞分别接PRV、TGEV、PEDV,接毒剂量为10 µL/孔,37 ℃ 5% CO2温箱再培养24 h,并设正常细胞对照。然后按照猪瘟阳性血清和FITC标记兔抗猪IgG荧光二抗最适工作浓度进行IFA试验,观察是否存在交叉反应,以确定本方法的特异性。
1.5.2FITC标记兔抗猪IgG荧光二抗特异性试验。按照1.5.1方法进行HCLV培养,以PBS代替猪瘟阳性血清,按照FITC标记兔IgG抗猪荧光二抗最适工作浓度进行IFA试验,并设未加二抗的病毒对照和正常细胞对照,观察有无非特异性荧光产生。1.6 猪瘟疫苗样品毒价测定。利用上述IFA方法,对牛睾丸细胞制备的猪瘟疫苗半成品(PCR检测无外源病毒污染)进行毒价测定,并利用SPSS进行回归分析,建立TCID50与兔体感染量(Rabbit infection dose, RID)之间的线性关系。
2 结果
2.1IFA试验条件优化
2.1.1不同有机溶剂的选择。从细胞固定效果来看,甲醇腐蚀性较小,固定后细胞形态较为完整;从染色亮度来看,甲醇、丙酮和丙酮溶液IFA染色亮度略好于其他有机溶剂;从使用的方便性来看,甲醇较好,且甲醇比丙酮对操作者呼吸道刺激小。综合考虑,选取冷甲醇对细胞进行固定最佳。不同有机溶剂对猪瘟接毒ST细胞的固定效果如图1所示。
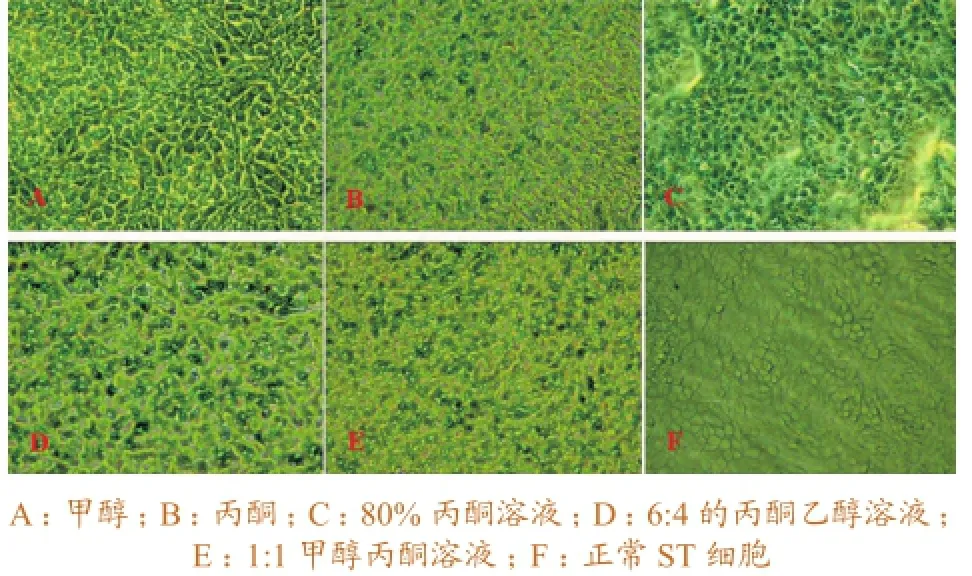
图1 不同有机溶剂对接种猪瘟的ST细胞的固定效果
2.1.2IFA一抗的筛选。镜检结果显示,猪瘟活疫苗检验用阳性血清染色效果较好,胞浆染色明显,细胞形态清晰,荧光亮度较好,其它一抗染色效果则较差。如图2所示。
2.1.3猪瘟活 疫苗检验用阳性血清最适工作浓度的确定。 根据镜检结果,当一抗浓度在1∶20~1∶640时,均可观察到特异性荧光,但荧光亮度从1∶80倍开始逐渐减弱,为保证每次染色效果及试验的可重复性,选取1∶40倍稀释作为一抗最适工作浓度。IFA染色结果如图3所示。
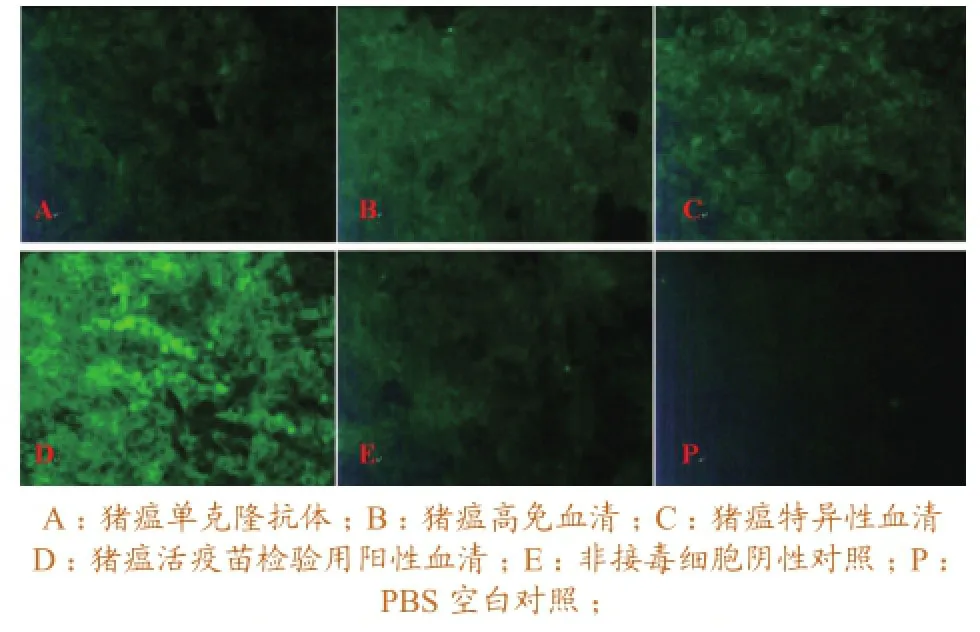
图2 不同一抗IFA染色结果
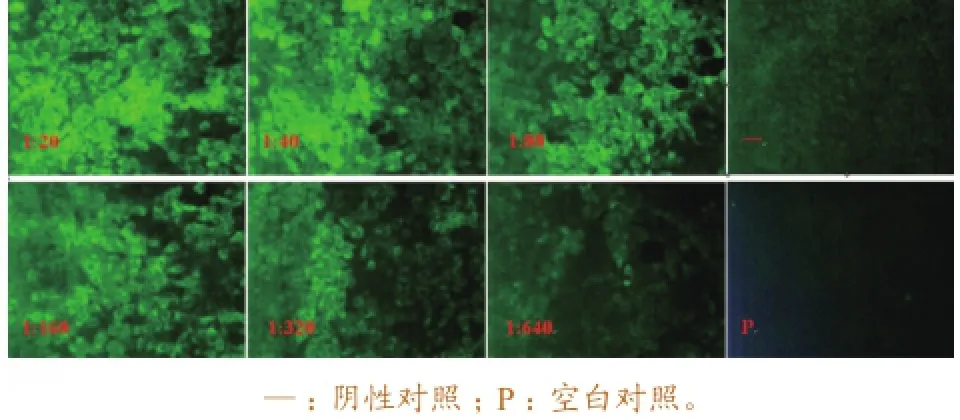
图3 一抗不同稀释倍数IFA染色结果
2.1.4最佳染色时间的确定。根据IFA染色结果,接毒后24 h未见特异性荧光;接毒后36 h、48 h可见较小的特异性荧光斑;接毒后72 h,荧光达到最亮;接毒后96 h,荧光亮度略有下降,且死细胞有所增加。因此,最佳染色时间定在接毒后72~96 h。不同时间IFA染色效果如图4所示。

图4 接猪瘟病毒后不同时间IFA染色结果
2.2IFA特异性试验
2.2.1不同病毒抗原交叉反应试验。镜检结果显示,接种HCLV、PRV、TGEV、PEDV的ST细胞进行IFA,除接种HCLV的ST细胞具有明显特异性的绿色荧光外,接种其他3种病毒的ST细胞均未见特异性荧光染色,表明所建立的HCLV IFA检测方法与其他病毒感染细胞无交叉反应,具有较好的特异性。PRV、TGEV、PEDV感染细胞IFA染色结果如图5所示。

图5 不同病毒接ST细胞IFA染色结果
2.2.2FITC标记兔抗猪IgG荧光二抗特异性试验。镜检结果显示,PBS取代一抗进行IFA试验,无特异性荧光,表明二抗具有较好的特异性。
2.3猪瘟疫苗半成品毒价测定结果。利用所建立的IFA方法,对牛睾丸细胞制备的猪瘟疫苗半成品进行毒价测定,并利用SPSS建立TCID50与RID之间的拟合线性回归方程,R2=0.996,线性关系较好,其数量关系为y=2.783x+110 107.213,即RID/ mL=2.783TCID50/mL +110 107.213具体结果见表1。
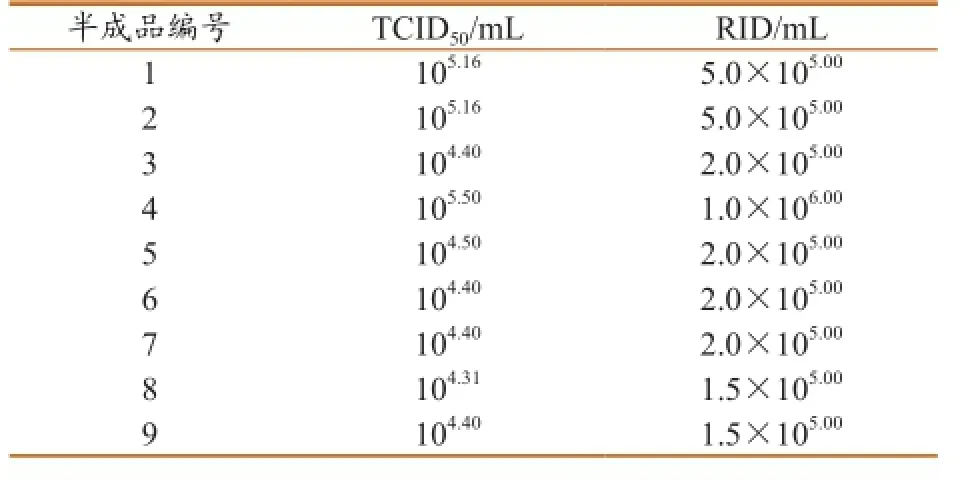
表1 猪瘟疫苗半成品毒价测定结果
3 讨论
猪瘟兔化弱毒疫苗(HCLV)是我国研制的优秀疫苗,是国家猪病防治计划中强制免疫所用疫苗,对于我国猪瘟的防控起着重要作用。目前,商品化的猪瘟疫苗品类较多,包括乳兔组织苗、脾淋苗、细胞苗,并以细胞苗占据主导地位。不同疫苗之间效价差别较大,给猪瘟疫苗质量控制,包括病毒含量测定带来诸多不便。因此,建立猪瘟疫苗的快速检测方法尤为必要。
HCLV在多种细胞上增殖,包括牛睾丸细胞、ST细胞、PK15细胞等,但不引起细胞病变。除传统的RID的方法外,科研人员还建立了其他一些快速检测方法,如RT-PCR方法、实时荧光定量RT-PCR方法[6-7]、ELISA方法[8]等,也进一步探索了这些方法与RID之间的关系,但由于无法反映有效病毒含量,无法有效推广。随着HCLV抗体技术的发展,单克隆抗体、兔源阳性血清等被应用于IFA方法中[9-10]。该方法可检测猪瘟疫苗中有效病毒含量,可重复性好,可替代RID方法,成为HCLV病毒含量测定方法,为进一步控制和提高猪瘟疫苗质量奠定了基础。
本研究建立的IFA方法,进一步明确了细胞固定所用的有机溶剂,并且所选一抗为疫苗检验用标准阳性血清,具有 标准的制备方法,可进一步降低检测费用。在以PCR方法进行特异性检测的同时,利用 该法对商品化猪瘟疫苗进行病毒含量的测定,与RID效价具有较好的线性关系,为该方法的应用进一步奠定了基础。
[1] 斯特劳,阿莱尔,蒙家林,等. 猪病学[M]. 赵德明,张仲秋,沈建忠,等译. 9版. 北京:中国农业大学出版社,2008.
[2] Edwards S,Fukusho A,Lefèvre P C,et al. Classical swine fever: the global situation [J]. Vet Microbiol, 2000,73(2/3):103-119.
[3] 仇华吉,童光志,沈荣显. 猪瘟兔化弱毒疫苗——半个世纪的回顾[J]. 中国农业科学,2005(8):1675-1685.
[4] 中国兽药典委员会.中华人民共和国兽药典:2010年版三部[M]. 北京:中国农业出版社,2010.
[5] 崔尚金,全滟平,李曦,等. 猪圆环病毒间接免疫荧光方法的建立[J].中国预防兽医学报,2007(1):63-66.
[6] 邓力,张彦明,李维维,等. 猪瘟兔化弱毒荧光定量PCR检测方法的建立及初步应用[J].西北农林科技大学学报(自然科学版),2011(2):1-8.
[7] 葛叶,张兴娟,朱庆虎,等. 荧光定量RT-PCR方法与兔体定型热试验对于检测猪瘟兔化弱毒疫苗的平行关系[J]. 中国预防兽医学报,2011(9):699-703.
[8] 唐红慧,杜希珍,刘大伟,等. 应用猪瘟抗原/血清ELISA测定猪瘟兔化弱毒疫苗中的病毒含量[J]. 金陵科技学院学报,2010(4):73-78.
[9] 李晶梅,朱薇,秦红刚,等. IFA和IPMA方法测定猪瘟兔化弱毒病毒含量[J]. 中国兽药杂志,2013(10):35-38.
[10] 戴志红,蒋卉,李翠,等. 用间接免疫荧光检测方法评价猪瘟兔化弱毒活疫苗效力的研究[J]. 中国兽药杂志,2014(1)34-37.
(责任编辑:朱迪国)
Establishment of an Indirect Immunofl uorescence Assay for HCLV Titer Detection
Niu Chengming1,2,Yao Jing3,Yang Lingzhi1,2,Yang Qin1,2,Ma Jingxia4,Zhu Jie
(1. Shandong Binzhou Wohua Biotech Co.,Ltd.,Binzhou,Shandong 256606;2. Shandong Engineering Laboratory of Animal Pathogenic Microbiology,Binzhou,Shandong 256606;3. Binzhou Entry-exit Inspection and Quarantine Bureau,Binzhou,Shandong 256603;4. Binzhou Animal Husbandry and Veterinary Bureau,Binzhou,Shandong 256600)
An indirect immunofluorescence assay(IFA)was developed for detecting HCLV titer rapidly and effectively by using the positive serum of classical swine fever(CSF)as the first antibody and the fluorescein isothiocyanated(FITC)labeled rabbit anti-pig IgG as the second antibody. Results showed the optimum working concentration of the fi rst antibody was 1∶40,and the dilution ratio of second antibody was 1∶32. The IFA displayed clear and specifi c fl uorescence in ST cells inoculated with hog cholera lapinized virus(HCLV)utilizing the above mentioned method,while negative results were obtained in ST cells inoculated with pseudorabies virus (PRV),porcine epidemic diarrhea virus(PEDV)and transmissible gastroenteritis virus(TGEV). Detection for different CSF semi-finished vaccines showed good correlation between Rabbit infection dose(RID)tested with rabbits and 50% tissue culture infective dose(TCID50)tested with IFA,and the fitted curve was RID/mL=2.783TCID50/ mL+110107.213.
hog cholera lapinized virus(HCLV);indirect immunofl uorescence assay;rabbit infection dose
S851.3
B
1005-944X(2016)10-0086-04
10.3969/j.issn.1005-944X.2016.10.022

