探究胶质纤维酸性蛋白在6-OHDA大鼠胃体中的表达变化
任沁展 郑丽飞 刘 玮 朱进霞
(首都医科大学基础医学院生理学与病理生理学系, 北京 100069)
· 基础研究 ·
探究胶质纤维酸性蛋白在6-OHDA大鼠胃体中的表达变化
任沁展郑丽飞*刘玮朱进霞
(首都医科大学基础医学院生理学与病理生理学系, 北京 100069)
目的 研究胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)在6-羟多巴(6-hydroxydopamine, 6-OHDA)大鼠胃体中的表达变化情况,探讨神经胶质细胞在帕金森病(Parkinson’s disease, PD)胃轻瘫中的作用机制。方法用6-OHDA 损毁大鼠中枢黑质多巴胺能神经元,建立PD模型。采用免疫荧光法检测酪氨酸羟化酶(tyrosine hydroxylase, TH)免疫阳性神经元在黑质的分布,并用同样的方法检测GFAP和神经微丝蛋白(neurofilament, NF)在大鼠胃体肌层的分布情况,采用蛋白免疫印记法(Western blotting)检测GFAP在6-OHDA模型大鼠胃体的表达情况。结果6-OHDA大鼠黑质内神经元大量丢失,并伴有TH免疫反应性明显降低;6-OHDA大鼠胃体肌层GFAP和NF免疫反应性下降;Western blotting结果显示6-OHDA模型大鼠胃体肌层GFAP蛋白下调。结论6-OHDA模型大鼠胃部GFAP和NF表达降低,可能参与了胃轻瘫发病的过程,本研究可能为PD患者胃轻瘫防治提供新的思路。
6-羟多巴大鼠;胶质纤维酸性蛋白;神经微丝蛋白
帕金森病(Parkinson’s disease, PD)是一种常见的神经退行性疾病。PD患者常伴有胃肠功能障碍[1],如胃轻瘫等,并且对某些患者来说,胃肠功能障碍已经成为PD的主要症状。但其发病机制尚不清楚。最近研究[2-3]显示,PD患者的黏膜和黏膜下神经丛中肠神经胶质细胞中胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)的蛋白和mRNA水平较高,这提示肠神经胶质细胞与PD有着紧密的联系。
GFAP是星形胶质细胞的特异性标志物,而肠神经胶质细胞与星形胶质细胞相似,GFAP也是肠神经胶质细胞的特异性标志物[4]。肠神经胶质细胞作为肠神经系统重要的组成部分,能够分泌神经营养因子营养神经元,并维持神经元的生理特性和功能。相关研究报道,在一些神经退行性疾病中,神经胶质细胞的改变参与了疾病的调节[5],GFAP的表达和修饰也发生了变化,如在PD患者的结肠活检中发现GFAP高表达,而GFAP的磷酸化则在PD组较对照组低[6]。将6-羟多巴(6-hydroxydopamine,6-OHDA)微量注射到大鼠双侧黑质内制备的6-OHDA PD大鼠模型出现胃轻瘫的症状,其胃部肠神经系统也出现了改变,如胆碱能神经元和一氧化氮能神经元的递质或标志物减少、多巴胺能神经元的递质增加[7],而肠神经胶质细胞出现什么变化尚不清楚。因此,本实验为了揭示肠神经胶质细胞在PD胃轻瘫发病中的作用,通过免疫荧光和蛋白印记的方法检测了GFAP在6-OHDA大鼠胃部的情况。
1 材料与方法
1.16-OHDA处理PD模型大鼠的制备
取SPF级雄性SD大鼠20只(首都医科大学实验动物部提供),实验动物许可证号:SCXK(京)2015-0001。体质量为210~250 g,按照实验动物福利许可经实验动物委员会批准,动物在室温条件下,正常昼夜更替光照,食水24 h供应,采用数字表法将其随机分为实验组和对照组,对照组大鼠9只,6-OHDA处理组11只。
腹腔注射10%(质量分数)水合氯醛(0.4 g/kg)进行麻醉,将大鼠头部固定于立体定位仪上,按照大鼠脑立体定位图谱进行定位双侧黑质位置,黑质的坐标:前囟后5.6 mm(AP=-5.6 mm),旁开±2.0 mm(ML=±2 mm),深度7.5 mm(DV=-7.5 mm),用微量注射器每侧匀速注入6-OHDA[2 μg/μL,含0.2%(质量分数)抗坏血酸,美国Sigma公司]2 μL。对照组大鼠实验方法同上,每侧黑质注射无菌0.9%(质量分数)氯化钠注射液2 μL[含0.2%(质量分数)抗坏血酸]。饲养4周后,模型建立并取材。
1.2免疫组织化学测定脑组织和胃组织
脑组织取材:将动物用10%(质量分数)水合氯醛麻醉后,经左心先灌流37 ℃的0.9%(质量分数)氯化钠注射液300 mL,之后用250 mL 4%(质量分数)多聚甲醛进行灌流固定,完成后开颅取出全脑,将脑组织浸泡于4 ℃ 4%(质量分数)多聚甲醛溶液中后固定12 h,之后将组织浸泡于15%(质量分数)蔗糖溶液和30%(质量分数)蔗糖溶液中,对脑组织进行梯度脱水。
胃取材:将大鼠脱臼处死后取出新鲜胃体,用OCT包埋剂包埋,放入液氮中快速冷冻。
大鼠的脑组织梯度脱水后,取出组织块,用OCT包埋,在 Leica 冰冻切片机中进行大脑黑质切片,切片厚度为20 μm,脑片漂片于磷酸盐缓冲液(phosphate buffered solution-tween 20, PBST)溶液液面上,用多聚赖氨酸处理的载玻片捞取,用小毛笔轻轻铺平,过夜晾干。将贴有脑片的载玻片放入柠檬酸盐缓冲液中进行微波抗原修复,自然冷却至室温。用PBST缓冲液洗片3×10 min。用5%(体积分数)马血清封闭30 min,弃掉封闭血清,孵抗酪氨酸羟化酶(tyrosine hydroxylase, TH)的一抗(小鼠抗大鼠,1∶5 000,美国Sigma公司),4 ℃过夜。弃去一抗,用PBST清洗3×10 min。滴加二抗(驴抗小鼠,美国Invitrogen公司),孵育2 h后滴加4,6-二脒基-2-苯基吲哚(4,6-diamino-2-phenyl indole, DAPI)避光孵育5 min,吸去标记液,用PBS洗片3×5 min,用甘油封片。在荧光显微镜(ECLIPSE Ni-U, 日本Nikon公司)下观察并拍照。
取胃体组织包块,用冰冻切片机切片,厚度为 7 μm,并将其平整的黏附在用多聚赖氨酸处理的载玻片上,室温过夜。组织干燥后置于染缸中,倒入冷丙酮,固定10 min,接着用PBST清洗组织4次,每次10 min。取5%(体积分数)的马血清孵育30 min(湿盒中)。完成后甩掉封闭血清,加入一抗神经微丝蛋白(neurofilament, NF)(1∶500,美国Novus公司)、GFAP(1∶400,美国Santa公司)进行双标,4 ℃过夜孵育。次日取出组织切片,甩掉一抗,用PBST洗4次,每次10 min。滴加二抗(驴抗小鼠、驴抗兔,美国Invitrogen公司),孵育2 h后滴加DAPI,10 min后PBS洗片4次,甘油封片。在荧光显微镜下观察并拍摄。
1.3蛋白印记(Western blotting)法测定胃组织
收集新鲜胃组织,沿肠系膜剪开并用Kreb液将胃内容物冲洗干净。在解剖显微镜下将胃体组织黏膜面朝下用小针固定,用精细的镊子将胃的黏膜层和肌层分开。剪取胃体肌层组织30~50 mg,加入300 μL蛋白裂解液于离心管中。机械研磨直至组织粉碎,进一步用超声震荡仪超声破碎。4 ℃,12 000 r/min,离心30 min。小心吸出上清移液,移入另一离心管中,弃去沉淀。用二辛可酸(bicinchoninic, BCA)法进行蛋白定量。配制10%(质量分数)浓缩胶和5%(质量分数)分离胶,在电泳槽中倒入电泳缓冲液,将上样蛋白与5×上样缓冲液混匀,95 ℃水浴5 min变性,在每个加样孔中加入100 μg蛋白样品,进行电泳,将电压调到80 V使溴酚蓝跑到分离胶时,再换成120 V直至溴酚蓝到达分离胶底部。取出凝胶进行转膜,恒电流状态下转膜,295 mA, 90 min,取出转有总蛋白的硝酸纤维素膜,Tris-HCl 缓冲盐溶液(tris-buffered saline, TBS)洗5 min,用含10%(质量分数)脱脂奶粉Tris-HCl 盐缓冲液(tris-buffered saline and tween 20, TBST)溶液室温封闭1 h,加入一抗(GFAP,1∶5 000,美国Santa公司),4 ℃孵育过夜。第二日取出后室温轻摇30 min,TBST洗膜3次,每次10 min,加入绿色荧光标记二抗(1∶10 000,美国Rockland公司),室温轻摇2 h,TBST洗膜3次,每次10 min,然后用TBS洗膜1次,10 min。最后用Odyssey红外成像仪扫描成像,并用Odyssey软件进行结果分析。
1.4统计学方法

2 结果
2.1大鼠黑质部位注射6-OHDA的帕金森动物模型鉴定
在多巴胺的合成过程中,TH是限速酶,所以TH可以作为多巴胺能神经元的标志物。从免疫荧光的染色结果(图1A和1B)来看,6-OHDA模型鼠黑质部位的TH免疫阳性神经元(红色)的数量和荧光强度明显低于对照组,表明6-OHDA大鼠黑质部位的多巴胺能神经元数量减少。提示6-OHDA处理的PD大鼠模型造模成功。
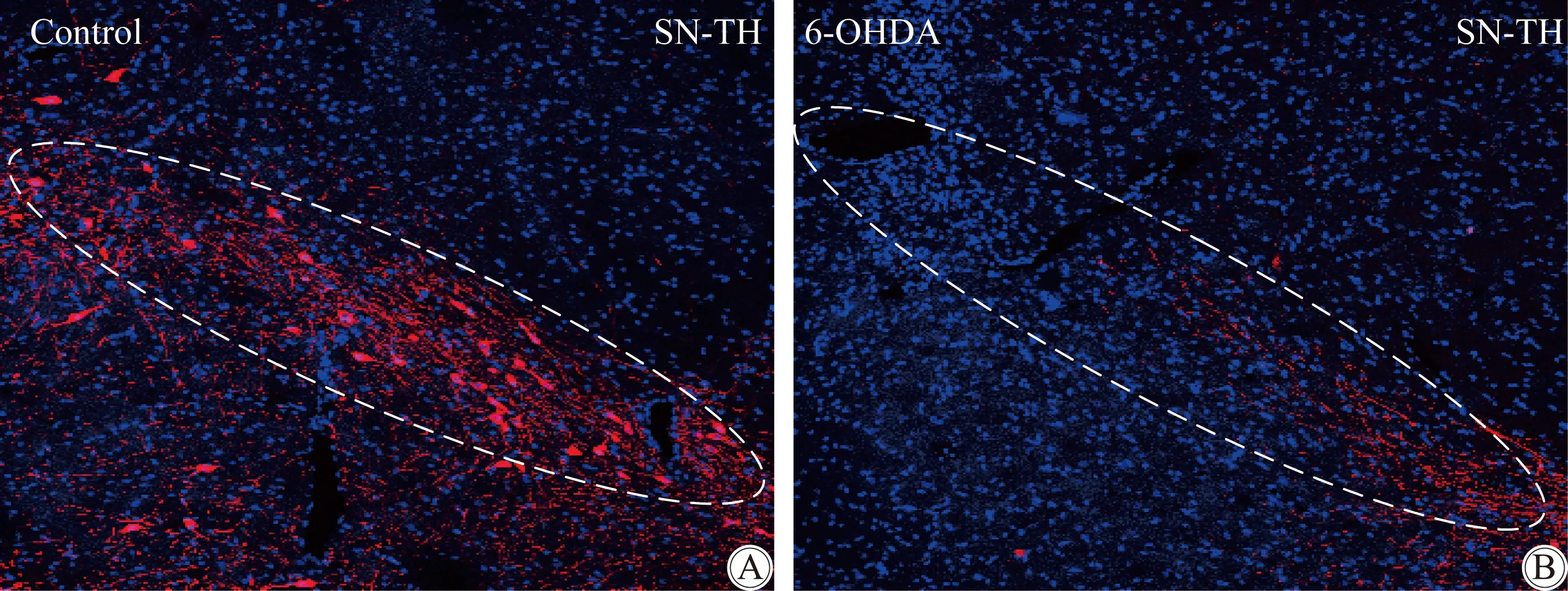
图1 酪氨酸羟化酶免疫阳性神经元在大鼠黑质致密部的分布情况
Dashed ovals show images of TH-immunoreactive neurons (red) in SN pars compacta in control (A) and 6-OHDA (B) rats. Nuclei (blue) are stained by 4′,6-diamidino-2-phenylindole (DAPI). 6-OHDA:6-hydroxydopamine;scale bars: 200 μm.
2.2GFAP和NF在PD组和对照组大鼠胃体肌间神经丛中的分布情况
为了明确肠神经胶质细胞在胃体肌层的分布情况,采用免疫组织化学的方法进行了形态学的观察。GFAP是肠神经胶质细胞的特异性标志物,NF是神经元的标志物。结果显示在对照组及6-OHDA大鼠的胃体肌间神经丛中GFAP(绿色)和NF均呈现免疫阳性(红色),并且GFAP标记的肠神经胶质细胞包绕在NF标记的神经元周围。与对照组相比,6-OHDA大鼠胃体肌间神经丛中GFAP和NF免疫阳性细胞的数量和荧光强度都低于对照组(图2)。
2.3GFAP在PD组和对照组大鼠胃体肌间神经丛中的蛋白表达差异
为了明确肠神经胶质细胞在6-OHDA大鼠胃体肌层的变化情况,进一步采用Western blotting的方法检测了胃体肌层中GFAP的蛋白,GFAP的表达以3-磷酸甘油醛脱氢酶(glyceraldehyde-3 phasparc dehydrogenase,GAPDH)作为内参,并以比值的形式表示。结果显示6-OHDA大鼠组GFAP蛋白(0.14±0.03,n=4)较对照组(0.20±0.03,n=4)有明显的下调,差异具有统计学意义(P<0.01),详见图3。
3 讨论
本实验通过用6-OHDA损毁黑质部位多巴胺能神经元制备的PD大鼠模型,观察到6-OHDA大鼠较正常对照组大鼠胃体肌间神经丛中GFAP和NF的表达量下降。
在本实验中,6-OHDA损毁了黑质部位的多巴胺能神经细胞,标志着动物模型造模成功。本实验室之前的研究[8]显示,6-OHDA大鼠较正常对照组的大鼠会有胃轻瘫的表现如胃动力减弱、胃排空延迟等。在本实验中,GFAP作为神经胶质细胞的标志物,在PD大鼠胃体肌层中表达较正常对照组低,提示在PD大鼠胃体中神经胶质细胞的数量和功能可能出现降低。作为神经元的标志物,NF在PD大鼠胃体中的表达也较对照组低。近年来研究[9]显示神经营养因子在肠神经系统的形成过程中有着重要的作用。神经胶质细胞可以通过释放神经营养因子如胶质源性的神经生长因子(line-derivednervegrowthfactor,GDNF)、神经生长因子(nervegrowthfactor,NGF)、脑源性神经营养因子(brain-derivedneurotrophicfactor,BDNF)[10]和神经营养因子3(neurotrophin-3,NT-3),能够诱导胚胎时期的神经嵴细胞的分化、增生,形成完善的肠神经系统[11-12],其中NT-3还能促进神经细胞轴突的生长[12-13],促进神经传导功能的修复[14],这些研究提示神经胶质细胞具有营养神经元,维持神经元的生理特性和功能。GDNF和NT-3还能维持和促进神经元存活、分化、再生,为神经元的生长提供良好的微环境[15],GDNF还对修复损伤的神经元有营养和保护作用[16]。更加值得注意的一点是NT-3与迷走神经还有交互作用[17]。而在6-OHDA大鼠胃部由于神经营养因子的减少,可能引起神经元出现结构和功能的异常。肠神经系统在胃动力调控中起着至关重要的作用,其结构和功能的异常将会引起胃动力障碍[18],具体机制还有待进行进一步研究[19-20]。

图2 神经胶质酸性蛋白和神经微丝在大鼠胃体肌间神经丛中的分布情况
GFAP-immunoreactivity (green) and NF-immunoreactivity (red) were showed in gastric myenteric plexus of control (A,B,C) and 6-OHDA (D,E,F).C:merged image of A and B;F:merged image of D and E; 6-OHDA:6-hydroxydopamine; scale bars: 20 μm.

图3 神经胶质酸性蛋白在对照组和6-OHDA组大鼠胃体肌层的表达差异
A: GFAP protein level was detected from gastric muscular externa of control and 6-OHDA rats by Western blotting. Glyceraldehyde-3-phosphate dehydrogenase (GAPDH) was used as an internal reference.B: Compared to control, GFAP protein expression was significantly reduced in gastric muscular externa of 6-OHDA rats (**P<0.01vscontrol,n=4).6-OHDA:6-hydroxydopamine.
有研究[2]显示,PD患者中胃肠道中的炎性反应因子前体与GFAP和另一种神经胶质细胞的标志物Sox-10的表达有非常强的相关性,胶质细胞的增生或反应增强可能是PD的始动因素[5,21],PD患者的结肠活检中也发现GFAP的表达上调,高度怀疑是神经胶质细胞反应性增生。这些研究结果提示,在PD患者起病时,肠神经胶质细胞反应性增生,被激活后释放细胞因子产生炎性反应,造成PD。但随着PD的发展,肠神经胶质细胞可能会像中枢神经系统的小胶质细胞一样[22]出现反应下降,进而导致GFAP阳性细胞数量的减少或功能的减退,从而影响到肠神经系统及胃动力。
综上所述,6-OHDA处理模型大鼠胃部GFAP和NF的降低可能参与到了胃轻瘫发病的过程,本研究可能为PD患者胃轻瘫防治提供新的思路。
[1]PfeifferRF.GastrointestinaldysfunctioninParkinson’sdisease[J].ParkinsonismRelatDirsord, 2011, 17(1): 10-15.
[2]Devos D, Lebouvier T, Lardeux B,et al.Colonic inflammation in Parkinson’s disease[J].Neurobiol Dis, 2013, 50: 42-48.
[3]Clairembault T, Kamphuis W, Leclair-Visonneau L,et al. Enteric GFAP expression and phosphorylation in Parkinson’s disease[J].J Neurochem, 2014, 130(6): 805-815.
[4]Neunlist M, Rolli-Derkinderen M, Latorre R,et al.Enteric glial cells: recent developments and future directions[J].Gastroenterology, 2014, 147(6): 1230-1237.
[5]Clairembault T, Leclair-Visonneau L, Neunlist M,et al. Enteric glial cells: new players in parkinson’s disease?[J].Mov Disord, 2015, 30(4): 494-498.
[6]Clairembault T, Kamphuis W, Leclair-Visonneau L,et al.Enteric GFAP expression and phosphorylation in Parkinson’s disease[J].J Neurochem, 2014, 130(6): 805-815.
[7]Tian Y M, Chen X, Luo D Z,et al.Alteration of dopaminergic markers in gastrointestinal tract of different rodent models of Parkinson’s disease[J].Neuroscience, 2008, 153(3): 634-644.
[8]Zheng L F, Song J, Fan R F,et al.The role of the vagal pathway and gastric dopamine in the gastroparesis of rats after a 6-hydroxydopamine microinjection in the substantia nigra[J].Acta Physiol, 2014, 211(2): 434-446.
[9]von Boyen G B, Reinshagen M, Steinkamp M,et al.Enteric nervous plasticity and development: dependence on neurotrophic factors[J].J Gastroenterol, 2002, 37(8): 583-588.
[10]Mele T, Juric D M.Metrifonate, like acetylcholine, up-regulates neurotrophic activity of cultured rat astrocytes[J].Pharmacol Rep, 2014, 66(4): 618-623.
[11]Rodrigues D M, Li A Y, Nair D G,et al.Glial cell line-derived neurotrophic factor is a key neurotrophin in the postnatal enteric nervous system[J].Neurogastroenterol Motil, 2011, 23(2): e44-e56.
[12]Chalazonitis A, Rothman T P, Chen J,et al.Neurotrophin-3 induces neural crest-derived cells from fetal rat gut to develop in vitro as neurons or glia[J].J Neurosci, 1994, 14(11 Pt 1): 6571-6584.
[13]毕建清, 姚远, 文铁桥.神经营养因子NT-3神经干细胞移植对帕金森病大鼠功能修复研究[J].科技导报, 2009, 27(14): 48-53.
[14]郭家松, 曾园山, 李海标,等.神经干细胞与NT-3基因修饰雪旺细胞联合移植促进全横断脊髓损伤大鼠功能修复的实验研究[J].中国康复医学杂志, 2005, 20(5): 323-326.
[15]王旭阳, 江敦清, 陈世文,等.封闭内源性NT-3在脊髓损伤后期神经元有髓神经纤维出芽中的作用[J].山东大学学报:医学版, 2014, 52(12): 5-9.
[16]陈琳, 戴建国, 王中立,等.脑内胶质细胞源性神经营养因子及其受体复合物研究进展[J].中国药理学通报, 2013, 29(3): 315-318.
[17]Fox E A, Biddinger J E, Baquet Z C,et al.Loss of neurotrophin-3 from smooth muscle disrupts vagal gastrointestinal afferent signaling and satiation[J]. Am J Physiol Regul Integr Comp Physiol, 2013, 305(11): R1307-R1322.
[18]Lake J I, Heuckeroth R O. Enteric nervous system development: migration, differentiation, and disease[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 305(1): G1-G24.
[19]史小翠,冯小燕,宋然,等. 帕金森大鼠消化道组织中蛋白质NHERF家庭和CAL的表达变化[J].首都医科大学学报,2013,34(2):232-238.
[20]李颖,黄英,王大佳,等. Sox10和EDNRB在人胚胎肠神经系统发育中的表达[J]中国医科大学学报,2014,43(3):243-246.
[21]Burda J E, Sofroniew M V. Reactive gliosis and the multicellular response to CNS damage and disease[J].Neuron, 2014, 81(2): 229-248.
[22]Gerhard A, Pavese N, Hotton G,et al. In vivo imaging of microglial activation with [11C](R)-PK11195 PET in idiopathic Parkinson’s disease[J].Neurobiol Dis, 2006, 21(2): 404-412.
编辑孙超渊
, E-mail:13581582937@163.com
The expression of glial fibrillary acidic protein in gastric corpus of 6-OHDA rats
Ren Qinzhan, Zheng Lifei*, Liu Wei, Zhu Jinxia
(DepartmentofPhysiologyandPathophysiology,SchoolofBasicMedicalSciences,CapitalMedicalUniversity,Beijing100069,China)
ObjectiveTo study the glial fibrillary acidic protein (GFAP) expression in gastric corpus of 6-hydroxydopamine (6-OHDA) treated rats and explore the underlying mechanism of enteric glial cells in gastroparesis of Parkinson’s disease (PD). Methods6-OHDA PD rat model was made by microinjecting 6-OHDA into bilateral substantia nigra. Immunofluorescence was used to observe the distribution of tyrosine hydroxylase (TH) immunoreactive (IR) neurons in the substantia nigra and the expression of GFAP and neurofilament (NF) in gastric corpus of 6-OHDA rats. Western blotting was applied to detect the expression of GFAP and NF in gastric corpus of 6-OHDA rats. ResultsIn rats treated with 6-OHDA, the number of TH-IR neurons in the substantia nigra was significantly reduced; Immunofluorescence results showed that both GFAP and NF expression were distinctly decreased in gastric corpus of 6-OHDA rats; Compared with the control rats, the protein level of GFAP was significantly decreased in gastric corpus of 6-OHDA rats by Western blotting. ConclusionThe results suggest that decrease of NF and GFAP in gastric corpus may play a role in the course of gastroparesis of 6-OHDA rats, which may provide a new idea for prevention of gastroparesis in PD.
6-hydroxydopamine rats; glial fibrillary acidic protein; neurofilament
国家自然科学基金(81170346,81370482,31400991),北京市自然科学基金(7121003, 7132017),北京市属高等学校创新团队建设与教师职业发展计划项目(IDHT20140514),首都医科大学基础临床科研合作课题(14JL14)。This study was supported by National Natural Science Foundation of China (81170346, 81370482, 31400991), Natural Science Foundation of Beijing (7121003, 7132017), Project of Construction of Innovative Teams and Teacher Career Development for Universities and Colleges Under Beijing Municipality (IDHT20140514) and Basic-Clinical Scientific Research Cooperation Project of Capital Medical University (14JL14).
时间:2016-10-1610∶57
http://www.cnki.net/kcms/detail/11.3662.R.20161016.1057.020.html
10.3969/j.issn.1006-7795.2016.05.011]
R 363
2015-12-18)

