皇菊花发育过程中挥发油化学成分及其抗氧化活性的研究
胡文杰 许樟润 鲁思情 刘思敏 曾建军
(井冈山大学生命科学学院,吉安 343009)
皇菊花发育过程中挥发油化学成分及其抗氧化活性的研究
胡文杰 许樟润 鲁思情 刘思敏 曾建军*
(井冈山大学生命科学学院,吉安 343009)
通过气相色谱-质谱联用技术鉴定分析了皇菊花发育过程中的挥发油成分,以峰面积归一化法进行了定量分析,同时运用紫外分光光度计测定其对DPPH自由基清除能力。结果表明:皇菊花在不同发育时期的挥发油成分及含量差异明显,现蕾期、初绽期、盛花期和末花期分别鉴定出40、43、45和35种化学成分,共鉴定出67种化学成分,包括烯烃类(36种)、醇类(18种)、酮类(2种)、酯类(4种)、醛类(3种)及氧化物类(4种)化合物,他们之间的共有成分有22种,特有成分现蕾期(5种)、初绽期(6种)、盛花期(8种)和末花期(5种)。4个不同发育时期的烯烃类、醇类、酮类和酯类化合物的含量均较高,是主要的挥发油成分,但化合物种类和含量存在较大差异;皇菊花挥发油对DPPH自由基的清除能力强于Vc,其清除自由基的能力显示出良好的抗氧化活性。
皇菊;发育阶段;挥发油;气相色谱—质谱联用仪;抗氧化活性
皇菊为菊科(Asteraceae)植物菊(ChrysanthemummorifoliumRamat.)的干燥头状花序,在我国大部分地区广泛分布,具有“散风清热,平肝明目”的功效,临床用于治疗冠心病和高血压[1]。皇菊按照花瓣颜色分类属于黄菊的一种,是我国传统的常用中药材和保健茶之一,主要以头状花序供药用。据文献记载,皇菊具有散风清热、清肝明目和解毒消炎等作用,对口干、火旺、目涩,或由风、寒、湿引起的肢体疼痛、麻木的疾病均有一定的疗效[2]。目前,有关皇菊的研究报道非常少,仅见其有效成分分析[2]、繁育[3]和挥发油[4]方面,但现有挥发油的研究尚未从皇菊花发育过程中挥发油的化学成分及含量方面进行系统的比较分析。为了能够更好地了解和研究皇菊花发育过程中的挥发油主成分及含量,开发其实用价值,本文采用水蒸气蒸馏法提取皇菊花发育过程中的挥发油,通过气相色谱—质谱联用技术对其化学成分进行研究,并分析了其挥发油的抗氧化活性,旨在为该药用植物挥发油的开发利用提供参考。
1 材料与方法
1.1 材料
皇菊采自井冈山大学生物园。在开花期间,于晴朗、光照良好的上午采集皇菊植株上自然开放的鲜花。根据花蕾张开程度,把皇菊花发育过程大致分为4个时期:即现蕾期(肉眼可见花蕾)、初绽期(舌状花展开2~3层)、盛花期(外轮花瓣完全展开)和末花期。这4个时期的鲜花采摘后立即带回实验室;C8~C40正构烷烃。
1.2 方法
1.2.1 挥发油提取
精确称取上述各时期的样品各200 g,采用水蒸气蒸馏法提取其挥发油,收集挥发油,分别密封避光冷藏备用。
1.2.2 GC-MS分析
色谱条件:色谱柱为Elite-5 MS,石英毛细管柱(30 m×0.25 mm×0.25 μm);升温程序为:起始温度50℃,5 min,以3℃·min-1升至140℃,再以10℃·min-1升至260℃保持10 min;载气为高纯He(φ1=99.999%),柱前压为50 kPa;载气流量为1.0 mL·min-1,分流比10∶1,进样量0.5 μL。
质谱条件:电子轰击(EI)离子源;离子源温度180℃,接口温度:260℃,扫描范围(m/z)50-620。
1.2.3皇菊花挥发油对DPPH自由基清除作用的测定
吸取一定量皇菊花的挥发油,用丙酮稀释至体积分数为0.20;分别取稀释好的挥发油20、40、60、80和100 μL置于5只试管,样品体积少于100 μL试管以丙酮补至100 μL,配置成样品质量浓度梯度分别为0.002、0.004、0.006、0.008、0.010 μg·μL-1的溶液,再分别加入4 mL 24 μmol·mL-1的DPPH乙醇(95%)溶液,混合,避光2 h,在波长517 nm处测吸光度(Ai),以不加样品的DPPH乙醇液为对照,测定对照组的吸光度为(A0),平行3次,取其平均值;以0.1 g·L-1Vc为对照,按照上述同样的方法测定其对DPPH自由基的清除率:
清除率=(1-Ai/A0)×100%
(1)
2 结果与分析
2.1 皇菊花不同时期出油率(质量分数)
皇菊花发育过程中4个时期出油率(质量分数)有所差异,现蕾期0.18%、初绽期0.37%、盛花期0.55%和末花期0.33%。各个时期出油率的大小排序为:盛花期>初绽期>末花期>现蕾期。若以出油率为选择标准,皇菊花的最佳采收时间为盛花期,这一结果可为皇菊原料采集时间提供重要参考依据。
2.2 皇菊花不同时期挥发油化学成分
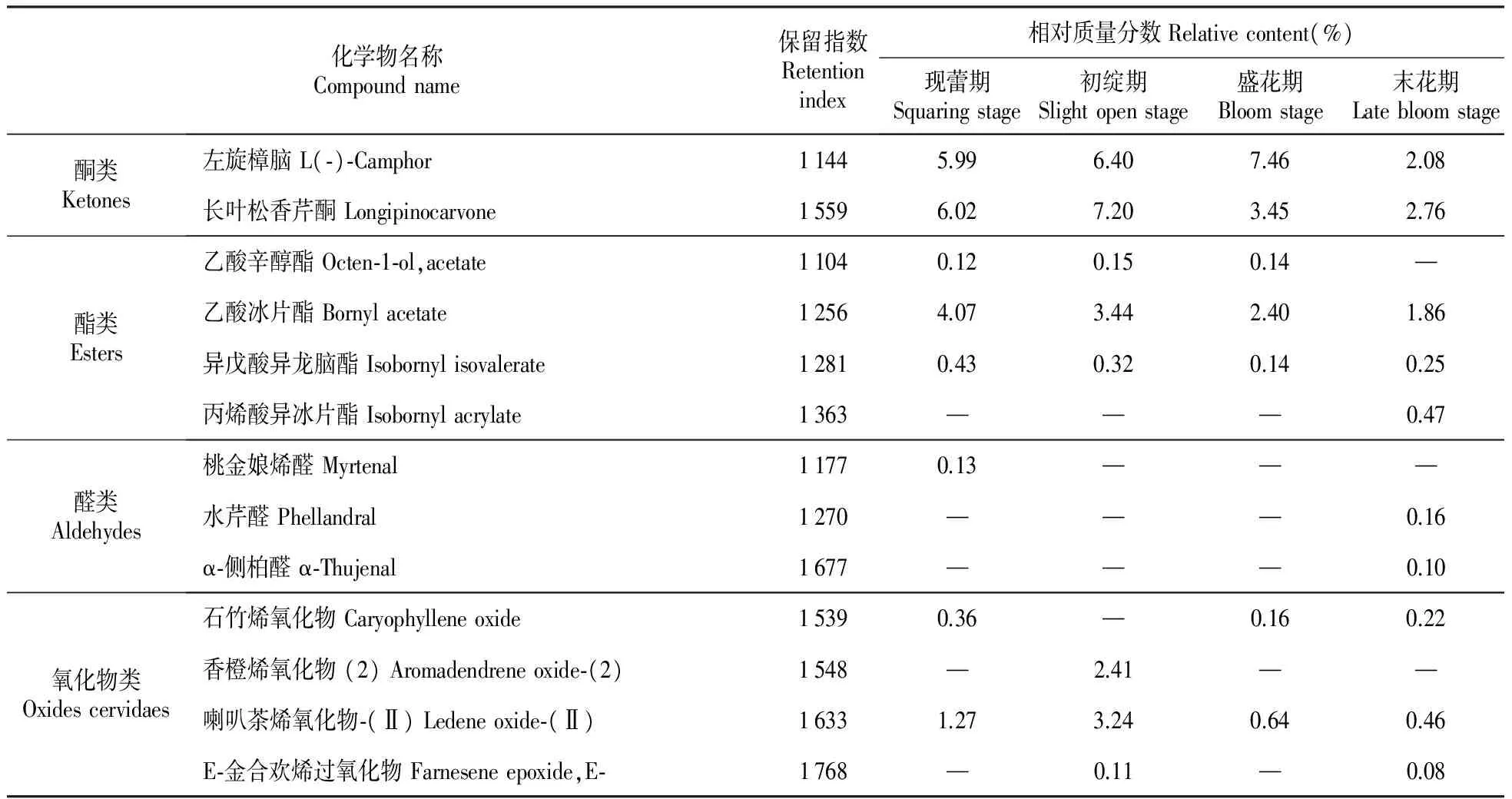
皇菊花4个发育时期挥发油组分中共鉴定出67种化学成分,包括烯烃类化合物36种、醇类化合物18种、酮类化合物2种、酯类化合物4种、醛类化合物3种及氧化物类化合物4种,具体见表1。
2.2.1 现蕾期
皇菊现蕾期共检测出挥发油化学成分40种,以烯烃类化合物含量最高,为52.12%(表2),含量最高的化合物是ρ-邻伞花烃,含量为11.29%(表1)。α-蒎烯、莰烯、萜品油烯、ρ-邻伞花烃、γ-萜品烯、β-榄香烯、异丁香烯、β-金合欢烯、α-姜黄烯、姜烯、β-倍半水芹烯、1,8-桉叶油醇、反式—松香芹醇、龙脑、4-萜烯醇、α-松油醇、顺—澳白檀醇、左旋樟脑、长叶松香芹酮、乙酸冰片酯、异戊酸异龙脑酯和喇叭茶烯氧化物-(Ⅱ)22种化学成分是共有成分,在其他3个时期均检测到。而反式2,2-二甲基-3-庚烯、顺式-4-侧柏醇、13-十七炔-1-醇、异长叶醇和桃金娘烯醛5种化学成分是现蕾期特有的化学成分,在其他3个时期均未检测到。
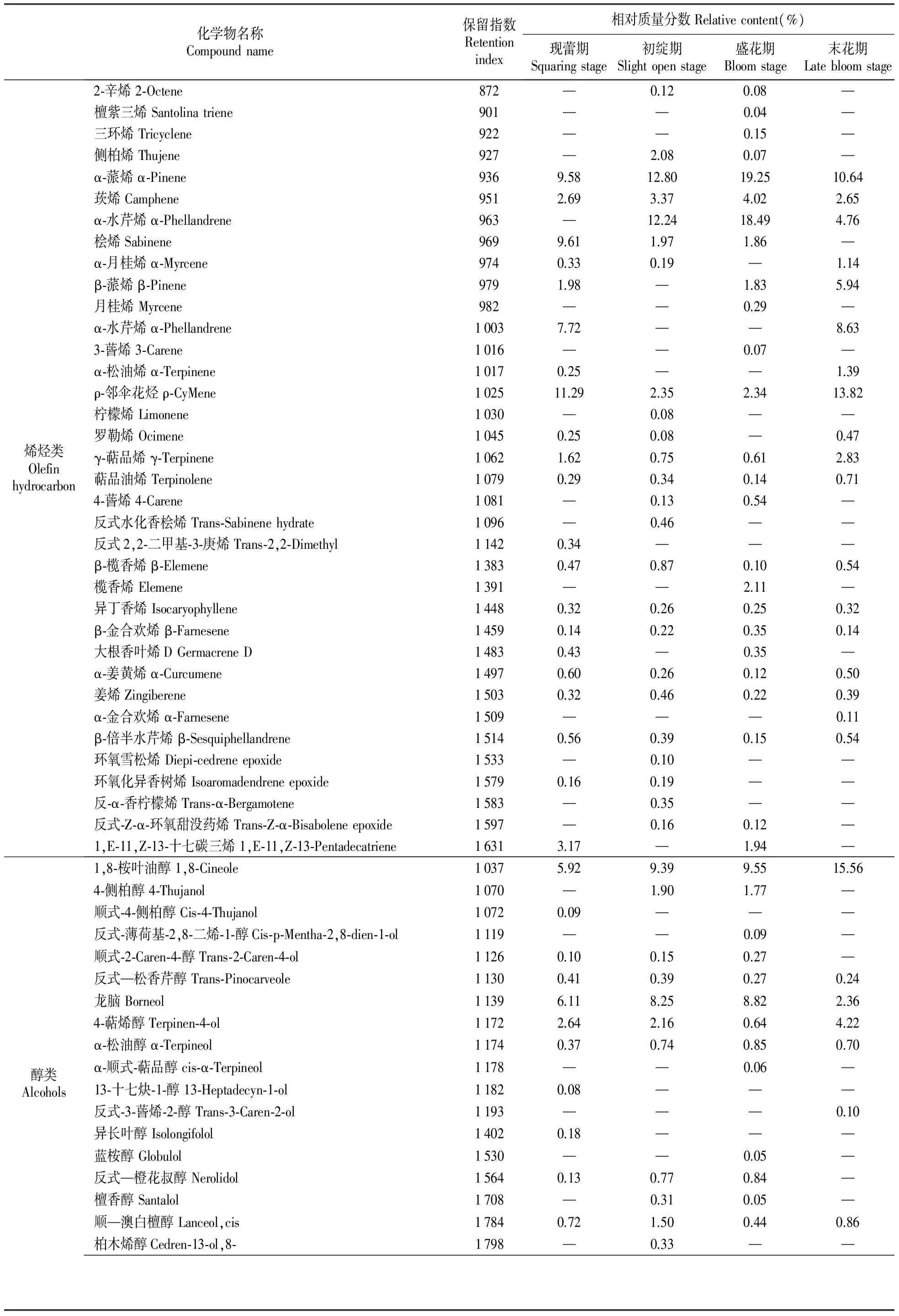
表1 皇菊花挥发油成分及其含量测定结果
续表1Continuedtable1
化学物名称Compoundname保留指数Retentionindex相对质量分数Relativecontent(%)现蕾期Squaringstage初绽期Slightopenstage盛花期Bloomstage末花期Latebloomstage酮类Ketones左旋樟脑L(⁃)⁃Camphor11445.996.407.462.08长叶松香芹酮Longipinocarvone15596.027.203.452.76酯类Esters乙酸辛醇酯Octen⁃1⁃ol,acetate11040.120.150.14—乙酸冰片酯Bornylacetate12564.073.442.401.86异戊酸异龙脑酯Isobornylisovalerate12810.430.320.140.25丙烯酸异冰片酯Isobornylacrylate1363———0.47醛类Aldehydes桃金娘烯醛Myrtenal11770.13———水芹醛Phellandral1270———0.16α⁃侧柏醛α⁃Thujenal1677———0.10氧化物类Oxidescervidaes石竹烯氧化物Caryophylleneoxide15390.36—0.160.22香橙烯氧化物(2)Aromadendreneoxide⁃(2)1548—2.41——喇叭茶烯氧化物⁃(Ⅱ)Ledeneoxide⁃(Ⅱ)16331.273.240.640.46E⁃金合欢烯过氧化物Farneseneepoxide,E⁃1768—0.11—0.08
注:“—”表示未检出,下同。
Note:“—”not been detected,the same as below.
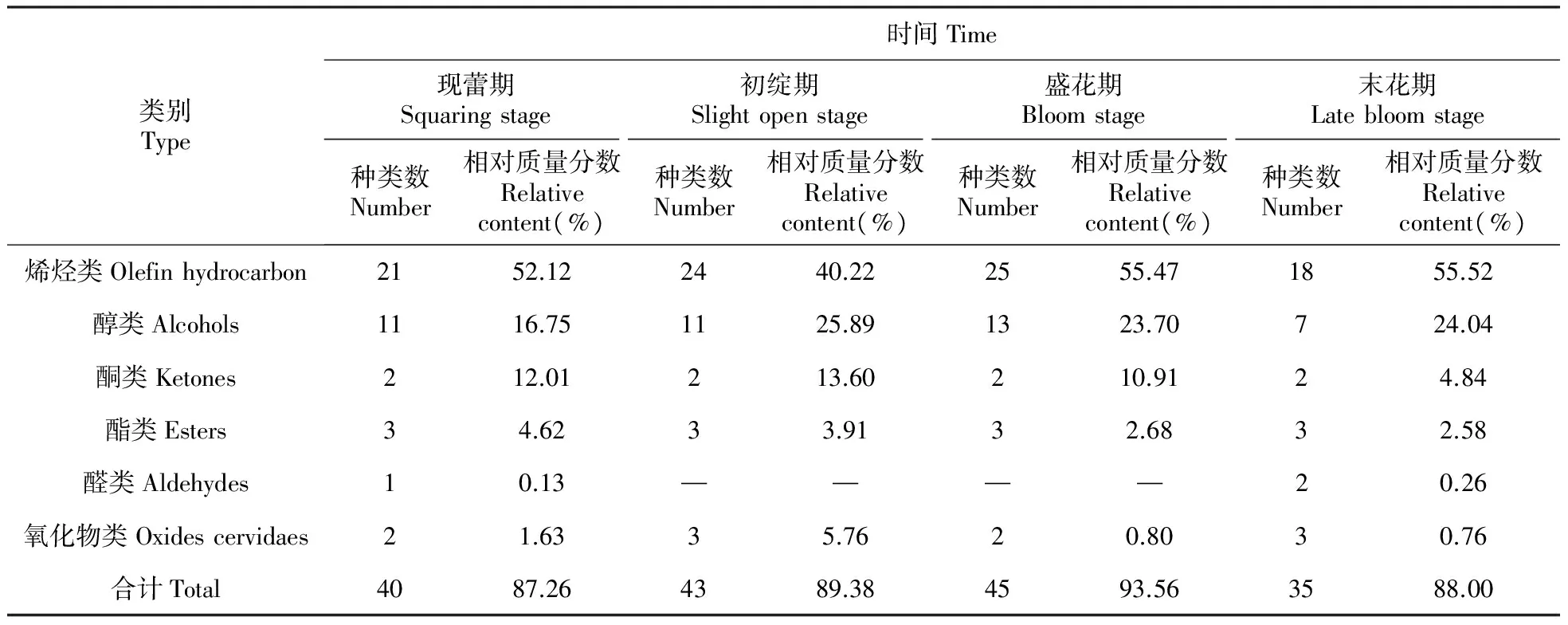
表2 皇菊花挥发油成分种类及其含量
2.2.2 初绽期
皇菊初绽期共检测出挥发油化学成分43种,检测出化学成分的数量是现蕾期的1.75倍,有6种化合物是初绽期特有的化学成分,即反式水化香桧烯、柠檬烯、反-α-香柠檬烯、环氧雪松烯、柏木烯醇和香橙烯氧化物(2)在其他各个时期均未被检出(表1)。烯烃类、醇类和酮类是主要的挥发油成分,含量分别占挥发油总量的40.22%、25.89%和13.60%(表2)。含量较多的化合物有α-蒎烯、α-水芹烯、1,8-桉叶油醇、龙脑、长叶松香芹酮和左旋樟脑,分别占挥发油总量的12.80%、12.24%、9.39%、8.25%、7.20%和6.40%;莰烯、桧烯、侧柏烯、ρ-邻伞花烃、4-侧柏醇、4-萜烯醇、顺—澳白檀醇、乙酸冰片酯、喇叭茶烯氧化物-(Ⅱ)和香橙烯氧化物(2)的含量在1.00%~5.00%(表1)。
2.2.3 盛花期
皇菊花盛花期共检测出挥发油化学成分45种,烯烃类、醇类和酮类是主要的挥发油成分,含量分别占挥发油总量的55.47%、23.70%和10.91%(表2)。含量较多的化合物有α-蒎烯、α-水芹烯、1,8-桉叶油醇、龙脑和左旋樟脑,其含量分别为19.25%、18.49%、9.55%、8.82%和7.46%(表1);莰烯、桧烯、β-蒎烯、ρ-邻伞花烃、榄香烯、1,E-11,Z-13-十七碳三烯、4-侧柏醇、长叶松香芹酮和乙酸冰片酯的含量在1.00%~5.00%(表1)。檀紫三烯、三环烯、月桂烯、3-蒈烯、榄香烯、反式-薄荷基-2,8-二烯-1-醇、α-顺式-萜品醇和蓝桉醇8种化合物仅在此时期被检出,且含量较少,分别为0.04%、0.15%、0.29%、0.07%、2.11%、0.09%、0.06%、和0.05%(表1)。
2.2.4 末花期
皇菊花末花期共检测出35种挥发油化学成分,主要为烯烃类和醇类(表2)。含量较多的化合物有α-蒎烯、ρ-邻伞花烃和1,8-桉叶油醇,分别为10.64%、13.82%和15.56%,其次为莰烯、α-水芹烯、α-月桂烯、β-蒎烯、α-松油烯、α-水芹烯、γ-萜品烯、龙脑、4-萜烯醇、左旋樟脑、长叶松香芹酮和乙酸冰片酯,其含量分别为2.65%、4.76%、1.14%、5.94%、1.39%、8.63%、2.83%、2.36%、4.22%、2.08%、2.76%和1.86%(表1)。α-金合欢烯、反式-3-蒈烯-2-醇、丙烯酸异冰片酯、α-侧柏醛和水芹醛5种化合物在其它3个时期未被检出,是末花期特有的化学成分。
2.3皇菊花不同发育时期挥发油中化合物成分及含量的变化
2.3.1 烯烃类化合物
由表2可知,皇菊花挥发油中主要的化学成分为烯烃类化合物,尤其是末花期,检测出烯烃类化合物占挥发油总量的55.52%。随着花蕾的发育,烯烃类化合物的含量逐渐降低,与现蕾期相比,初绽期下降至40.22%,但此后又逐渐增加,至末花期,烯烃类化合物的含量增至55.52%。α-蒎烯的含量在盛花期最高,随着花蕾的发育,其含量逐渐升高,但到末花期含量反而降低。α-蒎烯在4个发育时期均具有较高的含量(表1)。
2.3.2 醇类化合物
由表2可以看出,醇类化合物是皇菊花挥发油中另一类主要化学成分,随着花的发育,醇类化合物在现蕾期就被检测出,含量为16.75%,花蕾初绽期迅速上升到25.89%,含量达到最高,随后含量又逐渐降低,盛花期为23.70%,至末花期含量上升到24.04%。皇菊花挥发油中的醇类化合物主要包括1,8-桉叶油醇、龙脑、4-侧柏醇、4-萜烯醇和顺—澳白檀醇。
2.3.3 酮类化合物
皇菊花挥发油中含有较多的酮类化合物。从表2可知,皇菊花中的酮类化合物在现蕾期开始被检测出,随着花蕾的发育其含量呈现先增加而后又逐渐降低的变化趋势,至末花期酮类化合物降为最低,其含量仅为4.84%。酮类化合物的含量依次为初绽期>现蕾期>盛开期>末花期(表2)。皇菊花挥发油中的酮类化合物主要包括左旋樟脑和长叶松香芹酮。
2.3.4 酯类化合物
由表2可知,酯类物质是皇菊花挥发油中第四大类物质,随着花的发育,酯类化合物在现蕾期就被检测出,含量为4.62%,随后的3个发育时期含量逐渐的降低,初绽期(3.91%)、盛花期(2.68%)和末花期(2.58%)。皇菊花挥发油中的酯类化合物主要包括乙酸冰片酯,而丙烯酸异冰片酯仅在末花期被检测到。
2.3.5 其他化合物
烯烃、醇类、酮类酯类和氧化物类化合物各发育时期均被检出,而醛类化合物在现蕾期和末花期被检测出。氧化物类成分在现蕾期开始被检测出,含量为1.63%,随着花蕾的发育其含量呈现先增加而后又逐渐降低的变化趋势,至末花期氧化物类化合物降为最低,其含量仅为0.76%。氧化物类化合物的含量依次为初绽期>现蕾期>盛开期>末花期(表2),这点与酮类物质含量变化趋势一致。皇菊花挥发油中的氧化物类化合物主要是喇叭茶烯氧化物-(Ⅱ)。醛类化合物在现蕾期和末花期被检测出,含量甚微,含量分别仅为0.13%和0.26%。
2.4 皇菊花挥发油对DPPH自由基清除作用
由图1可知,皇菊花挥发油对DPPH自由基有较强的清除作用,在所测定体积范围内,其清除效果较高于Vc。随着挥发油和Vc使用量的增加,对DPPH自由基的清除效果也不断增大。皇菊花挥发油的使用量(X)与对DPPH自由基清除率(Y)之间的回归方程为Y=6 531.5X+32.321(R2=0.982 3);Vc的使用量(X)与对DPPH自由基清除率(Y)之间的回归方程为Y=5 815.2X+22.607(R2=0.990 9)。挥发油和Vc半抑制率IC50值分别为0.002 71和0.004 71 μg·μL-1。说明皇菊花挥发油中的抗氧化物质提供氢离子给DPPH自由基的能力更强,皇菊花挥发油具有良好的抗氧化活性。

图1 挥发油对DPPH自由基清除作用Fig.1 Scavenging capacity of volatile oil against DPPH
3 讨论
本研究结果表明,皇菊花发育过程中挥发油成分的种类和含量逐渐增多,在现蕾期挥发油成分种类也已达到40种,含量达到87.26%,之后随着花的开放,挥发油成分的种类和含量在盛花期达到高峰,到末花期迅速减少。这与菊花[5]、玫瑰[6]和文心兰[7]等观赏植物花的发育过程中香气成分的种类和含量的变化趋势基本一致。这种植物花器官的挥发油(香气)多样性的释放机制可能与植物经济有效地诱引不同昆虫在不同时期访花采蜜,从而最大限度地达到自身的授粉目的有关[8~9],也可能与花器官挥发油(香气)物质生物合成途径及其积累和释放模式的不同有关[10],因为植物的花器官到底能散发出哪些花香挥发物,并不取决于这些花香物质本身的挥发特性,而是取决于香气物质合成区域膜结构上的某些载体对其选择性的释放特性[11],然而这种植物花器官的复杂的花香调节模式有待进一步研究。
皇菊花不同发育时期挥发油的化学成分基本为烯烃类、醇类、酮类、酯类及其含氧衍生物等。这些物质可用于香精香料、保健和医药等,具有重要的开发利用价值,尤其是皇菊花不同发育时期挥发油中均含有的含量较高的α-蒎烯、ρ-邻伞花烃、1,8-桉叶油醇和左旋樟脑等化合物,其用途非常广。如α-蒎烯具有抗肿瘤[12]、抗真菌[13]、抗过敏及改善溃疡等[14~15]作用;ρ-邻伞花烃对谷象具有潜在的毒性等作用[16];1,8-桉叶油醇也称为桉油精,典型的新鲜樟脑特有的香味和辛辣味,因此广泛用于风味食品、制药和化妆品行业,具有抗菌、抗癌、抗炎、抗氧化、杀菌、杀虫等多种药理活性[17~18];左旋樟脑是医药,日用品及国防工业中不可缺少的原料,应用广泛,有兴奋、强心、消炎、镇痛、抗菌、止咳、促渗、杀螨等药理作用[19]。此外,皇菊花不同发育过程挥发油中还有许多其他成分,这些成分的功效目前尚未明确,有待于进一步研究。
人体在新陈代谢过程中会产生多种带负电的自由基,清除多余的自由基对人体健康有重要作用[20~21]。天然药物中含有多种抗氧化性成分,如酚类、黄酮类、萜类、不饱和烃和生物碱等组成。以皇菊花为材料提取的挥发油,其主要物质是烯烃类、醇类、酮类、酯类及其含氧衍生物等。这些化合物含有双键等还原性基团,它们协同作用,使皇菊花挥发油的抗氧化能力大大增强。
4 结论
皇菊花在盛花期出油率最高,因此生产上提取挥发油的皇菊花应该在盛花期进行采摘。
本试验从皇菊花的现蕾期、初绽期、盛花期和末花期4个不同发育时期挥发油中分别鉴定出40、43、45和35种化合物,共鉴定出67种化学成分,包括烯烃类(36种)、醇类(18种)、酮类(2种)、酯类(4种)、醛类(3种)及氧化物类(4种)化合物,他们之间的共有成分有22种,特有成分现蕾期(5种)、初绽期(6种)、盛花期(8种)和末花期(5种)。本研究可为更好地开发利用皇菊资源提供参考依据。
从皇菊花挥发油的抗氧化能力研究表明,皇菊花挥发油清除DPPH自由基的能力有明显的量效关系,且对自由基的清除能力强于Vc,说明其抗氧化能力效果显著。
1.张辕.基于三种标记的中国传统菊花品种鉴定及分类研究[D].北京:北京林业大学,2014.
Zhang Y.Studies on the identification and classification of Chinese traditional chrysanthemum cultivars based on three types of markers[D].Beijing:Beijing Forestry University,2014.
2.刘玉珊,许震寰,刘静,等.皇菊的有益成分含量及其可食用性分析[J].安徽农业科学,2014,42(31):10905-10906.
Liu Y S,Xu Z H,Liu J,et al.Analysis of the beneficial components and edibility of the imperial chrysanthemum[J].Journal of Anhui Agricultural Sciences,2014,42(31):10905-10906.
3.王康才,茅毓英,张雪琼.杭菊花茎尖组织培养初探[J].中药材,2000,23(3):125-127.
Wang K C,Mao Y Y,Zhang X Q,et al.A preliminary study on tissue culture of stem apex ofChrysanthemummorifolium[J].Jorunal of Chinese Medicinal Materials,2000,23(3):125-127.
4.胡文杰,邱修明,曾建军,等.皇菊不同部位挥发油化学成分比较分析[J].天然产物研究与开发,2015,27(7):1187-1193.
Hu W J,Qiu X M,Zeng J J,et al.Comparative analysis of the components of essential oils from different parts of imperial chrysanthemum[J].Natural Product Research and Development,2015,27(7):1187-1193.
5.徐瑾,李莹莹,郑成淑,等.菊花不同花期及花序不同部位香气成分和挥发研究[J].西北植物学报,2012,32(4):722-730.
Xu J,Li Y Y,Zheng C S,et al.Studies of aroma compounds in chrysanthemum in different florescence and inflorescence parts and aroma releasing[J].Acta Botanica Boreali-Occidentalia Sinica,2012,32(4):722-730.
6.冯立国,生利霞,赵兰勇,等.玫瑰花发育过程中芳香成分及含量的变化[J].中国农业科学,2008,41(12):4341-4351.
Feng L G,Sheng L X,Zhao L Y,et al.Changes of the aroma constituents and contents in the course ofRosarugosaThunb. flower development[J].Scientia Agricultura Sinica,2008,41(12):4341-4351.
7.张莹,李辛雷,王雁,等.文心兰不同花期及花朵不同部位香气成分的变化[J].中国农业科学,2011,44(1):110-117.
Zhang Y,Li X L,Wang Y,et al.Changes of aroma components inOncidiumsharry baby in different florescence and flower Parts[J].Scientia Agricultura Sinica,2011,44(1):110-117.
8.Ayasse M,Schiestl F P,Paulus H F,et al.Evolution of reproductive strategies in the sexually deceptive orchidOphryssphegodes:how does flower-specific variation of odor signals influence reproductive success?[J].Evolution,2000,54(6):1995-2006.
9.Schade F,Legge R L,Thompson J E.Fragrance volatiles of developing and senescing carnation flowers[J].Phytochemistry,2001,56(7):703-710.
10.Dudareva N,Pichersky E.Biochemical and molecular genetic aspects of floral scents[J].Plant Physiology,2000,122(3):627-633.
11.Goodwin S M,Kolosova N,Kish C M,et al.Cuticle characteristics and volatile emissions of petals inAntirrhinummajus[J].Physiologia Plantarum,2003,117(3):435-443.
12.Zhang Z,Guo S,Liu X,et al.Synergistic antitumor effect of α-pinene and β-pinene with paclitaxel against non-small-cell lung carcinoma(NSCLC)[J].Drug Research,2015,65(4):214-218.
13.da Silva A C R,Lopes P M,de Azevedo M M B,et al.Biological activities of α-pinene and β-pinene enantiomers[J].Molecules,2012,17(6):6305-6316.
14.de Almeida Pinheiro M,Magalhães R M,Torres D M,et al.Gastroprotective effect of α-pinene and its correlation with antiulcerogenic activity of essential oils obtained fromHyptisspecies[J].Pharmacognosy Magazine,2015,11(41):123-130.
15.Nam S Y,Chung C K,Seo J H,et al.The therapeutic efficacy of α-pinene in an experimental mouse model of allergic rhinitis[J].International Immunopharmacology,2014,23(1):273-282.
16.Çaglar Ö,Çalmasur Ö,Aslan I,et al.Insecticidal effect of essential oil ofOriganumacutidensagainst several stored product pests[J].Fresenius Environmental Bulletin,2007,16(1):1395-1400.
17.Machado M,Dinis A M,Santos-Rosa M,et al.Activity ofThymuscapitellatusvolatile extract,1,8-cineole and borneol againstLeishmaniaspecies[J].Veterinary Parasitology,2014,200(1-2):39-49.
18.Silva C J,Barbosa L C A,Demuner A J,et al.Chemical composition and antibacterial activities from the essential oils of myrtaceae species planted in Brazil[J].Química Nova,2010,33(1):104-108.
19.Manoguerra A S,Erdman A R,Wax P M,et al.Camphor poisoning:an evidence-based practice guideline for out-of-hospital management[J].Clinical Toxicology,2006,44(4):357-370.
20.Yin H Y,Xu L B,Porter N A.Free radical lipid peroxidation:mechanisms and analysis[J].Chemical Reviews,2011,111(10):5944-5972.
21.葛丽娜,韩雪,任珂珂,等.火棘花挥发油化学成分的GC-MS分析及抗氧化活性研究[J].植物研究,2014,34(2):276-281.
Ge L N,Han X,Ren K K,et al.GC-MS analysis on chemical constituents and antioxidant activity of volatile oil fromPyracanthafortuneanaflowers[J].Bulletin of Botanical Research,2014,34(2):276-281.
This research is supported by item of science and technology floor plan of higher school in jiangxi province(KJLD14064);Students’ innovative undertaking plan project in Jinggangshan university(SMKX20140001)
introduction:HU Wen-Jie(1974—),male,Doctor,Mainly engaged in natural product chemistry.
date:2016-09-12
ChemicalComponentsofVolatileOilsfromYellowChrysanthemummorifoliumDuringFlowerDevelopmentStagesandtheirAntioxidantActivity
HU Wen-Jie XU Zhang-Run LU Si-Qing LIU Si-Min ZENG Jian-Jun*
(College of Life Sciences,Jinggangshan University,Ji’an 343009)
The chemical components of volatile oils from YellowChrysanthemummorifoliumduring flower development stages were identified by GC-MS, and the relative content of each component was determined by peak area normalization methods. The DPPH free radical scavenging activity of the volatile oils was determined by ultraviolet spectrophotometer. The results were as follows: the components and contents of essential oils in YellowC.morifoliumflowers were significantly different among different flower development stages. There were 40, 43, 45 and 35 compounds, identified at squaring stage, slight open stage, bloom stage and late bloom stage, respectively. In total, 67 components were identified from the volatile oils of four different development stages including olefin hydrocarbon(36), alcohols(18), ketones(2), esters(4), aldehydes(3) and oxides cervidae(4). Twenty-two common compounds were detected in YellowC.morifoliumduring flower development stages. The numbers of special components among four periods were 5, 6, 8 and 5 compounds, respectively. The contents of olefin hydrocarbon, alcohols, ketones and esters were high, which were the main components at during flower development stages, nevertheless the specific components and their contents were distinctly different at these stages; The ability of scavenging DPPH radicals of the volatile oils was stronger than that of Vc, and the volatile oils showed strong antioxidant activity.
YellowChrysanthemummorifolium;development stage;volatile oil;GC-MS;antioxidant activity
江西省高等学校科技落地计划项目(KJLD14064);井冈山大学大学生创新创业计划项目(SMKX20140001)
胡文杰(1974—),男,博士,主要从事天然产物化学研究。
* 通信作者:E-mail:jianjunzen@139.com
2016-09-12
* Corresponding author:E-mail:jianjunzen@139.com
S682.31;Q945.6+4
A
10.7525/j.issn.1673-5102.2016.06.019

