化学沉淀法合成超细二氧化硅
郑 婧,林吟沁
(福建生物工程职业技术学院,福州 350002)
化学沉淀法合成超细二氧化硅
郑 婧,林吟沁
(福建生物工程职业技术学院,福州 350002)
以硅酸钠为硅源,乙酸乙酯为酸化剂,通过沉淀法制备超细二氧化硅。考察了硅酸钠浓度、焙烧温度、超声分散等因素对制备二氧化硅的影响。通过一系列的实验得出制备超细二氧化硅较好的工艺条件:硅酸钠的浓度为0.20 g/mL,焙烧条件为600 ℃,4 h。并采用XRD、N2等温吸附-脱附、FT-IR、SEM等手段对二氧化硅进行表征。结果表明:所制得的二氧化硅为无定形结构,分散性较好,BET比表面积可达400 m2/g以上。
超细二氧化硅; 沉淀法; 硅酸钠; 超声
1 引 言
超细SiO2为无定形白色粉末(指其团聚体),是一种无毒、无味、无污染的无机非金属材料,比表面积大、密度小和分散性好[1]。超细SiO2材料的特殊结构,使它产生了四大效应,这些效应使其合成的材料具有传统材料所不具备的物理、化学特性而被广泛用于橡胶、农药、造纸、油墨、塑料加工等行业[2]。超细二氧化硅的制备方法有物理法和化学法两种:物理法一般指机械粉碎法;化学法包括气相沉淀法、沉淀法、溶胶-凝胶法和离子交换法等[3]。此外,王玉琨等[4]以正硅酸乙酯为硅源,在Tritonx-100/正辛醇/环乙烷/水(氨水)微乳液体系中合成出纳米二氧化硅。而超临界干燥法[5]、撞击流反应-沉淀法[6]等一些新方法也都被应用于超细二氧化硅的制备。本文采用沉淀法在反应条件较温和的情况下,合成出具有较大比表面积,分散性好的超细二氧化硅。
2 实 验
2.1 实验试剂与表征
硅酸钠(国药集团化学试剂有限公司)、乙酸乙酯(广东西陇化工厂)、聚乙二醇(国药集团化学试剂有限公司)、盐酸(无锡市灵达化工试剂厂)以上试剂皆为分析纯;去离子水。
X射线衍射(XRD)测试在荷兰Phillip X'pert-MPD型X射线衍粉末射仪上测定,Co Kα(λ=0.15064)辐射,管压40 kV,管流20 mA。在Nicolet 560(Perkin Elmer Spectrometer Spectrum 2000)型红外光谱仪上测定样品的红外光谱,KBr压片,扫描范围400~4000 cm-1。用Micromeritics公司的ASAP 2020型物理化学吸附仪测定超细二氧化硅粉体的N2吸附-脱附曲线;分别采用BET方程和BJH模型计算样品的比表面积和孔径分布。用XL30 ESEM/TMP型扫描电子显微镜来观察二氧化硅超细粉的形貌。
2.2 制备过程
将2.6 g的九水硅酸钠溶于13 mL的去离子水中,40 ℃搅拌至完全溶解。逐滴加入5 mL的乙酸乙酯,待出现沉淀后加入0.1 g的PEG1000,搅拌20 min后逐滴加入7 mL的去离子水,继续搅拌一段时间后用37%的浓盐酸调节其pH值。搅拌4 h,超声15 min,陈化,用自制溶液离心,100 ℃干燥,焙烧得超细二氧化硅。
3 结果与讨论
3.1 反应产物的确定
3.1.1 红外光谱测定
将经水解-缩聚后的产物离心、干燥、焙烧采用KBr压片法,摄谱范围在400~4000 cm-1,扫描次数32,分辨率4 cm-1进行红外测试,所得谱图如图1所示。
图1为经过600 ℃焙烧样品的红外谱图,从图中可知此样品在3600~3200 cm-1存在结构水的吸收峰;在1650~1600 cm-1有毛细管水和表面吸附水的吸收峰;而1094 cm-1、806 cm-1和475 cm-1左右的吸收峰分别代表了高聚态的Si-O-Si反对称伸缩振动峰、单硅酸根的Si-O-Si对称伸缩振动峰、和Si-O-Si弯曲伸缩振动吸收峰[7]。图中960 cm-1处Si-OH伸缩振动峰并不很明显,这可能是因为在高温焙烧过程中硅醇基脱水形成Si-O-Si,构成二氧化硅三维网络结构的缘故[8]。

图1 经600 ℃焙烧样品的FT-IR谱图Fig.1 FT-IR spectrum of sample annealled at 600 ℃
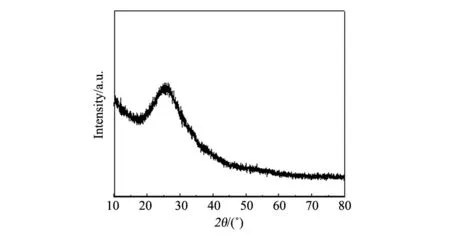
图2 经600 ℃焙烧样品XRD谱图Fig.2 XRD patterns of sample annealled at 600 ℃
3.1.2 XRD的测定
从图2中可以看出经焙烧的样品仅在2θ=25°附近出现一馒头峰,表明所制得的样品主要以非晶态的形式存在,经高温焙烧后并没有发生晶形的转变和相转变[9]。
3.1.3 比表面积和孔径分布的测定
从图3中可以看出样品的N2吸附-脱附曲线为Ⅳ型,在相对压力较低时存在一个拐点,此拐点标志着单层吸附的完成。在相对压力较高的区域,吸附量有显著的增加,由于毛细管凝聚还在此区域出现了滞后现象,即在脱附时得到的等温线和吸附时得到的等温线不重合。等温线在相对压力为0.4附近因为吸附量的减少而出现了滞后环的突然闭合,这是由于N2从内部孔径小于4 nm孔中脱附的缘故[10]。
与脱附分支相比,吸附分支受TSE效应影响更小从而能得到更准确的孔径分布曲线[11]。本文皆使用吸附分支的数据来计算样品的孔径分布。从图3中可知样品的孔径分布较宽,孔径分布曲线从第一点就开始下降,样品的平均孔径仅为3.8 nm,由此推断此样品可能不存在孔结构,而只有缝隙间的孔[12]。
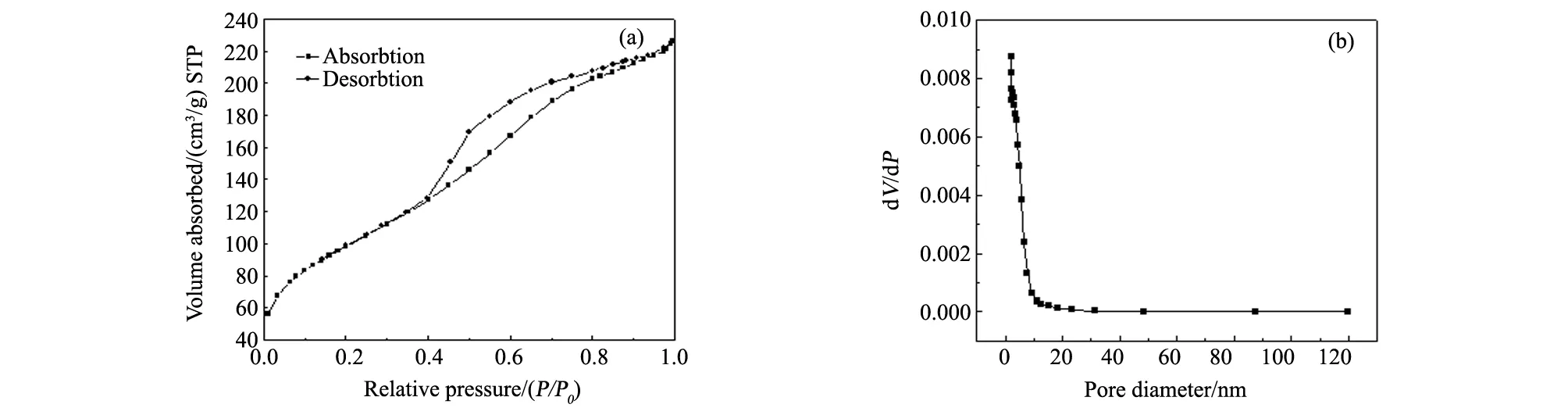
图3 超细SiO2的N2吸附-脱附等温线(a)和孔径分布图(b)Fig.3 N2 adsorption-desorption isotherm(a) and pore size distribution(b) of ultrafine SiO2
3.2 各影响因素的讨论
通过改变硅酸钠浓度、焙烧温度等反应条件,分析反应条件的改变对超细二氧化硅结构和性质的影响。
3.2.1 硅酸钠浓度的影响
调节硅酸钠的浓度是沉淀反应的关键步骤,反应体系中硅酸钠的浓度太高或太低都不利于沉淀的生成。硅酸钠的浓度过小则易形成溶胶,而其浓度过大则易形成凝胶。本实验在其它反应条件不变的情况下改变体系中硅酸钠的浓度(0.05~0.25 g/mL)以考察其对超细二氧化硅制备的影响。

表1 不同硅酸钠浓度合成超细SiO2的BET比表面积Tab.1 BET specific surface aera of ultrafine SiO2 prepared with different Na2SiO3·9H2O concentration
从表1可以看出反应物硅酸钠的浓度对最后产物比表面积有较大影响:产物比表面积随着硅酸钠浓度的增大呈先升后降的趋势,在浓度(以反应体系中含有Na2SiO3·9H2O计)为0.2 g/mL时达到最大值452.33 m2/g。这可能是因为:当硅酸钠浓度较小时,形成的硅酸溶胶较稀,硅溶胶胶凝慢,有利于形成粗大的晶核。且当硅酸钠浓度较小时,硅溶胶胶凝不完全,体系中仍有大量的硅溶胶存在,致使硅溶胶中结合的水比较多,在后续的干燥过程中很容易产生硬团聚,故其比表面积较小。随着硅酸钠浓度的增大,沉淀生成速率稍大于沉淀长大速率,这种情况下得到的二氧化硅溶胶粒子大小适中使得产物具有较大比表面积[13]。当硅酸钠的浓度继续增大,反应会很快形成大量的很小的二氧化硅溶胶粒子,它们很容易堆积在一起,并紧密结合,使得最终产物比表面积下降[14]。
3.2.2 焙烧温度的影响
在SiO2合成过程中,加入表面活性剂可以抑止硅酸凝胶的形成,但未除去表面活性剂的SiO2粉末的比表面积远小于处理过的样品。且实验采用自制溶液对产物进行洗涤、离心产物中可能会有其残留。为了得到纯净的、具有较高比表面积的产品必须对产物进行焙烧处理。此外,由于超细SiO2被广泛应用于催化领域,而许多反应的反应温度都高于室温,因此超细SiO2的热稳定性是评价其优劣的重要因素。超细SiO2的高温热稳定实验采用样品在不同的温度下焙烧4 h的方法进行。
从图4中可知,经400 ℃、500 ℃、600 ℃焙烧的样品都具有二氧化硅的红外特征峰即在1093 cm-1、806 cm-1和471 cm-1左右都存在高聚态的Si-O-Si反对称伸缩振动峰、单硅酸根的Si-O-Si对称伸缩振动峰、和Si-O-Si弯曲伸缩振动吸收峰。但三者之间又存在着差异:随着焙烧温度的升高471 cm-1、806 cm-1和1093 cm-1附近的吸收峰都有所增强,且不同程度地向高波数方向移动,这可能是因为:在高温焙烧过程中SiO2颗粒间通过硅醇基Si-OH缩合形成Si-O-Si键,颗粒构成的网络结构有所增强[15]。而967 cm-1附近的吸收峰却随着焙烧温度的升高而逐渐降低甚至消失,这可能是因为在焙烧过程中硅醇基Si-OH脱水形成Si-O-Si构成二氧化硅三维网络结构,其转化的程度随着温度的升高而加剧[16]。1093 cm-1左右的吸收峰是考察焙烧温度影响的一个重要参数,随着焙烧温度的变化,此处吸收峰的位置也发生变化[17]。焙烧温度从400 ℃升高至600 ℃此处的吸收峰从1093 cm-1降低至1089 cm-1而后又升高至1094 cm-1。产生这种变化的原因是:随着焙烧温度的升高Si-O-Si键伸缩程度发生了变化。此外,3600~3200 cm-1结构水的吸收峰和1650 cm-1附近毛细管水和表面吸附水的吸收峰并没有随着焙烧温度的升高而减弱这可能是因为:超细SiO2粉末具有多孔结构,易吸附空气中的水分[18]。

图4 不同焙烧温度下超细SiO2的FT-IR谱图Fig.4 FT-IR spectra of ultrafine SiO2 annealled at different temperatures
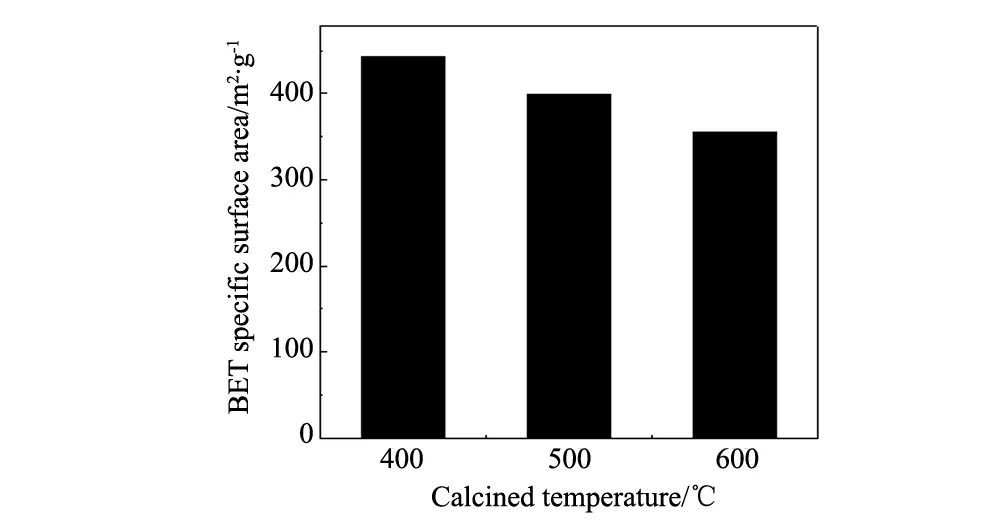
图5 不同焙烧温度下超细二氧化硅BET比表面积Fig.5 BET specific surface areas of ultrafine SiO2annealled at different temperatures
从图5中可以看出随着焙烧温度的升高,超细二氧化硅的比表面积呈逐渐下降的趋势从400 ℃的443.07 m2/g降至600 ℃的355.79 m2/g。SiO2的表面积和颗粒粒度与热处理温度有密切关系[19],高温焙烧会导致SiO2微观结构变化[20],如:微孔烧结、比表面积减少、表观容积缩小、视密度增大等。随着焙烧温度的升高,超细SiO2的比表面呈逐渐下降的趋势,这可能是因为超细SiO2表面活性很大,颗粒容易附在一起,温度升高至一定值时原始颗粒相互接触处颈部质点将发生扩散转移,从而使SiO2颗粒较快地连接长大[21]。也有可能是由于在高温作用下粒子间的羟基脱水缩合,Si-O键断裂,孔结构坍塌,导致比表面积下降[16]。
3.2.3 超声处理的影响
超声波是一种特殊形式的能量和波动形式,能通过液体介质向四周传播,产生超声空化现象[22]。超声空化作用可以极大地提高非均相反应的速率,实现非均相反应物间的微观均匀混合,加速反应物和产物的扩散过程,促进固体新相的生成,控制颗粒的尺寸和分布。超声波在强化非均相界面之间传质方面比传统方法具有明显的优势和独到之处[23]。

图6 未使用超声处理(a)、使用超声处理(b)超细SiO2扫描电镜图Fig.6 SEM microstructures of ultrafine SiO2 prepared with(b)/without(a) ultrasound treatment
液相中的颗粒在布朗运动、范德华引力、搅拌力等作用下相互靠近碰撞而不断产生团聚。本文在采用添加表面活性剂为分散剂并辅助以超声分散以期将团聚程度降至最低。
从图6中可以看出经过超声的样品分散性好,颗粒大小均一,团聚情况有明显的改善;而未经超声的样品团聚现象十分严重,样品主要以块状体形式存在,在块状体之间夹杂着一些颗粒,这些颗粒的粒径也都较经超声样品的粒径要大。超声之所以能起到这样的作用可能是因为[24-25]:超声空化形成的大量空泡破灭时产生强大的冲击波,冲击波对团聚颗粒反复冲击一方面破坏颗粒间的表面吸附,使团聚颗粒被剥离、脱落下来;另一方面也会引起氢键等化学结合力的断裂而使团聚颗粒相互脱落。此外,空化产生的气泡振动,还能对颗粒表面进行剥离,打散团聚。而超声空化产生的冲击波和微射流对颗粒的剪切与破碎作用使形成的团聚体破碎,释放出所包含的水分子,从而阻止氢键的形成,有效地破坏了晶核或微粒间的团聚,控制了颗粒的尺寸。
超声对干燥过程也有一定的影响:毛细管力是骨架吸水和干燥脱水过程中粉体进一步团聚的推动力,这种推动力取决于毛细管力的半径和液固表面张力。毛细管越细,水的表面张力愈大,推动力愈大。而经超声波作用后的前驱体,由于超声使前驱体颗粒分散良好, 陈化时形成的三维网络状结构较疏松,毛细管增大,产生的毛细管力较小。这样得到的三维网络结构有利于最后得到疏松、少(无)团聚的超细SiO2。
4 结 论
(1)以硅酸钠为硅源,乙酸乙酯为酸化剂,采用化学沉淀法在温和、开放的体系中反应得到超细二氧化硅。通过一系列的实验得到制备超细二氧化硅的最佳工艺:硅酸钠的浓度为0.20 g/mL,焙烧条件为600 ℃,4 h;
(2)化学沉淀法制备的超细二氧化硅具有较大的比表面积(452.33 m2/g),分散性好;
(3)超声的加入改善了超细二氧化硅的分散性,一定程度上解决了超细二氧化硅的团聚问题;
(4)焙烧条件对超细二氧化硅有一定的影响:随着焙烧温度升高,二氧化硅原始颗粒相互接触处颈部质点将发生扩散转移,使得SiO2颗粒较快地连接长大导致超细二氧化硅的比表面积呈下降的趋势。
[1] 应德标.超细粉体技术[M].北京:化学工业出版社,2006:35-41.
[2] 刘俊渤,臧玉春,吴景贵,等.纳米二氧化硅的开发与应用[J].长春工业大学学报,2003,24(4):9-12.
[3] 瞿其曙,何友昭,淦五二,等.超细二氧化硅的制备及研究进展[J].硅酸盐通报,2000,19(5): 57-62.
[4] 王玉琨,钟浩波,吴金桥.微乳液法制备条件对纳米SiO2粒子形貌和粒径分布的影响[J].精细化工,2002,19(8):466-468.
[5] 杨 儒,张广延,李 敏,等.超临界干燥制备纳米SiO2粉体及其性质[J].硅酸盐学报,2005,33(3):281-286.
[6] 周玉新,于绪平,伍 沅.撞击流反应-沉淀法制备超细白炭黑[J].化学工程与装备,2007,(4):1-4.
[7] Duran A,Serna C F V.Structure considerations about SiO2glasses prepared by sol-gel[J].JournalofNon-CrystallineSolids,1986,82(1):69-77.
[8] 刘忠义,王莉玮,王子忱,等.硅酸钠法合成高比表面多孔二氧化硅[J].高等学校化学学报,1998,19(5):770-773.
[9] 李 曦,刘连利,王莉丽,等.凝胶网格沉淀法制备纳米二氧化硅[J].硅酸盐通报,2007,26(3):486-490.
[10] Wang Y R,Alain T.Nanoporous zeolite single crystals:ZSM-5 nanoboxes with uniform intracrystalline hollow structures[J].MicroporousandMesoporousMaterials,2008,113(1-3):286-295.
[11] Johan C G,Louk A A P,Javier P R.Pore size determination in modified micro-and mesoporous materials.Pitfalls and limitations in gas adsorption data analysis[J].JournalofMicroporousandMesoporousMaterials,2003,60(1-3):1-17.
[12] 陈 超.Bi2SiO5/SiO2的制备及其催化性能研究[D].福州:福州大学学位论文,2008.
[13] 李 阳,崔秀兰,郭俊文.溶胶凝胶法制备超细二氧化硅的研究[J].内蒙古大学学报(自然科学版),2007,38(6):707-711.
[14] 余慧明,陈雪梅.大孔容高分散沉淀二氧化硅的制备及改性[J].涂料工业,2008,38(4):7-10.
[15] Caroline M P,James A R,Michael D A.Infrared spectroscopic study of sol-gel derived mixed-metal oxides[J].JournalofNon-crystallinesolids,2001,279(2-3):119-125.
[16] Woei C E,Kuan Y C.Effects of annealing temperature on ultra-low dielectric constant SiO2thin films derived from sol-gel spin-on-coating[J].PhysicaB.,2008,403:611-615.[17] 唐新桂,周歧发,尹荔松,等.纳米级二氧化硅玻璃粉的制备及其特性[J].中山大学学报(自然科学版),1998,37(5):35-38.
[18] Alok M,Douglds M S.Agglomeration during the drying of fine silica powders[J].AmericanCeramicSocietyBulletin,1997,80(7):1720.
[19] 卢芳仪,卢爱军.高纯二氧化硅的研制[J].上海化工,2000,(16):18-20.
[20] 贾东舒,童忠良.纳米SiO2粉体的制备与研究[J].化工进展,2003,22(7):735-738.
[21] 郑典模,苏学军.化学沉淀法制备纳米SiO2的研究[J].南昌大学学报(工科版),2003,25(2):39-41.
[22] Wang B Y,Wu J M,Yuan Z Y,et al.Synthesis of MCM-22 zeolite by an ultrasonic-assisted aging procedure[J].UltrasonicsSonochemistry,2008,15(4):334-338.
[23] 陈志刚,陈彩凤,刘 苏.超声场中湿法制备Al2O3纳米粉工艺研究[J].硅酸盐学报,2003,31(2):213-217.
[24] Du K,Fu W Y,Wei R H,et al.Ultrasonic-assisted synthesis of highly dispersed MoO3nanospheres using 3-mercaptopropyltrimethoxysliane[J].UltrasonicsSonochemistry,2008,15(3):233-238.
[25] 顾幸勇,李 霞,刘 淇,等.水热法制备ZrO2(3Y)纳米粉体中矿物剂的作用[J].陶瓷学报,2005,26(4):216-219.
Synthesis of Ultrafine SiO2by Chemical Precipitation Method
ZHENGJing,LINYin-qin
(Fujian Vocational College of Bioengineering,Fuzhou 350002,China)
This article briefly summarizes the synthesis and characterization of ultrafine SiO2.Using Na2SiO3·9H2O as source of silica ultrafine SiO2were obtained by precipitatin process. In this work some influences of sodium silicate concentration, calcining heat and ultrasonic treatment on the synthesis of ultrafine SiO2were discussed. The results show that the optimal preparation condition Is, sodium silicate concentration is 0.20 g/mL, and calcination condition is 600 ℃, 4 h. N2adsorption-desorption isotherms, XRD, FT-IR and some other experiment methods were used to investigate the structure and other physical properties of the samples. The results show that the SiO2are amorphous, and the BET specific surface areas of the samples are larger than 400 m2/g。
ultrafine SiO2;precipitation method;Na2SiO3·9H2O;ultrasonic
郑 婧(1983-),女,助教,硕士.主要从事催化材料的研究.
TQ424.26;TQ426.65
A
1001-1625(2016)09-2941-05

