CYP3A5和VEGFR3基因多态性对舒尼替尼治疗胃肠道间质瘤的影响
厉志昂,王亚旭,黄勇
(重庆医科大学第二附属医院胃肠外科,重庆400010)
CYP3A5和VEGFR3基因多态性对舒尼替尼治疗胃肠道间质瘤的影响
厉志昂,王亚旭△,黄勇
(重庆医科大学第二附属医院胃肠外科,重庆400010)
目的探讨细胞色素P4503A5(CYP3A5)和血管内皮生长因子受体3(VEGFR3)基因多态性对舒尼替尼治疗胃肠道间质瘤(GIST)的影响。方法收集2013年8月至2014年8月该院胃肠外科住院手术治疗的25例GIST患者肘静脉外周血标本,采用聚合酶链反应测序对CYP3A5基因rs776746和VEGFR3基因rs307826的基因序列进行检测,术后因应用伊马替尼耐药或不能耐受或基因检测表明舒尼替尼敏感而应用舒尼替尼治疗,并随访跟踪疗效及不良反应。结果25例患者中VEGFR3基因rs307826 AG型仅2例(8.0%),AA型23例(92.0%),未发现GG型;AA型患者疾病控制率明显高于AG型,差异有统计学意义(Fisher=8.696,P=0.033 0);rs307826位点基因型与患者年龄、性别、肿瘤部位、肿瘤危险度分级、肿瘤临床病理类型等均无关(P>0.05)。25例患者中CYP3A5基因rs776746 AG型12例(48.0%),GG型13例(52.0%),未发现AA型;GG型患者不良反应明显轻于AG型,差异有统计学意义(Fisher=8.901,P=0.012 0);rs776746位点基因型与患者年龄、性别、肿瘤部位、肿瘤危险度分级、肿瘤临床病理类型等均无关(P>0.05)。结论舒尼替尼治疗GIST可明显提高大部分患者疾病控制率。检测CYP3A5基因多态性对GIST的个体化治疗及不良反应的预防和处理具有重要意义。
胃肠肿瘤;间皮瘤;多态性,单核苷酸;基因型;舒尼替尼
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是一组来源于胃肠道间叶源性肿瘤,国内发病率为百万分之一至二,但在消化道间叶肿瘤中占有及其重要的地位。分子水平研究使人们进一步深入认识了GIST,GIST发生因素中最为关键的是c-kit基因及血小板源性生长因子受体基因突变[1-3]。酪氨酸激酶抑制剂——伊马替尼、苹果酸舒尼替尼胶囊(索坦)等靶向治疗药物的应用极大提高了GIST的疗效。
基因多态性是指一个生物群体中存在多种不连续的基因型。有研究表明,基因多态性可影响不同个体对疾病的易感性、药物不良反应和疗效[4]。肿瘤的发生、生长、转移与血管内皮生长因子(vascular endothelial growth factor,VEGF)的高表达密切相关。VEGF受体3(vascular endothelial growth factor receptor,VEGFR3)是VEGFR中的一种,主要表达于淋巴管内皮细胞,其信号通路在肿瘤淋巴转移、肿瘤淋巴管形成等方面具有重要意义。细胞色素P450(cytochrome P450,CYP)是人体内一种与药物代谢有关的酶,参与多种化合物的代谢包括药物的生物转化等,与药物在体内的清除密切相关,能代谢近90.0%临床药物[5]。CYP3A5是CYP3A的一种亚型,其表达的多态性被认为是CYP3A活性差异的最重要因素。随着人们对GIST认识的逐步加深,研究基因多态性与疾病发生、发展的关系受到越来越多的关注,目前,尚未见有关CYP3A5基因rs776746和VEGFR3基因rs307826多态性与舒尼替尼治疗GIST的疗效与不良反应的研究。本研究回顾性分析了CYP3A5基因rs776746和VEGFR3基因rs307826多态性与舒尼替尼治疗GIST的疗效、不良反应的关系,并希望可以为GIST的靶向治疗提供更加科学、有效、个体化的临床依据。
1 资料与方法
1.1资料
1.1.1资料来源收集2013年8月至2014年8月本院胃肠外科住院手术治疗的25例GIST患者术后2周采集的肘静脉血标本,术后常规进行病理检查及基因检测均证实为GIST。
1.1.2排除标准排除患有高血压、冠心病、糖尿病等基础疾病的患者。
1.1.3仪器与试剂无水乙醇、95%乙醇、CYP3A5基因rs776746引物、VEGFR3基因rs307826引物、全血DNA提取试剂盒、DNA FFPE Tissue试剂盒、Taq酶、dNTP、聚合酶链反应(polymerase chain reaction,PCR)仪9700、海尔冰箱、涡旋混合器XW-80A、ABI3730DNA测序仪、平板离心机、电热恒温水浴锅、电泳仪JY300C、Ge1Doc凝胶成像分析系统等。
1.2方法
1.2.1治疗方法25例患者中应用伊马替尼期间出现疾病进展17例,不能耐受伊马替尼4例(将常规剂量400 mg改为300 mg后患者仍有严重骨髓抑制),基因检测c-kit外显子9突变及野生型4例,故均采用索坦(美国辉瑞公司,批号不详)口服,每天1次,每次50 mg,用药28 d停药14 d。根据患者身体耐受情况和病情程度以12.5 mg为梯度单位适当调整剂量[6]。
1.2.2基因测序收集的外周静脉血标本用乙二胺四乙酸抗凝,离心,分离血细胞和血浆,于-20℃冰箱保存。提取全血基因组DNA,并对目的基因进行PCR扩增,设计合成CYP3A5基因rs776746和VEGFR3基因rs307826位点的PCR引物序列(表1)。用50 mL PCR扩增体系扩增:94℃预变性5 min,94℃变性15 s,60℃退火25s,72℃延伸30 s 40个循环;72℃延伸5 min。扩增后用琼脂凝胶电泳,电泳完毕取出凝胶,在紫外线成像系统下观察PCR检测结果。最后进行基因测序,使用Chromas软件进行数据分析。
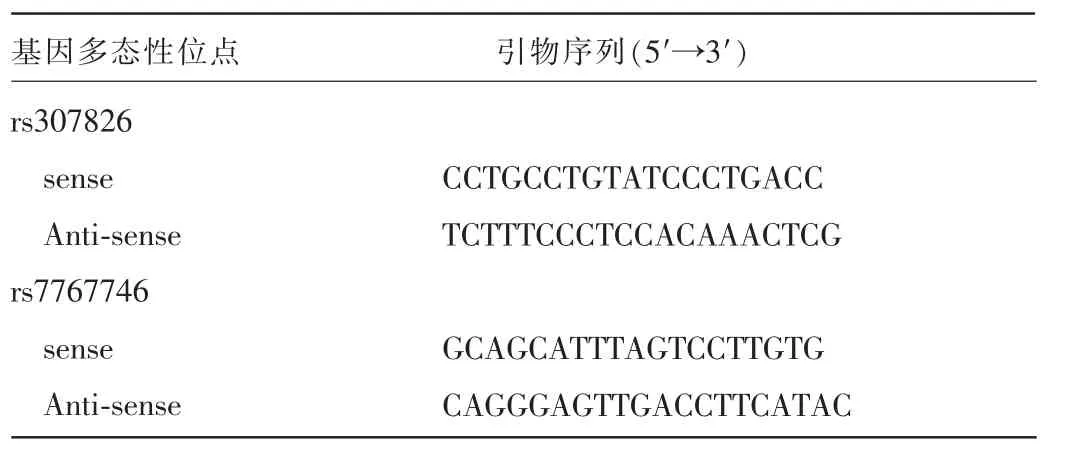
表1 PCR引物
1.2.3观察指标严密观察患者血常规,肝、肾功能,心电图和尿常规等,于第1次用药及以后每12周复查腹部CT,并做相应记录。
1.2.4疗效判定标准采用文献[7]的标准,在第24周进行疗效评估包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。主要观察终点为无进展生存期(progression-free survival,PFS)、总生存期(overall survival,OS)、客观有效(CR+PR)及疾病控制(CR+PR+SD)。PFS定义为从接受第一剂量舒尼替尼至PD的时间,OS定义为从接受第一剂量舒尼替尼至死亡的时间。采用NCI标准对患者出现的不良反应进行判定及记录。
1.2.5随访对出院患者进行电话、电子邮箱、门诊随访等,对患者出院后病情控制情况进行调查和统计。
1.3统计学处理应用SPSS21.0统计软件进行数据分析,计数资料以率或构成比表示,采用χ2检验、Fisher′s精确检验。P<0.05为差异有统计学意义。
2 结果
2.1一般资料25例患者一般资料见表2。
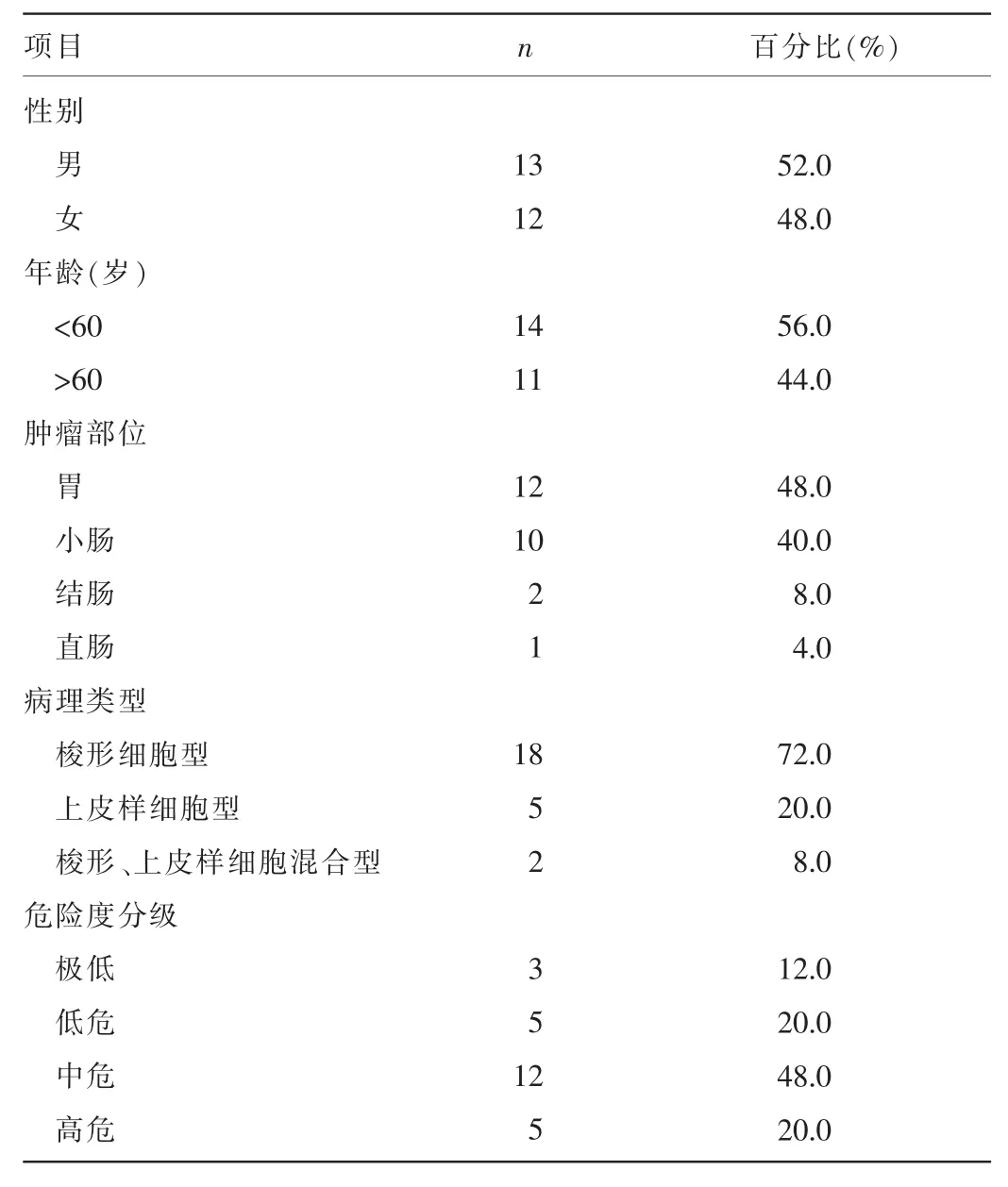
表2 患者一般资料(n=25)
2.2基因测序结果
2.2.1VEGFR3基因rs30782625例患者中AG型2例(8.0%),AA型23例(92.0%),未发现GG型。
2.2.2CYP3A5基因rs77674625例患者中AG型12例(48.0%),GG型13例(52.0%),未发现AA型。
2.3基因位点多态性分析
2.3.1VEGFR3基因rs307826rs307826位点基因型与患者年龄、性别、肿瘤部位、肿瘤危险度分级、肿瘤临床病理类型等均无关(P>0.05),见表3。
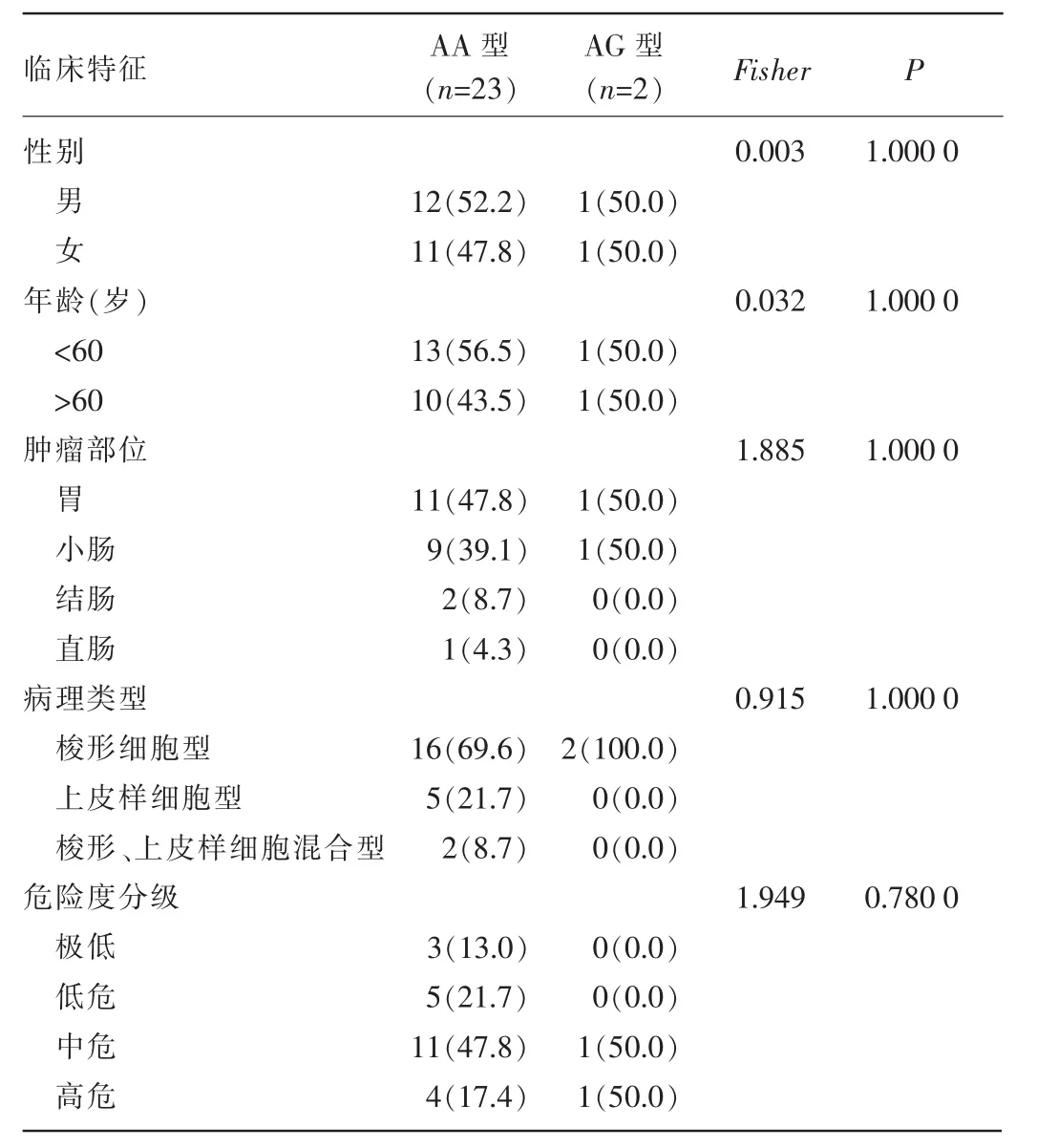
表3 VEGFR3基因rs307826位点基因型与临床特征相关性[n(%)]
2.3.2CYP3A5基因rs776746rs776746位点基因型与患者年龄、性别、肿瘤部位、肿瘤危险度分级、肿瘤临床病理类型等均无关(P>0.05),见表4。

表4 CYP3A5基因rs776746位点基因型与临床特征相关性[n(%)]
2.4VEGFR3基因rs307826位点多态性对舒尼替尼疗效的影响25例患者中出现不同程度进展16例,AA型患者疾病控制率明显高于AG型,差异有统计学意义(Fisher=8.696,P=0.033 0),见表5。

表5 EGFR3基因rs307826位点多态性与舒尼替尼疗效分析
2.5CYP3A5基因rs776746位点多态性对舒尼替尼不良反应的影响主要不良反应为手足综合征、恶心、乏力、腹泻、血液系统并发症等,GG型患者不良反应明显轻于AG型,差异有统计学意义(Fisher=8.901,P=0.012 0)。见表6。
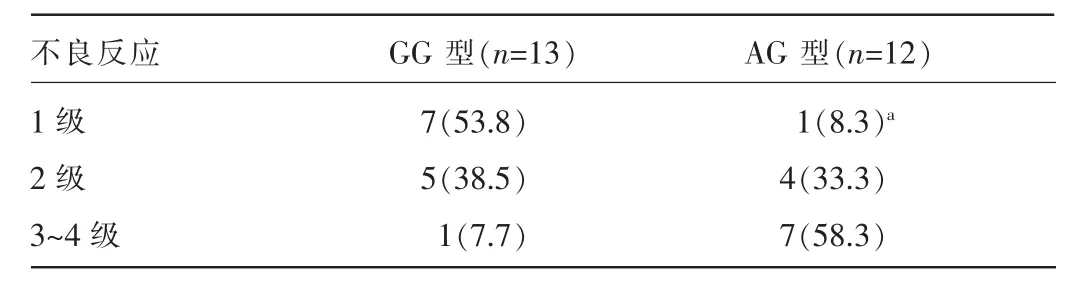
表6 CYP3A5基因rs776746位点多态性与舒尼替尼不良反应分析
3 讨论
GIST发病率虽然不高,但却是消化道中最常见的间叶源性肿瘤,男女发病比例相差无几(分别为55.0%、45.0%),各年龄段均可发病,发病年龄为55~60岁[8]。目前,主要以手术为主,再辅以靶向生物治疗等综合治疗。随肿瘤分子生物学的发展及研究,靶向治疗已成为GIST不可替代的治疗方式。2002年美国食品药品监督管理局(food and drug administration,FDA)批准伊马替尼用于无法手术切除或复发转移的GIST患者,目前为止仍为GIST靶向治疗的一线用药。Fujimoto等[9]研究发现,术前应用伊马替尼进行新辅助治疗后患者直肠GIST瘤体缩小明显,降低了手术难度,增加了手术效果。Bamboat等[10]认为,伊马替尼在GIST新辅助治疗方面安全、可行,且耐受性良好。但随伊马替尼的应用,伊马替尼耐药或患者不耐受情况越来越受到重视,2006年1月FDA批准舒尼替尼作为伊马替尼耐药或不能耐受的二线用药。舒尼替尼对伊马替尼耐药或不耐受的GIST患者有效。在GIST治疗中靶向治疗具有更好的疗效及耐受性,但靶向治疗药物的不良反应与个体差异不容忽视。有研究表明,靶向药物不良反应及疗效与CYP3A5基因和VEGFR3基因中某些片段的单核苷酸多态性密切相关[11]。因此,检测这些基因多态性片段对评估舒尼替尼疗效及不良反应具有重要意义。
VEGFR3是VEGF-C特异性受体,VEGF-C与VEGFR3特异性结合,受体发生磷酸化,激活相应传导通路,促进淋巴管内皮细胞增殖、迁移、分化等生物学过程,影响肿瘤侵袭性,改变细胞基质与肿瘤细胞的黏附性,为肿瘤细胞浸润创造了条件[8]。有研究表明,在GIST中VEGFR与PDGFR-α表达均升高,表达强度随肿瘤危险度升高而升高,且VEGFR升高较PDGFR-α明显[12]。总之,通过检测VEGFR3基因单核苷酸多态性,有助于评判GIST危险度及药物疗效,且根据检测结果给予个体化用药。
CYP3A5基因是CYP3A家族的一个亚型。Faivre等[13]认为,CYP3A5基因突变能影响其代谢酶活性,改变代谢底物的速率和能力。在临床用药中这是出现个体差异的最重要原因之一。因此,对CYP3A5基因的研究成为解释酶活性差异的热点,导致药物个体差异的重要因素之一是CYP3A5基因多态性。有研究表明,CYP3A5基因rs776746多态性可用以检测肾细胞癌应用舒尼替尼靶向治疗过程中的药物不良反应,因药物不良反应而减量的风险与CYP3A5基因rs776746位点高代谢等位基因相关(危害比:3.75,95%可信区间:1.67~8.41,P= 0.001 4),rs776746位点GG型较AG型不容易引起药物不良反应[14-15]。在GIST的治疗中舒尼替尼产生的不良反应亦不容忽视。因此,通过检测CYP3A5基因多态性可预测舒尼替尼治疗GIST过程中的不良反应,从而早预防及治疗,为个体化治疗提供依据。本研究发现,GIST患者中CYP3A5基因rs776746位点AG型占48.0%,GG型占52.0%,未发现AA型,因此,虽然GIST患者能明显从舒尼替尼治疗中受益,但其不良反应不容忽视,应密切观察并及时处理。本研究还发现,CYP3A5基因rs776746和VEGFR3基因rs307826位点基因型与患者年龄、性别、肿瘤危险度分级、肿瘤临床病理类型等均无关(P>0.05);GIST患者中VEGFR3基因rs307826位点AA型占92.0%,且AA型患者疾病控制率明显高于AG型,差异有统计学意义(Fisher=8.696,P=0.033 0),表明AA型患者舒尼替尼疗效较好,且大多数GIST患者为AA型,表明大多数GIST患者能从舒尼替尼治疗中获益。GG型患者不良反应明显轻于AG型,差异有统计学意义(Fisher=8.901,P=0.012 0)。上述研究结果在舒尼替尼治疗肾癌中亦有相似结论[15]。本研究未发现CYP3A5基因rs776746 AA型和VEGFR3基因rs307826 GG型,这2种基因型可能不是GIST患者突变热点。
综上所述,GIST患者能明显从舒尼替尼治疗中获益,但药物不良反应是不容忽视的,因此,检测CYP3A5基因rs776746位点单核苷酸多态性能提早预防及治疗舒尼替尼不良反应,对个体化治疗及预防具有重要意义,尽量避免因其不良反应而导致减量或停药。当然,该结论尚有待于扩大样本进一步研究证实。
[1]Schaefer IM,Delfs C,Cameron S,et al.Chromosomal aberrations in primary PDGFRA-mutated gastrointestinal stromal tumors[J].Hum Pathol,2014,45(1):85-97.
[2]Palmirotta R,De Marchis ML,Ludovici G,et al.Mutational analysis of gastrointestinal stromal tumors(GISTs):procedural approach for diagnostic purposes[J].Cancer Genomics Proteomics,2013,10(3):115-123.
[3]Corless CL.Gastrointestinal stromal tumors:what do we know now?[J]. Mod Pathol,2014,27 Suppl 1:S1-16.
[4]F觟rsti A,Jin Q,Altieri A,et al.Polymorphisms in the KDR and POSTN genes:association with breast cancer susceptibility and prognosis[J].Breast Cancer Res Treat,2007,101(1):83-93.
[5]王若伦,叶晓光,叶丽卡,等.细胞色素P4503A5基因多态性的研究进展[J].中国药房,2008,19(4):304-307.
[6]Laperouse P,Raines D,Diamond K,et al.Gastrointestinal stromal tumors:a case report and review of the literature[J].J La State Med Soc,2008,160(3):128-133.
[7]Choi H.Response evaluation of gastrointrstimal stromal tumors[J].Oncologist,2008,13 Suppl 2:S4-7.
[8]Demetri GD,heinrich MC,Fletcher JA,et al.Molecular target modulation,imaging,and clinical evaluation of gastrointestinal stromal tumor patients treated with sunitinib malate after imatinib failure[J].Clin cancer Res,2009,15(18):5902-5909.
[9]Fujimoto Y,Akiyoshi T,Konishi T,et al.Laparoscopic sphincter-preserving surgery(intersphincteric resection)after neoadjuvant imatinib treatment for gastrointestinal stromal tumor(GIST)of the rectum[J].Int J Colarertul Die,2014,29(1):111-116.
[10]Bamboat ZM,DeMatteo RP.Metastasectomy for gastrointestinal stromaltumors[J].J Surg Ottcol,2014,109(1):23-27.
[11]Ganapathi RN,Bukowski RM.Predicting responses to sunitinib using single nucleotide polymorphisms:progress and recommendations for future trials[J].Genome Med,2011,3(12):79.
[12]李建军,陈宏,张庆亭,等.VEGFR、PDGFR-α在胃肠道间质瘤中的表达与意义[J].河南职工医学院学报,2013,25(4):381-384.
[13]Faivre S,Demetri G,Sargent W,et al.Molecular basis for sunitinib efficacy and future clinical development[J].Nat Rev Drug Discov,2007,6(9):734-745.
[14]Xu CF,Bing NX,Ball HA,et al.Pazopanib efficacy in renal cell carcinoma:evidence for predictive genetic markers in angiogenesis-related and exposure-related genes[J].J Clin Oncol,2011,29(18):2557-2564.
[15]刘秀峰,秦叔速,王琳,等.苹果酸舒尼替尼二线治疗国人晚期胃肠间质瘤的临床观察[J].临床肿瘤学杂志,2013,18(7):636-639.
Influence of CYP3A5 and VEGFR-3 gene polymorphism on sunitinib treatment of gastrointestinal stromal tumors
Li Zhiang,Wang Yaxu△,Huang Yong
(Department of Gastrointestinal Surgery,Second Affiliated Hospital,Chongqing Medical U-niversity,Chongqing 400010,China)
ObjectiveTo investigate the influence of cytochrome P4503A5(CYP3A5)and vascular endothelial growth factor receptor 3(VEGFR-3)gene polymorphism on the sunitinib treatment in gastrointestinal stromal tumors(GIST).Methods The elbow venous peripheral blood sample was taken for detecting the gene sequence of rs776746 polymorphisms of CYP3A5 gene and rs307826 polymorphisms of VEGFR3 gene by PCR direct sequencing.Sunitinib was used due to imatinib resistance after operation,or unable tolerance or sunitinib sensitivity indicated by gene detection.The curative effect and adverse reactions were fol lowed up and tracked.ResultsAmong 25 cases,only 2 case(8.0%)were rs307826 type of VEGFR3 gene,23 cases(92.0%)were AA type and GG type was not found;the disease control rate of AA type was significantly higher than that of AG type,the difference was statistically significant(Fisher=8.696,P=0.033);rs307826 site genotype had no relation with the age,sex,tumor site,tumorriskgrade andtumorclinicopathologicaltype(P>0.05).Among25 cases,12 cases(48.0%)were rs776746 AG type of CYP3A5 gene,13 cases(52.0%)were GG type and AA type was not found;the adverse reactions in the patients with GG type were significantly slighter than those in AG type,the difference was statistically significant(Fisher=8.901,P=0.012 0);rs776746 site genotype had no relation with the age,sex,tumor site,tumor risk grade and tumor clinicopathological type(P>0.05).ConclusionThe sunitinib treatment of GIST can elevate the disease control rate in the majority of patients.Detecting the polymorphism of CYP3A5 gene has an important significance to the individualized therapy,prevention and treatment of adverse reactions in GIST.
Gastrointestinal neoplasms;Mesothelioma;Polymorphism,single nucleotide;Genotype;Sunitinib
10.3969/j.issn.1009-5519.2016.12.010
A
1009-5519(2016)12-1806-04
厉志昂(1991-),硕士研究生,主要从事胃肠道间质瘤的研究与治疗。
△,E-mail:408861993@qq.com。
(2016-03-01)

