铬还原酶ChrT工程菌的遗传稳定性研究*
周思敏,唐娴,邓鹏,董兰岚,何元,贾燕,白群华,肖虹
(重庆医科大学公共卫生与管理学院/医学与社会发展研究中心/健康领域社会风险预测治理协同创新中心,重庆400016)
铬还原酶ChrT工程菌的遗传稳定性研究*
周思敏,唐娴#,邓鹏,董兰岚,何元,贾燕,白群华,肖虹△
(重庆医科大学公共卫生与管理学院/医学与社会发展研究中心/健康领域社会风险预测治理协同创新中心,重庆400016)
目的研究重组铬还原酶ChrT工程菌的遗传稳定性。方法将ChrT工程菌传至50代,每10代进行遗传稳定性相关检测。同时设置不加菌液的对照组作为空白对照组。结果各代ChrT工程菌的菌落生长形态、革兰染色、生化反应结果与原代菌株一致;各代ChrT工程菌质粒稳定,ChrT基因序列未见突变或丢失;经异丙基硫代-β-D-半乳糖苷(IPTG)诱导表达后,各代ChrT工程菌的目的蛋白表达水平与原代无明显差别;在含六价铬[Cr(Ⅵ)]50 mg/L的LB液体培养基中,与空白对照组比较,48 h后各代ChrT工程菌培养基中Cr(Ⅵ)的质量浓度明显减少,差异均有统计学意义(P<0.05);各代ChrT工程菌间除Cr(Ⅵ)能力比较,差异无统计学意义(P>0.05)。结论ChrT工程菌生物学特性稳定,可用于治理环境中Cr(Ⅵ)的污染。
铬;大肠杆菌;基因表达;生物转化;铬还原酶;工程菌;遗传稳定性
铬是一种非常重要的金属元素,广泛地应用于冶金、制革、颜料、染料、香料、造币、医药等制造行业,具有巨大的经济价值[1]。随着工业化进程的不断推进,中国已成为世界铬盐生产大国,每年的产铬总量超过30万吨[2];然而,含铬废水未经处理直接排放及铬渣的任意堆积,对水体和土壤等环境都造成了严重污染[3-4]。环境中常见的铬其存在形式有三价铬[Cr(Ⅲ)]和六价铬[Cr(Ⅵ)]2种[4-6];Cr(Ⅵ)由于有极高的水溶性,其毒性远大于水溶性低的Cr(Ⅲ),是国际公认的致癌金属物之一[2,7]。Cr(Ⅵ)可经皮肤、呼吸和饮食进入人类机体,对皮肤、呼吸道和消化道有刺激和致癌作用[8]。因此,治理环境中的Cr(Ⅵ)污染十分必要。
目前,国内外处理环境中的Cr(Ⅵ)污染大多采用理化法,如化学还原法、离子交换法、吸附法、膜分离法等[9-10],但理化法存在消耗原材料多、产生大量淤泥、处理费用高、容易产生新污染等缺点[11]。近年发展起来的生物治理方式可利用微生物的吸附使环境中Cr(Ⅵ)的浓度降低,或利用微生物的铬还原酶使Cr(Ⅵ)还原为Cr(Ⅲ),从而达到Cr(Ⅵ)解毒的目的[12-14]。这种微生物治理方法具有经济、高效、无须大量化学试剂、无二次新污染等诸多优点[15],已成为世界各国治理环境中Cr(Ⅵ)污染的研究热点。铬还原酶ChrT是一种黄素蛋白,以还原型辅酶Ⅱ(NADPH)为电子供体,以Cr(Ⅵ)为电子受体(底物),为呼吸链提供电子,同时达到还原底物的目的[16],即将Cr(Ⅵ)还原为Cr(Ⅲ)。沙雷菌(Serratia sp.)S2是从长期Cr(Ⅵ)污染的环境中分离筛选出具有高效除Cr(Ⅵ)能力的细菌[17],被证实具有铬还原的相关基因ChrT[18]。目前已利用基因工程技术将ChrT基因连接至表达载体并转入宿主菌大肠埃希菌(E.coli)BL21(DE3),使其获得清除Cr(Ⅵ)能力,成功构建了ChrT工程菌[19];但对于实际应用中工程菌的稳定性并未深入研究。因此,本研究以铬还原酶ChrT工程菌为基础,探讨其遗传稳定性,为工程菌实际应用的可行性提供依据。
1 材料与方法
1.1材料
1.1.1菌种与质粒大肠埃希菌BL21(DE3)感受态细胞[天根生化科技(北京)公司],表达载体pET-28a(+)(Novagen公司)。
1.1.2主要试剂质粒小提试剂盒、2×Pfu PCR Master-Mix高保真酶[天根生化科技(北京)公司],异丙基硫代-β-D-半乳糖苷(IPTG)、DNA marker(日本Takara公司),LB培养基、卡那霉素[生工生物工程(上海)股份有限公司];其他试剂均为国产或进口分析纯试剂。
1.2方法
1.2.1ChrT工程菌传代取适量ChrT工程菌接种于100 mL的LB液体培养基中,37℃,200 r/min离心,培养24 h转种传代,共传50代。每10代取菌液进行1次遗传稳定性相关检测。
1.2.2菌落生长形态观察每10代取菌液划线接种于LB平板,于37℃培养24 h,观察各代ChrT工程菌菌落生长形态。
1.2.3革兰染色每10代取菌液按照常规方法[20]进行革兰染色,于普通光学显微镜下观察细菌染色情况。
1.2.4生化反应每10代取菌液接种大肠埃希菌微量生化反应管,于37℃培养24 h,观察结果。
1.2.5重组质粒鉴定每10代取适量菌液用质粒小提试剂盒提取质粒,操作步骤参照试剂盒说明书;以提取的质粒为模板,进行ChrT基因的PCR扩增并将扩增产物送至生工生物工程(上海)股份有限公司测序。
1.2.6蛋白表达产物检测每10代取1 mL菌液接种于100 mL LB培养液中,37℃,250 r/min离心;3 h后加入诱导剂IPTG,37℃,200 r/min离心;10 h后取菌液进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE),检测ChrT蛋白的表达水平。
1.2.7ChrT工程菌除Cr(Ⅵ)能力检测每10代取1mL菌液接种于100 mL含50 mg/L Cr(Ⅵ)的LB液体培养基中,37℃,200 r/min离心,48 h后取上清液,检测其Cr(Ⅵ)水平,以确定各代ChrT工程菌去除Cr(Ⅵ)的能力。每一种处理均设置3个重复,同时设置不加菌液的对照组作为空白对照组。
1.3统计学处理应用SPSS17.0统计软件进行数据分析,计量资料以表示,采用2个独立样本t检验比较各代ChrT工程菌与空白对照组的除Cr(Ⅵ)能力,单因素方差分析比较各代ChrT工程菌间的除Cr(Ⅵ)能力,P<0.05为差异有统计学意义。
2 结果
2.1ChrT工程菌菌落生长形态原代(第0代)与第50代ChrT工程菌在LB平板上的生长形态无明显区别,均为典型的大肠埃希菌菌落形态:白色、圆形、隆起、光滑,无杂菌生长,与文献[21]报道一致。见图1。
2.2ChrT工程菌革兰染色镜下观察,各代ChrT工程菌的革兰染色结果均为革兰阴性无芽孢杆菌,见图2。

图1 ChrT工程菌菌落生长形态

图2 ChrT工程菌革兰染色
2.3各代ChrT工程菌生化反应各代ChrT工程菌的生化反应结果均未发生改变,与大肠埃希菌相符,见表1。

表1 各代ChrT工程菌菌株生化反应结果
2.4重组质粒各代ChrT工程菌质粒的PCR产物的琼脂糖凝胶电泳结果见图3。各代均能扩增出全ChrT基因(约600 bp),且各代ChrT基因的测序结果一致,并未发生变异。
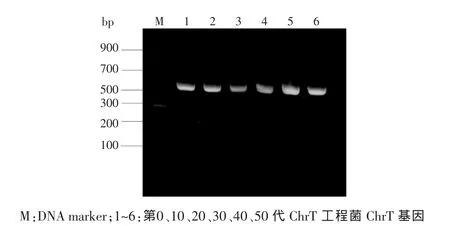
图3 各代ChrT工程菌质粒的PCR产物鉴定
2.5目的蛋白表达各代ChrT工程菌经IPTG诱导表达的目的蛋白表达结果见图4。各代ChrT工程菌均能表达出目的蛋白(约为26×103),且表达水平与原代无明显差别。

图4 各代ChrT工程菌目的蛋白的表达水平
2.6ChrT工程菌铬还原能力测定各代ChrT工程菌的除Cr(Ⅵ)效率见图5。各代ChrT工程菌对Cr(Ⅵ)都具有一定还原能力;在含Cr(Ⅵ)50 mg/L的LB液体培养基中,与空白对照组比较,48 h后各代ChrT工程菌培养基中Cr(Ⅵ)的质量浓度明显减少,差异均有统计学意义(P<0.05);同时,各代ChrT工程菌除Cr(Ⅵ)能力并未发生改变,各组间剩余的Cr(Ⅵ)质量浓度比较,差异无统计学意义(P>0.05),除Cr(Ⅵ)率约为40%。

图5 各代ChrT工程菌的除Cr(Ⅵ)能力
3 讨论
微生物治理Cr(Ⅵ)污染的应用中,由于Cr(Ⅵ)对细菌的DNA具有损伤,除Cr(Ⅵ)的效率和稳定性不稳定[22]。为解决这一问题,有研究者提出将铬相关基因导入其他适应力更强的宿主菌中,构建高效除Cr(Ⅵ)工程菌[23]。ChrT工程菌是利用基因工程技术,以沙雷菌S2基因组DNA为模板,扩增铬还原酶ChrT基因,将所得ChrT基因连接至表达载体pET-28a(+)并转化进大肠埃希菌感受态细胞大肠埃希菌BL21(DE3)所获得[24];大肠埃希菌获得了铬还原酶ChrT基因并使之表达,从而具有了除Cr(Ⅵ)的能力。
大肠埃希菌具有易培养、遗传背景清楚、载体受体系统完备、生长快速等优点,已经成为基因工程构建中的主要宿主菌之一[25-27]。然而,其质粒加上外源基因并转化到大肠埃希菌BL21(DE3)之后,可能会产生一系列的生理效应,影响其自身的稳定性[22];此外,在大肠埃希菌表达外源基因时,有时会引起重组质粒的不稳定[28]。近年来,有学者指出工程菌的不稳定包括了质粒的不稳定及其表达产物的不稳定2个方面[26],进而直接影响工程菌性能及目的蛋白的表达;因此,对于利用基因工程技术扩展微生物的实际应用而言,这是一个必须解决的重要问题。就目前的研究来看,主要的解决方法为组建合适的载体、选择适当的宿主、施加选择压力、控制基因过量表达、控制培养条件等[29-30]。
工程菌经过多代增殖后,宿主菌稳定性、质粒稳定性和表达产物的稳定性在实际应用中至关重要。本研究通过对铬还原酶ChrT工程菌进行传代培养,并对不同代菌株的生物学、遗传学特性的稳定性进行了全面检测。结果表明,连续传代50代,各代ChrT工程菌菌株的菌落生长形态、革兰染色、生化反应、重组质粒、目的蛋白表达水平及除Cr(Ⅵ)能力均与原代一致,说明该ChrT工程菌具有良好的遗传稳定性,能够确保ChrT基因在大肠埃希菌BL21(DE3)内持续稳定地表达,并在各代间保持量产、活性等一致,为大规模生产和实际应用奠定基础。
[1]肖伟,王磊,李倬锴,等.六价铬还原细菌Bacillus cereus S5.4还原机理及酶学性质研究[J].环境科学,2008,29(3):751-755.
[2]马亚梦,王洋洋,谭秀民,等.Cr(Ⅵ)污染生物修复研究进展[J].安徽农业科学,2015,43(22):176-178.
[3]刘振龙.厌氧消化污泥堆存解毒铬污染土壤研究[D].青岛:青岛理工大学,2014.
[4]刘帅霞.两段式还原工艺解毒铬渣技术研究[D].上海:东华大学,2013.
[5]酆婧轩,李芸邑,师帅,等.硫代硫酸钠、磷酸钠联合处理铬渣中的六价铬[J].中国环境科学,2015,35(11):3333-3339.
[6]封琳.厌氧消化污泥解毒铬污染土壤实验研究[D].青岛:青岛理工大学,2013.
[7]郭彦娟.水源六价铬污染应急处理技术研究[J].仪器仪表与分析监测,2014(1):35-37.
[8]马亚楠.新疆阿克苏和伊犁地区肉牛产地土壤、水和饲料中重金属含量的测定研究[D].乌鲁木齐:新疆农业大学,2013.
[9]晁浏宏,杨海舟.离子交换法处理含铬废水的动态吸附试验研究[J].四川建材,2014,40(1):114-116.
[10]陈素红.玉米秸秆的改性及其对六价铬离子吸附性能的研究[D].济南:山东大学,2012.
[11]Costa M,Klein CB.Toxicity and carcinogenicity of Chromium compounds in humans[J].Crit Rev Toxicol,2006,36(2):155-163.
[12]杨威.铬污染土壤特性表征与陶粒制备机制[D].重庆:重庆大学,2012.
[13]高小朋,张欠欠,许平,等.微生物还原Cr(VI)的研究进展[J].微生物学通报,2008,35(5):820-824.
[14]宋玄,李裕,张茹.铬污染土壤修复技术研究[J].山西化工,2014,34(1):86-88.
[15]杨文玲,王继雯,慕琦,等.耐Cr(VI)菌株的筛选及条件优化[J].河南科学,2013,31(8):1175-1179.
[16]谭小庆,白群华,韩令力,等.耐铬沙雷氏菌CQMUS2 FMN_red基因片段的克隆与序列分析[J].生物技术,2013,23(5):8-11.
[17]贾燕,白群华,肖虹.重庆市某电镀厂聚集区域铬污染状况调查[J].现代预防医学,2014,41(6):978-980.
[18]Deng P,Tan X,Wu Y,et al.Cloning and sequence analysis demonstrate the chromate reduction ability of a novel chromate reductase gene from Serratia sp[J].Exp Ther Med,2015,9(3):795-800.
[19]谭小庆,邓鹏,吴颖,等.铬还原酶T体外合成及活性鉴定[J].重庆医科大学学报,2014,39(7):973-977.
[20]洪庆华,石璐,孙井梅,等.革兰氏染色三步法应用试验探讨[J].实验室研究与探索,2010,29(11):15-17.
[21]秦李娜,刘英,胡海峰,等.重组精氨酸脱亚胺酶工程菌的遗传稳定性[J].中国医药工业杂志,2015,46(5):459-461.
[22]龙腾发,柴立元,郑粟,等.生物法解毒六价铬技术的应用现状与进展[J].安全与环境工程,2004,11(3):22-25.
[23]倪修龙,王毓芳,徐章法.含铬废水的生物治理[J].上海化工,2000,25(23):4-6.
[24]谭小庆.沙雷氏菌CQMUS2铬还原酶ChrT基因的克隆、表达及酶活性的初步研究[D].重庆:重庆医科大学,2014.
[25]翟成一,徐岩,聂尧,等.产普鲁兰酶重组大肠杆菌质粒稳定性的研究[J].工业微生物,2015,45(2):13-20.
[26]薛晓畅,李萌,秦鑫,等.重组人B淋巴细胞刺激因子工程菌生物学特性的稳定性[J].中国生物制品学杂志,2008,21(9):777-779.
[27]邵哲旭,李芊,边春象,等.大肠杆菌TOP10F′中重组质粒pBAD/gⅢA-NTF2稳定性考察[J].绵阳师范学院学报,2010,29(2):79-83.
[28]陈悦,李环,韦萍.产乙酰鸟氨酸脱乙酰基酶基因工程菌的构建及遗传稳定性研究[J].工业微生物,2008,38(2):23-27.
[29]黄志立.基因工程菌发酵过程中的不稳定性研究[J].深圳职业技术学院学报,2002,1(3):23-28.
[30]吴乃虎.基因工程原理(上册)[M].2版.北京:科学出版社,1998:229-239.
Study on genetic stability of recombinant chromium reductase ChrT engineered bacterium*
Zhou Simin,Tang Xian#,Deng Peng,Dong Lanlan,He Yuan,Jia Yan,Bai Qunhua,Xiao Hong△(School of Public Health and Management,Research Center for Medicine and Social Development,Collaborative Innovation Center for Social Risk Prediction and Governance in Health Field,Chongqing Medical University,Chongqing 400016,China)
ObjectiveTo study the genetic stability of recombinant chromium reductase(ChrT)engineered bacterium. MethodsThe ChrT engineered bacterium was subcultured for 50 passages and the genetic stability related detection was performed in every 10 passages.At the same time the blank control group without adding the bacterial solution was set.ResultsThe colony growth pattern,Gram′s staining and biochemical reaction results of every passage of ChrT engineered bacterium were consistent with the primary bacterial strain;plasmids in each passage of ChrT engineered bacterium were stable and ChrT gene sequences had no mutation or loss;after IPTG induction expression,the expression level of target protein in each passage of ChrT engineering bacterium had no significant difference from the primary passage;in the liquid medium containing hexavalent Cr(Ⅵ)50 mg/L LB,the mass concentration of Cr(Ⅵ)after 48 h in the ChrT engineering bacterial medium in each passage was significantly decreased compared with the blank control group,the difference was statistically significant(P<0.05);except the Cr(Ⅵ)ability,the differences among different passages of ChrT engineering bacterium had no statistical significance(P>0.05).ConclusionThe ChrT engineeredbacteriumshowsstable biologicalcharacteristicsandcanbe usedto governthe environmentalCr(Ⅵ)contamination.
Chromium;Escherichia coli;Gene expression;Biotransformation;Chromate reductase;Engineered strain;Genetic stability
10.3969/j.issn.1009-5519.2016.18.003
A
1009-5519(2016)18-2789-04
重庆市教委科学技术研究项目(KJ1500216);重庆医科大学大学生科学研究与创新实验项目(201410)。
周思敏(1992-),硕士研究生,主要从事微生物与环境污染治理工作;唐娴(1993-),本科,主要从事卫生检验方向研究。#为共同第一作者。
△,E-mail:xhk20@163.com。
(2016-05-19)

