苹果树腐烂病菌拮抗枯草芽孢杆菌E1R-j抗菌蛋白的分离纯化
牛焕杰,李 辉,王娜娜,张 红,王 惠,黄丽丽
(西北农林科技大学 a 理学院,b 植物保护学院,c 旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
苹果树腐烂病菌拮抗枯草芽孢杆菌E1R-j抗菌蛋白的分离纯化
牛焕杰a,c,李辉b,c,王娜娜b,c,张红a,c,王惠a,黄丽丽b,c
(西北农林科技大学 a 理学院,b 植物保护学院,c 旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100)
【目的】 从枯草芽孢杆菌E1R-j菌株的发酵液中分离纯化抗菌蛋白,分析确其对苹果树腐烂病菌菌丝的抑制作用,为更好地利用该菌株防治植物病害和研制生物农药奠定基础。【方法】 采用盐酸沉淀法从E1R-j发酵液中提取粗蛋白,并筛选酸沉淀的最佳pH值,然后通过反相柱RESOURCETMRPC、凝胶柱Superdex-75、阴离子交换柱DEAE-Sepharose和脱盐柱层析技术,提取并分离纯化粗蛋白;在粗蛋白分离纯化过程中,以皿内对峙试验测定蛋白的抗菌活性;通过扫描电镜技术,观察抗菌蛋白对病原菌菌丝的抑制作用。【结果】 以pH 4.0盐酸沉淀获得的粗蛋白活性最强,抑菌效果最佳。反相柱RESOURCETMRPC获得的活性峰收集物经凝胶柱Superdex-75、阴离子交换柱DEAE-Sepharose和脱盐柱层析后,得到1个对称的活性峰,其收集物经非变性聚丙烯酰胺凝胶电泳(Native-PAGE)检测为单一条带,变性聚丙烯酰胺凝胶电泳(SDS-PAGE)图谱中显示有2个分子质量相近的条带,表明该抗菌蛋白可能含有2个亚基,2个亚基的分子质量分别为55和60 ku,将该活性蛋白命名为EP-1。扫描电镜结果显示,抗菌蛋白EP-1可使苹果树腐烂病菌菌丝出现膨大、弯曲以及原生质外渗等现象。【结论】 通过盐酸沉淀及柱层析技术,从枯草芽孢杆菌E1R-j发酵液中分离纯化出一种分子质量为115 ku的抗菌蛋白EP-1,其对苹果树腐烂病菌菌丝生长具有明显的抑制和破坏作用。
枯草芽孢杆菌;抗菌蛋白;分离纯化;抑制作用;苹果树腐烂病菌
枯草芽孢杆菌(Bacillussubtilis)是一种常见的植物病害生防微生物,其通过产生多种抗菌物质,如蛋白质[1]、肽类[2]、脂肽类[3]和挥发性物质[4]等抑制真菌、细菌、病毒和植原体的正常生长,在植物病害防治方面具有重要的应用价值[5]。许多枯草芽孢杆菌的天然分离菌株已成功应用于植物病害的生物防治,例如国内已开发成功并投入生产的枯草芽孢杆菌商品制剂有百抗、麦丰宁、纹曲宁、依天得、根腐消等[6],国外也有多种枯草芽孢杆菌生防制剂投放市场,如活菌杀菌剂Serenade TM、Sonata AS及混合生防制剂BioYield、Kodiak、Subtilex等[7]。E1R-j菌株是西北农林科技大学植物保护学院植物病害综合治理实验室从小麦根部分离到的1株内生枯草芽孢杆菌,前期研究发现其对小麦全蚀病菌、苹果树腐烂病菌、番茄灰霉病菌、番茄早疫病菌、油菜菌核病菌和苹果纹枯病菌等多种病原真菌有很好的抑菌活性[8],并在小麦全蚀病[9]和小麦条锈病[10]的生物防治方面具有显著防效和重要应用价值。另外,西北农林科技大学植物保护学院植物病害综合治理实验室对其发酵条件进行了优化[11],并从其发酵液中提取出抗菌脂肽物质和抗菌蛋白[12-13]。
苹果树腐烂病是由苹果黑腐皮壳菌 (ValsamaliMayabe et Yamada) 引起的一种苹果树皮腐烂溃烂的病害。该病在我国普遍发生,严重阻碍了我国苹果产业的发展[14]。本研究采用盐酸沉淀法从E1R-j发酵液中提取粗蛋白,并通过各种柱层析技术,纯化抗苹果树腐烂病菌的蛋白,以期为防治苹果树腐烂病奠定理论基础。
1 材料与方法
1.1供试菌株及其培养和保存
枯草芽孢杆菌(Bacillussubtilis) E1R-j菌株为西北农林科技大学植物保护学院植物病害综合治理实验室分离保存,在LB固体培养基(酵母粉 5.0 g/L、蛋白胨10.0 g/L、NaCl 10.0 g/L,琼脂15 g/L)、28 ℃活化培养24 h后备用。苹果树腐烂病菌(Valsamali) 03-8菌株由西北农林科技大学植物保护学院植物病害综合治理实验室提供,在PDA培养基(土豆200 g/L、葡萄糖20 g/L、琼脂15 g/L)、28 ℃培养48 h后备用。
1.2试剂与仪器
试剂:乙腈、三氟乙酸购自TEDIA,均为色谱纯试剂;蛋白预染Marker购自Solarbio公司;考马斯亮蓝G-250为沃尔森公司产品;细菌过滤器(孔径0.22 μm)购于上海生工;培养基及凝胶配置需要的试剂均为国产分析纯试剂。
仪器:蛋白层析使用爱默生公司的AKTA蛋白层析系统,所用的层析柱购自GE公司。冷冻离心机为Beckman公司生产。蛋白质电泳检测使用Bio-Rad mini protein Ⅲ蛋白电泳系统。菌丝观察采用JEOL JSM-6360LV 型号的扫描电镜。
1.3E1R-j菌株发酵液的制备
用接种环取一环划斜面保存的枯草芽孢杆菌E1R-j菌株接种到LB平板培养基上,28 ℃培养箱中培养至平板长满菌落。取一环活化好的枯草芽孢杆菌E1R-j菌株单菌落接入LB培养基中,28 ℃、150 r/min摇床培养24 h作为种子液,参考杨洁等[11]优化好的发酵条件,将种子液按3.0%(体积比)的接种量接入50 mL Landy培养基中,40 ℃、200 r/min摇床培养72 h,经4 ℃、10 000 r/min离心30 min去除菌体,收集上清液备用。
1.4发酵液酸沉淀最佳pH值的确定
将1.3节上清液等分为6份,每份200 mL,分别用6 mol/L盐酸调pH至5.5,5.0,4.0,3.0,2.0,1.5,每个处理设3个重复。4 ℃冰箱静置24 h后,10 000 r/min离心20 min收集沉淀物,将不同pH值下产生的沉淀物分装于干净的50 mL离心管中(用前称取净管质量),冷冻干燥,在万分之一天平上称其质量,用同等体积的水溶解之后,用0.1 mol/L NaOH调pH至中性,定容至相同体积,取200 μL进行抑菌活性测定,根据抑菌圈直径大小确定酸沉淀的最佳pH值。
1.5粗提物的制备
用6 mol/L的HCl将发酵液的pH值调至1.4节优化好的最佳pH值,4 ℃冰箱静置24 h,4 ℃、10 000 r/min离心20 min,收集沉淀,将沉淀的pH值用0.1 mol/L的NaOH调至中性,冷冻干燥成粉末。用甲醇多次抽提,合并抽提液,旋蒸除去甲醇,用少量的蒸馏水溶解即得粗提物,4 ℃冰箱保存备用。
1.6抗菌蛋白的分离纯化
RPC反相柱层析:首先将1.5节得到的粗提物用0.22 μm细菌过滤器过滤,然后过反相柱RESOURCETMRPC,采用2种流动相进行梯度洗脱。流动相A为超纯水(含0.09%三氟乙酸),流动相B为乙腈(含0.1%三氟乙酸)。先用流动相A冲洗色谱柱,待基线平衡后,上样1 mL,调节流动相B的比例在60 min内由0到100%,在1 mL/min的流速下梯度洗脱,于280 nm波长下检测,馏分分管收集,每管收集1 mL,经冷冻干燥成粉末后用少量无菌水溶解,逐管检测其对靶标菌03-8菌株的抑菌活性,以无菌水为对照。
凝胶柱Superdex-75:将多次经RPC反相柱层析后每管有活性的样品平行合并后浓缩,过凝胶柱Superdex-75,流动相为0.02 mol/L的磷酸缓冲液(pH 7.0),先用流动相冲洗色谱柱,待基线平衡后,上样1 mL(样品预先经0.22 μm细菌过滤器过滤),在0.5 mL/min的流速下洗脱60 min,在280 nm波长下检测,每管收集0.5 mL,冷冻干燥成粉末后用少量无菌水溶解,逐管检测其对靶标菌03-8菌株的抑菌活性,以无菌水为对照。
阴离子交换柱DEAE-Sepharose:将经凝胶柱Superdex-75分离得到的有活性的各管平行合并,浓缩之后过阴离子交换柱DEAE-Sepharose,用两种流动相进行梯度洗脱。流动相A为0.02 mol/L的Tris-HCl缓冲液(pH 7.0),流动相B为在流动相A的基础上加入1 mol/L NaCl的高盐溶液。先用A液洗至基线平稳,上样1 mL(样品预先经0.22 μm细菌过滤器过滤),在1 mL/min的流速下逐渐增加B的比例从0~100%,洗脱60 min,检测波长为280 nm,每管收集0.5 mL,冷冻干燥后用少量无菌水溶解,逐管检测其对靶标菌03-8菌株的抑菌活性,以无菌水为对照。
脱盐柱:方法同凝胶柱Superdex-75。
1.7皿内抑菌活性检测
将靶标菌03-8菌株接种到PDA平板中央,28 ℃恒温培养箱中培养24 h,在距离培养皿中心25 mm处打孔或放置牛津杯,在孔或牛津杯内加入经0.22 μm细菌过滤器过滤后的待测组分,28 ℃培养24 h,以无菌水为对照,观察抑菌效果,每处理设3个重复。
1.8抗菌蛋白的Native-PAGE和SDS-PAGE检测
1.8.1非变性聚丙烯酰胺凝胶电泳(Native-PAGE)Native-PAGE参考《蛋白质化学》[15]的方法,对PAGE分离胶的浓度进行筛选,设12%,15%和20% 3个浓度,浓缩胶浓度为5%,15 mA冰浴电泳至指示剂前沿到达胶的底部,电泳结束后用考马斯亮蓝G-250染色。
Native-PAGE胶的电洗脱回收:Native-PAGE胶冰浴电泳结束后,切取部分泳道染色,根据染色结果切取其余含有目的蛋白的泳道,装入处理过的透析袋中(截留分子质量8 000~14 000 u),加入适量的Native-PAGE胶电泳缓冲液,最后将透析袋放入普通的水平核酸电泳槽中,并在电泳槽中加入相同的电泳缓冲液,100 V低温电泳3.5 h,将透析袋放入PBS缓冲液中透析过夜,将透析袋中的蛋白冻干浓缩。将冻干样品用少量ddH2O溶解后对03-8菌株抑菌活性进行检测。
1.8.2变性聚丙烯酰胺凝胶电泳(SDS-PAGE)SDS-PAGE参考Laemmli等[16]的方法,采用5%的浓缩胶,12%的分离胶,浓缩胶的电流为15 mA,进入分离胶时电流设置为25 mA,待电泳结束后,考马斯亮蓝G-250染色。
1.9抗菌蛋白对菌丝生长抑制作用的扫描电镜观察
首先,将活化好的03-8菌株接种到PDA培养基的中央,28 ℃培养24 h后,在距离培养皿中心25 mm处打孔,在孔内加入20 μL电洗脱回收的蛋白条带,继续在28 ℃培养,以无菌水为对照,分别在培养24 h和72 h的抑菌圈边缘取菌丝块(5~7 mm)各6块,参照康振生[17]的方法进行扫描电镜样品的制备,进而通过扫描电镜观察菌丝的生长情况。
1.10数据分析
用SPSS软件进行统计分析,采用LSD法在 0.05 水平上进行差异显著性分析。
2 结果与分析
2.1E1R-j抗菌粗蛋白的提取
用6 mol/L盐酸调节E1R-j发酵液pH分别为5.5,5.0,4.0,3.0,2.0,1.5后产生沉淀和上清液,以苹果树腐烂病菌为指示菌,分别对调至中性的上清部分和沉淀部分进行生物活性测定,结果见图1和图2。由图1可见,pH 4.0,3.0,2.0,1.5的发酵液上清液样品周围没有抑菌圈,表明用盐酸调节发酵液pH到4.0以下时,发酵液上清液没有抑菌活性,说明活性物质已经完全在沉淀中。而pH 5.0以上时活性物质仍有部分存在于上清液中,说明酸沉淀提取活性物质时,加酸量必须达到pH 4.0以下才能使活性物质完全脱离上清液而达到分离目的。图2结果显示,将发酵液pH分别调至5.5,5.0,4.0,3.0,2.0,1.5时,沉淀物复溶调至中性后均有抑菌活性,而pH小于4.0时产生沉淀物的抑菌活性在0.05水平上无显著性差异,但其与pH 5.0和 5.5 时产生沉淀物的抑菌活性存在显著差异。这些结果说明,在pH 4.0以下时发酵液中的活性物质已经沉淀完全,因此选用pH 4.0 作为盐酸沉淀提取抗菌粗蛋白的最佳pH值。
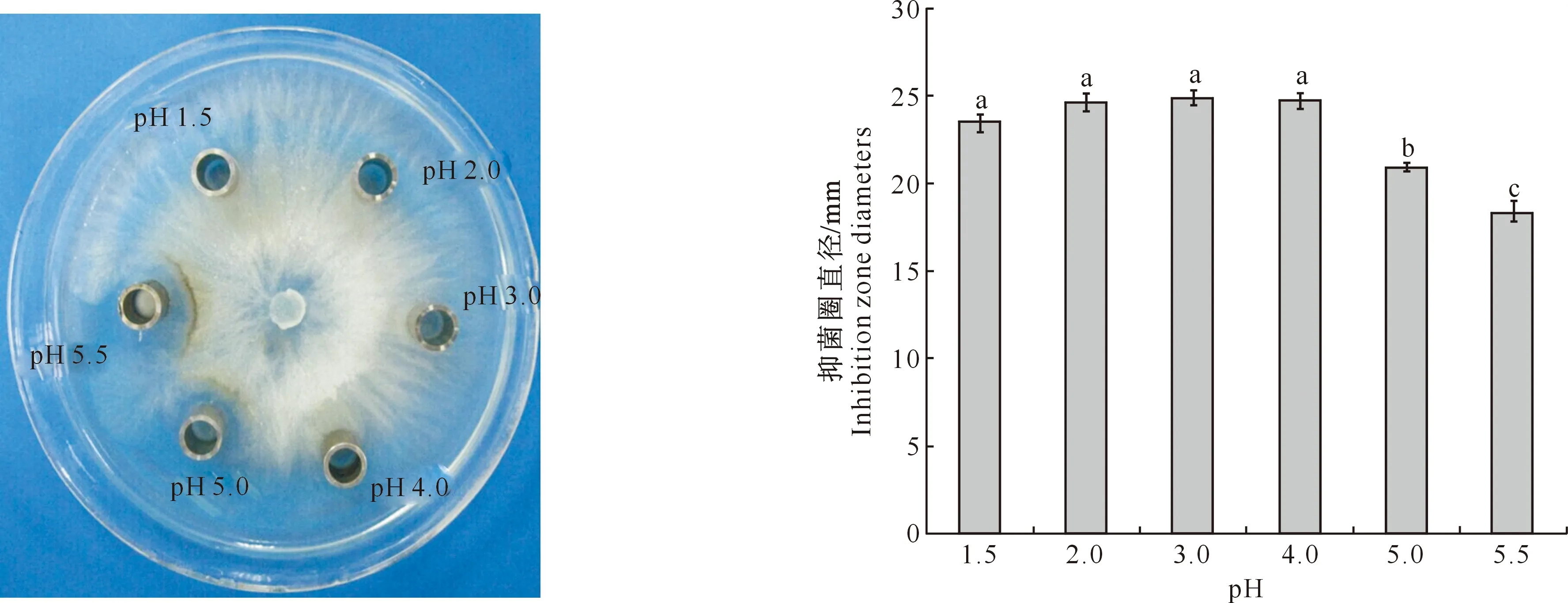
图 1 盐酸沉淀后不同pH值上清液对苹果树腐烂病菌的抑制活性
2.2E1R-j抗菌蛋白的分离纯化
将经过酸沉淀得到的粗抗菌蛋白进行反相柱RESOURCETMRPC层析,在280 nm波长下检测,得到6个主要的吸收峰,共收集60管(图3)。对每个峰下收集的各管馏分分别进行抑菌活性检测,发现峰4(C7、C8、C9、C10、C11管)和峰5 (C12、D1、D2、D3、D4、D5、D6管)有抑菌活性,峰6(D7、D8、D9管)有微弱的抑菌活性(图4),其他峰没有抑菌活性。将峰5对应的7管馏分合并浓缩,经Superdex-75柱分离,紫外检测显示共有4个吸收峰(图5)。分别收集各峰对应馏分,进行抑菌活性试验发现,峰1对应馏分对苹果树腐烂病菌菌丝生长具有明显抑菌活性,其他峰没有抑菌活性。将峰1对应的各管馏分合并浓缩,再用DEAE-Sepharose柱分离,得到1个吸收峰(图6)。生物活性测定结果发现,峰1对苹果树腐烂病菌有抑菌活性。

图 3 枯草芽孢杆菌E1R-j抗菌蛋白的RESOURCETMRPC层析图谱

图 4 经反相柱RESOURCETMRPC层析后峰4、峰5和峰6对应组分对苹果树腐烂病菌的抑菌活性
考虑到DEAE-Sepharose柱将盐引入,故将峰1对应的馏分再经脱盐柱除盐,得到3个吸收峰(图7)。生物活性测定结果发现,第1个峰对应的馏分具有抑菌活性,其余峰没有抑菌作用。

图 5枯草芽孢杆菌E1R-j抗菌蛋白的Superdex-75层析图谱
Fig.5Elution profile of antifungal protein produced byBacillussubtilisE1R-j by Superdex-75
图 6枯草芽孢杆菌E1R-j抗菌蛋白的DEAE-Sepharose层析图谱
Fig.6Elution profile of antifungal protein produced byBacillussubtilisE1R-j by DEAE-Sepharose
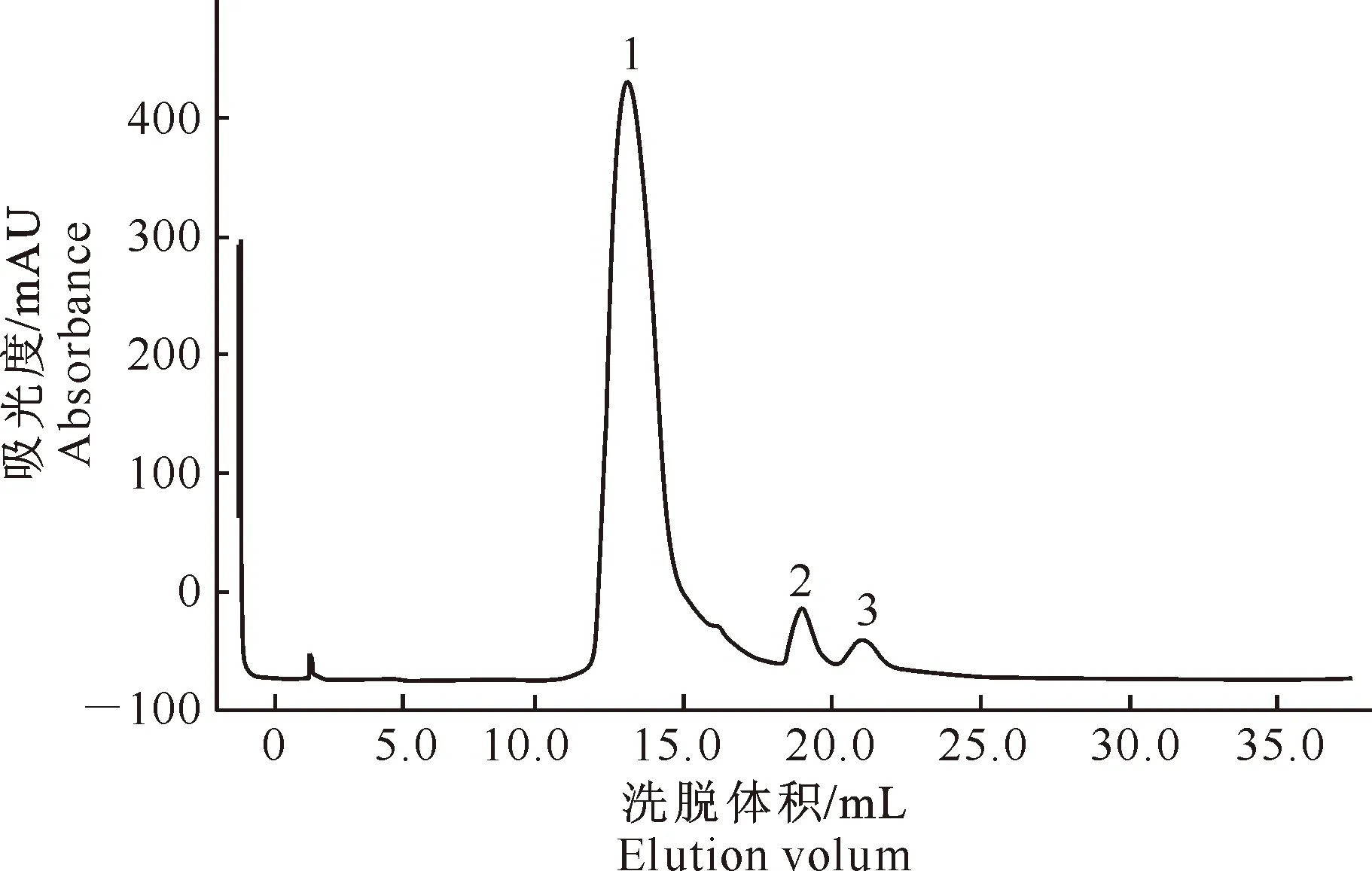
图 7 枯草芽孢杆菌E1R-j抗菌蛋白的脱盐柱层析图谱
2.3E1R-j抗菌蛋白的Native-PAGE和SDS-PAGE检测
将分离纯化后的抗菌蛋白分别用12%,15%,20% 3个不同浓度分离胶的Native-PAGE电泳进行检测,均显示出单一的电泳条带(图8),表明通过以上分离纯化从枯草芽孢杆菌E1R-j的发酵液中获得一种抗菌蛋白,命名为EP-1。该抗菌蛋白已达到电泳纯。此外, 该抗菌蛋白在SDS-PAGE中有55和60 ku 2个条带,表明该抗菌蛋白可能含有2个亚基。
另外,从图8还可以看出,分离胶浓度为20%的PAGE中,Marker没有达到很好分离,且蛋白条带有些拖尾,在分离胶浓度12%的PAGE中,Marker分离很好,但本试验得到的抗菌蛋白条带偏下,只有15%分离胶浓度下抗菌蛋白处于较好位置。因此,15%分离胶浓度的Native-PAGE比较适合枯草芽孢杆菌E1R-j抗菌蛋白的电泳条带回收。

图 8枯草芽孢杆菌E1R-j抗菌蛋白的Native-PAGE和SDS-PAGE电泳图谱
M.预染Marker 11~180 ku;1.过脱盐柱的冻干样品;2.回收条带
Fig.8Native-PAGE and SDS-PAGE spectrum of antifungal protein produced byBacillussubtilisE1R-j
M.Prestained marker 11-180 ku;1.Freeze-dried sample after desalting column;2.Electro-elution band
在上述15%分离胶浓度的Native-PAGE中,将抗菌蛋白的电泳条带经电洗脱回收,对03-8菌株进行抑菌活性检测,结果发现回收的抗菌蛋白条带具有明显的抑菌活性(图9),进一步证明此单一条带确为枯草芽孢杆菌E1R-j的抑菌活性物质条带。此外,与回收前相同浓度抗菌蛋白的抑菌活性进行对比,发现回收后的抑菌活性比回收前有所降低。这可能是由于回收率不能达到100%所致。
2.4E1R-j抗菌蛋白对苹果树腐烂病菌菌丝形态的破坏
取Native-PAGE电洗脱回收蛋白条带抑菌圈边缘的菌丝块,以无菌水为对照进行扫描电镜观察,结果显示:经抗菌蛋白处理24 h后的苹果树腐烂病菌菌丝未见明显形态变化,处理72 h后菌丝严重畸形,菌丝弯曲(图10-B),顶端膨大、局部细胞破裂导致原生质外渗(图10-C)。而对照组菌丝光滑、形状均匀(图10-A)。进一步证明本试验从枯草芽孢杆菌E1R-j发酵液中分离得到的抗菌蛋白对苹果树腐烂病菌菌丝的生长具有明显的抑制作用。

图 9 回收前后E1R-j抗菌蛋白对苹果树腐烂病菌的抑菌活性
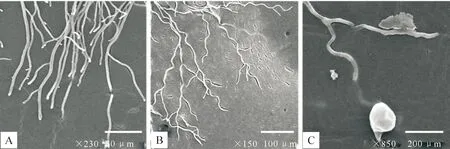
图 10E1R-j抗菌蛋白对苹果树腐烂病菌菌丝形态的影响(扫描电镜观察)
A.正常病菌菌丝形态;B、C.经抗菌蛋白处理72 h后的菌丝形态
Fig.10Effect of antifungal protein on hyphal growth ofValsamalithrough scanning electron microscope
A.Hyphae of 03-8 untreated;B,C.Hyphae of 03-8 treated with antifungal protein for 72 h
3 讨 论
本试验采用盐酸沉淀法,结合多种柱层析技术,从枯草芽孢杆菌E1R-j的发酵液中分离纯化出1种对苹果树腐烂病菌具有抑制作用的抗菌蛋白EP-1。目前,抗菌蛋白的提取分离方法普遍采用硫酸铵盐析,再逐步层析纯化[18-22]。但硫酸铵盐析存在一些缺点:一是耗时耗力;二是硫酸铵中常含有少量重金属离子,对蛋白质巯基有敏感作用[23];三是盐析后样品中含有大量硫酸铵,除盐是一个很大的问题,而且用硫酸铵盐析可将除目的蛋白以外的其他蛋白也沉淀下来,增加了后续的分离纯化难度。而盐酸沉淀法适合提取对pH值较稳定的蛋白。本试验采用盐酸沉淀法代替硫酸铵盐析,将枯草芽孢杆菌E1R-j去菌后的发酵液用盐酸调节pH至4.0,发酵液中产生絮状物质,冰箱中静置过夜后离心,上清液调至中性后没有抑菌活性,证明已将活性物质沉淀完全,而沉淀复溶后则显示出较强抑菌活性,表明该抗菌蛋白比较耐酸、稳定,而且可以在酸的作用下沉淀,且调至中性后可以复溶。因此,本研究选用盐酸沉淀法提取抗菌粗蛋白,将稳定、耐酸的蛋白与其他变性蛋白分开,简化了后续的分离纯化过程。
本实验室黄保全等[13]曾通过硫酸铵盐析、疏水层析、阴离子交换层析等手段,已经从枯草芽孢杆菌E1R-j中提取分离出一种抗小麦全蚀病菌的蛋白j1,其分子质量为51.9 ku,等电点为8.7。而本试验采用盐酸沉淀法、反相柱、Superdex-75、阴离子交换柱及脱盐柱从E1R-j发酵液中分离纯化出抗苹果树腐烂病菌的蛋白EP-1,分子质量为115 ku。经比较研究发现,本试验得到的抗菌蛋白与j1在 Native-PAGE中活性条带的位置不同,分子质量不同,且在阴离子交换柱DEAE-Sepharose中活性峰的出峰位置也不相同,由此可推断,本试验得到的抗菌蛋白与j1并非同一种蛋白,至于他们之间在结构和活性方面的关系有待进一步研究。
本试验选用的靶标菌为苹果树腐烂病菌03-8菌株,与黄保全等[13]使用的小麦全蚀病菌相比,其生长周期短,2 d就可以得出抑菌活性结果,缩短了活性测定时间,提升了试验进度。而且,由于苹果树腐烂病目前危害严重,尚需新的防治途径,本试验分离纯化出的抗菌蛋白也为苹果树腐烂病的防治提出了新的思路和药剂开发可能。
本研究在分离纯化的第一步反相柱层析RESOURCETMRPC得到了峰4和峰5 两个主要活性峰,本试验只对峰5进行了进一步分离纯化得到了抗菌蛋白EP-1,峰4对应的活性物质还需进一步的分离纯化,至于峰4的主要活性物质是另一种类的活性蛋白,还是与前期以小麦全蚀病菌为靶标分离出的蛋白j1相同尚待进一步研究。
[1]Zhao X Y,Zhao X M,Wei Y M,et al.Isolation and identification of a novel antifungal protein from a RhizobacteriumBacillussubtilisstrain F3 [J].J Phytopathol,2013(161):43-48.
[2]Bechard J,Eastwell K C,Sholberg P L,et al.Isolation and partial chemical characterization of an antimicrobial peptide produced by a strain ofBacillussubtilis[J].J Agric Food Chem,1998(46):5355-5361.
[3]徐扬,王楠,李伟,等.海洋枯草芽孢杆菌3512A抗真菌脂肽的分离纯化及结构特性鉴定 [J].中国生物防治,2009,25(4):328-333.
Xu Y,Wang N,Li W,et al.Purification and structural identifications of the antifungal lipopeptides produced by marine bacteriumBacillussubtilis3512A [J].Chinese Journal of Biological Control,2009,25(4):328-333.
[4]Fiddaman P J,Rossall S.The production of antifungal volatiles byBacillussubtilis[J].Journal of Applied Bacteriology,1993(74):119-126.
[5]刘雪,穆常青,蒋细良,等.枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用 [J].中国生物防治,2006,22(S1):179-184.
Liu X,Mu C Q,Jiang X L,et al.Research progress of the metabolic substances produced byBacillussubtilisand their application on biocontrol of plant disease [J].Chinese Journal of Biological Control,2006,22(S1):179-184.
[6]陈向东.枯草芽孢杆菌作为生防制剂在农业上的应用 [J].微生物学通报,2013,40(7):1323-1324.
Chen X D.Application ofBacillussubtilisin agriculture as biocontrol agent [J].Microbiology China,2013,40(7):1323-1324.
[7]Fravel D R.Commercialization and implementation of biocontrol [J].Annual Review of Phytopathology,2005(43):337-359.
[8]乔红萍.小麦内生细菌对小麦全蚀病的生物防治研究 [D].陕西杨凌:西北农林科技大学,2006.
Qiao H P.Biological control of take-all disease of wheat by endophytic bacteria [D].Yangling,Shaanxi:Northwest A&F University,2006.
[9]Liu B,Qiao H P,Huang L L,et al.Biological control of take-all in wheat by endophyticBacillussubtilisE1R-j and potential mode of action [J].Biological Control,2009(49):277-285.
[10]Li H,Zhao J,Feng H,et al.Biological control of wheat stripe rust by an endophyticBacillussubtilisstrain E1R-j in greenhouse and field trials [J].Crop Protection,2013(43):201-206.
[11]杨洁,姬婧媛,康振生,等.枯草芽孢杆菌产抗菌脂肽发酵条件的优化 [J].西北农业学报,2012,21(7):54-60.
Yang J,Ji J Y,Kang Z S,et al.Optimization of fermentation conditions of anti-fungal lipopeptide produced byBacillussubtilisE1R-j [J].Acta Agriculturae Boreali-Occidentalis Sinica,2012,21(7):54-60.
[12]杨洁.枯草芽孢杆菌E1R-j产抗菌脂肽的发酵条件的优化及分离纯化 [D].陕西杨凌:西北农林科技大学,2012.
Yang J.Studies on optimization of fermentation conditions and purification of anti-fungal lipopeptide produced byBacillussubtilisE1R-j [D].Yangling,Shaanxi:Northwest A&F University,2006.
[13]黄保全,黄丽丽,康振生,等.小麦内生枯草芽孢杆菌E1R-j胞外抗菌蛋白的分离纯化与性质 [J].西北农业学报,2009,18(6):285-290.
Huang B Q,Huang L L,Kang Z S,et al.Purification and characterization of an extracellular antifungal protein from wheat endophyticBacillussubtilisstrain E1R-j [J].Acta Agriculturae Boreali-Occidentalis Sinica,2009,18(6):285-290.
[14]李正鹏,高小宁,杜占涛,等.陕西渭北地区苹果树腐烂病菌发生情况调查 [J].西北农业学报,2013,22(1):174-178.
Li Z P,Gao X N,Du Z T,et al.Survey of apple valsa canker in Weibei Area of Shaanxi Province [J].Acta Agriculturae Boreali-Occidentalis Sinica,2013,22(1):174-178.
[15]汪世龙.蛋白质化学 [M].上海:同济大学出版社,2012:217-219.
Wang S L.Protein chemistry [M].Shanghai:Tongji University Press,2012:217-219.
[16]Laemmli U K,Favre M.Gel electrophoresis of prot ins [J].J Mol Biol,1973(80):575-599.
[17]康振生.植物病原真菌的超微结构 [M].北京:中国科学技术出版社,1995:9-10.
Kang Z S.Ultrastructure of plant pathogenic fingi [M].Beijing:China Science & Technologe Press,1995:9-10.
[18]Merve Senol,Hayrunnisa Nadaroglu,Neslihan Dikbas,et al.Purification of chitinase enzymes fromBacillussubtilisbacteria TV-125,investigation of kinetic properties and antifungal activity againstFusariumculmorum[J].Annals of Clinical Microbiology and Antimicrobials,2014,13:35.
[19]Luo Y,Sun L F,Zhu Z,et al.Identification and characterization of an anti-fungiFusariumoxysporumf.sp.cucumeriumprotease from theBacillussubtilisstrain N7 [J].Journal of Microbiology,2013(51):359-366.
[20]Li J,Yang Q,Zhao L H,et al.Purification and characterization of a novel antifungal protein fromBacillussubtilisstrain B29 [J].Journal of Zhejiang University Science B,2009(4):264-272.
[21]纪兆林,唐丽娟,张清霞,等.地衣芽孢杆菌W10抗菌蛋白的分离纯化与其理化性质的研究 [J].植物病理学报,2007,37(3):260-264.
Ji Z L,Tang L J,Zhang Q X,et al.Isolation,purification and characterization of antifungal protein fromBacilluslicheniformisW10 strain [J].Acta Phytopathologica Sinica,2007,37(3):260-264.
[22]陈夕军,李娟,孙启利,等.水稻内生枯草芽孢杆菌G87抗菌蛋白的分离纯化及理化特性 [J].微生物学报,2010,50(10):1353-1357.
Chen X J,Li J,Sun Q L,et al.Isolation,purification and characterization of antifungal protein from rice endophytic bacteriumBacillussubtilisG87 [J].Acta Microbiologica Sinica,2010,50(10):1353-1357.
[23]张宝俊,张家榕,韩巨才,等.内生解淀粉芽孢杆菌LP-5抗菌蛋白的分离纯化及特性 [J].植物保护学报,2010,37(2):143-147.
Zhang B J,Zhang J R,Han J C,et al.Purification and characterization of an antifungal protein from endophyticBacillusamyloliquefaciensLP-5 [J].Acta Phytophylacica Sinica,2010,37(2):143-147.
Isolation and purification of antifungal protein fromBacillussubtilisE1R-j againstValsamali
NIU Huanjiea,c,LI Huib,c,WANG Nanab,c,ZHANG Honga,c,WANG Huia,HUANG Lilib,c
(aCollegeofScience,bCollegeofPlantProtection,cStateKeyLaboratoryofCropStressBiologyinAridAreas,NorthwestA&FUniversity,Yangling,Shaanxi712100,China)
【Objective】 This study isolated and purified antifungal protein from the fermentation liquid of E1R-j and clarified the inhibitory effect on the hyphae ofValsamali(03-8) to use the strain for prevention of plant disease and development of biological chemicals.【Method】 The antifungal crude extract was separated from the fermentation filtrate by HCl precipitation and the optimal pH value was selected before the antifungal protein was purified on column chromatography including RESOURCETMRPC,Superdex-75,DEAE-Sepharose and desalting column.During the whole process,the antifungal activity was determined using the oxford plate assay system and the inhibitory effect against hyphae of 03-8 was studied using scanning electron microscope.【Result】 When pH was 4.0,the antifungal activity of protein precipitated by HCl was the strongest.A symmetrical active peak was obtained through RESOURCETMRPC,Superdex-75,DEAE-Sepharose and desalting column.A single protein band showed in polyacrylamide gel electrophoresis (Native-PAGE) while two close bands showed in sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE),indicating that the antifungal protein named as EP-1 had two subunits with molecular weights of 55 and 60 ku.The scanning electron microscopy results showed that the hyphae of 03-8 treated with EP-1 were severely deformed with symptoms of mycelium swollen,hyphal bending and cytoplasm leak.【Conclusion】 The antifungal protein EP-1 with a molecular of 115 ku was isolated and purified through HCl precipitation and column chromatography,and it showed inhibitory and destructive effect on hyphae of 03-8.
Bacillussubtilis;antifungal protein;isolation and purification;inhibitory effect;Valsamali
时间:2016-08-0909:41DOI:10.13207/j.cnki.jnwafu.2016.09.018
2015-02-13
公益性行业(农业)科研专项(201203034);陕西省科技统筹创新工程计划项目(2011KTZB02-02-02)
牛焕杰(1990-),女,山东济宁人,在读硕士,主要从事天然产物研究。E-mail:niuhuanjie@126.com
王惠(1959-),女,陕西临潼人,教授,硕士生导师,主要从事天然产物研究。E-mail:wanghuiab@sina.com
S476.8
A
1671-9387(2016)09-0135-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160809.0941.036.html

