胶质瘤PET分子影像的应用进展
孔艳艳 综述 管一晖 审校
复旦大学附属华山医院PET中心,上海 200235
胶质瘤PET分子影像的应用进展
孔艳艳 综述 管一晖 审校
复旦大学附属华山医院PET中心,上海 200235
无创PET检查灵敏度高,能反映活体的代谢和分子水平,可通过糖代谢、氨基酸代谢、胆碱代谢、核酸代谢及乏氧等检测胶质瘤的代谢功能改变,在胶质瘤诊断、治疗和预后中发挥重要作用。18F-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)显像的灵敏度高,但特异度较差。氨基酸显像可提供较好的肿瘤细胞增殖情况,胆碱、核酸显像能更敏感地从代谢方面反映胶质瘤的细胞增殖情况,乏氧显像则更有效地反映胶质瘤放化疗后的耐受情况。因此,PET能更好地指导胶质瘤活检取材、手术方案制订、放疗计划实施、疗效监测、鉴别复发与治疗后改变等。每一种显像剂均有各自优缺点,需综合应用于胶质瘤诊治研究。本综述总结了各类PET显像剂及其在胶质瘤诊断、预后、治疗及疗效监测中的作用。
胶质瘤;正电子发射断层成像;18F-脱氧葡萄糖;11C-蛋氨酸;18F-胸腺嘧啶核苷;18F-硝基咪唑;11C-胆碱

孔艳艳,彝族。影像医学与核医学博士,复旦大学附属华山医院医师,核医学分会青年委员会委员。研究方向为AD PET基础与临床研究。目前主持课题2项,主要负责课题4项。近年来以第一作者发表论文7篇,美国核医学年会摘要4篇,申请专利2项。上学期间多次获得复旦大学一等学业奖学金和专项奖学金。2016年获“华山医院优秀住院医师”。
胶质瘤是最常见的颅脑肿瘤,其恶性程度、发病率及死亡率高,早期诊断、良恶性判定、预测治疗反应、预后评估是治疗的关键。目前脑部CT和MRI及相应的增强显像是诊断脑部肿瘤的常规方法,但CT、MRI在肿瘤生物功能性诊断的灵敏度、特异度等方面存在不足,很难提供胶质瘤细胞代谢、血管生成等分子水平的生物特性信息。因此,如何对胶质瘤的生物学行为进行全面准确的判断是影像学难题,需通过其他分子影像学技术进行多方位的协同观察,才能进一步提高对胶质瘤的诊治和预后判定。目前,具有高灵敏度和高空间分辨率的PET是分子影像学领域中的领先技术,也是分子影像学的代表。PET联合能与分子靶点特异性结合的探针,可活体、无创、重复、实时于细胞分子水平定性和定量研究胶质瘤发生发展过程,提供形态学和功能代谢双重信息,对提高胶质瘤生物学行为、诊断及治疗等方面的认识具有重要意义,从而用于脑肿瘤的良恶性鉴别、术前病理分级、病程分期、鉴别肿瘤复发或坏死、探测残留肿瘤、立体定向穿刺、放疗计划制订、判断肿瘤对治疗的敏感性、患者预后判断等方面[1]。随着PET高特异性分子成像探针的开发,其将在胶质瘤诊断中彰显无尽的魅力。
最常用的放射性示踪剂为经典的18F-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG),为临床提供了CT、MRI难以获取的各种关于肿瘤能量代谢的生物学信息,在肿瘤复发与残留肿瘤鉴别等方面尤其重要。近年来,肿瘤生物靶区体积(biological target volume,BTV)概念的出现预示着PET的应用将更广泛,其通过对肿瘤组织血流灌注、代谢、增殖活性、乏氧、肿瘤相关受体、血管生成及凋亡等方面的显示,为进一步优化放疗提供了重要手段。但从技术上看,仅FDG显然是不够的,这是因为大脑皮质对葡萄糖的相对高摄取, FDG对脑肿瘤的显像特异性及对低度恶性脑肿瘤显像的敏感性受到较大限制,所以PET尚需其他显像剂如氨基酸类、胆碱类、乙酸类、核酸类、神经受体、乏氧显像剂等[2]。其共同的优势是较低的脑本底摄取,可从不同代谢途径、受体水平等多角度反映肿瘤的异常增殖,从多种不同代谢途径反映肿瘤的异质性,从而提供更好的诊断特异性及对肿瘤形态精确描绘,为PET在脑肿瘤方面的应用提供了更好的技术平台。
1 脑肿瘤PET显像常用显像剂
1.118F-FDG
18F-FDG是临床最常用的显像剂,能反映体内葡萄糖利用状况。胶质瘤细胞的分裂增殖比正常细胞快,能量消耗相应增加。葡萄糖为组织细胞能量的主要来源之一,肿瘤细胞的异常增殖需葡萄糖的过度利用,其途径是增加葡萄糖膜转运能力和糖代谢通路中的主要调控酶活性。肿瘤细胞糖酵解的增加与糖酵解酶的活性增加有关,与之有关的酶有己糖磷酸激酶、6-磷酸果糖激酶、丙酮酸脱氢酶等。目前,肿瘤细胞中的葡萄糖转运mRNA表达增高,导致葡萄糖转运蛋白增加。因此,脑肿瘤细胞内可积聚大量18F-FDG,经PET显像可显示肿瘤的部位、形态、大小、数量及肿瘤内的放射性分布,为病理分级和病程分期提供有价值的信息,可用于肿瘤的良恶性判别、分级、鉴别肿瘤复发或坏死等方面,有助于脑肿瘤的诊断和临床预后估计[3-4]。18F-FDG PET/CT显像能无创、定量、动态地从细胞分子水平观察肿瘤组织特有的生物学特性,对脑肿瘤病变的定性有较高的特异度和准确率。葡萄糖代谢显像在脑肿瘤诊断和临床处理等方面有特别重要的价值,尤其是在肿瘤的良恶性判别、术前病理分级、病程分期、鉴别肿瘤复发或坏死、探测残留肿瘤等方面提供了CT、MRI难以获取的信息[5]。
恶性肿瘤增殖较快,蛋白质合成和葡萄糖利用率明显高于其他正常组织细胞,且恶性程度高的肿瘤细胞比生长较慢的恶性程度低的肿瘤更明显。由此,通过探查肿瘤组织的葡萄糖代谢情况和蛋白合成率可了解肿瘤的生物学行为,为病理分级和病程分期提供有价值的信息(图1)。按病理分级,脑胶质瘤FDG的代谢率如下:Ⅰ~Ⅱ级为(3.8±1.6) mg/100 g·min,Ⅱ~Ⅲ级为(6.6±3.3)mg/100 g·min,其中Ⅲ级为(5.7±2.7) mg/100 g·min,Ⅳ级为(7.3±3.6) mg/100 g·min。随着恶性程度增加,肿瘤组织葡萄糖代谢率也增加。在临床应用时,FDG PET还可提供肿瘤是否进一步恶变或升级的信息[4]。18F-FDG常用于良恶性鉴别、术前病理分级、胶质瘤复发或残存病灶与放化疗后组织坏死的鉴别[6](图1)。胶质瘤的治疗除手术外常用放疗和(或)化疗,治疗后常出现后续反应如放射性坏死等,临床上可分为急性期(数小时至数周)、亚急性早期(数周至4个月)、亚急性晚期(4个月至数年)和慢性期。肿瘤复发或残存病灶与治疗后坏死的鉴别十分重要,FDG PET显像在这方面较传统影像学更有优势。肿瘤复发或残存病灶FDG代谢异常增高,而放疗、化疗后坏死脑组织则显示低代谢或无代谢状态。
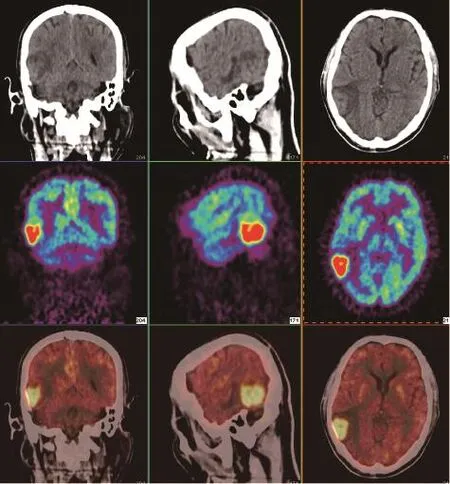
图1 胶质肉瘤18F-FDG PET/CT表现
1.2氨基酸
氨基酸是人体营养物质,在体内主要代谢途径为合成蛋白质;转化为具有重要生物学活性的酶、激素等;氨基酸通过转运、脱氨、脱羧,变成二氧化碳、尿素等,而被其他组织利用或排出体外。其中蛋白质合成是主要代谢途径。肿瘤细胞恶性增殖的基础是对氨基酸需求量增加,转运速度加快,明显高于正常组织,因此肿瘤组织摄取氨基酸与恶性程度相关[1]。如11C-蛋氨酸(11C-methionine,11C-MET)进入体内后,可参与体内蛋白质合成,或转化为S-腺苷蛋氨酸作为甲基供体,因而能在活体反映氨基酸的转运代谢及蛋白质合成情况[7]。疾病或生理、生化改变出现蛋白质合成异常,标记氨基酸可显示其异常变化,优点是正常脑组织摄取很低,因此检测肿瘤的准确率较高,对肿瘤边缘的描绘更清楚,尤其对FDG低摄取或等摄取的脑肿瘤的诊断更有价值[8],在发现肿瘤病灶、鉴别脑肿瘤良恶性、判断肿瘤复发、勾画肿瘤浸润范围界限、早期评价治疗效果方面有特定的临床价值。11C和18F标记氨基酸显像,肿瘤组织与正常组织的放射性比值高,图像清晰,有助于肿瘤组织与炎症或其他糖代谢旺盛病灶的鉴别[9],与18F-FDG联用可弥补18F-FDG 的不足,提高肿瘤的鉴别能力,还可用于鉴别肿瘤复发与放疗后改变。
目前,用于人体PET显像的标记氨基酸有L-甲基-11C-MET (11C-MET)、L-1-11C-亮氨酸、L-11C-酪氨酸、L-11C-苯丙氨酸、L-1-11C-MET、L-2-18F-酪氨酸、18F-乙基酪氨酸(O-(2-[18F]fluoroethyl)-L-tyrosine,18F-FET)、L-4-18F-苯丙氨酸、11C-氨基异丙氨酸及13N-谷氨酸等。通常脑灰质的葡萄糖代谢较高,脑肿瘤位于这样一个高本底背景下,低代谢或无代谢肿瘤(如低级别胶质瘤、脑膜瘤等)很难显示出来[10],而11C和18F标记氨基酸显像与18F-FDG 联用可提高脑肿瘤的鉴别能力,还可用于鉴别肿瘤复发与放疗后改变。放射性坏死组织、炎性细胞对FDG也有一定摄取,这种摄取与低度恶性肿瘤复发难以区分,因此引入脑本底及炎症、坏死组织摄取较低的氨基酸显像剂有助于鉴别。肿瘤组织中氨基酸代谢活跃的区域11C-MET摄取明显升高,而间变坏死区11C-MET摄取明显下降。肿瘤复发或残存病灶呈11C-MET高摄取,放射性坏死组织11C-MET摄取与正常脑皮质相似,且不受炎症反应的影响。与18F-FDG相比,11C-MET有两个优势:① 肿瘤的间变坏死区对11C-MET的摄取较18F-FDG明显下降,而对18F-FDG的摄取未见明显改变。②11C-MET的脑本底较低。正常脑皮质对18F-FDG摄取较高,对11C-MET的摄取较低,因此11C-MET对肿瘤边缘界限、肿瘤间变坏死区、近脑皮质区的低度恶性肿瘤检出效果较好[11](图2)。此外,某些肿瘤具有11C-MET PET显像的特异性表现,如所有脑膜瘤呈11C-MET高摄取且分布均匀,边界清晰,与周围正常脑组织区别明显;而神经瘤11C-MET呈低摄取且分布不均,特别有囊性结构或坏死时低摄取更明显。11C-MET作为胶质瘤分子影像学探针也存在一些弊端,如某些良性病灶造成的局部血流增加、炎细胞浸润等可出现11C-MET摄取进而造成假阳性结果。11C-MET PET在复发性脑肿瘤或肿瘤残余组织表现为高11C-MET聚集灶,而肿瘤放射性坏死组织11C-MET摄取与正常脑皮质相似,且不受炎症反应的影响(图2、3)。脑肿瘤的预后与肿瘤的恶性程度及其增殖潜能有一定关系;有研究指出,肿瘤/脑皮质摄取比(tumor-to-mean cortical uptake ratio,T/MCU)对患者预后有一定参考价值。T/MCU<2.1时,人均生存时间超过5年;当T/MCU≥2.1时,则生存时间在8个月左右。
11C的物理半衰期只有20.4 min,因此限制了11C-MET的临床应用。18F标记的L-酪氨酸克服了这一缺点。18F-FET是酪氨酸类似物,通过主动转运进入肿瘤细胞后不再参与氨基酸代谢,而在细胞内累积,可反映细胞对氨基酸的转运过程。肿瘤细胞的氨基酸需求明显增加,氨基酸转运显著增高[12]。较长的半衰期可让酪氨酸有足够时间滞留在肿瘤细胞内,而周围脑组织代谢洗脱后使肿瘤显示清楚,尤其对分化程度好的胶质瘤灵敏度很高[13-14]。炎性细胞对18F-FET摄取明显减低,低于FDG甚至MET,在区分各种治疗所致炎症、坏死与肿瘤复发方面具有独特价值[12]。此外,治疗前及治疗后早期,病灶摄取18F-FET的改变对监测治疗反应、调整治疗方案及预后评估具有一定意义[13],18F-FET联合MRI还可用于制订三维适形放疗的生物靶区[15]。然而,氨基酸PET显像在鉴别脑肿瘤良恶性、病理分级方面存在一定的假阴性和假阳性,多种显像剂的组合使用可能会克服这方面的缺陷。
1.3核苷酸类
核酸显像剂18F-脱氧尿嘧啶核苷(18F-fluoro-2’-deoxyuridine,18F-FUdR)可反映脑肿瘤核酸代谢。通常FUdR在脑肿瘤研究中具有很高的对比度(因其他正常脑组织摄取低),可反映肿瘤细胞的核酸合成情况。11C-胸腺嘧啶核苷(11C-TdR)和5-18F-尿嘧啶(5-18F-FU)是较常用的核酸类代谢显像剂,参与核酸合成,反映细胞分裂繁殖速度。11C-TdR主要用于肿瘤显像,研究表明其在血中清除速度很快,给药后20 min即能得到脑肿瘤的清晰图像。5-18F-FU可用于评价化疗疗效。此外,5-18F-FU和11C-胸腺嘧啶脱氧核苷也可用于脑肿瘤显像[16]。
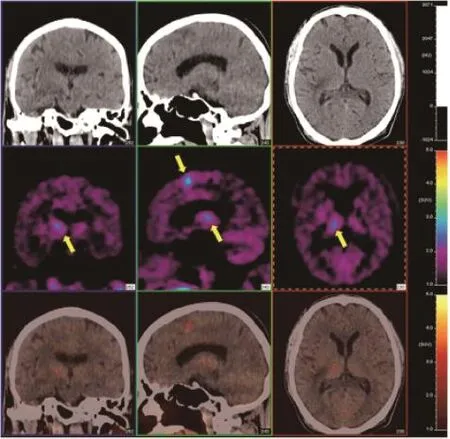
图2 脑肿瘤治疗后复发11C-MET PET显像
18F-胸苷(3’-deoxy-3’-18F-fluorothymidine,18F-FLT)能直接评估细胞胸苷激酶的活性。18F-FLT在体内被细胞胸苷激酶1 (thymidine kinase 1,TK1)磷酸化后滞留在细胞内,正常细胞的TK1活性仅在DNA合成阶段升高10倍左右,而恶性肿瘤细胞的TK1活性不仅升高更明显且表现为持续性,所以可通过18F-FLT显示TK1活性这一特点对肿瘤细胞分裂增殖情况进行显像。细胞培养实验显示,18F-FLT摄取与S期细胞百分比及TK1活性相关性较好[17]。肿瘤对18F-FLT的摄取较快,注射后5~10 min即达峰值并保持稳定达75 min。18F-FLT与Ki-67指数的相关性明显好于FDG,且高级别胶质瘤对18F-FLT的摄取明显高于低级别胶质瘤及对照,因此18F-FLT可作为反映胶质瘤增殖活性的指标。但18F-FLT与18F-FDG一样均为非特异性显像剂,所以肿瘤细胞增殖数量、病灶大小及18F-FLT与TK1的亲和力低于正常胸腺嘧啶等因素均对18F-FLT PET诊断结果造成影响[18]。FLT对胶质瘤的敏感性略低于MET,且FLT在鉴别低级别胶质瘤与非肿瘤病变方面的价值有限,尤其是对低级别的星形细胞瘤。
1.4胆碱
胆碱是一种对动植物非常重要的季铵盐碱。在哺乳动物体内有3种主要代谢途径:第1种代谢途径为胆碱磷酸化途径,即所有细胞都利用胆碱作为合成生物膜分子的重要成分磷脂,如磷脂酰胆碱(卵磷脂)等的前体。首先,胆碱激酶(广泛分布于哺乳动物肝、脑和肺等组织)利用ATP提供的磷酸基催化胆碱发生磷酸化反应,生成磷酸胆碱;然后,磷酸胆碱在CTP和磷酸胆碱胞苷转移酶作用下转化为CDP-胆碱;最后,CDP-胆碱在甘油二酯和脂肪酰甘油转移酶作用下转化为卵磷脂。卵磷脂是生物膜的重要组分之一,参与细胞识别和信息传递。第2种代谢途径为胆碱氧化途径。胆碱在胆碱脱氢酶作用下转化为甜菜碱醛,后者在甜菜碱醛脱氢酶作用下转化为甜菜碱。甜菜碱是一种有机渗透剂,可维持细胞容量的动态平衡。第3种代谢途径为胆碱乙酰化途径。在胆碱乙酰化转移酶催化下,胆碱与CoA作用生成乙酰胆碱。尽管只有少量胆碱发生乙酰化,但这种代谢途径非常重要,因为乙酰胆碱是一种胆碱能神经递质,可特异作用于各类胆碱受体。3种代谢途径以胆碱磷酸化途径与肿瘤的关系最密切。
致癌作用具有加剧细胞增殖的特性,细胞恶性转化会激活胆碱激酶,导致磷酸胆碱含量增加,快速增殖的肿瘤细胞含有大量磷脂特别是卵磷脂;膜结构成分如脂蛋白及磷脂(卵磷脂)等也可调节细胞信号转导过程,从而影响细胞增殖和分化。大量研究表明,大多数恶性肿瘤细胞磷酸胆碱含量高,而相应正常细胞磷酸胆碱含量相当低,甚至无法探测到。脑肿瘤胆碱PET显像发现,脑肿瘤胆碱标记化合物(choline-containing compound,CCC)的含量高于正常脑组织;高度恶性胶质瘤的CCC含量高于低度恶性胶质瘤;慢性放射性坏死病灶的CCC含量低于间变性肿瘤;放疗临床证实有效者,随访肿瘤组织CCC含量降低[19]。可见,恶性肿瘤的发生与胆碱磷酸化途径密切相关。如果用正电子核素(如11C和18F等)标记胆碱或其类似物,该标记物进入体内后,正常脑组织对胆碱也表现为低摄取,11C-胆碱显像可获得高对比度的脑肿瘤显像(图3)。有研究显示,高级别胶质瘤摄取11C-胆碱的程度显著高于低级别胶质瘤,提示11C-胆碱对胶质瘤的分级有一定的价值[20]。因此,胆碱代谢PET可用于肿瘤显像研究。
甲基-11C-胆碱是较常用的胆碱代谢显像剂,优点是脑肿瘤/非肿瘤放射性比值高,肿瘤显像清晰,静脉注射5 min内即达稳定,因此注射后5 min即可进行显像,显著加快了检查流程,比FDG PET显像具有明显优势。11C-胆碱PET与18F-FDG PET联用能很好地诊断胶质瘤并进行分级、较好地鉴别放射性坏死与复发。与MRI相比,在低级别胶质瘤复发与放射性坏死的鉴别中11C-胆碱PET/CT有更好的价值[21]。
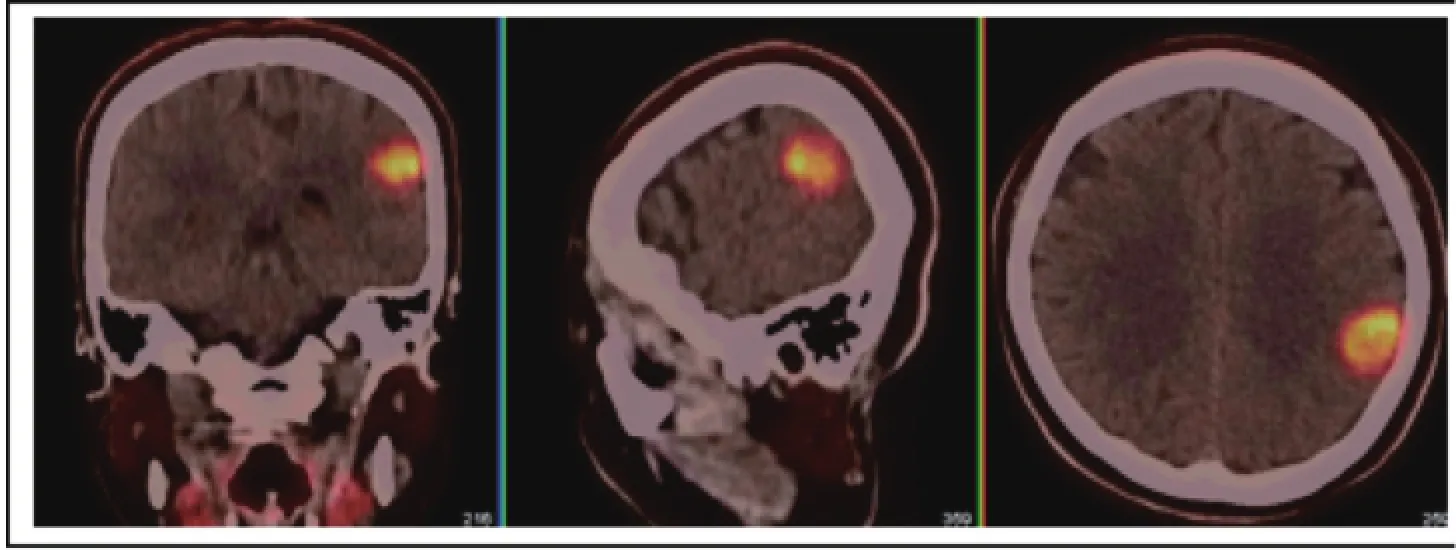
图3 胶质瘤Ⅲ级11C-MET PET/CT显像
1.5脂肪酸
11C-乙酸盐是PET显像常用的脂肪酸代谢显像剂。11C-乙酸在线粒体内转化为11C-乙酰CoA,并进入三羧酸循环氧化为二氧化碳和水,反映细胞的终末代谢情况[22];11C-TdR和5-18FFU能参与核酸合成,反映细胞内有氧代谢。良性肿瘤细胞以有氧代谢为主,恶性程度高的肿瘤细胞以乏氧酵解(葡萄糖代谢)为主,因此乙酸可用于脑良恶性肿瘤的鉴别诊断[23](图4)。
1.6肿瘤受体
肿瘤受体如多巴等在胶质瘤病灶范围界定、肿瘤恶性程度分级、治疗反应评估、疾病预后及肿瘤复发转移与放射性脑损伤鉴别诊断中应用较广。其显像原理主要是通过L-6-18F-多巴(6-[18F] fluoro-L-3,4-dihydroxyphenylalanine,18F-FDOPA)作为经典的多巴胺递质显像剂,在氨基酸转运体的作用下快速通过血-脑屏障,并在脱羧酶的作用下生成18F-多巴胺,被多巴受体高表达的胶质瘤细胞摄取[24-25]。高级别胶质瘤表达生长抑素受体(somatostatin receptor,SSTR),SSTR可介导胶质瘤治疗,目前用于靶向胶质瘤治疗及显像[26]。
1.7乏氧
乏氧是指可利用的氧减少或氧分压降到临界值以下的状态,限制甚至终止细胞、组织和器官的生理功能。肿瘤乏氧,即肿瘤供氧不足,在实体肿瘤中是一个常见现象,亦是恶性肿瘤的一个重要特征。胶质瘤是常见的乏氧肿瘤之一,其中18F-硝基咪唑 (18F-fluoromisonidazole,18F-FMISO)可选择性地与肿瘤乏氧细胞结合,且能通过血-脑屏障,是一种较好的乏氧显像剂,可反映脑胶质瘤的乏氧状态,从而指导胶质瘤的放化疗方案[27]。
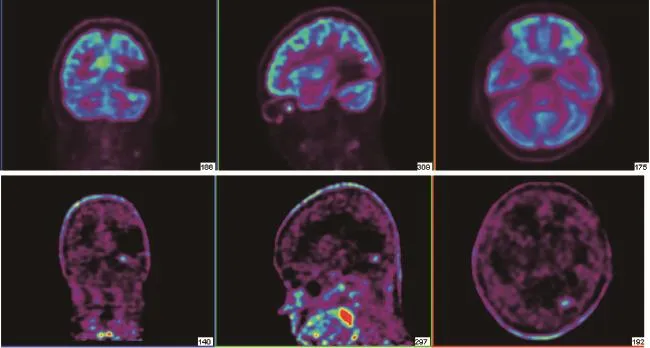
图4 胶质瘤Ⅲ级11C-乙酸 PET/CT显像
1.8血管生成
血管生成在肿瘤的发生发展中起重要作用。整合素ανβ3在胶质瘤等多种肿瘤细胞表面和新生血管内皮细胞中高表达,而在正常细胞和血管中低水平表达。RGD肽是含有精氨酸-甘氨酸-门冬氨酸(Arg-Gly-Asp)序列的一类短肽,能特异性结合细胞表面的整合素[28]。用正电子放射性核素18F标记含RGD序列的多肽,行PET显像可无创性地在活体显示肿瘤生长过程中ανβ3受体的表达变化,间接反映新生血管生成及肿瘤生长情况,在肿瘤诊断及临床治疗疗效评价方面具有重要价值。
1.9表皮生长因子受体
表皮生长因子受体(epidermal growth factor receptor,EGFR)过度表达及其下游信号转导通路如RAS-RAF-MAPK活化在恶性胶质瘤的发生发展中起重要作用,特别是在恶性程度最高的胶质母细胞瘤中,而且EGFR扩增或过表达的胶质瘤患者及EGFR低表达或不表达的患者对表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)具有更好的反应。喹唑啉衍生物PD153035是一种特异度较高的EGFR胞内区ATP竞争性TKI,且11C-PD153035不仅有较高的放射性和放化纯度,还具有更高的生物稳定性和更低的基础代谢率,可用来测量肿瘤中EGFR表达情况[29]。
1.10其他转位蛋白
转位蛋白18 kDa (translocator protein 18 kDa,TSPO)在中枢神经系统中主要分布于胶质细胞线粒体外膜,并在甾体合成相关组织中高度表达,是胶质瘤的潜在新型显像剂[30],[18F]PBR06、[18F]-DPA-714为TSPO配体,[18F]PBR06 PET显像能更特异性地显示胶质瘤的生长,其信噪比优于18F-FDG,且早于MRI改变,具有潜在应用价值[31-33]。此外,还有骨代谢、细胞凋亡及基因表达等显像剂,目前在国内外临床及研究中均获得了较好的应用。
2 PET显像在脑肿瘤术后复发及预后评估中的应用
脑肿瘤临床复发主要指术后结构改变与复发鉴别及胶质瘤从低级别(低度恶性)向高级别(高度恶性)间变。关于肿瘤术后改变与复发的鉴别中,一组45例18F-FDG PET与MRI的比较研究显示,18F-FDG PET的灵敏度、特异度分别为100%和92.9%,MRI分别为93.5%和50%,指出18F-FDG PET显像的灵敏度较高可能与先做MRI有关,建立在已有MRI发现的基础上。因此,MRI灵敏度高,可作为筛选检查,疑有复发可能再做18F-FDG PET[34],以协助区分复发或手术治疗引起的结构改变,以避免失去治疗机会或过度治疗。
有研究报道一组28例低级别胶质瘤,19例呈代谢者随访27个月仍存活,9例代谢增高者6例随访时间内死亡,提示18F-FDG PET对预后有价值。18F-FDG PET对高级别胶质瘤较敏感,但对无间变的低级别胶质瘤灵敏度较低。11C-MET能对低级别胶质瘤的灵敏度起补偿作用,但对近中线的少突胶质细胞瘤、转移性脊索瘤及囊性神经节瘤则呈假阴性。
3 PET/CT在脑肿瘤放疗定位中的应用
FDG有助于对脑肿瘤进行分级,但受高本底摄取的限制,其对肿瘤浸润范围的判断能力有限,尤其是对低级别肿瘤,无法有效将其与周围正常脑组织区分开来。相对于FDG的缺点,上述示踪剂均能显示对比度较好的脑肿瘤图像。与增强MRI结果比较,非FDG PET显示的病灶范围通常更大,可为肿瘤切除范围的制订及放疗靶区的勾画提供更完整的信息[35]。恶性肿瘤常有异质性,故肿瘤活性最高的部位不总是MRI上增强最显著的部位,而应是肿瘤代谢活性最强的部位,PET即是提供代谢信息的最佳工具[35]。许多恶性肿瘤由于生长过速导致其中心部位无法得到足够血供而坏死,此类肿瘤代谢最旺盛的部位往往处于肿瘤的边缘及浸润部位。系列活检结果显示,离MRI增强边缘3 cm处仍有肿瘤细胞存在,且80%的肿瘤复发位于原增强病灶边缘2 cm范围内。有研究显示,不仅在肿瘤的实质性区域,肿瘤的浸润区域同样可表现为11C-MET摄取增高,因此将其用于PET引导下的定向穿刺活检较传统FDG有更好的效果。
放疗是脑胶质瘤的重要局部治疗手段,在少数情况下是唯一治疗手段。既往应用解剖学图像来确定脑胶质瘤的放疗几何靶区并不容易,其原因包括:① 脑胶质瘤特别是高度恶性者,肿瘤往往呈浸润性生长,传统的影像学手段很难确定肿瘤浸润深度和范围;② 手术造成的术后改变使传统解剖学影像手段常用的解剖标志发生了变化,增加了临床医师判断残余肿瘤浸润范围的难度;③ 放疗后肿瘤复发与放疗造成的正常脑组织放射性坏死难以鉴别等。
近年来,随着三维立体适形/调强放疗(three-dimensional conformal radiotherapy/intensitymodulated radiotherapy,3D-CRT/IMRT)技术建立和临床应用,可在大大提高肿瘤靶区物理剂量的同时显著降低肿瘤周围正常组织的物理剂量。从理论上推测,这些新技术的临床应用有望提高对生长在放射线耐受剂量低的脑组织内的脑胶质瘤放疗疗效。3D-CRT/IMRT通过改变靶区内剂量场的分布,实现照射野形状与靶区实际形状在三维空间上相一致,高剂量区的分布与靶区的形状在三维空间上相一致,从而准确地将剂量分布到计划区域,在保证肿瘤照射剂量的同时尽量减少正常组织所受剂量,目前已广泛应用于全身各种肿瘤尤其是脑部肿瘤的放疗中。然而,放疗的精确性提高后,对需照射的肿瘤靶区确定的精确性也需随之提高,这样才能使肿瘤放疗在精确性提高的基础上准确性显著提高。为保证肿瘤部位照射量的同时减少不良反应,准确的计划靶区体积(planning target volume,PTV)的确定显得尤为重要。PTV是在肿瘤总体积(gross tumor volume,GTV)的基础上制订的,因此肿瘤放疗计划制订的关键在于对GTV的准确制订,其中非创伤性的显像技术起关键作用。多种显像技术通过不同的显像原理提供了肿瘤的不同信息,互为补充:MRI能精确显示软组织的解剖结构;CT对骨性结构的描画及照射剂量的准确计算非常重要;以PET为代表的功能性显像技术则提供了肿瘤浸润范围及生物学特性等额外信息。
众所周知,CT在脑部肿瘤的显像方面有较大的局限性:① 脑胶质瘤特别是高度恶性者,肿瘤呈浸润性生长非常明显;② 手术所造成的术后改变增加了临床医师判断肿瘤外侵范围的难度;③ 放疗后肿瘤复发还是正常组织损伤难以鉴别等。随着对肿瘤生物学特性的理解不断加深及现代影像学技术的不断发展,目前认为GTV应是一个基于多种影像学信息的综合概念。理想的肿瘤放疗靶区应为肿瘤的生物靶区体积(biological target volume,BTV),即将最新的功能性显像技术与传统的解剖显像图像融合,以体现肿瘤组织的血流灌注、代谢、增殖活性、乏氧、特异性受体、血管生成及凋亡等方面。
PET是一种用正电子核素进行的放射性示踪显像技术,以解剖形态方式显示活体组织器官内生物化学物质的浓度及其随时间的变化。其显像基础是符合探测(coincidence detection)原理:将标记了正电子放射性核素的示踪剂注入受检者体内时,放射性核素随示踪剂浓聚于受检靶器官并发射正电子。正电子穿过人体组织时,在很短的距离内(1 mm左右)与体内物质的电子发生湮灭辐射(annihilation radiation),产生一对运动方向互成180°、能量为511 keV的γ光子对。这些光子对被围绕人体的探测器采集,经过符合处理获得正电子发射点的位置和时间。以这些位置和时间信息为依据,可重建三维PET图像。由于PET显像仪的不断发展,特别是18F-FDG在全身葡萄糖代谢显像中的成功应用,极大影响了肿瘤的诊断、分期和治疗方式。
PET作为目前最先进的功能性影像学手段在肿瘤BTV制订方面有独特优势。随着PET技术的不断改进及临床应用经验的不断丰富,在制订肿瘤治疗计划方面起重要作用。已有报道显示,18F-FDG PET在非小细胞肺癌、头颈部肿瘤及妇科肿瘤中的应用能优化放疗疗效。但在脑肿瘤显像中,18F-FDG PET由于大脑正常皮质本底摄取过高的影响,无法有效显示低级别胶质瘤,其在脑肿瘤3D-CRT中的应用效果亦无法令人满意。以11C-胆碱为代表的正电子显像剂比传统的18F-FDG PET体现出更大的优势,有多项研究表明11C-胆碱在脑肿瘤显像中不仅灵敏度高,特异度好,还能获取高对比度的肿瘤影像,对脑肿瘤外形边缘的描绘具有18F-FDG显像无法比拟的优势,在脑肿瘤放疗计划的制订中有良好的理论应用前景。脑肿瘤BTV制订方面,有研究者选择8例胶质瘤患者进行增强MRI、18FDG PET、11C-胆碱显像,图像采集后输入放疗计划系统进行BTV勾画并计算PTV,最后与手术病理对比,发现MRI显示与肿瘤实体部分大小无显著差异,18FDG显示与肿瘤实体分别相差2.1、-13.5、-49.9、-32.4、-36.1、-115.2、-4.9及-1.5 cm3,11C-胆碱显示与肿瘤实体分别相差29.5、45.2、60.9、7.2、85.4、124.2、5.3及3.9 cm3。该作者认为11C-胆碱PET对BTV勾画是可行的,结果优于18FDG PET,相对于MRI11C-胆碱PET更可能包括肿瘤亚临床浸润范围。采用11C-MET PET与MRI进行融合制订放疗计划,发现在27% (3/11)病例中11C-MET PET有助于GTV勾画,同时定量11C-MET PET还具有一定的预后指导意义。利用123I-α-甲基酪氨酸(123I-iodo-L-α-methyl tyrosine,IMT) SPECT与MRI图像融合,制订脑胶质瘤3D-CRT计划,结果显示平均GTVIMT、GTVT2和GTVT1Gd分别为43、82和16 cm3。虽然IMT SPECT对PTV影响较小(5%),但对补量区(boost volume)有明显影响(37%)。上述研究为功能性影像在脑瘤放疗计划中的应用开拓了新的领域。
4 PET在脑肿瘤放疗后坏死与复发鉴别中的应用
鉴别放射性脑损伤与肿瘤复发是当前脑肿瘤研究中的难题之一,因为两者临床特征和神经影像学表现有相似之处。尽管许多非侵袭性影像学技术用于鉴别诊断,但没有证据证明其中的某一技术在诊断灵敏度和特异度方面肯定优于其他技术。因此,临床在选择何种影像学技术需由其实用性、肿瘤部位和大小及临床判断来决定。当然精确的鉴别诊断最终依赖切除标本的组织学检查,而最终的鉴别结果直接影响治疗方案的取舍。对神经科临床医师来讲,脑肿瘤复发与放射性脑损伤的鉴别诊断非常重要,确诊前制订治疗计划一定要慎重,以免给患者造成不必要的严重后果。
一般说来,MRI可给脑肿瘤患者提供很好的解剖图像,但仍有局限性。MRI较难准确区别肿瘤残留与手术后早期手术本身造成的影响,因为手术区肉芽组织增生、血-脑屏障破坏及肿瘤残留组织在MRI上经常表现为不同程度的强化影。更重要的是,恶性肿瘤放疗后的放射性脑损伤与肿瘤残留皆可表现为逐渐增大的强化灶、水肿、占位效应及局部坏死、囊变等,给MRI鉴别诊断带来一定困难。病理学研究表明,复发的肿瘤组织常与放射性坏死组织混杂存在,MRI鉴别这种混杂状态非常困难。还有研究表明,MRI鉴别脑肿瘤放射性坏死与复发的灵敏度相对较低,为87.2%,结合PET多种显像剂,可提高胶质瘤复发、坏死及治疗后改变[36]。
由于18F-FDG PET/CT的显像原理是恶性肿瘤组织中肿瘤细胞代谢增强,细胞增殖加快,从而使葡萄糖转运蛋白mRNA表达增加和葡萄糖转运蛋白水平相应提高,葡萄糖类似物FDG可在高代谢部位和恶性肿瘤组织等处异常浓聚,所以18FFDG PET/CT能无创、定量、动态地从细胞分子水平观察肿瘤组织特有的生物学特性,对肿瘤病变的定性有较高的特异度和准确率。另外,18FFDG PET还可用于脑部肿瘤恶性程度的判断,根据局部病变有无明显FDG摄取可将放疗后的脑坏死与肿瘤残留区分。高度恶性肿瘤的无氧酵解高于低度恶性肿瘤,18F-FDG PET可探测肿瘤细胞的生理生化过程,定量测定脑肿瘤的葡萄糖代谢率。
但实际应用中FDG PET鉴别脑肿瘤放疗后坏死与复发时,仍有一定的假阴性和假阴性。有研究表明,单独应用18F-FDG PET/CT鉴别脑肿瘤放疗后坏死与复发的灵敏度为76.9%。假阴性主要与下列因素有关:① FDG在脑内有较高的本底,而脑部肿瘤放疗后代谢减低, FDG浓聚显著下降;② 脑肿瘤的分化程度:有研究表明FDG的摄取与肿瘤的分化程度有关,分化程度低的肿瘤FDG摄取增高,分化程度高的脑肿瘤FDG摄取与脑白质相似,因此高分化的脑部恶性肿瘤易出现假阴性;③ 照射后时间;④ 放疗方法。假阳性主要与放射性坏死本身的代谢(坏死组织周围炎性细胞摄取葡萄糖)有关,FDG由于会有相应的非特异摄取而产生假阳性。
要提高鉴别脑部肿瘤放疗后坏死与复发的准确率,还需灵敏度更高的非FDG显像剂。正常脑组织胆碱摄取量很低,而脑肿瘤的一个重要特征是细胞膜合成明显增加,因此脑肿瘤的胆碱摄取率较周围正常脑组织及坏死脑组织高得多(瘤与脑的放射性摄取比约为11.0)[37]。有研究表明,11C-Choline PET/CT诊断的灵敏度为92.3%,显著高于MRI及18F-FDG PET/CT[38](图5)。
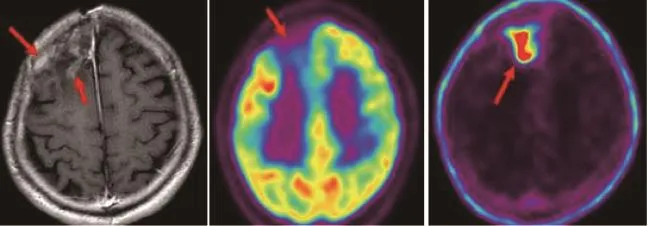
图5 胶质瘤复发11C-Choline PET显像
5 脑部PET/MRI应用潜能
PET/MRI融合系统对脑部结构的显像是PET的主要应用,也是最早进行研究的领域。高分辨率多参数MRI系统证明这种融合对脑部结构和功能的显像并没有明显损失,反而使结构的形态特征和生物学信息更容易结合。各种代谢和功能参数的同步采集可能会给大脑组织和疾病及其变化带来新的显像方式,PET/MRI在分子和细胞成像方面开辟了新的领域,在血管生成、基因转移、细胞移植和功能等方面有很好的进展。
PET的最大优势是灵敏度高,检测生物化学物质和分子示踪剂的特异度较高,PET/MRI融合系统主要用于神经系统[39]。PET对脑部的功能显像主要是通过脑部葡萄糖代谢显像获得。早期的PET分辨率低,灵敏度低,衰减和散射校正不足,只能显示到脑部皮质部分。随着技术提高,发展到在6.5~7 mm的空间分辨率内连续呈现47幅图像,横向和轴向范围可达5~8 mm。目前,PET显像仪的灵敏度和空间分辨率均大大提高,但空间分辨率相对于CT和MRI来讲仍较低,因此出现了PET/CT和PET/MRI。但融合系统在软件构成方面面临巨大挑战,同时受生物体本身的影响,如分子和生物遗传活动是否受影响仍在探索中。虽然商品化的PET/CT融合系统在临床应用很成功,但由于CT对软组织的分辨率有限,PET/CT在脑部中的应用价值并不高,这就促进了PET/ MRI的发展。将HRRT PET与7.0T高磁场的磁共振仪连接,可提供高灵敏度的脑部分子或生物信息和高分辨率的解剖结构[40]。
最近有研究回顾了PET和MRI数据的同时性获得,有助于检测胶质瘤分级和辨别肿瘤周围关键神经活动区域。胶质瘤是脑内最常见的原发肿瘤,起源于神经上皮,由异常增生的胶质细胞组成,正常神经元数量减少或缺失。因此,胶质瘤的磁共振波谱 (magnetic resonance spectroscopy,MRS)通常表现为N-乙酰天冬氨酸(N-acetyl aspartate,NAA)峰及肌酐(creatinine,Cr)峰降低,胆碱(choline,Cho)峰升高,故Cho/ Cr和Cho/NAA值升高,NAA/Cr和NAA/Ch值降低[41]。研究发现,高级别胶质瘤NAA峰降低较低级别胶质瘤明显,在肿瘤中心部位常明显降低甚至缺乏。高级别与低级别胶质瘤的1H-MRS 表现不同,临床可借助1H-MRS表现对胶质瘤进行分级[42-43]。PET对脑胶质瘤的诊断主要是利用18FFDG在脑内的代谢状况,代谢活跃区域显像明显,代谢减低区域显像相对减弱,坏死区域基本不显影[44],MRI在多发性硬化(multiple sclerosis,MS)的诊断及病情判断中具有独特的领先地位,能显示CT无法显示的长径<0.2 cm 的病灶,对脑干、脊髓部位的亚临床损伤及微小病灶、后颅窝病灶更显优势,可通过病灶特点及增强扫描作出定性诊断并辨别病程与病期,是MS的最直观辅助检查,不仅定位准确,还能清晰显示病灶数目、分布、大小、形态及信号特征[45]。而液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列对诊断MS优于T1 FLAIR、T2WI,其发现MS病灶明显多于后者,且重复性好,能较好地显示近皮质处和脑室旁等传统T2易漏诊的病灶,尤其对小病灶的显示明显优于T1 FLAIR、T2WI。
6 结语
随着人们对胶质瘤分子生物学及基因组学的认识越来越清晰,借助分子影像学对胶质瘤进行分子水平检测越来越重要。各类正电子显像剂在脑胶质瘤的临床应用中各具特点,各有优势和不足。要提高脑胶质瘤诊断、分级、术后评估、预后判断的效能,可应用多种显像剂和(或)多模式显像方法,从多角度反映胶质瘤的生物学特性。随着分子探针的不断改进和成像技术的日益完善,相信在不久的将来分子影像学在临床应用中会彰显巨大作用。
[1] ALBERT N L, WELLER M, SUCHORSKA B, et al. Response Assessment in Neuro-Oncology working group and European Association for Neuro-Oncology recommendations for the clinical use of PET imaging in gliomas [J]. Neuro-Oncology, 2016, 18(9): 1199-1208.
[2] KOSTENIKOV N A, TIUTIN L A, FADEEV N P,et al. Differential diagnosis of brain gliomas by positron emission tomography using various radiopharmaceuticals[J]. Vestn Rentgenol Radiol, 2014, (5): 13-18.
[3] ZHANG Y, XU H, WANG H, et al. Fluorine-18-deoxyglucose positron emission tomography/ computed tomography with Ki67 and GLUT-1 immunohistochemistry for evaluation of the radiosensitization effect of oleanolic acid on C6 rat gliomas[J]. Nucl Med Commun, 2015, 36(1): 21-27.
[4] MERIC K, KILLEEN R P, ABI-GHANEM A S, et al. The use of18F-FDG PET ratios in the differential diagnosis of common malignant brain tumors [J]. Clin Imaging, 2015, 39(6): 970-974.
[5] OBORSKI M J, LAYMON C M, LIEBERMAN F S,et al. Distinguishing pseudoprogression from progression in high-grade gliomas: a brief review of current clinical practice and demonstration of the potential value of18F-FDG PET [J]. Clin Nucl Med, 2013, 38(5): 381-384.
[6] HATZOGLOU V, YANG T J, OMURO A, et al. A prospective trial of dynamic contrast-enhanced MRI perfusion and fluorine-18 FDG PET-CT in differentiating brain tumor progression from radiation injury after cranial irradiation [J]. Neuro-Oncology, 2016,18(6): 873-880.
[7] HEISS W D. Clinical impact of amino acid PET in gliomas [J]. J Nucl Med, 2014, 55(8): 1219-1220.
[8] THON N, KUNZ M, LEMKE L, et al. Dynamic18F-FET PET in suspected WHO grade Ⅱ gliomas defines distinct biological subgroups with different clinical courses [J]. Int J Cancer, 2015, 136(9): 2132-2145.
[9] JANSEN N L, SUCHORSKA B, WENTER V, et al. Prognostic significance of dynamic18F-FET PET in newly diagnosed astrocytic high-grade glioma [J]. J Nucl Med, 2015, 56(1): 9-15.
[10] SHI X, YI C, WANG X, et al.13N-ammonia combined with18F-FDG could discriminate between necrotic highgrade gliomas and brain abscess [J]. Clin Nucl Med, 2015,40(3): 195-199.
[11] TAKANO K, KINOSHITA M, ARITA H, et al. Diagnostic and prognostic value of11C-Methionine PET for nonenhancing gliomas [J]. AJNR Am J Neuroradiol,2016, 37(1): 44-50.
[12] DUNET V, POMONI A, HOTTINGER A, et al. Performance of18F-FET versus18F-FDG-PET for the diagnosis and grading of brain tumors: systematic review and meta-analysis [J]. Neuro-oncology, 2016, 18(3): 426-434.
[13] PYKA T, GEMPT J, HIOB D, et al. Textural analysis of pre-therapeutic [18F]-FET-PET and its correlation with tumor grade and patient survival in high-grade gliomas [J]. Eur J Nucl Med Mol Imaging, 2016, 43(1): 133-141.
[14] STEGMAYR C, SCHONECK M, OLIVEIRA D, et al. Reproducibility of O-(2-18F-fluoroethyl)-L-tyrosine uptake kinetics in brain tumors and influence of corticoid therapy: an experimental study in rat gliomas [J]. Eur J Nucl Med Mol Imaging, 2016, 43(6): 1115-1123.
[15] JABER M, WOLFER J, EWELT C, et al. The value of 5-aminolevulinic acid in low-grade gliomas and high-grade gliomas lacking glioblastoma imaging features: an analysis based on fluorescence, magnetic resonance imaging,18F-fluoroethyl tyrosine positron emission tomography, and tumor molecular factors [J]. Neurosurgery, 2016, 78(3): 401-411; discussion 11.
[16] CHIEN Y C, CHEN J C, LIN W C, et al. Using18F FBAU for imaging brain tumor progression in an F98/ tk-luc glioma-bearing rat model [J]. Oncol Rep, 2014,32(2): 691-699.
[17] ZHAO F, CUI Y, LI M, et al. Prognostic value of 3’-deoxy-3’-18F-fluorothymidine ([18F] FLT PET)in patients with recurrent malignant gliomas [J]. Nucl Med Biol, 2014, 41(8): 710-715.
[18] FERDOVA E, FERDA J, BAXA J, et al. Assessment of grading in newly-diagnosed glioma using18F-fluorothymidine PET/CT [J]. Anticancer Res, 2015,35(2): 955-959.
[19] GIOVANNINI E, LAZZERI P, MILANO A, et al. Clinical applications of choline PET/CT in brain tumors[J]. Curr Pharm Des, 2015, 21(1): 121-127.
[20] LI W, MA L, WANG X, et al.11C-choline PET/CT tumor recurrence detection and survival prediction in post-treatment patients with high-grade gliomas [J]. Tumour Biol, 2014, 35(12): 12353-12360.
[21] TAKENAKA S, ASANO Y, SHINODA J, et al. Comparison of11C-methionine,11C-choline, and18F-fluorodeoxyglucose-PET for distinguishing glioma recurrence from radiation necrosis [J]. Neurol Med Chir,2014, 54(4): 280-289.
[22] LIU R S, CHANG C P, CHU L S, et al. PET imaging of brain astrocytoma with 1-11C-acetate [J]. Eur J Nucl Med Mol Imaging, 2006, 33(4): 420-427.
[23] YAMAMOTO Y, NISHIYAMA Y, KIMURA N, et al.11C-acetate PET in the evaluation of brain glioma: comparison with11C-methionine and18F-FDG-PET [J]. Mol Imaging Biol, 2008, 10(5): 281-287.
[24] CICONE F, FILSS C P, MINNITI G, et al. Volumetric assessment of recurrent or progressive gliomas: comparison between F-DOPA PET and perfusion-weighted MRI [J]. Eur J Nucl Med Mol Imaging, 2015, 42(6): 905-915.
[25] KARAVAEVA E, HARRIS R J, LEU K, et al. Relationship between [18F]FDOPA PET Uptake, apparent diffusion coefficient (ADC), and proliferation rate in recurrent malignant gliomas [J]. Mol Imaging Biol, 2015,17(3): 434-442.
[26] KIVINIEMI A, GARDBERG M, FRANTZEN J, et al. Somatostatin receptor subtype 2 in high-grade gliomas: PET/CT with68Ga-DOTA-peptides, correlation to prognostic markers, and implications for targeted radiotherapy [J]. EJNMMI Res, 2015, 5: 25.
[27] KAWAI N, LIN W, CAO W D, et al. Correlation between18F-fluoromisonidazole PET and expression of HIF-1alpha and VEGF in newly diagnosed and recurrent malignant gliomas [J]. Eur J Nucl Med Mol Imaging,2014, 41(10): 1870-1878.
[28] TSIAPA I, EFTHIMIADOU E K, FRAGOGEORGI E, et al.99mTc-labeled aminosilane-coated iron oxide nanoparticles for molecular imaging of αvβ3-mediated tumor expression and feasibility for hyperthermia treatment [J]. J Colloid Interface Sci, 2014, 433: 163-175.
[29] SUN J, CAI L, ZHANG K, et al. A pilot study on EGFR-targeted molecular imaging of PET/CT with11C-PD153035 in human gliomas [J]. Clin Nucl Med,2014, 39(1): e20-e26.
[30] RONCAROLI F, SU Z, HERHOLZ K, et al. TSPO expression in brain tumours: is TSPO a target for brain tumour imaging [J]. Clin Transl Imaging, 2016, 4: 145-156.
[31] BUCK J R, MCKINLEY E T, FU A, et al. Preclinical TSPO ligand PET to visualize human glioma xenotransplants: a preliminary study [J]. PLoS One, 2015,10(10): e0141659.
[32] PERSSON M, NEDERGAARD M K, BRANDTLARSEN M, et al. Urokinase-type plasminogen activator receptor as a potential PET biomarker in glioblastoma [J]. J Nucl Med, 2016, 57(2): 272-278.
[33] SU Z, RONCAROLI F, DURRENBERGER P F, et al. The 18-kDa mitochondrial translocator protein in human gliomas: an11C-(R)PK11195 PET imaging and neuropathology study [J]. J Nucl Med, 2015, 56(4): 512-517.
[34] DANKBAAR J W, SNIJDERS T J, ROBE P A, et al. The use of18F-FDG PET to differentiate progressive disease from treatment induced necrosis in high grade glioma [J]. J Neurooncol, 2015, 125(1): 167-175.
[35] SUCHORSKA B, ALBERT N L, TONN J C. Usefulness of PET imaging to guide treatment options in gliomas [J]. Curr Treat Options Neurol, 2016, 18(1): 4.
[36] BERNTSSON S G, FALK A, SAVITCHEVA I,et al. Perfusion and diffusion MRI combined with11C-methionine PET in the preoperative evaluation of suspected adult low-grade gliomas [J]. J Neurooncol,2013, 114(2): 241-249.
[37] KHANGEMBAM B C, KARUNANITHI S,SHARMA P, et al. Perfusion-metabolism coupling in recurrent gliomas: a prospective validation study with13N-ammonia and18F-fluorodeoxyglucose PET/CT [J]. Neuroradiology, 2014, 56(10): 893-902.
[38] CICUENDEZ M, LORENZO-BOSQUET C,CUBERAS-BORROS G, et al. Role of [11C]methionine positron emission tomography in the diagnosis and prediction of survival in brain tumours [J]. Clin Neurol Neurosurg, 2015, 139: 328-333.
[39] HENRIKSEN O M, LARSEN V A, MUHIC A, et al. Simultaneous evaluation of brain tumour metabolism,structure and blood volume using [18F]-fluoroethyltyrosine(FET) PET/MRI: feasibility, agreement and initial experience [J]. Eur J Nucl Med Mol Imaging, 2016, 43(1): 103-112.
[40] TIWARI V, PANDE S C, GOEL S, et al. Application of PET-MRI in pseudo progression versus true progression in high grade gliomas: A new avenue! [J]. J Neurosci Rural Pract, 2014, 5(1): 94-98.
[41] LEU K, POPE W B, CLOUGHESY T F, et al. Imaging biomarkers for antiangiogenic therapy in malignant gliomas [J]. CNS Oncol, 2013, 2(1): 33-47.
[42] ERTL-WAGNER B, INGRISCH M, NIYAZI M, et al. PET-MR in patients with glioblastoma multiforme [J]. Radiologe, 2013, 53(8): 682-690.
[43] KIM E S, SATTER M, REED M, et al. A novel,integrated PET-guided MRS technique resulting in more accurate initial diagnosis of high-grade glioma [J]. Neuroradiol J, 2016, 29(3): 193-197.
[44] YOON J H, KIM J H, KANG W J, et al. Grading of cerebral glioma with multiparametric MR imaging and18F-FDG-PET: concordance and accuracy [J]. Eur Radiol, 2014, 24(2): 380-389.
[45] ZUKOTYNSKI K, FAHEY F, KOCAK M, et al.18F-FDG PET and MR imaging associations across a spectrum of pediatric brain tumors: a report from the pediatric brain tumor consortium [J]. J Nucl Med, 2014,55(9): 1473-1
Application of PET molecular imaging in gliomas
KONG Yanyan, GUAN Yihui (PET Center of Huashan Hospital,Fudan University, Shanghai 200235, China)
Correspondence to: GUAN Yihui E-mail: guanyihui@hotmail.com
Non-invasive positron emission tomography (PET) enables the measurement of metabolic and molecular processes with high sensitivity. PET plays a significant role in the diagnosis, prognosis, and treatment of gliomas and predominantly detects gliomas by detecting their metabolic alterations, including energy metabolism, amino acid metabolism, choline metabolism,nucleic acid metabolism, and hypoxic metabolism, etc. Glucose metabolic tracers are related to tumor cell energy and exhibit good sensitivity but poor specificity for gliomas. Amino acid metabolic tracers provide a better delineation of tumors and cellular proliferation. Choline and nucleic acid metabolic tracers have high sensitivity for gliomas and cellular proliferation. Hypoxic metabolism tracers are useful for detecting resistance to radiotherapy and chemotherapy. Therefore, PET imaging techniques are useful for detecting biopsy-targeting points, deciding on tumor resection, radiotherapy planning, monitoring therapy, and distinguishing glioma recurrence or progression from post-radiotherapy effects. However, it is not possible to use only one PET tracer to make all clinical decisions because each tracer has both advantages and disadvantages. This study focuses on the different kinds of PET tracers and summarizes their recent applications in patients with gliomas. Combinational uses of PET tracers are expected tocontribute to differential diagnosis, prognosis, targeted treatment, and monitoring therapy.
Glioma; Positron emission tomography;18F-fluorodeoxyglucose;11C-methionine; 3’-deoxy-3’-18F-fluorothymidine;18F-fluoromisonidazole;11C-choline
R445.5
A
1008-617X(2016)03-0196-13
国家自然科学基金(No:81271516、81571345),上海市科委项目(No:13JC1401503、14DZ1930400、14DZ1930402);复旦大学老年医学专项支持计划青年学者创新研究项目(No:IDF151006);上海市科委资助项目(No:16411968700 )
管一晖 E-mail:guanyihui@hotmail.com
(2016-09-10)

