大鼠脑干星形胶质细胞在应激性胃黏膜损伤中的作用*
秦雪,刘真,王璟,仝令印,孙海基
(山东师范大学生命科学学院生理学教研室,济南250014)
1 引 言
束缚—浸水应激(restraint water-immersion stress,RWIS)作为一种复合应激模型对躯体和心理方面有较大的刺激强度。该模型可在短时间内使大鼠情绪暴躁、体温下降并导致胃肠机能发生紊乱,如产生急性胃黏膜损伤[1]。许多研究证明,脑内多个核团和区域参与胃机能的调节。其中,位于延髓的DMV、NTS作为迷走复合体的组成部分,是调控胃机能的副交感初级中枢。
应激条件下,Fos蛋白的表达一般被认为是神经元激活的标志,本实验室的前期研究发现,RWIS不同时段,大鼠NTS、DMV等部位的Fos表达发生了不同程度的变化[2],说明其参与了束缚—浸水应激反应。脑和脊髓中存在大量星形胶质细胞,其中胶质纤维酸性蛋白(GFAP)是其重要组成成分[3],而引起星形胶质细胞发生反应的标志就是GFAP表达的增强。在一侧胫腓骨骨折的即刻应激反应模型中,延髓内脏带、中缝大核等有明显的GFAP阳性表达,并且与Fos蛋白的分布基本一致[4]。但对于星形胶质细胞是否参与RWIS的研究还未曾报道。已有研究表明,在应激条件下,星形胶质细胞在形态和功能方面的可塑性对调节神经元活动起到重要的作用。段丽等人[5]的研究表明,视上核(SON)内神经元是通过星形胶质细胞的活动状态对高渗刺激作出反应。如果神经元和星形胶质细胞都参与RWIS,那两者之间的关系是相互促进还是相互抑制目前尚不清楚。L-AA是一种谷氨酸类似物,它可抑制星形胶质细胞的表达,但不直接抑制神经元的表达。有研究表明,向脊髓鞘内注射L-AA后,可抑制星形胶质细胞在脊髓背角的表达;而且神经元的表达也明显减少。此外,大鼠经L-AA预先处理,可显著抑制高渗刺激下视上核星形胶质细胞的表达,对神经元Fos蛋白的表达也起到了抑制作用[6]。那么,L-AA预先处理的大鼠,在RWIS条件下,是否会影响NTS和DMV核团内神经元Fos的表达目前尚未有研究。
2 材料和方法
2.1 实验材料与试剂
实验动物是体重分别为220~250 g和250~300 g雄性Wistar大鼠,购于山东大学动物实验中心。兔c-Fos由美国Santa Cruz公司提供;兔抗GFAP由北京博奥森生物技术有限公司提供,两者均由PBS、10%Triton X-100和10%NGS稀释;正常山羊血清;SP系列试剂盒购于中杉金桥公司;L-α-aminoadipate,L-AA购于Aladdin试剂有限公司,由生理盐水稀释。
2.2 动物分组与模型制备
(1)将36只体重为220~250 g雄性 Wistar大鼠随机分为对照组和实验组,实验组又分为束缚浸水应激 0.5、1、2、3、5 h五个亚组,每组各 6只,正式实验前24 h饥饿处理。应激组大鼠经乙醚轻度麻醉后,背向木板固定四肢,10min后将其竖直放于冷水(21±1℃)中,水位达胸骨剑突处。对照组不进行束缚—浸水处理。(2)将12只体重为250~300 g大鼠随机分为生理盐水对照组和L-AA组各6只,按大鼠体重,以5 ml/kg的4%水合氯醛麻醉大鼠,侧脑室定位(前囟后0.96 mm,旁开1.8 mm,硬脑膜下3.5mm)埋管,手术后连续两天注射青霉素消炎,恢复三天,正式实验前24 h禁食。大鼠经乙醚轻度麻醉后,背向木板固定四肢,微量注射器侧脑室注射10μl生理盐水或者L-AA。10 min后将其竖直放于冷水(21±1℃)中1 h,水位达胸骨剑突处。为避免昼夜节律影响应激反应,所有束缚—浸水处理过程均在上午7时至12时进行。
2.3 胃黏膜损伤的评估
RWIS结束后,腹腔注射过量4%水合氯醛,将胃从腹腔取出后用4%多聚甲醛溶液固定40 min。将胃沿胃大弯剪开冲洗干净,解剖镜下(10×)观察胃黏膜损伤程度。胃黏膜损伤程度用Guth计数法计算后采用损伤指数(EI)表示。
2.4 组织准备
大鼠取出胃后,依次用0.01mol/l的PBS,pH=7.4和4℃的多聚甲醛,pH=7.4经心脏全身灌流固定、取脑,置于多聚甲醛中4℃冰箱后固定4 h,随后放入30%的蔗糖溶液中脱水过夜。脑沉底后用冰冻切片机对延髓进行片厚20μm的冠状切片,将切好的脑片放在 PBS(0.01 mol/l)中备用。
2.5 免疫组织化学染色
将两套相同切片漂洗后加入30%的过氧化氢/甲醇溶液,室温孵育30 min,消除内源性酶的活性;含10%正常羊血清和10%TritonX-1000的PBS 0.01mol/l pH=7.4,室温孵育 30 min;加入兔抗 GFAP抗体(1:500)或兔抗 c-fos抗体(1:600),4℃孵育24 h;再依次加入生物素标记山羊抗兔IgG和辣根酶标记链霉卵白素工作液,室温下各孵育2 h;DAB显色液避光显色5 min;各步骤之间均用PBS漂洗,将脑片贴在明胶处理的载玻片上,脱水、透明、中性树胶封片。
2.6 显微拍照计数及统计学分析
借助显微镜观察DMV和NTS中GFAP或者Fos-IR神经元表达情况;其吻端、中端和尾端GFAP或者 Fos-IR神经元的个数(个数/0.01 mm2)用Image pro-Plus 6.0图象分析软件统计。均数采用均数±标准误表示,数据处理用SPSS 13.0统计软件,用双尾独立性样本t-检验比较组间均数,用单因素方差分析和S-N-K多重比较进行吻端、中端、尾端间的均数比较。P<0.05为差异有统计学意义。
3 结果
3.1 束缚-浸水应激不同时间段对胃黏膜损伤和GFAP表达的影响
3.1.1 胃溃疡指数统计 与对照组相比,胃溃疡指数在应激组各时段均有极显著差异,P<0.01,见图1。随着应激时间延长,胃溃疡指数显著升高,胃黏膜损伤由对照组的光滑完整变为出现点状血斑,甚至出现条状血斑,见图2。
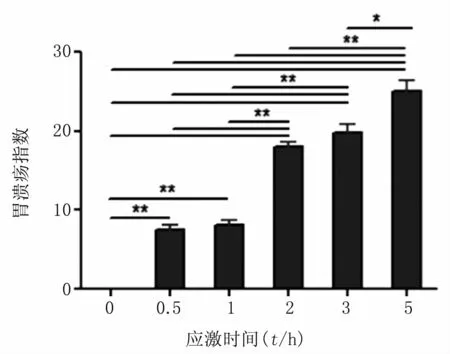
图1 对照组和应激组各时段胃溃疡指数的比较(*P<0.05,**P<0.01)Fig 1 The gastric ulcer index of the unstressed and stressed 0.5,1,2,3,5h rats(*P<0.05,**P<0.01)
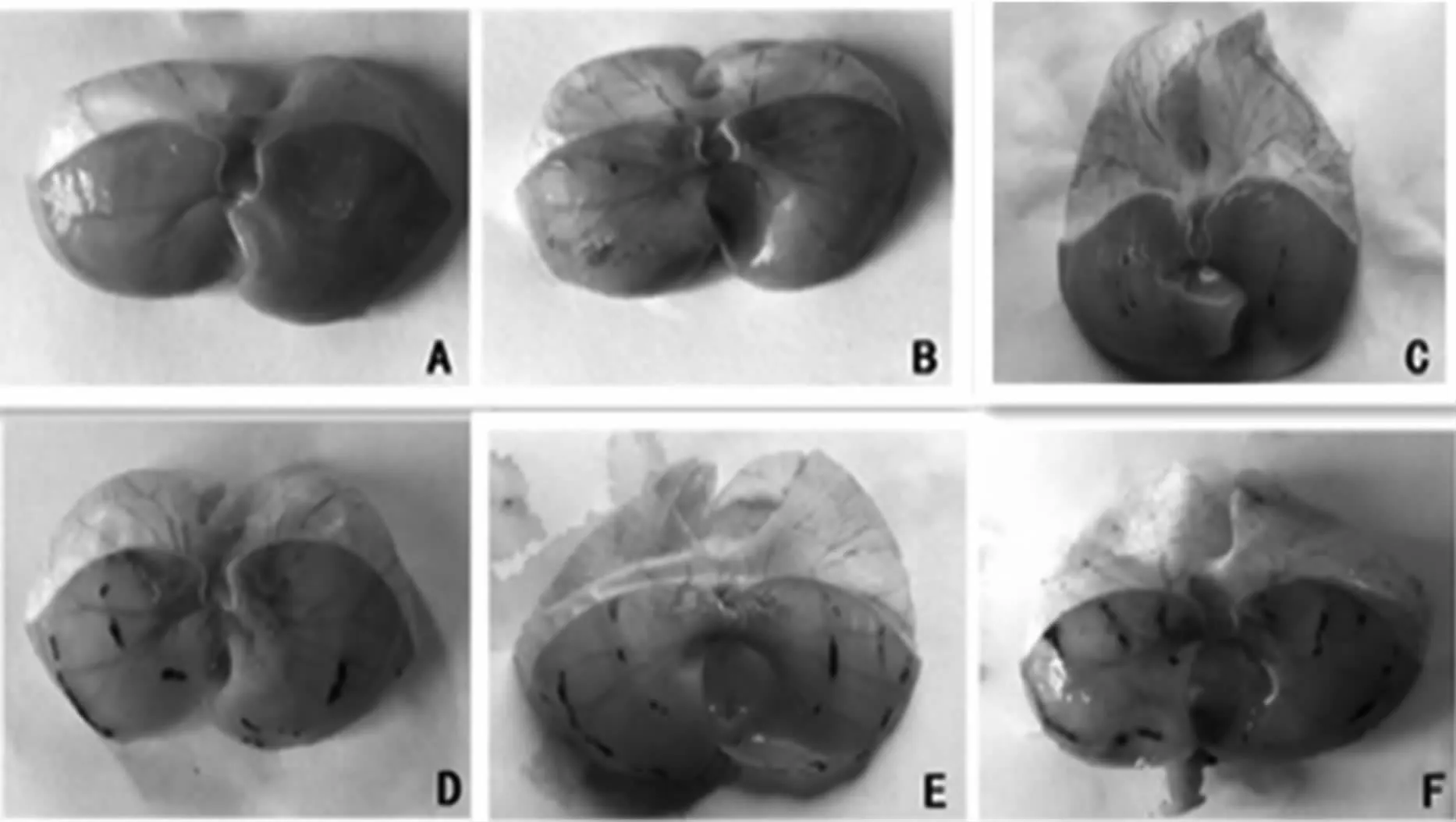
图2 RW IS不同时间段对胃黏膜损伤的比较A:对照组;B:RWIS 0.5小时组;C:RWIS 1小时组;D:RWIS 2小时组;E:RWIS 3小时组;F:RWIS 5小时组。Fig 2 Gastric mucosa of the unstressed and stressed ratsA:Unstressed group;B:RWIS 0.5h group;C:RWIS 1h group;D:RWIS 2h group;E:RWIS 3h group;F:RWIS 5h group.
3.1.2 NTS和DMV不同区段GFAP的表达 免疫组化结果显示,相比对照组,应激组各时段NTS和DMV不同区段GFAP表达增加,细胞突起增多。见图3。GFAP分布在NTS和DMV的吻-尾全段,应激1 h时,NTS和DMV三个区段的GFAP表达均达到高峰,之后GFAP表达有所下降,但与对照组相比仍有显著差异,见图4、图5、图6。
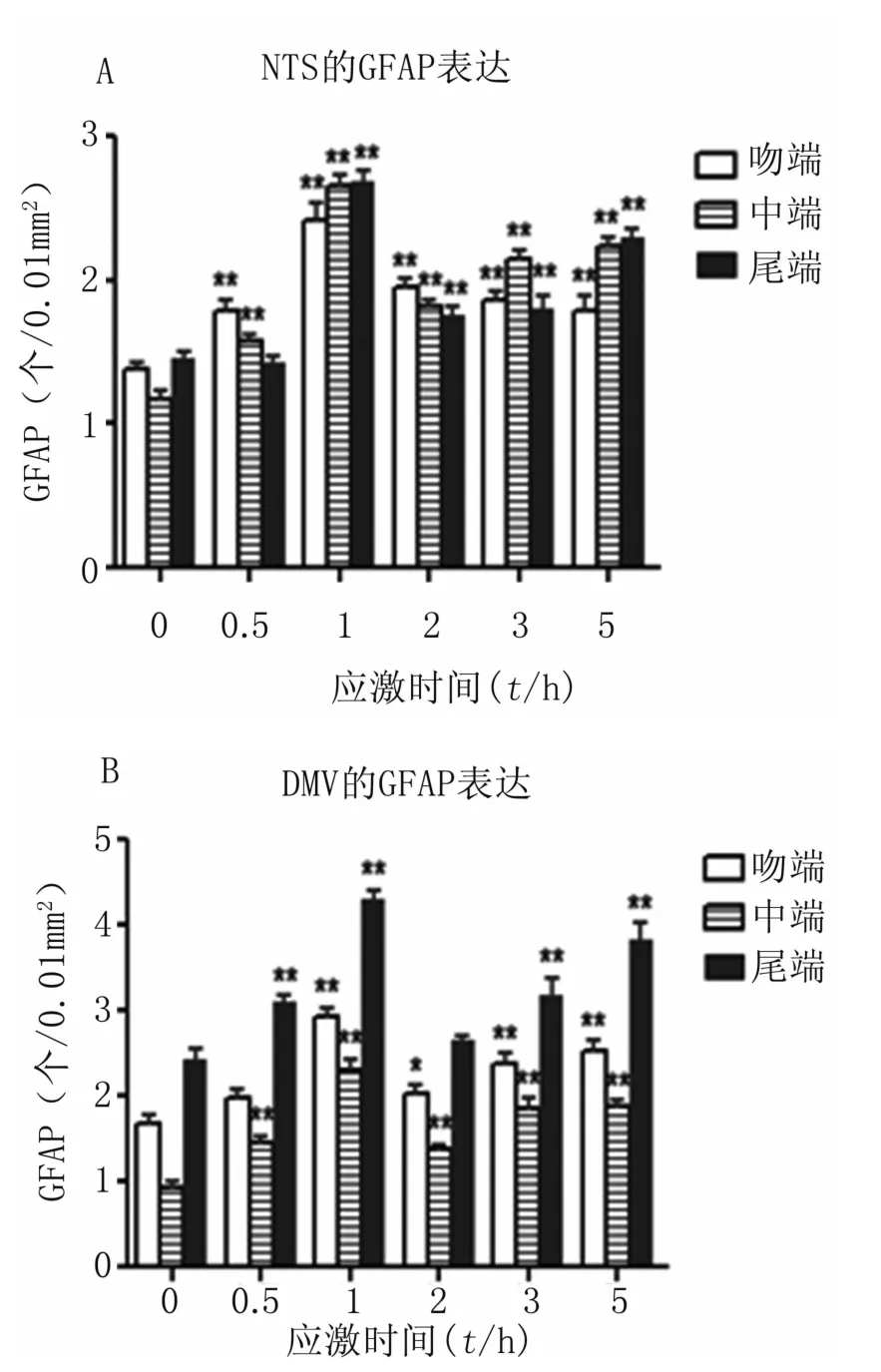
图3 对照组和应激 0.5、1、2、3、5h组 NTS和 DMV不同区段GFAP的表达各应激组与对照组比较,*P<0.05,**P<0.01 A:NTS不同区段GFAP表达;B:DMV不同区段GFAP表达。Fig 3 GFAP expression in different sections of the DMV and NTS in the unstressed and stressed 0.5,1,2,3,5h RatsEach stress group compared with control group,*P<0.05,**P<0.01 A:GFAP expression in different sections of the NTS;B:GFAP expression in different sections of the DMV
3.2 星形胶质细胞抑制剂L-AA对胃黏膜损伤和GFAP及Fos表达的影响
3.2.1 给药处理胃溃疡指数统计应激1 h,与生理盐水对照组相比,注射L-AA组胃溃疡指数降低,P<0.05,见图7。生理盐水对照组胃黏膜损伤程度较为严重,出现条索状血斑。而注射L-AA组,胃黏膜表面只有少数溃疡斑点,损伤较轻,见图8。
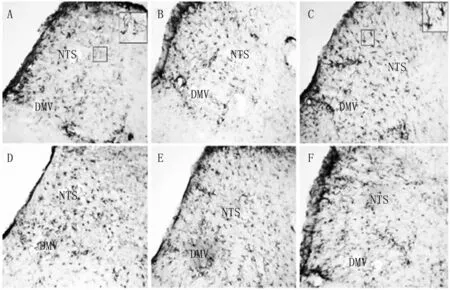
图4 对照组和RW IS不同时段组GFAP在大鼠NTS、DMV吻端的表达(×200)A:对照组;B:RWIS 0.5小时组;C:RWIS 1小时组;D:RWIS 2小时组;E:RWIS 3小时组;F:RWIS 5小时组。Fig.4 GFAP expression in the rostral portion of the NTS and DMV in the unstressed and stressed 0.5,1,2,3,5h rats(×200)A:Unstressed group;B:RWIS 0.5h group;C:RWIS 1h group;D:RWIS 2h group;E:RWIS 3h group;F:RWIS 5h group.
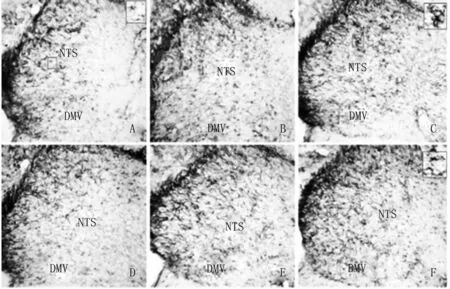
图5 对照组和RW IS不同时段组GFAP在大鼠NTS、DMV中端的表达(×200)A:对照组;B:RWIS 0.5小时组;C:RWIS 1小时组;D:RWIS 2小时组;E:RWIS 3小时组;F:RWIS 5小时组。Fig 5 GFAP expression in the intermediate portion of the NTS and DMV in the unstressed and stressed 0.5,1,2,3,5h rats(×200)A:Unstressed group;B:RWIS 0.5h group;C:RWIS 1h group;D:RWIS 2h group;E:RWIS 3h group;F:RWIS 5h group
3.2.2 给药处理GFAP和Fos在NTS和DMV不同区段的表达免疫组化结果显示,相比生理盐水对照组,使用L-AA抑制剂后,GFAP在NTS和DMV各个区段的表达明显减少,同时神经元标记物Fos表达也显著减少,说明L-AA可以抑制星形胶质细胞,见图9、图 10、图11。

图6 对照组和RW IS不同时段组GFAP在大鼠 NTS、DMV尾端的表达(×200)A:对照组;B:RWIS 0.5小时组;C:RWIS 1小时组;D:RWIS 2小时组;E:RWIS 3小时组;F:RWIS 5小时组。Fig 6 GFAP expression in the caudal portion of the NTS and DMV in the unstressed and stressed 0.5,1,2,3,5h rats(×200)A:Unstressed group;B:RWIS 0.5h group;C:RWIS 1h group;D:RWIS 2h group;E:RWIS 3h group;F:RWIS 5h group

图7 生理盐水对照组和注射L-AA组对胃溃疡指数的影响(*P<0.05,**P<0.01)Fig 7 The gastric ulcer index of the saline and L-AA rats(*P<0.05,**P<0.01)
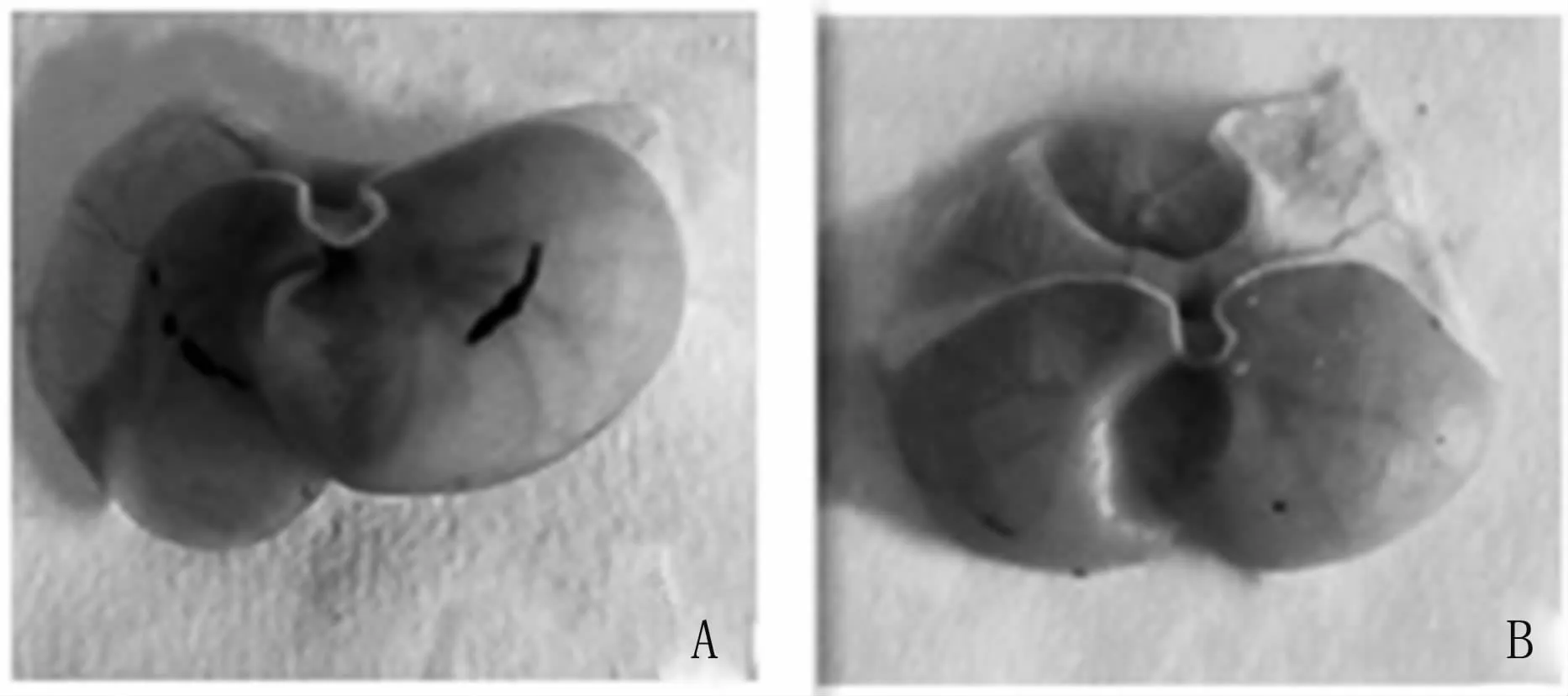
图8 生理盐水组、L-AA组大鼠胃粘膜A:生理盐水组;B:L-AA组。Fig 8 Gastric mucosa of the saline and L-AA ratsA:saline group;B:L-AA group
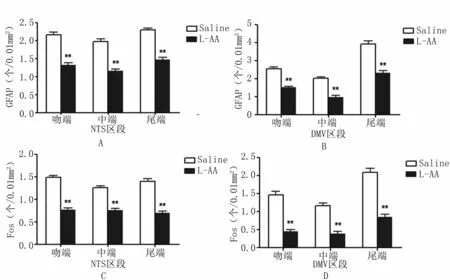
图9 生理盐水对照组和L-AA给药处理NTS和DMV不同区段GFAP和Fos的表达给药组与生理盐水组比较,*P<0.05,**P<0.01 A:NTS区段GFAP表达;B:DMV区段GFAP表达;C:NTS区段Fos表达;D:DMV区段Fos表达。Fig 9 GFAP and Fos expression in different sections of the DMV and NTS of the saline and L-AA rats.L-AA group compared with saline group,*P<0.05,**P<0.01 A:GFAP expression in the NTS;B:GFAP expression in the DMV;C:Fos expression in the NTS;D:Fos expression in the DMV
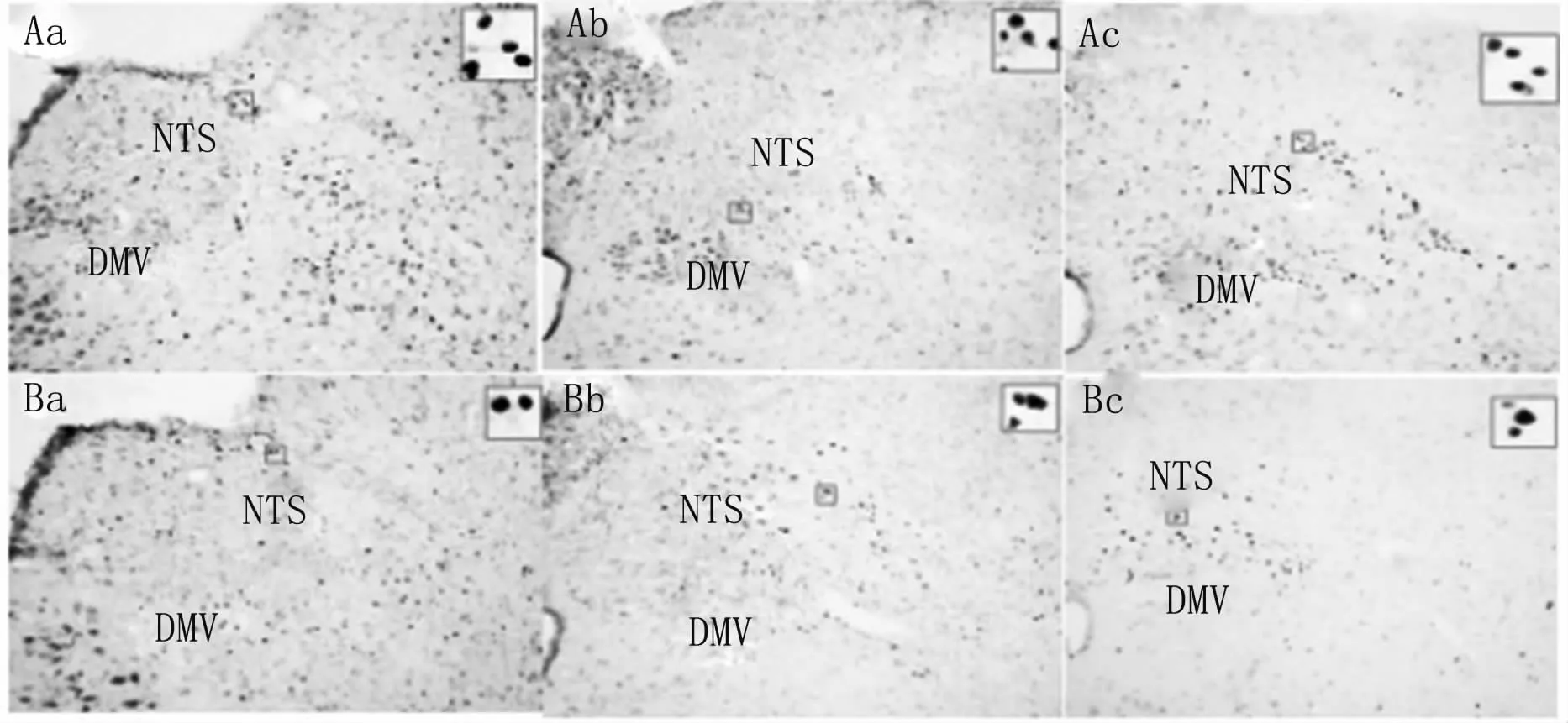
图10 生理盐水组和L-AA组大鼠NTS、DMV不同区段Fos表达(×100)A:生理盐水组;B:L-AA组;a:吻端;b:中端;c:尾端。Fig 10 Fos expression in different sections of the NTS and DMV in the saline and L-AA rats(×100)A:saline group;B:L-AA group;a:rostral;b:intermediate;c:caudal

图11 生理盐水组和L-AA组大鼠NTS、DMV不同区段GFAP的表达(×200)A:生理盐水组;B:L-AA组;a:吻端;b:中端;c:尾端。Fig 11 GFAP expression in the different sections of the NTS and DMV in the saline and L-AA rats(×200)A:saline group;B:L-AA group;a:rostral;b:intermediate;c:caudal.
4 讨论
NTS和DMV是迷走复合体的组成部分,是调控胃机能的低级中枢[7]。对大鼠进行RWIS后,来自胃肠道的感觉信息经迷走传入神经传导至孤束核,传入纤维的终末通过NTS内的神经元终末进入脑干[8-9]。这些传入信号经NTS整合后,主要利用谷氨酸、GABA或者去甲肾上腺素(NE)作为神经递质传递到相邻的DMV,与DMV中支配胃肠的胆碱能神经元形成突触联系。DMV支配胃的胆碱能神经元释放兴奋性(乙酰胆碱)或者抑制性(非胆碱能NANC)递质[10-12]。本实验室张玉玉等人的研究表明,大鼠NTS、DMV中Fos蛋白在RWIS条件下明显增加,表明大鼠NTS和DMV参与了RWIS。神经组织是由神经元和神经胶质细胞构成的。在神经胶质细胞中,星形胶质细胞是体积最大的胶质细胞,许多研究表明,星形胶质细胞在一些应激反应中起到重要的作用。胶质纤维酸性蛋白(glial fibrillary acidic protein GFAP)本身是脑和脊髓中成熟星形胶质细胞的一个组成成分[13],属于中间丝蛋白,有研究指出,在受到急性刺激时,海马、下丘脑、杏仁核和中脑导水管周围灰质里星形胶质细胞会释放神经递质参与了急性应激反应[14]。我们研究发现,在RWIS 1h时,NTS和DMV中GFAP表达都达到高峰。1 h后GFAP表达减弱,但与对照组比仍有显著差异。表明RWIS激活了NTS、DMV中的星形胶质细胞,参与了RWIS反应。
孤束核经矢状切可分为吻端、中端和尾端三部分,吻端(前囟-12.96~-13.32 mm)、中端(前囟-13.80~-14.04 mm)和尾端(前囟-14.52~-14.76 mm),各段约占 NTS全长的1/3。本实验研究结果显示,GFAP分布在NTS吻-尾全段。与对照组相比,RWIS 1h,NTS中GFAP表达达到高峰,其中,吻端2.42±0.1(个/0.01 mm2)是对照组 1.39±0.03(个/0.01 mm2)的1.74倍;中端2.66±0.08(个/0.01mm2)是对照组 1.18±0.05(个/0.01 mm2)的2.25倍;尾端 2.68±0.08(个/0.01 mm2)是对照组 1.46±0.04(个/0.01mm2)的 1.83倍。可见,NTS三个区段相比,GFAP在尾段和中段表达较多,这可能是NTS三个区段的不同功能影响了GFAP的表达分布,迷走神经的大量内脏传入主要与NTS尾段和中段相关,而吻段则主要负责接受味觉传入。DMV经矢状切也可分为吻端、中端和尾端三部分,位置与NTS大致一样。GFAP分布在DMV吻-尾全段。与对照组相比,RWIS 1h,DMV中GFAP表达达到高峰,其中,吻端2.92±0.11(个/0.01 mm2)是对照组 1.67±0.1(个/0.01 mm2)的1.75倍;中端 2.31±0.13(个/0.01 mm2)是对照组0.93±0.07(个/0.01 mm2)的2.49倍;尾端4.31±0.09(个/0.01 mm2)是对照组2.43±0.12(个/0.01 mm2)的1.77倍。可见,在DMV的三个区段,中段GFAP表达最强烈。这可能与DMV中段的功能有关,DMV中段存在迷走节前神经元支配胃的不同部位,因此形成了一个特定的胃代表区[15]。GFAP在中段表达最强烈,这可能是由于支配胃的兴奋性神经元主要分布于DMV中段及吻段内侧区域[16-17],而DMV尾段是支配胃的迷走抑制通路的起源处。
我们实验室前期研究发现RWIS导致NTS和DMV中神经元的Fos表达明显增加,表明NTS和DMV中神经元参与RWIS过程。本研究发现NTS和DMV中的星形胶质细胞也被激活,参与RWIS过程。那么NTS和DMV中星形胶质细胞对神经元激活是否存在着调节作用。高蓓等人的研究[6]指出,在急性腹腔高渗刺激模型中,向大鼠腹腔注射高浓度的盐水,视上核中的神经元和星形胶质细胞均明显增加。当星形胶质细胞被抑制剂抑制表达后,Fos阳性神经元在视上核中的表达显著减少,证明视上核中神经元对刺激的反应是通过星形胶质细胞的活动状态介导的。
L-AA是一种谷氨酸类似物,能够特异性地抑制星形胶质细胞的GFAP表达,但对神经元活动影响较小。注射L-AA后明显抑制了星形胶质细胞GFAP的表达,同时NTS和DMV中Fos表达均有极显著减少。提示,星形胶质细胞参与调节RWIS状态下的神经元激活。本研究中,L-AA处理组抑制星形胶质细胞表达后,能够显著抑制应激性胃溃疡。其机制可能是在RWIS状态下,NTS和DMV中星形胶质细胞,通过调控神经元的活性,而影响了胃机能的紊乱,导致应激性胃溃疡的产生。综上所述,在RWIS状态下,星形胶质细胞可能通过调节神经元的激活,参与了束缚浸水应激,影响了胃肠机能,导致胃黏膜损伤。

