基于质谱检测转基因生物外源蛋白质的消化稳定性
毛 劼,孙 兴,程娟献,王心正,赵永强,王红霞,何 昆,夏 晴*
(中国人民解放军军事医学科学院生物医学分析中心,北京 100850)
基于质谱检测转基因生物外源蛋白质的消化稳定性
毛劼,孙兴,程娟献,王心正,赵永强,王红霞,何昆,夏晴*
(中国人民解放军军事医学科学院生物医学分析中心,北京 100850)
基于无标记定量质谱检测技术建立了一种新的转基因生物外源蛋白质消化稳定性评价方法。以牛β-乳球蛋白、牛血清白蛋白和大豆胰蛋白酶抑制剂为标准蛋白质,经模拟人体胃/肠消化液消化后进行凝胶电泳分离,切取目标蛋白质条带进行酶切,提取肽段进行纳升液相色谱-电喷雾串联质谱分析。基于Mascot数据库检索鉴定目标蛋白质。计算各消化时间点蛋白质匹配肽段数与消化前蛋白质匹配肽段数的比值,当比值≤0.50时判断为目标蛋白质在该时间段内已消化。将此方法应用于转基因抗虫水稻“华恢1号”外源蛋白Cry1Ab/1Ac的消化稳定性分析,结果显示在模拟胃液中消化2 min时,比值下降到0.50以下,在模拟肠液中消化15 s后比值下降到0.50以下,表明该蛋白在胃/肠消化液中具有消化不稳定性。
转基因生物;消化稳定性;质谱;外源蛋白Cry1Ab/1Ac;无标记定量
转基因生物为全球创造了巨大的经济价值和环境效益[1-2]的同时,其食用安全性也成为了人们关注的焦点[3-4]。根据美国国家环境保护局提供的评价标准清单,对于转基因生物外源蛋白的食用安全性评价主要包括四方面:消化稳定性实验[5-7]、与已知的致敏原和毒蛋白进行氨基酸序列同源性的比对、热稳定性实验[8]以及实验动物的毒理实验[9-10]。依据中华人民共和国国家标准(农业部869号公告-2-2007《转基因生物及其产品食用安全检测 模拟胃肠液外源蛋白质消化稳定性试验方法》)[11],消化稳定性实验主要采用蛋白印迹法(Western blotting)。由于胃/肠液成分复杂,蛋白降解片段各异,难以预测,基于Western blotting技术的外源蛋白质及其降解片段的识别依赖于高特异性识别的抗体,而在很多情况下难以获得高质量的特异性抗体,由于非特异性识别信号的干扰,难以获得关于待测蛋白消化性的正确判断结果。而随着转基因技术的迅速发展,越来越多的优质外源基因被克隆和应用,亟待一种方便、快捷并且不依赖于特定抗体的通用技术,实现转基因外源蛋白质的消化稳定性评价。
质谱(mass spectrometry,MS)技术具有高分辨、高灵敏度及高通量等优点,其中无标记定量的图谱计数法无需复杂的数据处理步骤,概念简单、运算速率快、假阳性率低并且灵敏度高,在复杂样本的蛋白质鉴定和定量分析中得到越来越广泛的应用[12-13]。由于图谱计数法是一种半定量的方法,通过比较两个数据点间匹配肽段的鉴定图谱数的比值即可获得其变化关系。当两个数据点匹配肽段的鉴定图谱数的比值在0.50~2.00之间时,认为数据点之间没有变化;当比值≤0.50时,认为与前一个数据点相比降低;而当比值≥2.00时,则认为与前一个数据点相比增高[14]。
苏云金杆菌(Bacillus thuringiensis,Bt)是天然存在于土壤中的革兰氏阳性菌,其在芽孢形成过程中可产生具有杀虫活性的结晶蛋白质,即Bt毒蛋白,Bt毒蛋白经昆虫肠道水解成多肽后,与其肠道特异受体位点结合,破坏细胞膜渗透压的平衡导致细胞裂解,从而达到杀死昆虫的目的[15-16]。该蛋白质按氨基酸序列的同源性可分为45 大类,313 种。目前,抗虫转基因水稻采用的Bt蛋白基因有cry1Ab、cry1Ac、cry1Ab/1Ac融合基因等[17]。转基因抗虫水稻“华恢1号”外源Bt蛋白为我国自主合成的Cry1Ab/1Ac融合蛋白质,分子质量为68 277 D,其表达产物可以专一、高效地抑制二化螟、三化螟和稻纵卷叶螟等水稻鳞翅目害虫。对于转基因水稻表达的外源蛋白质Cry1Ab/1Ac消化稳定性的研究一直是人们关注的焦点,而传统的Western blotting方法对抗体要求高,且极易受非特异性识别信号的干扰,对于蛋白质消化稳定性不能提供准确的判断,给转基因作物外源蛋白质的食用安全性评价带来了一定的困难。本研究采用高分辨、高灵敏度以及高通量的质谱检测技术,基于无标记定量方法成功建立了一种更为准确的判断蛋白质消化稳定性的分析方法。该方法可成功应用于转基因水稻以及其他转基因生物及食品中外源蛋白质消化稳定性的研究。
1 材料与方法
1.1材料与试剂
基因工程表达纯化Cry1Ab/1Ac蛋白质由中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室提供;胃蛋白酶、胰酶购自美国Sigma公司,胃蛋白酶活力为3 200~4 500 U/mg pro;胰酶可满足以下反应体系要求:40 ℃、5 min内,将其质量25 倍的淀粉转化为水溶性的碳水化合物;40 ℃、60 min内(pH 7.5)消化掉其质量25 倍的酪蛋白;37 ℃(pH 9.0),每毫克胰酶每分钟能够从橄榄油中至少水解生成2 μmol脂肪酸。
牛β-乳球蛋白(bovine β-lactoglobulin,BLG)、牛血清白蛋白(bovine serum albumin,BSA)、大豆胰蛋白酶抑制剂(soybean trypsin inhibitor,STI)、NaHCO3、KH2PO4美国Sigma公司;盐酸 国药集团化学试剂有限公司;蛋白质分子质量标准 美国Thermo公司;二硫苏糖醇 美国Promega公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、溴酚蓝、过硫酸铵(ammonium persulfate,APS)、甘氨酸、丙烯酰胺美国A-Pharmacia公司;质谱纯乙腈、质谱纯甲醇、质谱纯水 美国Fisher Scientific公司;质谱纯甲酸、碘乙酰胺 美国Acros公司。
1.2仪器与设备
AB Triple TOF 5600+质谱仪(配有电喷雾离子源、纳升级液相色谱Expert Nano LC 425及Analyst 2.0数据处理系统) 美国AB公司;NESLAB gp100恒温水浴箱美国Neslab公司;电泳仪 美国Bio-Rad公司。
1.3方法
1.3.1蛋白质样本模拟胃/肠消化液消化
参照中华人民共和国国家标准(农业部869号公告-2-2007)[11]提供的配方配制模拟人体胃/肠消化液。在模拟胃/肠消化液添加的待测蛋白质,质量浓度分别为2、5 g/L,在37 ℃分别进行0、15 s及2、30、60 min的消化反应,同时设不加待测蛋白质的消化液(胃蛋白酶/胰酶)对照组和不加胃蛋白酶/胰酶的待测蛋白质对照组。
1.3.2SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)及胶内酶切
将各处理组及对照组蛋白样品进行电泳分离,根据分子质量切取蛋白条带进行胶内酶切,提取肽段并干燥。
1.3.3质谱检测
肽段提取样本上样后进行纳升液相色谱-电喷雾串联质谱(nano liquid chromatography-electronic spray ionmass spectrum/mass spectrum,Nano LC-ESI-MS/MS)分析,正离子检测,源温度150 ℃,雾化气流速为6 L/min,气帘气流速为25 L/min,电喷雾针电压为2 300 V。蛋白鉴定采用数据依赖采集模式,每个一级扫描后进行20 个MS/MS扫描。纳升级液相色谱分离用富集柱和分析柱联用方式。捕获柱为Chrom XP C18(350 μm×0.5 mm,3 μm,120 Å),分析柱为3C18-CL-120(75 μm×150 mm,3 μm,120 Å)。流动相A为含0.1%甲酸的超纯水,流动相B为含0.1%甲酸的乙腈。进样速率为7 μL/min,进样时间3 min。分析柱流速为300 nL/min,总分析时间为60 min。流动相B在2~40 min内由5%线性升至40%,1 min内升至80%,保留5 min,再在1 min内回到5%,平衡13 min。每两个样品之间加一个自动校正样品,以保证测定结果的准确度。
1.3.4质谱无标记定量测定
Mascot数据库检索设置如下条件:仪器类型为ESI-QUAD-TOF;检索类型为MS/MS二级离子检索;酶为胰蛋白酶;固定修饰为烷基化;可变修饰为乙酰化、去氨基化、氧化;分子质量为单同位素质量;肽段容差为2×10-5D;碎片容差为±0.2 D;允许最大的未被酶切位点数为2。通过Mascot数据库检索、定量所鉴定目标蛋白质的匹配肽段数,根据各消化时间点蛋白质匹配肽段数与消化前匹配肽段数的比值来判断目标蛋白质的消化稳定性。
2 结果与分析
2.1标准蛋白的消化稳定性
在农业部869号公告-2-2007中,BLG作为对照蛋白,在模拟胃液中稳定,60 min内不能被消化,而在模拟肠液中不稳定,15 s内被消化;BSA在模拟胃液中不稳定,15 s内被消化,而STI在模拟肠液中稳定,60 min内不能被消化。本研究采用BLG、BSA和STI建立了基于质谱检测转基因外源蛋白质的消化稳定性分析方法。这3 种蛋白质在模拟胃液消化实验和模拟肠液消化实验中的SDS-PAGE结果如图1~4所示,得到的质谱数据见表1~4,每个蛋白质样品重复进行两次实验,表中数据为两次实验的平均值,其中消化后匹配肽段数与消化前匹配肽段数的比值用表示。
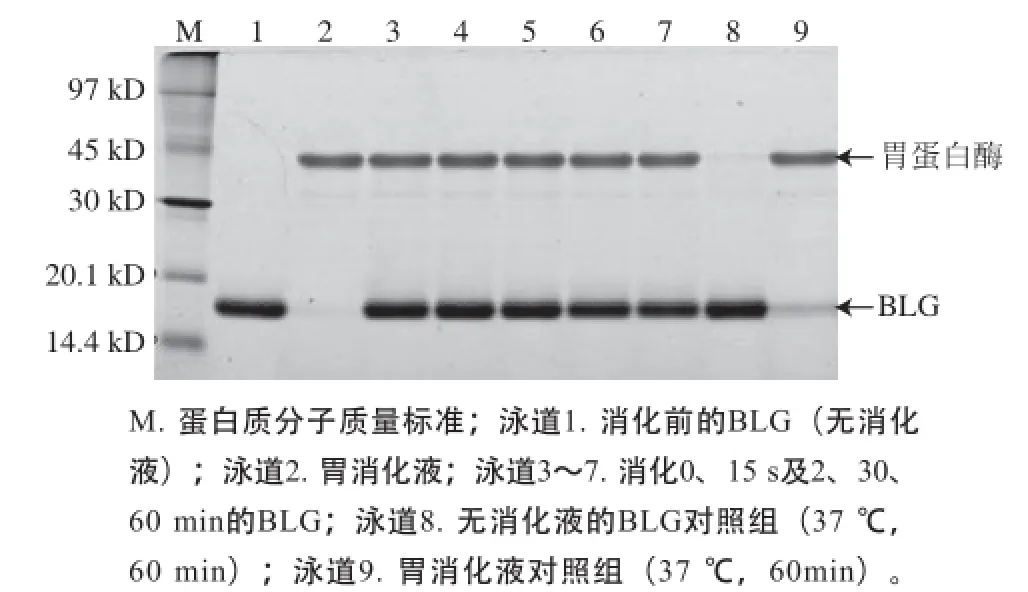
图1 模拟胃液消化的BLG蛋白SDS-PAGE图Fig.1 SDS-PAGE analysis of BLG in stimulated gastric fluid
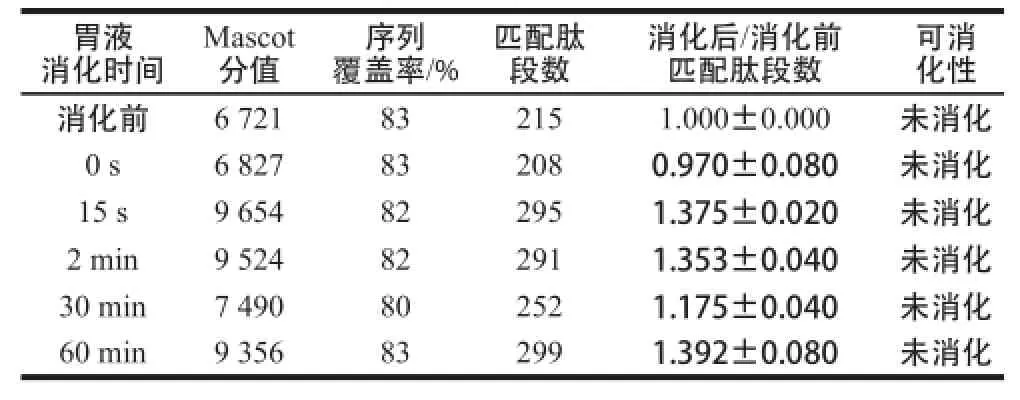
表1 模拟胃液消化BLG的质谱检测结果Table1 MS analysis of BLG in stimulated gastric fluid
如图1所示,在模拟胃液中消化的各个时间点,BLG的蛋白质条带均保持和消化前相同的强度,无减弱趋势,证明模拟胃液消化BLG的实验体系有效。切取各消化时间段的BLG条带进行酶切提取及质谱分析,通过Mascot数据库检索、定量所鉴定目标蛋白质的匹配肽段数。根据各消化时间点蛋白质匹配肽段数与消化前匹配肽段数的比值来判断目标蛋白质的可消化性,若比值≤0.50则判断为目标蛋白质在该时间点已消化,若0.50<比值<2则判断其在该时间点和该温度条件下未被消化。如表1所示,比值在所有时间点均大于0.50且小于2,表明BLG对胃消化液稳定,与其已知的胃液消化特性相符。
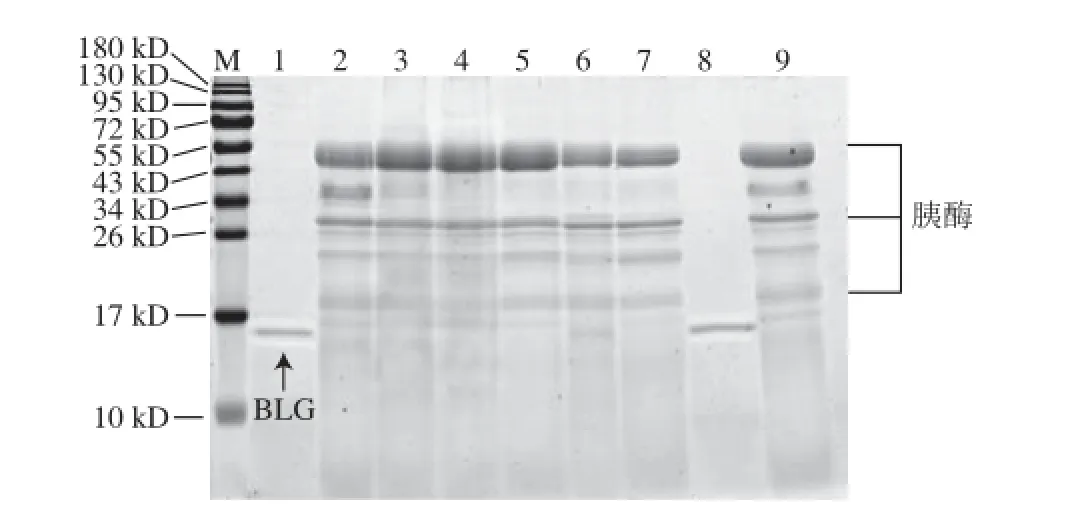
图2 模拟肠液消化的BLG蛋白SDS-PAGE图Fig.2 SDS-PAGE analysis of BLG in stimulated intestinal fluid

表2 模拟肠液消化BLG的质谱检测Table2 MS analysis of BLG in stimulated intestinal fluid
如图2所示,在模拟肠液中消化的各个时间段中,BLG的蛋白质条带在15 s时就已消失,证明模拟肠液消化BLG的实验体系有效。由表2质谱分析数据可知,BLG在模拟肠液消化15 s时,比值就下降至0.50以下,由此可判断BLG在模拟肠液中15 s内就已消化,为对肠液消化不稳定蛋白质,与其已知的肠液消化特性相符。
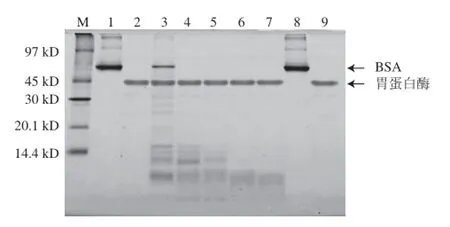
图3 模拟胃液消化的BSA蛋白SDS-PAGE图Fig.3 SDS-PAGE analysis of BSA in stimulated gastric fluid
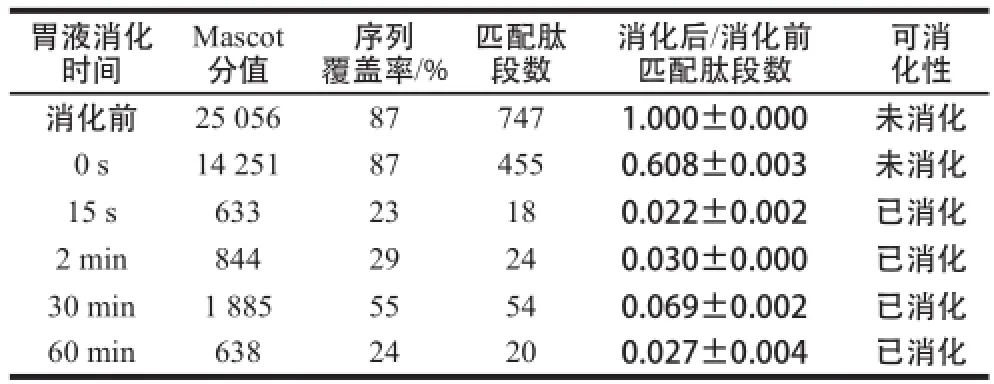
表3 模拟胃液消化BSA的质谱检测Table3 MS analysis of BSA in stimulated gastric fluid
如图3所示,BSA在模拟胃液中消化15 s时蛋白质条带就已消失,且比值下降至0.50以下(表3),证明模拟胃液消化BSA的实验体系有效,BSA为对胃消化液不稳定蛋白质,与其已知的胃液消化特性相符。
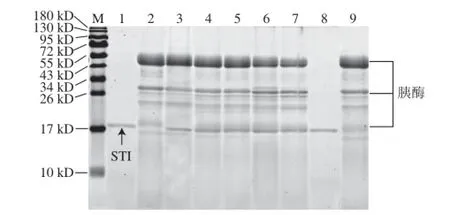
图4 模拟肠液消化的STI蛋白SDS-PAGE 图Fig.4 SDS-PAGE analysis of STI in stimulated intestinal fluid

表4 模拟肠液消化STI的质谱检测Table4 MS analysis of STI in stimulated intestinal fluid
如图4所示,在模拟肠液中消化的各个时间段中,STI蛋白质条带的强度没有减弱,且比值在所有时间点都大于0.50且小于2(表4),证明模拟肠液消化STI的实验体系有效,STI对肠消化液稳定,与其已知的肠液消化特性相符。
2.2试样蛋白的消化稳定性结果表述
现行的国家标准是在实验体系工作正常的情况下,根据SDS-PAGE图谱和Western blotting图谱中试样蛋白质条带及其可见降解片段消失的时间来判断蛋白质的可消化性。本研究依据BLG、BSA和STI在国家标准方法中的消化稳定性结果,建立了基于质谱检测试样蛋白质的消化稳定性结果表述方法如下。
在实验体系工作正常的情况下,根据SDS-PAGE蛋白条带酶切后的质谱检测所获得匹配肽段数,计算各消化时间点蛋白质匹配肽段数与消化前蛋白质匹配肽段数的比值,当0.50<比值<2时判断为目标蛋白质在该时间段内未消化,当比值≤0.50时判断为目标蛋白质在该时间段内已消化,当比值≥2时实验结果无效。试样蛋白质在模拟胃液和模拟肠液中的可消化性分别表述为:
试样蛋白质在0~15 s内,消化后与消化前蛋白质匹配肽段数的比值≤0.50,则表明已消化,表述为该蛋白质在模拟胃/肠液中极易消化。
试样蛋白质在15 s~2 min内,消化后与消化前蛋白质匹配肽段数的比值≤0.50,则表明已消化,表述为该蛋白质在模拟胃/肠液中易消化。
试样蛋白质在2~30 min内,消化后与消化前蛋白质匹配肽段数的比值≤0.50,则表明已消化,表述为该蛋白质在模拟胃/肠液中可消化。
试样蛋白质在30~60 min内,消化后与消化前蛋白质匹配肽段数的比值≤0.50,则表明已消化,表述为该蛋白质在模拟胃/肠液中难消化。
试样蛋白质于60 min时,消化后与消化前蛋白质匹配肽段数的比值仍>0.50,则表明仍不能被消化,表述为该蛋白质在模拟胃/肠液中极难消化。
2.3应用于Cry1Ab/1Ac的消化稳定性实验结果
将转基因水稻“华恢1号”外源蛋白质Cry1Ab/1Ac进行模拟胃消化液消化处理,然后进行SDS-PAGE分离(图5),切取各消化时间段的Cry1Ab/1Ac蛋白质条带进行酶切提取及质谱分析,通过Mascot数据库检索、定量所鉴定蛋白质的匹配肽段数,从而得到各时间点Cry1Ab/1Ac蛋白质匹配肽段数与消化前蛋白质匹配肽段数的比值。Cry1Ab/1Ac在模拟胃液中的可消化性见表5。在模拟胃液中消化15 s时,比值仍>0.50;消化2 min时,比值下降到0.50以下;消化30 min和消化60 min时,比值均在0.50以下。说明转基因水稻外源蛋白质Cry1Ab/1Ac在2 min内可被消化,在模拟胃液中的消化特性为易消化。
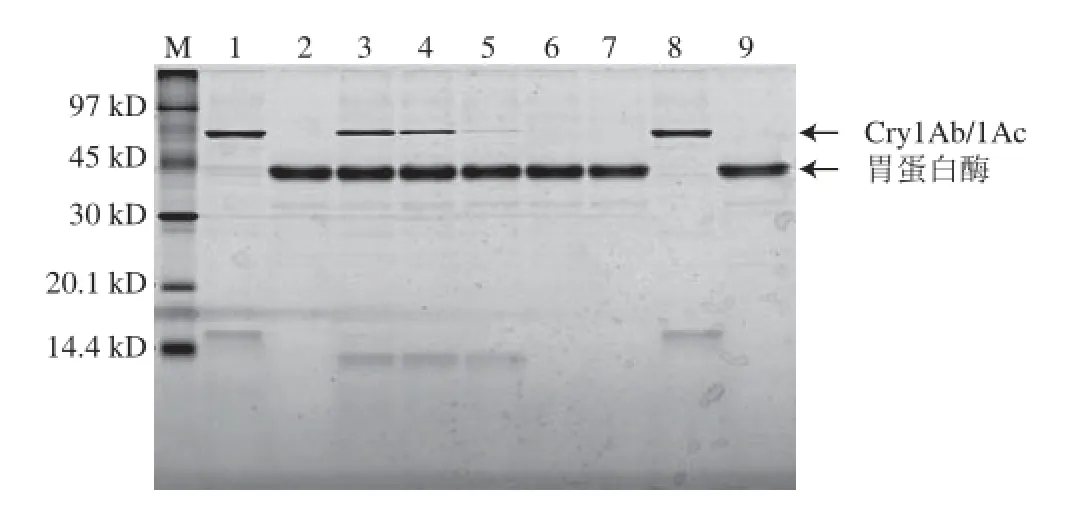
图5 转基因生物外源蛋白Cry1Ab/1Ac在模拟胃液中消化的SDS-PAGE图PAGEFig.5 SDS-PAGE analysis of Cry1Ab/1Ac in stimulated gastric fluid

表5 模拟胃液消化转基因水稻外源蛋白质Cry1Ab/1Ac的质谱检测结果Table5 MS analysis of Cry1Ab/1Ac in stimulated gastric fluid
将Cry1Ab/1Ac进行模拟肠消化液消化处理,然后进行SDS-PAGE分离(图6),切取各消化时间段的Cry1Ab/1Ac蛋白质条带进行酶切提取及质谱分析,通过Mascot数据库检索、定量所鉴定蛋白质的匹配肽段数,计算得到各时间点Cry1Ab/1Ac蛋白质匹配肽段数与消化前匹配肽段数的比值。Cry1Ab/1Ac在模拟肠液中消化情况总结列于表6,Cry1Ab/1Ac在模拟肠液中消化15 s内比值下降至0.50以下,并且其余各消化时间点的比值均≤0.50。需要指出的是,虽然表6中比值呈先下降又上升的趋势,但均≤0.50,因此仍为已消化。以上实验结果说明Cry1Ab/1Ac在15 s内可被消化,在模拟肠液中的消化特性判断为极易消化。
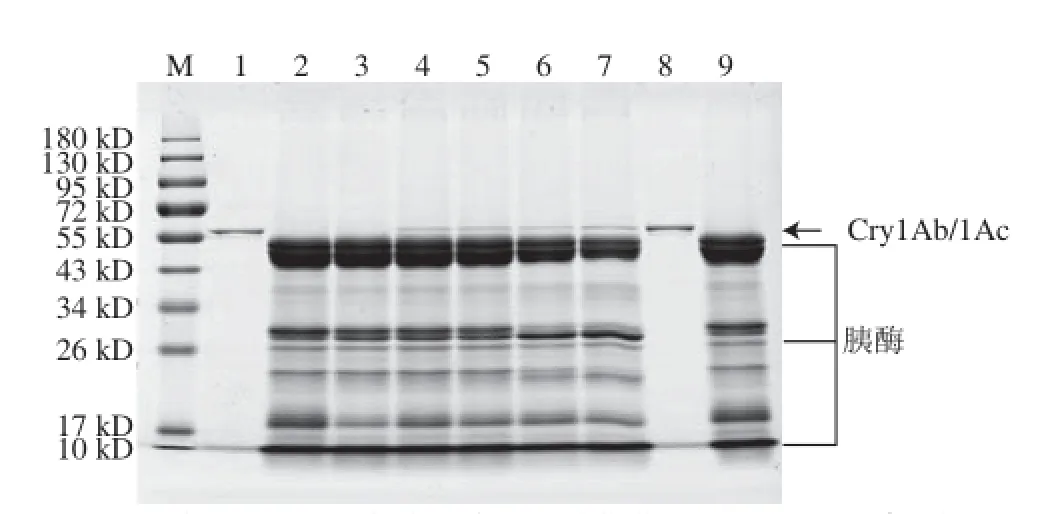
图6 转基因生物外源蛋白Cry1Ab/1Ac在模拟肠液中消化的SDS-PAGE图Fig.6 SDS-PAGE analysis of Cry1Ab/1Ac in stimulated intestinal fluid
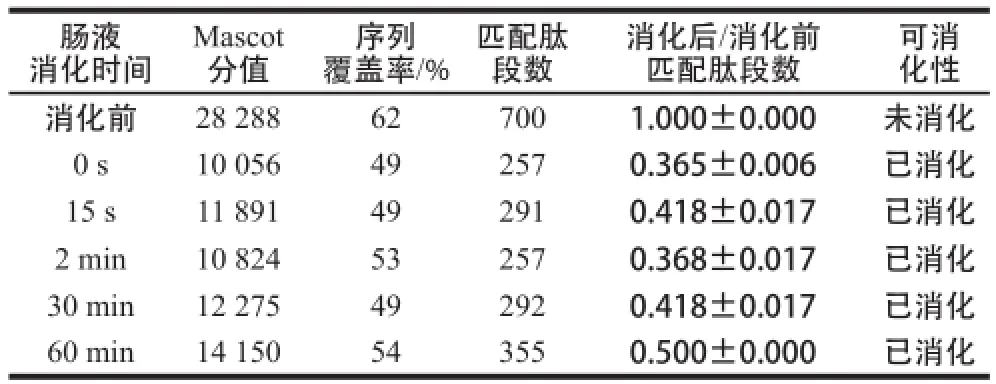
表6 模拟肠液消化转基因水稻外源蛋白质Cry1Ab/1Ac的质谱检测Table6 MS analysis of Cry1Ab/1Ac in stimulated intestinal fluid
3 结 论
蛋白质的消化稳定性是指外源蛋白在进入人体胃/肠消化系统后的降解程度,一般利用人工模拟胃液和肠液在体外进行实验。Astwood[18]首次将体外胃蛋白酶消化实验应用于食物致敏原的消化稳定性评价之后,消化稳定性实验就成为转基因作物外源蛋白质食用安全性评价的重要内容之一。Taylor等[19-20]的实验表明,若一种蛋白质在模拟胃液或肠液中能迅速被消化,可认为其对机体产生致敏作用的概率很小。传统判定蛋白质消化稳定性的Western blotting方法,需要制备针对外源蛋白质高度特异的抗体,且极易受胃/肠消化液内蛋白质及其降解片段等产生的非特异性识别信号的干扰,常常难以准确地判断蛋白质的消化稳定性。
质谱技术因其具有高分辨、高灵敏度以及高通量等优点,是蛋白质定性及定量研究的重要手段。基于质谱的定量分析包括稳定同位素标记(stable isotopic labeling)和无标记(label-free)两种方法[21]。图谱计数法首次由Liu Hongbin等[22]提出,是无标记定量方法之一,该方法把蛋白质中肽段的鉴定图谱总数作为定量指标来定量蛋白质,通过SEQUEST和Mascot等软件进行数据库检索、定性及定量分析[23-24]。图谱计数法作为一种快速的半定量方法,无需复杂的数据处理步骤,只需统计匹配肽段的鉴定图谱数,具有概念简单、运算速率快、假阳性率低以及能够高灵敏度地反映蛋白质表达水平等特点,得到了越来越广泛的应用[12-13]。
本研究基于BLG、BSA和STI成功建立了基于质谱检测的蛋白质消化稳定性实验方法,并且将该方法应用于转基因抗虫水稻表达外源蛋白质Cry1Ab/1Ac的消化稳定性评价中。通过Mascot数据库检索、定量所鉴定目标蛋白质的匹配肽段数,根据各消化时间点蛋白质匹配肽段数与无消化液组匹配肽段数的比值来判断目标蛋白质的消化稳定性,若比值≤0.50则判断为目标蛋白质在该时间段内已消化。Cry1Ab/1Ac在模拟胃液中消化2 min时比值下降至0.50以下,为易消化;Cry1Ab/1Ac在模拟肠液中15 s内比值下降至0.50以下,为极易消化,表明该外源蛋白质在模拟胃/肠消化液中不具有消化稳定性。该结果与基于SDS-PAGE以及用传统免疫印迹方法获得的实验结果相符[6-7,25]。本研究成功建立了一种基于质谱无标记定量的判断转基因水稻和其他转基因生物及食品中外源蛋白质的消化稳定性的分析方法。目前我国质谱技术及仪器已越来越普及,并且值得注意的是,该技术具有无需依赖特异性抗体的优点,因此基于质谱无标记定量方法的转基因生物外源蛋白质消化稳定性的检测方法具有很强的实用性和推广性。
[1] GREEN J M. The benefits of herbicide-resistant crops[J]. Pest Management Science, 2012, 68(10): 1323-1331. DOI:10.1002/ps.3374.
[2] 蒋家焕, 郭奕明, 杨映根, 等. 转基因水稻的研究和应用[J]. 植物学通报, 2003, 20(6): 736-744. DOI:10.3969/ j.issn.1674-3466.2003.06.014.
[3] GILBERT N. A hard look at GM crops[J]. Nature, 2013, 497: 24-26. DOI:10.1038/497024a.
[4] 肖国樱, 陈芬, 盂秋成, 等. 转基因水稻食用安全性评价内容与主要争论问题分析[J]. 杂交水稻, 2012, 27(1): 1-6. DOI:10.3969/ j.issn.1005-3956.2012.01.001.
[5] 蒋显斌, 樊庆鲁, 黄芊, 等. 抗除草剂转基因稻米蛋白的消化稳定性和热稳定性分析[J]. 西南农业学报, 2014, 24(5): 1797-1800. DOI:10.3969/j.issn.1001-4829.2014.05.001.
[6] 赵祥祥, 胡小兰, 唐瑭, 等. 转高赖氨酸融合蛋白基因水稻外源蛋白的消化稳定性和急性毒性[J]. 科学通报, 2013(21): 2068-2077. DOI:10.1007/s11434-013-5923-y.
[7] 张小霞, 刘允军, 严卫星, 等. 抗虫蛋白Cry1Ie对胃蛋白酶和热的稳定性研究[C]//中国毒理学会食品毒理专业委员会学术会议. 北京:卫生部卫生监督中心, 2006: 234-241.
[8] 农业部2031号公告-17-2013转基因生物及其产品食用安全检测蛋白质热稳定性试验[S/OL]. [2015-09-28]. http://www.moa.gov.cn/ govpublic/ncpzlaq/201312/t20131220_3719618.htm.
[9] SCHRØDER M, POULSEN M, WILCKS A, et al. A 90-day safety study of genetically modifi ed rice expressing Cry1Ab protein (Bacillus thuringiensis toxin) in Wistar rats[J]. Food &Chemical Toxicology,2007, 45(3): 339-349. DOI:10.1016/j.fct.2006.09.001.
[10] ZHOU X H, DONG Y, XIAO X, et al. A 90-day toxicology study of high-amylose transgenic rice grain in Sprague-Dawley rats[J]. Food & Chemical Toxicology, 2011, 49(12): 3112-3118. DOI:10.1016/ j.fct.2011.09.024.
[11] 农业部869号公告-2-2007 转基因生物及其产品食用安全检测 模拟胃肠液外源蛋白质消化稳定性试验方法[S/OL]. [2015-10-03]. http:// www.moa.gov.cn/zwllm/tzgg/gg/200706/t20070619_837364.htm.
[12] 张伟, 张纪阳, 刘辉, 等. 蛋白质质谱分析的无标记定量算法研究进展[J]. 生物化学与生物物理进展, 2011, 38(6): 506-518. DOI:10.3724/ SP.J.1206.2010.00560.
[13] 薛晓芳, 吴松锋, 朱云平, 等. 蛋白质组学研究中的无标记定量方法[J]. 中国生物化学与分子生物学报, 2006, 22(6): 442-449. DOI:10.3969/j.issn.1007-7626.2006.06.003.
[14] WILLIAM M O, KAREN M A, LAUREN A W, et al. Comparison of label-free methods for quantifying human proteins by shotgun proteomics[J]. Molecular & Cellular Proteomics, 2005, 4(10): 1487-1502. DOI:10.1074/mcp.M500084-MCP200.
[15] 李芳综, 徐海滨. 025转Bt基因玉米中外源蛋白的安全性评价策略及挑战[J]. 国外医学(卫生学分册), 2005, 32(2): 96-99.
[16] HÖFTE H, WHITELEY H R. Insecticidal crystal proteins of Bacillus thuringiensis[J]. Microbiological Reviews, 1989, 53(2): 242-255.
[17] 苏京平, 闫双勇, 孙林静, 等. 我国转基因水稻研究的现状[J]. 天津农业科学, 2007, 13(4): 7-11. DOI:10.3969/ j.issn.1006-6500.2007.04.003.
[18] ASTWOOD J D. Stability of food allergens to digestion in vitro[J]. Nature Biotechnology, 1996, 14(1): 1269-1273.
[19] TAYLOR S L, HEFLE S L. Will genetically modified foods be allergenic?[J]. Journal of Allergy and Clinical Immunology, 2001,107(1): 765-771. DOI:10.1067/mai.2001.114241.
[20] TAYLOR S L. Protein allergenicity assessment of foods produced through agricultural biotechnology[J]. Annual Review of Pharmacology & Toxicology, 2002, 42(1): 99-112. DOI:10.1146/ annurev.pharmtox.42.082401.130208.
[21] ELLIOTT M H, SMITH D S, PARKER C E, et al. Current trends in quantitative proteomics[J]. Journal of Mass Spectrometry, 2009,44(12): 1637-1660. DOI:10.1002/jms.1692.
[22] LIU H B, SADYGOV R G, YATES J R. A model for random sampling and estimation of relative protein abundance in shotgun proteomics[J]. Analytical Chemistry, 2004, 76(14): 4193-4201. DOI:10.1021/ ac0498563.
[23] ENG J K, McCORMACK A L, YATES III J R. An approach to correlate tandem mass spectral data of peptides with amino acid sequences in a protein database[J]. Journal of the American Society for Mass Spectrometry, 1994, 5(11): 976-989. DOI:10.1016/1044-0305(94)80016-2.
[24] PERKINS D N, PAPPIN D J, CREASY D M, et al. Probability-based protein identification by searching sequence databases using mass spectrometry data[J]. Electrophoresis, 1999, 20(18): 3551-3567.
[25] 李欣竹, 耿丽丽, 高继国, 等. Cry1Ie蛋白的模拟胃肠液消化稳定性及热稳定性分析[J]. 生物技术通报, 2015, 31(11): 214-221. DOI:10.13560/j.cnki.biotech.bull.1985.2015.11.028.
Mass Spectrometry-Based Analysis of Digestive Stability of Target Protein in Genetically Modified Organism
MAO Jie, SUN Xing, CHENG Juanxian, WANG Xinzheng, ZHAO Yongqiang, WANG Hongxia, HE Kun, XIA Qing*
(National Center of Biomedical Analysis, Academy of Military Medical Sciences, Beijing 100850, China)
Digestive stability analysis of exogenous protein is one of the important indexes of genetically modified organisms(GMO) safety assessment. In the present study, we established a novel assessment assay for protein digestive stability based on label-free quantification of mass spectrometry using bovine β-lacto globulin (BLG), bovine serum albumin (BSA) and soybean trypsin inhibitor (STI) as standard proteins. Protein samples were treated with simulated gastric/intestinal fluids(SGF/SIF), and then separated by sodium dodecyl sulfate-polyacrylamide gel electrophoresis. The target bands were then cut out and trypsinized. The extracted peptides were analyzed by nano liquid chromatography-electronic spray ion-mass spectrum/mass spectrum and identified by Mascot software. By calculating the ratio between the matched peptide numbers of the target protein before and after SGF/SIF treatment, the digestibility of the target protein was estimated. When the ratio was lower than 0.50, the target protein was considered digestible. This newly developed assay was applied to Cry1Ab/1Ac,the exogenous protein of the genetically modified rice ‘Huahui No. 1’. The results showed that the ratio was lower than 0.50 after digestion in SGF for 2 minutes, while it decreased to less than 0.50 after digestion in SIF for 15 seconds, indicating that it is very liable to be digested. Our study provides a novel MS-based method for digestive stability analysis of target proteins from genetically modified organisms, which is easy to operate with no need for specific antibody.
genetically modified organisms; digestive stability; mass spectrometry; exogenous protein Cry1Ab/1Ac;lable-free quantification
10.7506/spkx1002-6630-201619011
TS207.3
A
1002-6630(2016)19-0064-06
毛劼, 孙兴, 程娟献, 等. 基于质谱检测转基因生物外源蛋白质的消化稳定性[J]. 食品科学, 2016, 37(19): 64-69. DOI:10.7506/spkx1002-6630-201619011. http://www.spkx.net.cn
MAO Jie, SUN Xing, CHENG Juanxian, et al. Mass spectrometry-based analysis of digestive stability of target protein in genetically modified organism[J]. Food Science, 2016, 37(19): 64-69. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201619011. http://www.spkx.net.cn
2015-12-02
国家科技重大专项(2014ZX08011007;2016ZX08011007);国家重大科学仪器设备开发专项(2012YQ180117)
毛劼(1987—),女,硕士研究生,研究方向为分析化学。E-mail:maojie@proteomics.cn
夏晴(1973—),女,研究员,博士,研究方向为肿瘤转化医学、转基因食品安全评价。E-mail:qxia@ncba.ac.cn

