核磁共振法测定依帕列净含量
孙林林,张芬芬,沈文斌,丁 娅*
(1.中国药科大学 药物分析教研室,江苏 南京 210009 ;2.东华大学 分析测试中心,上海 201620;3.中国药科大学 药物科学研究院,江苏 南京 210009)
核磁共振法测定依帕列净含量
孙林林1,张芬芬2,沈文斌3*,丁娅1*
(1.中国药科大学药物分析教研室,江苏南京210009 ;2.东华大学分析测试中心,上海201620;3.中国药科大学药物科学研究院,江苏南京210009)
分别以盐酸吉西他滨和齐多夫定为内标,采用定量核磁共振法对依帕列净含量进行测定。以氘代二甲亚砜和重水混合液为溶剂,确定氢定量核磁共振方法(1H-qNMR)的测试条件为:激发脉冲角度30°;时间域数据点32 K;测定温度303 K;脉冲延迟时间20 s;采样次数32;窗函数0.3 Hz。在此实验条件下,结果专属性良好,稳定性可达24 h,耐用性符合要求。以样品与内标的峰面积比对其摩尔比绘制标准曲线,结果显示,依帕列净与内标盐酸吉西他滨的摩尔比在0.512 5~1.953 8范围内,依帕列净与内标齐多夫定的摩尔比在0.494 7~1.966 0范围内线性关系良好,相关系数(r2)均为0.999 9。以盐酸吉西他滨和齐多夫定为内标时,依帕列净的含量测定结果分别为99.83%和99.77%,相对标准偏差(RSD)分别为0.06%和0.19%。2种内标方法的测定结果一致,所建立的方法专属、准确、简便、快捷,适用于新药的含量测定。
依帕列净;定量核磁共振;盐酸吉西他滨;齐多夫定
依帕列净(Empagliflozin)是由勃林格殷格翰(Boehringer Ingelheim)公司开发的一种新型选择性钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂,商品名为Jardiance,于2014年8月1日由美国FDA批准上市,用于改善2型糖尿病(T2DM)患者的血糖控制。SGLT2表达于肾脏近端小管,负责肾小管内大部分葡萄糖的重吸收。依帕列净通过抑制SGLT2减少葡萄糖的重吸收,降低肾糖阈,增加尿糖的排泄[1-2]。此外,依帕列净还可降低体重[3],适度降血压,可用于同时患有T2DM和高血压的病人[4]。由于降糖机制不同,依帕列净作为SGLT2抑制剂可与其他常用类型的降糖药联合应用,如吡格列酮(Pioglitazone)[5]、二甲双胍(Metformin)[6]等。由于依帕列净是一种新型药物,各国药典均未收录,尚无法确定对照品。在实际药品检验工作中,准确快速测定依帕列净的含量对于药品的质量控制有着非常重要的意义,因此需要制备工作对照品,并对其含量进行测定。
定量核磁共振(Quantitative nuclear magnetic resonance,qNMR)技术不需要待测物对照品,仅以已知含量的药物或化学物质为参比即可对其进行含量测定[7],样品前处理步骤简便、快捷,可显著提高检测效率,已先后被美国药典、英国药典[8]、欧洲药典、中国药典 2010 版收录[9]。近年来,qNMR技术在药品含量测定领域的应用越来越广泛,主要包括药物对照品、原料药、药物制剂的含量测定等。目前,qNMR 包括1H,13C,19F,31P,14N,15N-NMR等,定量方法主要包括相对定量法和绝对定量法,其中绝对定量法又分为内标法、外标法和标准添加法。由于1H 核磁共振定量技术灵敏度高,适用范围广,国内外已有大量研究报道[10-16]。
本研究采用齐多夫定和盐酸吉西他滨两种内标,以氘代二甲亚砜和重水混合为溶剂,分别建立了qNMR定量测定依帕列净含量的方法,考察了实验条件的影响,对所建立的方法进行验证,并应用于依帕列净供试品的含量测定。
1 实验部分
1.1仪器与试剂
Avance-300型超导核磁共振仪及Topspin 2.1操作软件(瑞士Bruker公司);BT125D分析用电子天平(感量0.01 mg,德国 Sartorius公司)。
依帕列净(江苏柯菲平医药科技有限公司,批号140202);盐酸吉西他滨(含量99.8%,中国药品生物制品检定所,批号100622-201202);齐多夫定(含量100.0%,中国药品生物制品检定所,批号100672-200401);氘代二甲亚砜(99.9 atom% D,DMSO-d6,Sigma-Aldrich公司),重水(99.9 atom% D,D2O,Sigma-Aldrich公司)。
1.2实验方法
1.2.1供试品溶液的制备分别精密称取依帕列净供试品约15.0 mg及内标盐酸吉西他滨10.0 mg置于同一离心管中,加入0.5 mL氘代二甲亚砜(DMSO-d6)和0.1 mL D2O溶液,振荡溶解,平行制备3份,转移至直径为5 mm的样品管中待测;分别精密称取依帕列净供试品约15.0 mg及内标齐多夫定8.9 mg置于同一离心管中,加入0.4 mL DMSO-d6和0.25 mL D2O,振荡溶解,平行制备3份,转移至直径为5 mm的样品管中待测。
1.2.2核磁共振定量实验条件激发脉冲角度30°;时间域数据点32 K;测定温度303 K;脉冲延迟时间20 s;采样次数32;窗函数0.3 Hz;扫描宽度3 840 Hz,中心频率1 710 Hz。图谱处理时,均采用手动方式依次进行相位校正、基线校正和化学位移校正,并根据所选的定量峰及积分范围进行积分。
2 结果与讨论
2.1样品制备方法及氘代溶剂的选择
合适的溶剂首先应满足对样品和内标均有良好的溶解度,考虑到待测物及内标的溶解性,选择氘代二甲亚砜为溶剂,同时加入不同比例的重水以消除活泼质子的干扰。当内标为盐酸吉西他滨时,选择0.5 mL DMSO-d6和0.1 mL D2O混合为溶剂;而内标为齐多夫定时,由于依帕列净δ4.91附近的活泼质子在常用的混合溶剂系统(0.4 mL DMSO-d6和0.1 mL D2O混合或0.5 mL DMSO-d6和0.1 mL D2O混合)中很难交换完全,需加大D2O量使其尽可能交换完全,因此最终选择0.4 mL DMSO-d6和0.25 mL D2O混合为溶剂。由于DMSO-d6和D2O的粘度较大且内标液转移可能带来较大误差,因此采用直接称量样品与内标配样。
2.2内标物的选择
合适的内标应满足能与待测样品同时溶于溶剂系统,并使参考峰与样品峰分离,以及不与待测样品相互作用等。根据依帕列净的氢谱(图1A),选择在7.5~8.5 ppm或4.7~6.5 ppm出现信号的物质作为内标物。根据本实验室已有研究,分别以盐酸吉西他滨和齐多夫定作为内标物测定其氢谱(图1B和C)。由两图可知,盐酸吉西他滨和齐多夫定均有符合条件的信号可用作定量峰;且两者的分子量与依帕列净分子量接近,可减少称量误差。因此最终选用盐酸吉西他滨和齐多夫定作为内标物。

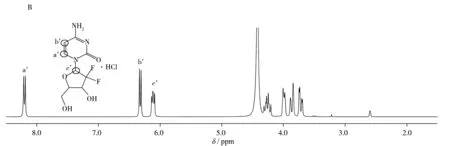



图1 待测物及内标物的1H NMR图Fig.1 1H NMR spectra of analyte and the interral standardsA.empagliflozin,B.gemcitabine hydrochloride,C.zidovudine,D.mixture of empagliflozin and gemcitabine hydrochloride,E.mixture of empagliflozin and zidovudine;marked signals were selected for quantitative analysis
2.3定量峰的选择
定量峰首先应满足在选定的积分范围内无干扰,在此基础上应选择性质相近的信号峰,当有多个信号峰符合条件时,取其平均值,以减少误差。依帕列净和盐酸吉西他滨混合后的氢谱见图1D,δ6.78和δ4.91处的信号峰相对独立,与盐酸吉西他滨内标峰(δ8.08,δ6.16,δ6.06)无重合,因此选定δ6.78(2H,d)和δ4.91(1H,t)为依帕列净的定量峰,δ8.08(1H,d),δ6.16(1H,d)和δ6.06(1H,t)为内标盐酸吉西他滨的定量峰。依帕列净和齐多夫定混合后的氢谱见图1E,以齐多夫定为内标时,依帕列净δ4.91附近的活泼质子很难完全交换,因此选定δ6.74(2H,d)为依帕列净的定量峰,δ7.75(1H,s),δ6.15(1H,t)为内标齐多夫定的定量峰。
2.4定量核磁共振参数的选择
2.4.1脉冲延迟时间(d1)的选择 共振峰面积与该共振峰的质子数成正比是核磁共振定量的基础,而保证这一基础的前提是使自旋核达到完全弛豫。当d1≥5T1(纵向弛豫时间)时,才可保障99%以上的自旋核达到完全弛豫[13]。分别设置d1为2,5,10,20,40 s进行测定,结果显示,当d1≥10 s时,样品定量峰以及样品与内标定量峰面积比值无明显变化,因此最终选定延迟时间(d1)为20 s。
2.4.2采样次数的选择图谱的信噪比与采样次数的平方根成正比,核磁共振定量一般要求S/N≥250。分别考察采样次数为2,4,8,16,32,64次的图谱信噪比,结果表明,当采样次数为16,32和64次时,仪器信噪比均满足定量要求。为了取得较高的信噪比并节省检测时间,最终选择采样次数为32次。
2.5方法学验证
2.5.1专属性依帕列净供试品、内标盐酸吉西他滨标准品、齐多夫定标准品,以及内标分别与依帕列净混合溶液的核磁共振氢谱见图1。结果表明混合溶液中样品与内标各定量峰能够完全分离,无杂质及相互间干扰。
2.5.2线性及范围分别精密称取样品约30.0,22.6,15.0,10.0,7.5 mg,内标齐多夫定9.0 mg或内标盐酸吉西他滨10.0 mg,置于同一离心管中,按“1.2.1”方法平行配制5份样品溶液,按“1.2.2”条件进行测定。以(样品/内标)的摩尔比为横坐标(x),定量峰面积比为纵坐标(y)进行线性拟合。结果显示,以盐酸吉西他滨和齐多夫定为内标时,样品与内标盐酸吉西他滨和齐多夫定的摩尔比分别在0.512 5~1.953 8和0.494 7~1.966 0范围内,氢信号与样品称样量成正比,回归方程分别为y=0.009x-0.003和y=0.576x+0.026,相关系数(r2)均为0.999 9。表明所建立的核磁共振定量法线性关系良好。
2.5.3精密度精密称取适量样品和内标,按“1.2.2”测定条件分别在日内和日间做6组测试。结果显示,依帕列净与内标盐酸吉西他滨峰面积(NRAS/NSAR) 的日内相对标准偏差(RSD)为0.19%,日间RSD为0.28%;依帕列净与内标齐多夫定峰面积(NRAS/NSAR) 的日内RSD为0.31%,日间RSD为0.34%,方法的精密度良好。
2.5.4耐用性考察了采样次数(ns=24~40)、温度(T=298~308 K)及内标用量(IS±1 mg)变化对实验结果的影响。结果表明,以盐酸吉西他滨和齐多夫定为内标时,采样次数、温度和内标量的微小变化对测定结果的影响均较小,表明该法的耐用性良好。
2.5.5稳定性取同一供试品溶液分别在 0,2,4,8,12,18,24 h 进样测定,结果显示,依帕列净样品与内标盐酸吉西他滨以及齐多夫定峰面积比值的RSD(n=7)分别为0.06%和0.16%,表明供试品溶液室温放置 24 h 内稳定。
2.6样品测定
结果显示,以盐酸吉西他滨为内标测得依帕列净供试品的含量为99.83%(n=3,RSD=0.06%);以齐多夫定为内标测得依帕列净供试品的含量为99.77%(n=3,RSD=0.19%),两种内标所测结果一致,表明该方法结果准确、可靠。
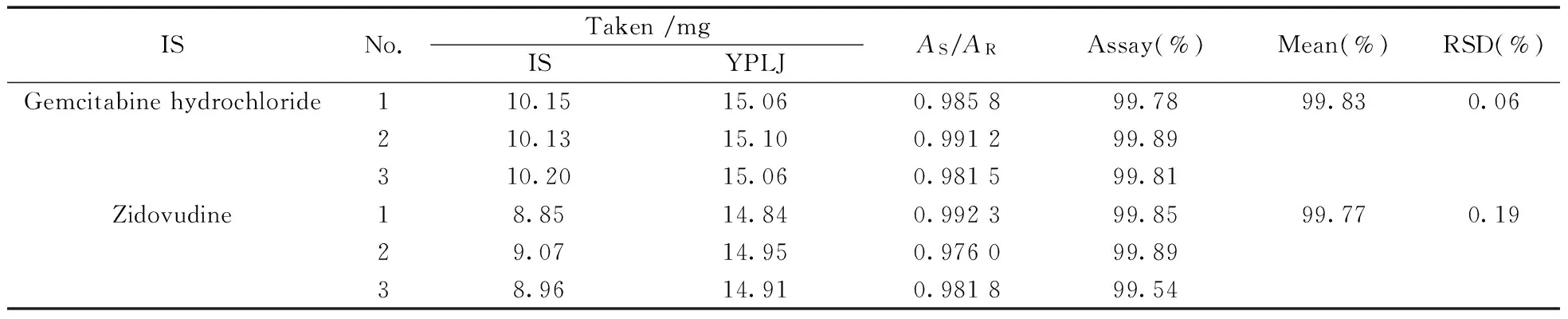
表1 依帕列净(YPLJ)的含量测定结果Table 1 Absolute content of empagliflozin
3 结 论
本研究采用盐酸吉西他滨和齐多夫定2种内标,以氘代二甲亚砜和重水混合液为溶剂,选取合适的1H-qNMR测试条件和定量峰,对依帕列净供试品进行含量测定。结果显示,2种内标所测结果一致,所建立的方法操作简便、特异性强、快速准确,为依帕列净原料药的含量测定提供了一种新手段,有望为其质量控制研究提供实验依据。
[1]Malla P,Kumar R,Mahapatra M K,Kumar M.Med.Res.Rev.,2014,34(6):1146-1167.
[2]Zhao X,Cui Y M,Zhao S,Lang B,Broedl U C,Salsali A,Pinnetti S,Macha S.Clin.Ther.,2015,37(7):1493-1502.
[3]Michel M C,Mayoux E,Vallon V.Naunyn-Schmiedeberg'sArch.Pharmacol.,2015,388(8):801-816.
[4]Tikkanen I,Narko K,Zeller C,Green A,Salsali A,Broedl U C,Woerle H J,Bajaj H S.Can.J.Diabetes,2013,37(S4):S30.
[5]Kovacs C S,Seshiah V,Merker L,Christiansen A V,Roux F,Salsali A,Kim G,Stella P,Woerle H J,Broedl U C.Clin.Ther.,2015,37(8):1773-1788e1.
[6]Haering H U,Merker L,Christiansen A V,Roux F,Salsali A,Kim G,Meinicke T,Woerle H J,Broedl U C.DiabetesRes.Clin.Pract.,2015,110(1):82-90.
[7]Chen X L,Guo Y J,Hu Y J,Yu B Y,Qi J.J.Pharm.Biomed.Anal.,2016,124 :281-287.
[8]Holzgrabe U,Deubner R,Schollmayer C,Waibel B.J.Pharm.Biomed.Anal.,2005,38(5):806-812.
[9]National Pharmacopoeia Committee.ThePharmacopoeiaofthePeople'sRepublicofChina(Part Ⅱ,2010 Ed.).Beijing:China Medical Science Press(国家药典委员会.中华人民共和国药典.二部.北京:中国医药科技出版社),2010:81-83.
[10]Jiang M H,Yu X B,Mao L S,Shen W B,Di B.J.Chin.Pharm.Univ.(蒋孟虹,于小波,毛黎顺,沈文斌,狄斌.中国药科大学学报),2013,44(4):339-342.
[11]Holzgrabe U.Prog.Nucl.Magn.Reson.Spectrosc.,2010,57(2):229-240.
[12]Guo Q S,Shi G Q,Song W,Xu X.J.Instrum.Anal.(郭强胜,石高旗,宋巍,许旭.分析测试学报),2012,31(1):117-120.
[13]Bharti S K,Roy R.TrendAnal.Chem.,2012,35:5-26.
[14]Zhang F F,Jiang M H,Shen W B,Ding Y.J.NanjingNorm.Univ.:Eng.Technol.Ed.(张芬芬,蒋孟虹,沈文斌,丁娅.南京师范大学学报:工程技术版),2014,14(2):8-18.
[15]Kuchta K,Ortwein J,Hennig L,Rauwald H W.Fitoterapia,2014,96(12):8-17.
[16]Hu M F,Jiang M,Qiu H,Wang L J,Wei Q.J.Instrum.Anal.(胡敏芳,江明,邱慧,王玲娟,魏强.分析测试学报),2013,32(12):1511-1514.
Quantitative Determination of Empagliflozin by Nuclear Magnetic Resonance
SUN Lin-lin1,ZHANG Fen-fen2,SHEN Wen-bin3*,DING Ya1*
(1.Department of Pharmaceutical Analysis,China Pharmaceutical University,Nanjing210009,China;2.Analysis and Testing Center,Donghua University,Shanghai201620,China;3.Pharmaceutical Research Institute,China Pharmaceutical University,Nanjing210009,China)
A method was established to determine the content of empagliflozin by1H nuclear magnetic resonance spectroscopy(1H-NMR),using gemcitabine hydrochloride and zidovudine as the internal standard,repectively.NMR spectra were recorded using a standard 1D pulse sequence at a 30° flip angle and with DMSO-d6-D2O as the solvent.Thirty two scans of 32 K data points were acquired at a temperature of 303 K,a relaxation delay of 20 s and a line broad of 0.3 Hz.Under the optimal conditions,method validation indicated specificity,robustness and stability up to 24 h.A good linear relationship was obtained between peak area ratio and molar ratio of empagliflozin to the internal standard.For gemcitabine,the regression equation wasy=0.009x-0.003(r2=0.999 9) with a molar ratio range of 0.512 5-1.953 8.For zidovudine,the regression equation wasy=0.576x-0.026(r2=0.999 9) with a molar ratio range of 0.494 7-1.966 0.The contents of empagliflozin were 99.83%(n=3,RSD=0.06%)and 99.77%(n=3,RSD=0.19%)corresponding to the internal standards gemcitabine hydrochloride and zidovudine,respectively.The results were consistent with each other,indicating that the method had the advantages of accuracy,high sensitivity and good repeatability,and could be used for the quantification of new drugs.
empagliflozin;quantitative NMR;gemcitabine hydrochloride;zidovudine
2016-03-01;
2016-03-22
沈文斌,副研究员,研究方向:核磁共振,Tel:025-83271233,E-mail:cpunmrswb@163.com
丁娅,博士,副教授,研究方向:纳米药物分析及有机光谱分析,Tel:025-83271326,E-mail:ayanju@163.com
10.3969/j.issn.1004-4957.2016.09.015
O482.532;TQ460.72
A
1004-4957(2016)09-1157-05

