大孔树脂纯化叶多酚及其对胰淀粉酶的抑制作用
陈 江,张晓喻,*,刘 刚,王战国,刘海霞
(1.四川师范大学生命科学学院,四川成都 610100;2.成都大学医学院(护理学院),四川成都 610100)

陈江1,张晓喻1,*,刘刚1,王战国2,刘海霞1
(1.四川师范大学生命科学学院,四川成都 610100;2.成都大学医学院(护理学院),四川成都 610100)


多酚广泛存在于各类植物当中,具有多种生理功能[11],但含量相差很大。通常,对多酚进行提取主要采用有机溶剂法[12],但获得的提取物常含大量杂质,需要进一步纯化。大孔吸附树脂法是根据吸附性和分子筛原理将具有一定极性的有机大分子物质进行分离,该方法吸附选择性好,处理容量大,能在温和的条件下进行解析,并且可以充分利用,能有效降低生产成本,适合于工业化生产[13-14]。近年来,越来越多的研究集中在多酚的纯化工艺上。冯进等[13]用HPD 400树脂将蓝莓叶中的多酚含量由原来的38.75%提高到69.38%。王旭苹等[21]用SP850将树脂纯化酒花中的多酚,酒花多酚的纯度由13.2%提高到56.6%。张智等[15]研究了落叶松树皮中多酚的纯化工艺,纯化后,其含量可高达75.52%。
淀粉酶是影响饮食中淀粉等主要碳水化合物消化、吸收的关键酶之一,抑制其活性可以延缓人体对淀粉等物质的降解利用,从而抑制餐后血糖的升高[16-17]。目前已研究证实,植物多酚不仅能够减少氧化应激作用,而且能够通过抑制碳水化合物水解酶如淀粉酶、葡萄糖苷酶的作用来预防高血糖[18-19]。
1 材料与方法
1.1材料和仪器
Sartorius BP211D电子天平北京塞多利斯仪器系统有限公司;KQ5200E超声波清洗器昆山市超声仪器有限公司;UV-1700紫外-可见分光光度仪日本岛津公司;DIONEX-Summit P680ADGP-6型双三元高效液相色谱仪美国戴安公司;DHG-903电热恒温鼓风干燥箱上海精宏实验设备有限公司;真空冷冻干燥箱wizard 2.0美国VirTis公司。
1.2实验方法
1.2.2.1标准曲线的制作采用Folin-Ciocalteus法[23],以根皮苷为标准品[8],精确称取12.25 mg根皮苷标准品,以70%乙醇溶解后定容至25 mL,即得到浓度490 μg/mL的储备液。分别准确移取根皮苷储备液0.2、1.0、3.0、5.0、7.0 mL于5支10 mL容量瓶,70%乙醇定容,得不同浓度根皮苷的标准溶液。取0.5 mL不同浓度根皮苷标准液和蒸馏水(做空白对照)于具塞试管中,依次加入6.5 mL蒸馏水和0.5 mL FC试剂,摇匀后静置1 min,再加2.5 mL 10% Na2CO3溶液,摇匀,55 ℃保温7 min,然后迅速冷却至室温,于760 nm波长下测定吸光度,并以根皮苷浓度为横坐标,吸光度值为纵坐标进行线性拟合,得线性回归方程y=0.0025x+0.0061,R2=0.9997,用于计算总多酚的质量浓度。
1.2.3大孔树脂预处理新购的三种极性不同的大孔树脂D-101、AB-8、NKA-9,用体积分数为95%的乙醇溶液密封浸泡24 h后,用超纯水冲洗至无醇味备用。
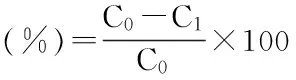
式(1)
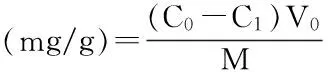
式(2)

式(3)
式(4)
1.2.5.3洗脱条件的确定按1.2.5.1和1.2.5.2所确定的上样条件上样并吸附平衡后,通过动态实验,分别考察不同乙醇体积分数的洗脱剂(10%、30%、50%、70%、90%)、洗脱体积(1~14 BV)和洗脱流速(1、2、3、4 mL/min)对多酚纯化的影响。
1.2.5.4最大上样量的确定按1.2.5.1和1.2.5.2确定的上样条件进行连续上样,每一个BV收集一次流出液,按1.2.2.1方法测定流出液中总多酚的质量浓度,以上样体积对总多酚的质量浓度作图,绘制泄露曲线。
1.2.6树脂重复利用实验经纯化使用过的D-101树脂用体积分数为95%的乙醇溶液密封浸泡24 h后,用超纯水冲洗至无醇味,再用5% HCl溶液密封浸泡2~4 h,用超纯水冲洗至中性;最后用2% NaOH溶液密封浸泡2~4 h,用超纯水冲洗至中性,然后按已确定的纯化工艺进行重复实验。重复10次,测定并计算所得纯化物的量以及其中总多酚的含量,并以所得纯化物中总多酚含量等对重复次数作图。

1.3.1麦芽糖标准曲线的制作准确称取1.00017 g麦芽糖,用蒸馏水溶解并定容至100 mL,配制成浓度为10.0017 mg/mL的麦芽糖储备液。分别精密量取麦芽糖储备液0、0.25、0.5、1.0、1.5、2.0、2.5、3.0 mL于10 mL容量瓶中,蒸馏水定容,得到不同浓度麦芽糖标准溶液。分别准确移取2 mL不同浓度麦芽糖标准溶液于25 mL容量瓶中,加入1% 3,5-二硝基水杨酸溶液2 mL,置于沸水浴中保温5 min,待溶液冷却至室温后,加入蒸馏水定容至刻度,在540 nm处测定溶液吸光值,以麦芽糖质量浓度为横坐标,对应吸光值作为纵坐标进行线性拟合,得到麦芽糖标准曲线为:y=0.0074x-0.0252,R2=0.9996,表明麦芽糖质量浓度在20.054~240.648 μg/mL范围时,浓度与其对应吸光度值呈良好的线性关系,用于测定胰淀粉酶活力。

式(5)

式(6)
淀粉酶活性以每分钟每克胰酶中淀粉酶催化作用下产生的麦芽糖的质量表示,即mg/min·g。
2 结果与分析

按1.2.4方法进行静态吸附与解吸,并根据树脂的吸附率和解析率选择吸附和解析性能较好的树脂。实验测得各树脂的静态吸附率、解析率等的结果见表1。
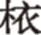
表1 三种不同树脂对栘叶多酚的静态吸附与解析性能
Table 1 Results of adsorption and desorption for polyphenol from Docyniaindica(Wall.)Dcneby three macroporous resins

表1 三种不同树脂对栘叶多酚的静态吸附与解析性能
树脂型号吸附率(%)吸附量(mg/g)解析率(%)多酚回收率(%)D-10196.60±0.296.28±0.0289.21±2.3386.17±2.38AB-895.20±0.336.19±0.0287.81±0.0483.60±1.86NKA-995.02±0.146.18±0.0184.46±1.1880.28±1.37
2.3上样浓度对吸附的影响
考察不同上样溶液质量浓度对吸附的影响,并以多酚回收率对上样溶液中多酚的质量浓度作图,结果见图1。由图1可知,当上样溶液的质量浓度在5~25 mg/mL之间时,多酚回收率总体呈现增长的趋势,但增长幅度不大,仅从82.34%±1.61% 增加到93.14%±1.05%,当上样溶液质量浓度达到25 mg/mL时,多酚回收率出现最大值,为93.14%±1.05%。但随着上样溶液质量浓度的进一步增加,多酚回收率却随之下降,当上样溶液质量浓度为30 mg/mL时,多酚回收率降至79.36%±1.27%。因此确定上样溶液的最佳质量浓度为25 mg/mL。

图1 上样溶液质量浓度对树脂吸附性能的影响Fig.1 Effect of sample concentration on adsorption properties
2.4上样流速对吸附的影响
考察不同上样流速对吸附过程的影响,并以吸附总量对上样流速作图,其结果见图2。由图2可知,随着上样流速的增大,D-101大孔吸附树脂的吸附总量呈现下降趋势,即流出液中总多酚的质量浓度逐渐增加。这是因为上样流速越慢,多酚与树脂的接触时间越久,树脂将多酚充分的吸附;而上样流速越快,多酚与树脂的接触时间越短,导致树脂吸附量降低。因此选择1 mL/min作为上样流速。

图2 上样流速对吸附的影响Fig.2 Effect of sample flow rate on flavonoids absorption
2.5乙醇体积分数的考察
考察不同体积分数的乙醇溶液对解析的影响,并以多酚回收率对乙醇的体积分数作图,结果见图3。由图3可知,随着乙醇体积分数的增加,多酚回收率也随之增加,但当乙醇体积分数增加到50%以上时,增加的幅度并不大,仅从89.4%增加到96.2%。而当乙醇体积分数为50%时,已能将树脂上近90%的多酚洗脱下来。继续增加乙醇体积分数虽然能够提高洗脱效果,但从经济的角度考虑,选择50%乙醇作为洗脱液,此时多酚的回收率为89.6%±2.6%。
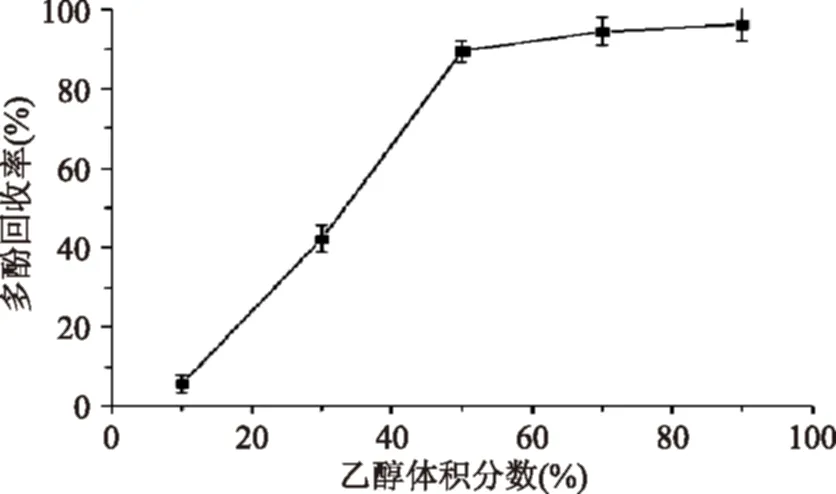
图3 乙醇体积分数对树脂解析性能的影响Fig.3 Effect of ethanol concentration on desorption properties
2.6洗脱流速对解析的影响
考察不同洗脱流速对解析的影响,并以多酚回收率对乙醇的洗脱流速作图,结果见图4。由图4知,实验所选各洗脱流速下,多酚的回收率均差距不大,均在90%左右。但随着洗脱流速的增加,多酚回收率却呈现下降的趋势,这可能是因为洗脱流速越快,洗脱剂与多酚的作用时间越短,导致多酚无法被充分的洗脱下来。但洗脱流速太慢,将导致洗脱时间延长。因此,综合考虑时间与成本等因素,选择3 mL/min的洗脱流速作为最佳洗脱流速,此时多酚回收率为89.92%±1.92%。
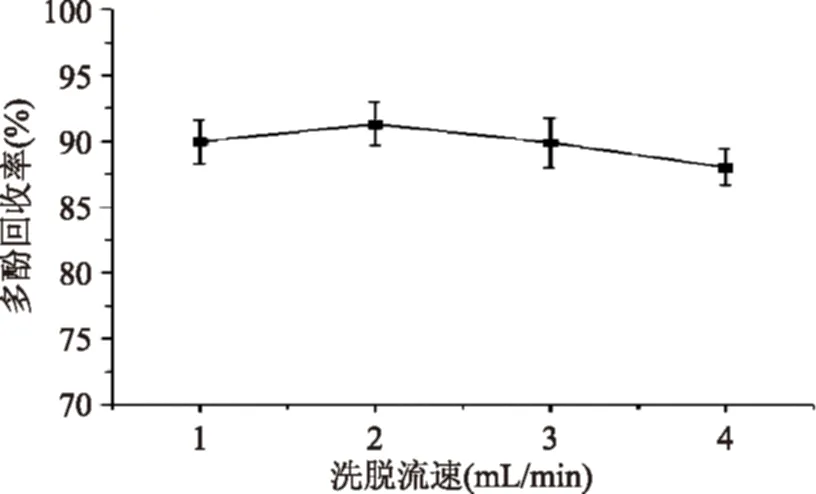
图4 洗脱流速对树脂解析性能的影响Fig.4 Effect of elution flow rate on desorption properties
2.7最大上样量确定
25 mg/mL的上样溶液连续上样,并按每1 BV收集流出液,按1.2.4方法计算流出液中多酚的质量浓度,并以多酚质量浓度对上样量作图,结果见图5。由图5可知,随着上样量的不断增加,流出液中总多酚的质量浓度也随之增加,当上样量达到11 BV时,流出液中总多酚的质量浓度迅速增加。在上样量达到21 BV以后时,流出液中总多酚的质量浓度达到最大值,为7.58 mg/mL,继续增加上样量,流出液中总多酚的质量浓度基本不变。综合考虑,选择上样量为10 BV。
图5 总多酚的泄露曲线Fig.5 The leakage curve of polyphenols
2.8洗脱体积对解析的影响

图6 洗脱曲线Fig.6 Dynamic desorption curve
2.9树脂重复利用实验
将D-101树脂回收并经过10次吸附-解析-再生的重复操作,以所得纯化物质量、纯化物中多酚和根皮苷含量对重复次数作图,结果见图7。

图7 D-101树脂重复使用性能实验Fig.7 Reusaility of D-101

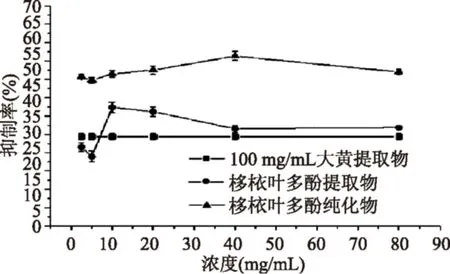
图8 栘叶多酚提取物及纯化物对胰淀粉酶的抑制Fig.8 Polyphenols of extract and purification from Docyniaindica(Wall.) Dcne with pancreatic amylase inhibitory effect
3 结论
[1]中国科学院《中国植物志》编委会.中国植物志 [M].第36卷.北京:科学出版社,1974:346-349.

[3]Huang Ji,Pei Shengji,Long Chunlin.An ethnobotanical study of medicinal plants used by the Lisu people in Nujiang,Northwest Yunnan,China [J].Economic Botany,2004,58(1):S253-S264.

[5]Nguyen T T L,Hoang T M T,Vu T H T,et al.Anti-obesity and body weight reducing effect ofDocyniaindica(Wall.)Decne fruit extract fractions in experimentally obese mice[J]. VNU Journal of Science,Natural Sciences and Technology,2011,27(2):125-133.
[6]Hazarika T K,Lalramchuana,Nautiyal B P.Studies on wild edible fruits of Mizoram,India used as ethno-medicine[J].Genetic Resources and Crop Evolution,2012,59(8):1767-1776.

[9]Sushma K,Shantibaladevi G A.Determination of antioxidant activity and vitamin C of some wild fruits of Manipur
[J].Bioscan,2010,5(3):501-504.
[11]李健,张令文,刘宁,等.大孔吸附树脂法纯化苦瓜皂苷工艺的研究[J].食品工业技术,2007,28(7):127-130.
[12]王雅,樊明涛,赵萍,等.大孔树脂对沙枣多酚的动态吸附解析性能研究[J].西北农林科技大学学报,2010,38(12):215-220.
[13]冯进,李敏,曾晓雄,等.大孔树脂纯化蓝莓叶多酚及其组成分析[J].食品科学,2013,34(10):86-91.
[14]贺金娜,曹栋,史苏佳.大孔树脂纯化苹果多酚的工艺优化[J].食品与发酵工业,2014,40(5):135-141.
[15]张智,于震,王振宇,等.落叶松树皮多酚纯化工艺研究[J].食品工业科技,2014,35(5):187-191.
[16]刘杰超,焦中高,王思新.苹果多酚提取物对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J].果树学报,2011,28(4):553-557.
[17]Krentz A J,Bailey C J.Oral antidiabetic agents:Current rolein type 2 diabetes mellitus[J].Drugs,2005,65:385-411.
[18]李波,包怡红,高锋,等.红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用[J].食品工业科技,2015,36(1):63-69.
[19]Hilda Nyambe-Silavwe,Jose A Villa-Rodriguez,IdoloIfie,et al.Inhibition of humanα-amylase by dietary Polyphenols[J]. Journal of Functional Foods,2015,19:723-732.
[20]刘京鑫,何云华.不同型号大孔树脂对苹果多酚物质的吸附特性[J].应用化工,2014,43(7):1208-1213.
[21]王旭苹,杨磊,杨小兰,等.大孔树脂纯化酒花多酚及其组成分析[J].食品科学,2013,34(22):15-20.
[22]Amar Djeridane,AichaHamdi,WafaBensania,et al.The in vitro evaluation of antioxidative activity,a-glucosidase and a-amylase enzyme inhibitory of natural phenolic extracts[J]. Diabetes & Metabolic Syndrome:Clinical Research & Reviews,2015(9):324-331.
[23]中华全国供销合作社杭州茶叶研究院.GB/T8313-2008,茶叶中茶多酚和儿茶素类含量的检测[S].北京:中华全国供销合作社,2008.
[24]金莹,孙爱东.大孔树脂纯化苹果多酚的研究[J].食品科学,2007,28(4):160-163.
[25]艾志录,王育红,王海,等.大孔树脂对苹果渣中多酚物质的吸附研究[J].农业工程学报,2007,23(8):245-246.
[26]孙京沙,张朝辉.大叶藻总黄酮的大孔树脂纯化工艺[J].食品科学,2014,35(14):5-10.
[27]袁德彬.复方黑骨藤精制工艺研究[D].四川:四川师范大学生命科学学院,2012.
[28]张俊生,朱士龙,李俊,等.大孔树脂对节节草总黄酮吸附分离特性研究[J].食品工业科技,2012,33(13):236-239.
[29]孙立军.苹果幼果总酚、绿原酸及根皮苷的连续分离及对淀粉酶的抑制[D].西安:陕西师范大学,2013.
Study on polyphenol purification by macroporous resin and inhibition activity to pancreatic amylase of polyphenol fromDocyniaindica(Wall.)Dcne leaves
CHEN Jiang1,ZHANG Xiao-yu1,*,LIU Gang1,WANG Zhan-guo2,LIU Hai-xia1
(1.College of Life Science,Sichuan Normal University,Chengdu 610100,China;2.School of Medical & Nursing,Chengdu University,Chengdu 610100,China)
To propose an optimal purification process for polyphenol extracted fromDocyniaindica(Wall.)Dcne leaves and investigate the inhibition of pancreatic amylase before and after purification. Macroporous resins D-101 was found more suitable to purify polyphenols by comparing their static adsorption and desorption capacities with those of two other kinds of macroporous resin. The purification process of D-101 was determined after static and dynamic experiment. When the D-101 was adsorbed with the maximum sample volume of 10 BV sample solution containing 25 mg/mL extractive at a rate of 1 mL/min,and desorpted with 8 BV of 50% ethanol at a flow rate of 3 mL/min,the content of the total polyphenol could be increased from 39.7% to 91.89%.The method proved to be simple and feasible for purification of total polyphenols extracted fromDocyniaindica(Wall.)Dcne leaves. After purification,the inhibitory rate of total polyphenols extracted fromDocyniaindica(Wall.)Dcne leaves increased,and the inhibition rate before and after purification was higher than that of 100 mg/mL rhubarb extract on pancreatic amylase,indicating that polyphenols ofDocyniaindica(Wall.)Dcne leaves had obvious inhibiting effect on pancreatic amylase,which the purification can improve.
Docyniaindica(Wall.)Dcne;polyphenol;macroporous resin;purification;pancreatic amylase
2015-11-27
陈江(1991-),男,在读硕士研究生,研究方向:食品非营养类物质的生物活性与功能,E-mail:18328616954@163.com。
张晓喻(1973-),女,博士,副教授,研究方向:食品非营养类物质的生物活性与功能,E-mail:zhangxy2005@126.com。
四川省科技厅科技支撑项目(2016SZ0026);四川师范大学校级重点培育项目(13ZDL11);四川省教育厅项目(14ZA0025);攀枝花市科技局项目(2014CY-S-8);西昌市教科和科学计划局2014年度科技项目;四川师范大学大精基金项目(DJ2013-02,DJ2014-13,DJ2015-04)。
TS201.1
A
1002-0306(2016)18-0143-06
10.13386/j.issn1002-0306.2016.18.019

