RE-B共掺杂片层TiO2的合成及其光催化性能
王瑞芬 王福明 宋金玲 安胜利, 王 鑫(内蒙古科技大学材料与冶金学院,内蒙古包头0400;北京科技大学冶金与生态工程学院,北京00083)
RE-B共掺杂片层TiO2的合成及其光催化性能
王瑞芬1,2,*王福明2宋金玲1安胜利1,2王鑫1
(1内蒙古科技大学材料与冶金学院,内蒙古包头014010;2北京科技大学冶金与生态工程学院,北京100083)
采用溶胶-凝胶法,利用钛酸四丁酯、硝酸镧、硝酸铈和硼酸为原料,对TiO2光催化剂进行稀土-B (RE-B)的共掺杂改性制备和性能研究。采用X-射线衍射法(XRD)、冷场发射扫描电子显微镜(SEM)、X射线光电子能谱(XPS)、紫外-可见吸收(UV-Vis)光谱和荧光(PL)光谱对制得样品的相组成、表面形貌结构、表面元素组成、光响应范围及带隙能和电子-空穴的复合情况进行了初步分析。结果表明,所制掺杂TiO2的组成均为锐钛矿型,掺杂使晶格发生了较大畸变,且细晶粒由未掺杂的27 nm减小到RE-B-TiO2的10 nm,形貌为片层状不规则堆放状态存在。XPS结果表明掺杂元素有效进入二氧化钛,PL谱显示共掺杂可有效延长光催化剂的载流子寿命。掺杂后吸收边均红移,La-B-TiO2由TiO2的405 nm移动到466 nm,相应地禁带宽度减小了0.4 eV。光催化实验表明:2 h内降解亚甲基蓝(MB)时掺杂能够同时提高紫外和可见光下二氧化钛的光催化效率,而共掺杂的降解效果又优于单掺杂,La-B-TiO2紫外光下的降解率达到80.67%,为同等条件下纯TiO2的2.7倍,可见光下的降解率为74.78%。
溶胶-凝胶法;稀土-B共掺杂;TiO2;亚甲基蓝;光降解
doi:10.3866/PKU.WHXB201511103
1 引言
TiO2是一种n型半导体光催化材料,具有众多其它光催化材料无法比拟的优势,如成本低、无毒、化学稳定性强等特点,特别是锐钛型纳米TiO2具有很高的光电活性,对波长小于387.5 nm的紫外光有很强的吸收1-4。但由于TiO2的禁带宽度在3.2 eV左右,只能利用太阳光中不足5%的紫外光5,而且TiO2自身的光生电子-空穴极易复合4,5,导致其光量子效率较低。在二氧化钛的改性研究中,离子掺杂6,7具有工艺简单、成本低廉、效果明显等优点,是目前最常用的TiO2改性方法。已有研究表明,很多金属掺杂8-10、非金属掺杂11-13或共掺杂14-17都能够较成功地提高TiO2纳米颗粒对染料的降解效率。
稀土离子具有独特的4f电子结构,而且稀土离子的4f、5d、6s电子能量比较相近,所以能够产生数目很多的能级,由此产生的多电子态可以成为载流子的浅势捕获陷阱,从而延长光生电子与空穴对的复合时间,提高二氧化钛的光催化效率18-22。B具有原子半径小和化学性质较活泼的优点,可以实现有效的掺杂,且由于B的2p轨道与O的2p轨道可以形成混合价带,从而使TiO2的禁带变窄11,提高它的可见光催化活性。据以往文献报道,稀土元素或B单独掺杂时,往往是仅能够实现拓宽TiO2光响应范围或者提高TiO2光催化效率中的一个目标,而且目前有关稀土La、Ce与B共掺杂改善二氧化钛光催化性能方面的研究仍鲜有报道,故本文尝试采用稀土元素La或Ce与B两组分共掺杂,以期通过共掺杂离子之间的相互协同作用,达到既提高其光催化效率又扩展光谱响应范围的目的。
2 实验部分
2.1试剂和仪器
主要试剂:无水乙醇,钛酸四丁酯[Ti(OC4H9)4];冰醋酸,硼酸均为分析纯;硝酸镧[La(NO3)3∙6H2O](>99.9%),硝酸铈[Ce(NO3)3∙6H2O](>99.9%)包头稀土研究院提供。主要仪器:磁力加热搅拌器、电热鼓风干燥箱、电热恒温水浴锅、智能箱式高温炉等常规仪器;D8 ADVANCE型X射线衍射仪(德国布鲁克);JSM-6701F冷场发射扫描电子显微镜(日本电子);Thermo ESCALAB 250XI多功能成像电子能谱仪(美国赛默飞世尔);U-3900紫外-可见分光光度计(日本日立);F-4600荧光光谱仪(日本日立)。
2.2测试方法
样品的粉末XRD测试以铜靶Kα为射线,采用的管电压为40 kV,测试扫描范围在10°-70°,扫描速率控制为5(°)∙min-1。采用冷场发射扫描电镜对样品进行形貌观察和分析,加速电压为14 kV,电流10 μA,溅射喷碳处理后,将样品固定在样品台上进行分析测试。XPS高分辨能谱检测时,激发源为经单色化处理后Al靶Kα射线,采用C 1s结合能284.8 eV为参考。使用日立F-3900,以BaSO4作参比,测量样品在200到700 nm范围内的紫外-可见吸收光谱,采用Khan法求吸收边和带隙宽度。荧光(PL)光谱测试时采用激发波长320 nm,发射波长340-600 nm,扫描速率为240 nm∙min-1,狭缝宽度5.0 nm。
2.3RE-B共掺杂纳米TiO2粉体的制备
将钛源钛酸四丁酯(TBOT)与溶剂无水乙醇(EtOH)及水解抑制剂冰醋酸按一定比例混合,此混合液标记为I;掺杂的稀土以硝酸盐溶液形式添加,硼(硼酸)以水溶液形式添加。具体操作时将一定体积稀土硝酸盐溶液、硼酸水溶液及无水乙醇混合,此液标记为II。二者混合完毕后,在激烈搅拌的条件下,将II液置分液漏斗中缓慢、逐滴加入到I液中,二者充分混合后继续搅拌1 h,将此溶胶置80°C水浴中陈化1 h得无色透明凝胶,将此凝胶置80°C恒温干燥箱烘干后,再置马弗炉中在500°C下焙烧得稀土-B共掺杂TiO2粉末样品,充分研磨后密封保存。在原料的具体数量控制上,采取La与Ti的摩尔百分比为1%、Ce与Ti的摩尔百分比为0.3%,B与Ti的摩尔百分比为20%,其余钛源、乙醇及水解抑制剂冰醋酸按体积比:VTBOT:VEtOH:Vacetate=17:80:15。掺杂稀土La和Ce均采用0.1 mol∙L-1硝酸盐溶液进行,B的掺杂是将H3BO3固体称取一定质量后加入水中形成溶液的方式加入,为了对比实验,同时制备了纯TiO2和La、Ce单掺杂二氧化钛样品。所得稀土单掺杂及RE与B共掺杂样品分别记为:TiO2、La-TiO2、Ce-TiO2、La/B-TiO2和Ce/B-TiO2。
3 表征与性能测试
3.1XRD物相分析
实验所得稀土单掺杂及稀土-B共掺杂样品的XRD测定结果如图1所示。据检测结果看出,本研究中所制备的样品均出现了对应于锐钛矿型TiO2(101)、(112)、(200)、(105)和(204)晶面的特征衍射峰,充分说明所制样品均为锐钛矿型TiO2晶体,且从衍射峰的峰形来看,所有样品,特别是纯TiO2和稀土单掺杂TiO2样品峰形体现为明锐的尖峰,而衍射峰愈是尖锐,则半高宽愈小,说明样品的结晶度愈好。在稀土单掺杂及稀土、B共掺杂样品的谱图中没有发现掺杂元素氧化物相的特征衍射峰,对比样品衍射谱图的第一主峰,也即2θ角在25.3°附近的衍射峰,可见到从纯TiO2到稀土单掺杂TiO2再到稀土与B共掺杂TiO2,掺杂使衍射峰的峰形发生明显宽化现象(β增大),且衍射峰的相对强度减弱。
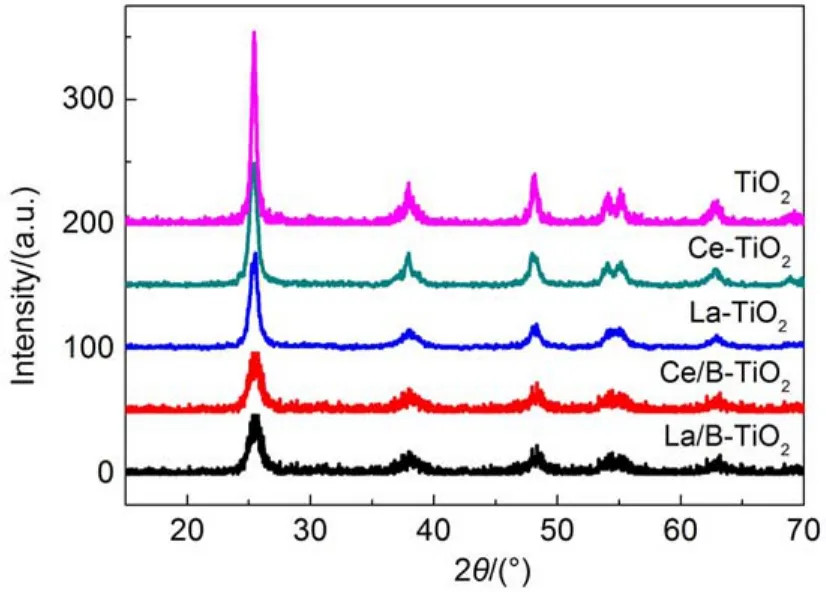
图1 不同样品的XRD谱图Fig.1 XRD patterns of different TiO2nanoparticles
由公式ε=Δd/d=β/4tgθ23可以估算晶格畸变ε的大小(式中β为XRD衍射峰的半高宽),d为晶面间距,θ为衍射角。由上述公式可以推算,单掺杂或共掺杂均使TiO2的晶格发生了畸变,特别是其中的RE-B共掺杂样品,β增加最大,表明RE-B共掺杂使TiO2晶格发生较大畸变。同时,由于B的离子半径(88 pm)远小于O的离子半径(140 pm),B离子很容易掺入TiO2晶格内部,以取代的方式占据O离子的晶格位置,导致掺杂纳米TiO2晶格发生更大畸变,进而使TiO2纳米颗粒各衍射峰明显宽化,衍射强度降低。同时,根据Scherrer方程Dhlk=kλ/(βcosθ)(Dhlk为晶粒尺寸;k为谢乐常数,k=0.89;λ=0.15406 nm)可知,谱图中衍射峰的半峰宽增加,相应的晶粒尺寸减少,说明引入一定量的掺杂离子均能起到抑制TiO2晶粒长大的作用。由上式估算的样品晶粒大小列于表1。
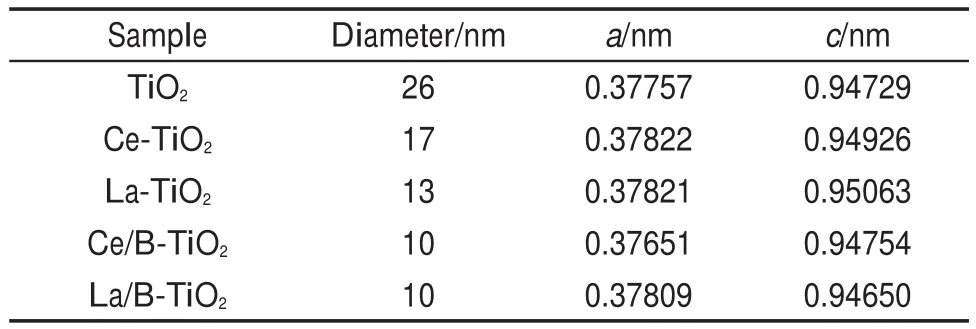
表1 样品晶粒大小和晶格参数Table 1 Crystallite size and lattice parameters of samples
3.2场发射扫描电子显微镜

图2La/B-TiO2的SEM图Fig.2 SEM images of La/B-TiO2
图2为La/B-TiO2在场发射扫描电镜下观察所得SEM图,图2(a)为低倍(18000)放大时样品的表面形貌图。可以看出样品表面形貌较好,整体上片层状结构清晰可见,且分布均匀,结晶化程度较好。图2(b)为局部高倍(50000)放大时样品的表面形貌图,进一步清晰地看到样品的形貌为薄片状结构堆积而成,但从照片也能看出部分区域明显已发生团聚,表明共掺杂纳米TiO2粉体具有很高的表面能,了较为严重的团聚。可以估算其片层平均厚度为10-15 nm左右,与前述根据XRD谱图估算出的结果一致,这种形貌特征也提供了较大的比表面积进而可以更加有效地吸附染料分子。
3.3X射线光电子能谱(XPS)
图3为样品La/B-TiO2的全能谱图及Ti、La和B 3种元素的XPS能谱图。由图3(a)可以看出,除了主要元素Ti、O、C的原子峰外,在835和853 eV处还出现了一个很弱的La 3d峰,在191 eV处出现了弱的B 1s峰,充分说明La和B原子有效进入了TiO2中。其中C元素来自于X射线光电子能谱仪本身的碳污染,由图3(b)可知,位于结合能458.07和463.92 eV处的两个肩峰,是Ti 2p轨道自旋相互作用分裂而成的2个能态:Ti 2p1/2和Ti 2p3/2,即Ti的+4价态引起的24-26;图3(c)可知,样品表面La元素在851.20和834.30 eV处的峰分别对应La 3d3/2和La 3d5/2的电子结合能,可以判断样品表面La元素主要以+3价的形式存在,结合XRD结果判段,产物中La元素是以Ti―O―La键的形式存在间隙位置中。图3(d)为B元素1s轨道的高分辨XPS图谱,结合能在191.82 eV的峰,其化学态可归结于Ti―O―B键27,这表明B极有可能是替代O进入晶格内。根据Ti 2p和La 3d的结合能数据,利用元素灵敏度因子法计算得到纳米材料中Ti/La的原子浓度比为1000:11,所以La与Ti的比为1.1% (原子分数,下同),非常接近制备时的理论值(1.0%),所以该法可以成功实现La的有效掺杂。同法可以计算出B与Ti的比例为11.8%,与其理论投加量20%相差较大,可能是由于XPS仅为元素的表面分析手段而带来的偏差所致。
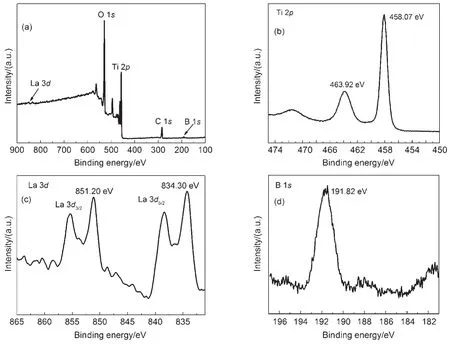
图3La/B-TiO2的XPS图谱Fig.3 XPS patterns of La/B-TiO2
3.4紫外-可见(UV-Vis)吸收光谱分析
稀土单掺杂及共掺杂样品的吸收谱如图4所示,采用Khan法计算得吸收边和带隙宽度数据见表2所列。
由图3可知,掺杂均能够起到增加可见光吸收的效果,掺杂后的RE-TiO2和RE-B-TiO2不论在紫外或可见光区域的光吸收能力均有不同程度的增强,且掺杂样品的吸收边带均发生红移,相应的半导体带隙减小。特别是La和B共掺杂的TiO2,其可见光的吸收明显增强,吸收边带红移最为显著,由纯二氧化钛的405 nm红移至466 nm,移动了61 nm,对应的带隙宽度降低了0.4 eV,从理论上讲,明显提高了太阳光的利用率且改善了催化剂的可见光活性。
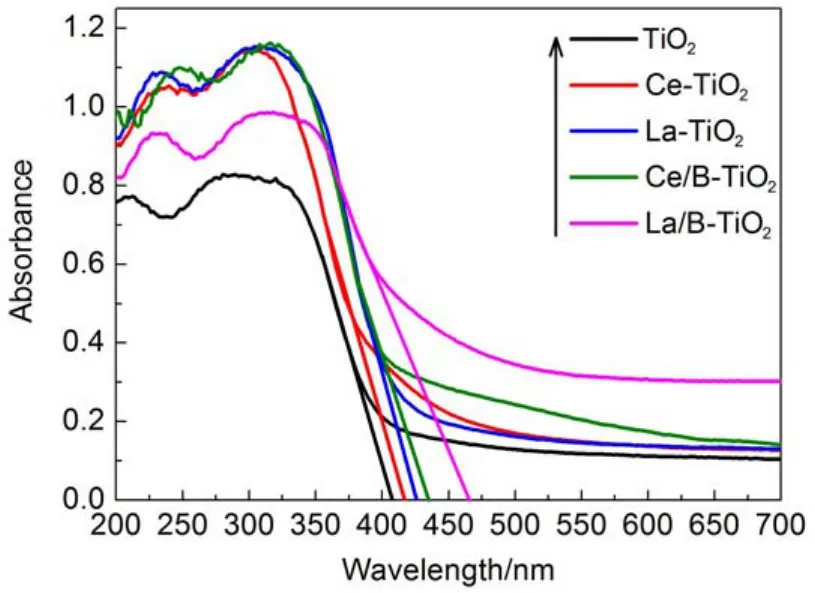
图4 纯TiO2和掺杂TiO2的UV-Vis光谱Fig.4 UV-Vis spectra of pure TiO2and doped TiO2

表2 样品的吸收边和带隙宽度Table 2 Absorption edge and gap of samples
同时,La、Ce的掺杂导致TiO2的本征吸收边发生红移主要是由于掺杂离子与Ti半径间较大差异而导致TiO2晶格产生的畸变,进而增加了光催化剂颗粒内部的应力,而内应力的增加又直接导致了TiO2能带结构的改变,最终使其带隙宽度减小,能级间距变窄,在紫外-可见吸收谱中出现曲线边带发生红移的现象。在此基础之上,进一步引入第二掺杂元素B,在B取代O进入TiO2晶格时,由于B的电负性低于氧,B的2p轨道与O的2p轨道易发生杂化,从而使掺杂TiO2禁带宽度变窄11,28,发生边带红移。另一方面,掺杂离子后可能在TiO2内部能级间形成了新的掺杂能级,从而使能量较小的光子也可以激发新形成的掺杂能级上捕获的e-和h+,最终使禁带宽度变窄、吸收边带红移,提高光子的利用率。
3.5荧光光谱
物质的PL是由于其内部载流子的重新复合而引起的,所以可以作为研究半导体材料电子结构和光学性能的有效方法,并且能够由此获得光生电子-空穴的迁移及复合等信息29,30。故不难总结,对于半导体其光生载流子复合的几率越高时,其对应的荧光光谱中发光强度就越大。
图5为实验所得样品的荧光光谱图,由图可知稀土单掺杂及稀土-B共掺杂的样品都表现出与纯TiO2相似的PL光谱,只是在荧光强度上有些差别。且PL谱图中并未出现新的发光峰,说明稀土或稀土-B共掺杂在此测定条件下并没有引起新的发光现象。掺杂样品的荧光强度均比纯TiO2强度低,而且发光强度依次顺序为TiO2>RE-TiO2> RE-B-TiO2,当掺杂稀土为La时,样品的荧光强度最低,类似文献报道中离子掺杂TiO2发生类似的荧光猝灭现象31。说明镧与B的共掺杂可以有效降低光生电子-空穴的复合几率,从而提高光催化剂的活性。
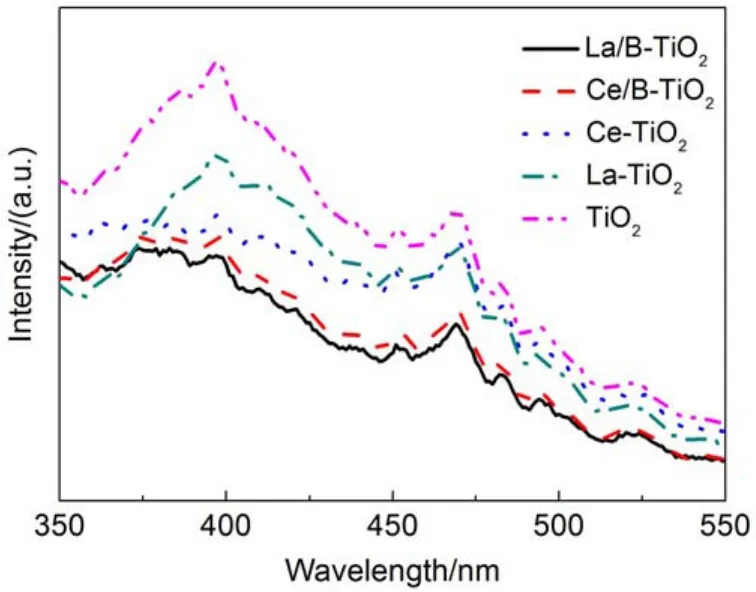
图5 掺杂改性及纯TiO2的荧光光谱Fig.5 PLspectra of doping-TiO2and pure TiO2
3.6光催化性能评价
3.6.1光催化实验原理及步骤
亚甲基蓝是一种常用的工业染料原料,如若随污水排放到环境当中容易引起环境污染,固本实验用它作为目标降解物具有一定的代表和实际意义。实验中采用模拟水样,亚甲基蓝溶液采用光谱扫描测量其吸收曲线的方法进行,根据朗伯-比尔定律计算亚甲基蓝的降解率。实验使用日本日立U-3900紫外-可见分光光度计进行光谱扫描。
具体光催化实验过程如下:采用15 W紫外灯为光源,以20 mg∙L-1亚甲基蓝水溶液为模拟污染物,催化剂的投加量控制在3 g∙L-1,实验中保持光源与液面距离为10 cm左右。实验开始时保持亚甲基蓝溶液与催化剂在暗处持续搅拌30 min使催化剂对于染料分子的吸附-脱附达到平衡,后置于紫外灯下,每隔20 min从溶液体系中分取2 mL左右进行离心分离催化剂,再用紫外-可见分光光度计测定其吸光度。根据公式计算其降解率(η):η= (A0-A)/A0×100%,式中:A0、A分别为有机物的初始吸光度和降解后的吸光度。
3.6.2光催化结果与分析
图6是不同样品在紫外光下降解亚甲基蓝的降解率曲线,选取亚甲基蓝在665 nm处对应的吸光度值进行计算。

图6 紫外光下不同样品对亚甲基蓝的降解率对比图Fig.6 Degradation rate of different samples over MB under UV light
图7为可见光下不同样品对亚甲基蓝的降解率对比图。由图7看出,稀土单掺杂及与B的共掺杂都显著提高了TiO2可见和紫外光下的光催化性能,特别是随着光降解时间的延长,这种提高更加明显。在所有制得样品中,稀土-B共掺杂样品效果优于稀土单掺杂样品,且La的改善作用大于Ce。在120 min内La/B-TiO2对亚甲基蓝的降解率达到了80.67%,为同等条件下纯TiO2降解率(29.8%)的近3倍。实验制备的纯TiO2也表现出了一定的可见光活性,结合前述UV-Vis结果可以看出,其吸收带边在405 nm,可能是样品存在缺陷结构,如氧空位等,也可能存在某种离子掺杂,这些与工艺参数或煅烧过程有关系。

图7 可见光下不同样品对亚甲基蓝的降解率对比图Fig.7 Degradation rate of different samples over MB under visble light
本文中掺杂的稀土离子半径(La3+和Ce4+的离子半径分别为0.116和0.102 nm)大于Ti4+(离子半径0.068 nm),若掺杂的稀土离子能够进入TiO2晶格中,则必然会引起TiO2晶格较大的膨胀,而由此造成的晶格畸变程度又对TiO2的光催化活性提高有着重要的影响。结合XRD分析认为,La3+和Ce4+可能已经取代Ti4+而进入TiO2晶格当中,由于离子半径的差异而引起的较大晶格畸变,是提高光催化活性的主要原因。
由于掺杂离子RE3+与钛离子半径的差异,部分Ti4+也可能进入到灼烧形成的La2O3或CeO2晶格中从而形成钛取代位,导致整体晶格畸变的同时又导致体系的电荷不平衡,特别是在La掺杂的样品体系中,由于离子价态的差异使电荷不平衡更加明显32,33,为了使体系电荷达到平衡,催化剂的表面必然会吸附部分OH-,这些吸附的OH-与体系中在紫外光照射下产生的空穴结合形成∙OH,而高活性的∙OH能与表面被吸附的有机物发生反应,从而既起到抑制光生电子-空穴重新复合的作用,又能够增强光催化降解有机物的能力。同时由于La3+半径大于Ce4+半径,La3+掺杂进入TiO2晶格后会导致更大的晶格畸变,因而La的掺杂效果总体强于Ce的掺杂效果。引入第二掺杂元素B时,由于B的2p轨道可以和O的2p轨道形成混合价带而使禁带变窄,从而提高其可见光催化活性34。同时由于B的缺电子特征使TiO2表面的路易斯酸性增强,因而表面吸附的OH-数量也增多,而OH-具有捕获光生空穴而转化为∙OH的能力,从而使B掺杂光催化剂的紫外、可见光催化活性均得到提高。
4 结论
采用改进的溶胶-凝胶法制备了多种稀土及稀土-B共掺杂纳米TiO2光催化剂,实验条件下所制光催化剂均为锐钛矿型且掺杂均使TiO2晶格发生了畸变,特别是RE-B共掺杂TiO2晶格发生了较大畸变,且掺杂均明显细化了晶粒,晶粒从未掺杂的27 nm减小到10 nm,所制备的掺杂催化剂为薄片层状结构,表面积较大。同时,掺杂光催化剂的吸收边带均产生了红移,移动最多的La/B-TiO2由纯二氧化钛405 nm移动到了466 nm,对应的禁带宽度降低了0.4 eV。XPS结果表明样品表面组成元素含有掺杂的稀土及B,掺杂元素有效进入TiO2中。荧光光谱直观表明通过RE及B的共掺杂可有效降低光生电子-空穴的复合几率,提高催化活性。紫外和可见光下降解亚甲基蓝降解亚的实验表明,掺杂均能提高二氧化钛的催化效果,共掺杂的降解效果均优于稀土单掺杂,在降解时间均为120 min时,降解效果最好的La/B-TiO2催化剂紫外光下的降解率可达到80.67%,为纯TiO2的2.7倍,在可见光下降解率为74.78%,略低于其在紫外光下的降解效率。
References
(1)Fujishima,A.;Honda,K.Nature 1972,238,37.doi:10.1038/ 238037a0
(2)Akpan,U.G.;Hameed,B.H.J.Hazard.Mater.2009,170,20.
(3)Fujishima,A.;Zhang,X.T.;Tryk,D.A.Surf.Sci.Rep.2008, 63,515.doi:10.1016/j.surfrep.2008.10.001
(4)Zhang,J.;Zhang,Y.P.;Lei,Y.K.Catal.Sci.Technol.2011,1, 273.doi:10.1039/c0cy00051e
(5)Devi,L.G.;Kavitha,R.Appl.Catal.B 2013,14-141,559.
(6)Han,Z.Y.;Du,Z.M.;Zhang,Y.H.;Zhao,L.S.;Cong,X.M. J.Inorg.Mater.2014,29(10),1110.
(7)Zhang,H.;Zhu,H.Appl.Surf.Sci.2012,258,10034.doi: 10.1016/j.apsusc.2012.06.069
(8)Binas,V.D.;Sambani,K.;Maggos,T.;Katsanaki,A.; Kiriakidis,G.Appl.Catal.B:Environ.2012,113,79.
(9)Wang,S.;Qian,H.;Hu,Y.;Dai,W.;Zhong,Y.;Chen,J.;Hu, X.Dalton Trans.2013,42,1122.doi:10.1039/C2DT32040A
(10)Qu,X.F.;Liu,L.Y.;Li,X.Q.;Du,F.L.J.Inorg.Mater.2015, 30(2),183.[曲晓飞,刘鲁英,李雪钦,杜芳林.无机材料学报,2015,30(2),183.]
(11)Devi,L G.;Kavitha,R.RSC Adv.2014,4,28265.doi:10.1039/ c4ra03291h
(12)Kilinc,N.;Sennik,E.;Isik,M.;Ahsen,A.S.;Ozturk,O.; Ozturk,Z.Z.Ceram.Int.2014,40,109.doi:10.1016/j. ceramint.2013.05.110
(13)Xiang,Q.J.;Lv,K.L.;Yu,J.G.Appl.Catal.B 2010,96,557. doi:10.1016/j.apcatb.2010.03.020
(14)Yang,M.Q.;Zhang,N.,Pagliaro,M.;Xu,Y.J.Chemical Society Reviews 2014,43,8240.doi:10.1039/C4CS00213J
(15)Zhang,N.;Zhang,Y.H.;Xu,Y.J.Nanoscale 2012,4,5792. doi:10.1039/c2nr31480k
(16)Wang,R.F.;Wang,F.M.;An,S.L.;Xu,J.Y.;Zhao,J.;Zhang, Y.Rare Metal Materials and Engineering 2014,43(9),2293.
(17)Raza,W.S.;Haque,M.M.;Muneer,M.;Fleisch,M.;Hakki, A.;Bahnemann,D.J.Alloy.Compd.2015,632,837.doi: 10.1016/j.jallcom.2015.01.222
(18)Ma,Y.F.;Zhang,J.L.;Tian,B.Z.;Chen,F.;Wang,L.Z. J.Hazard.Mater.2010,182,386.doi:10.1016/j. jhazmat.2010.06.045
(19)Xu,H.;Chen,W.;Wang,C.;Zhao,L.Mater.Sci.Eng.B 2012, 177,897.doi:10.1016/j.mseb.2012.04.002
(20)Xu,A.W.;Gao,Y.;Liu,H.Q.J.Catal.2002,207,151.doi: 10.1006/jcat.2002.3539
(21)Zhang,J.;Wu,W.C.;Yan,S.;Chu,G.;Zhao,S.L.;Wang,X.; Li,C.Appl.Surf.Sci.2015,344,249.doi:10.1016/j. apsusc.2015.03.078
(22)Liang,C.H.;Liu,C.S.;Li,F.B.;Wu,F.Chem.Eng.J.2009, 147,219.doi:10.1016/j.cej.2008.07.004
(23)Grujić-Brojčin,M.;Armaković,S.J.;Tomić,N.;Abramović, B.;Aleksandar,G.;Stojadinovic,B.Mater.Charact.2014,88, 30.doi:10.1016/j.matchar.2013.12.002
(24)Fan,X.;Wan,J.;Liu,E.Z.;Sun,L.;Hu,Y.;Li,H.;Hu,X.Y.; Fan,J.Ceram.Int.B 2015,41,5107.
(25)Xue,H.S.Study on Photocatalytic Properties of Rare Earth Ions Doped Titanium Dioxide Nanotubes Made by Template Method.Ph.D.Dissertation,Chongqing University, Chongqing,2008.[薛寒松.稀土掺杂二氧化钛纳米管模板法制备及光催化性能研究[D].重庆:重庆大学,2008.]
(26)Zhao,S.Q.;Guo,M.;Zhang,M.;Wang,X.D.;Chang,S. Scientia Sinica Chimica 2011,41(11),1699.[赵斯琴,郭敏,张梅,王习东,长山.中国科学化学,2011,41 (11),1699.]
(27)Zhao,W.;Ma,W.H.;Chen,C.C.Journal of the American Chemical Society 2004,126 15,4782.
(28)Vaiano,V.;Sacco,O.;Sannino,D.;Ciambelli,P.Appl.Catal. B-Environ.2015,170-171,153.
(29)Parida,K.M.;Sahu,N.J.Mol.Catal.A:Chem.2008,287, 151.doi:10.1016/j.molcata.2008.02.028
(30)Zhang,Y.H.;Tang,Z.R.;Fu,X.Z.;Xu,Y.J.ACS Nano 2011, 5,7426.doi:10.1021/nn202519j
(31)Zhou,J.;Zhang,Y.;Zhao,X.Industrial&Engineering Chemistry Research 2006,45(10),3503.
(32)Zhang,N.;Yang,M.Q.;Tang,Z.R.;Xu,Y.J.ACS Nano 2014, 8,623.
(33)Qian,S.W.;Wang,Z.Y.;Wang,M.Q.Mater.Sci.Eng.2003, 23(1),48.[钱斯文,王智宇,王民权.材料科学与工程,2003, 23(1),48.]doi:10.1016/S0928-4931(02)00225-4
(34)Han,C.;Yang,M.Q.;Zhang,N.;Xu,Y.J.Journal of Materials Chemistry A 2014,2,19156.doi:10.1039/ C4TA04151H
Synthesis and Photocatalytic Activities of Rare Earth-Boron Co-Doped Slice Layer TiO2
WANG Rui-Fen1,2,*WANG Fu-Ming2SONG Jin-Ling1AN Sheng-Li1,2WANG Xin1
(1School of Materials and Metallurgy,Inner Mongolia University of Science and Technology,Baotou 014010,Inner Mongolia Autonomous Region,P.R.China;2School of Metallurgical and Ecological Engineering,University of Science and Technology Beijing,Beijing 100083,P.R.China)
Rare earth(RE)and B co-doped(RE-B)nano-TiO2photocatalysts were prepared through a sol-gel method using tetrabutyl titanate,lanthanum nitrate,cerous nitrate,and boric acid.The phase constitution, surface morphology,surface elemental compositions,light responsivity,the band gap and the composite of the electronic hole of catalysts were characterized by X-ray diffraction(XRD),scanning electron microscopy(SEM), X-ray photoelectron spectroscopy(XPS),photoluminescence(PL)and ultraviolet-visible spectroscopy(UV-Vis). The results show that all the doped products were anatase TiO2,and RE-B doping generates large lattice distortion and had the function of refining the grain,with the grain size decreasing from 27 nm(TiO2)to 10 nm (La-B-TiO2).The doped TiO2was flake structure and piled up irregularly.Co-doping enhanced the absorption in the visible region and narrowed the band gap simultaneously.The absorption edge of La-B-TiO2moved from 405 nm to 466 nm,and the band gap decreased 0.4 eV correspondingly.XPS results show that the doping elements have effectively doped into the titanium dioxide,and PLspectra show that the co-doping can effectively extend the life of the carrier.The photocatalytic activities of the samples were estimated by degrading methyleneblue(MB)under visible and ultraviolet light irradiation for 2 h,and show much improved catalytic activity compared to un-doped TiO2.The degradation rate of MB using La/B-TiO2was 80.67%under ultraviolet light, which is about 2.7 times that of un-doped TiO2,and 74.78%under visible light.
Sol-gel method;RE-B co-doping;TiO2;MB;Photo-degradation
July 7,2015;Revised:November 5,2015;Published on Wed:November 10,2015.
O643.3
*Corresponding author.Email:jery19810528@126.com;Tel:+86-472-6896870.
The project was supported by the National Natural Science Foundation of China(21407084),Natural Science Foundation of Inner Mongolia,China (2015MS0571),and Higher School Foundation from Education Department of Inner Mongolia,China(NJZY13141).
国家自然科学基金(21407084),内蒙古自然科学基金(2015MS0571)和内蒙古自治区教育厅高等学校基金项目(NJZY13141)资助
©Editorial office ofActa Physico-Chimica Sinica

