产脂肪酶芽孢杆菌对仔鸡生长性能、肠道脂肪酶活力和微生物菌群的影响
郭威,郭晓军,袁洪水,朱宝成
(河北农业大学生命科学学院,河北保定071001)
科学实验研究
产脂肪酶芽孢杆菌对仔鸡生长性能、肠道脂肪酶活力和微生物菌群的影响
郭威,郭晓军,袁洪水,朱宝成*
(河北农业大学生命科学学院,河北保定071001)
本试验旨在研究产脂肪酶芽孢杆菌菌剂对仔鸡生长性能、肠道脂肪酶活力及微生物菌群的影响。选取900只1日龄健康仔鸡随机分为3组(每组3个重复,每个重复100只鸡):对照组饲喂基础日粮,试验组分别饲喂添加0.5%和1%产脂肪酶芽孢杆菌菌剂的试验饲粮,试验期42 d。结果表明:(1)添加1%产脂肪酶芽孢杆菌仔鸡全期料重比降低了8.50%(P<0.05),添加0.5%剂量组饲喂全期料重比降低了5.00%(P<0.05)。(2)添加0.5%和1%菌剂组21日龄仔鸡肠道内脂肪酶活力分别提高了8.84%(P<0.05)和25.31%(P<0.05)。(3)添加1%产脂肪酶芽孢杆菌组21日龄仔鸡盲肠中大肠杆菌含量降低了33.93%(P<0.05),乳酸杆菌和双歧杆菌含量分别增加了73.78%(P<0.05)和28.82%(P<0.05);添加0.5%剂量组21日龄仔鸡盲肠中大肠杆菌含量降低了14.89%(P<0.05)。由此可见,添加1%产脂肪酶芽孢杆菌对仔鸡全期的料重比、肠道内脂肪酶活力和微生物菌群的改善作用影响显著。
脂肪酶;芽孢杆菌;生长性能;脂肪酶活力;微生物菌群
王恬等(2006)指出,刚出壳的禽类脂肪消化率低的重要因素之一可能是胰腺脂肪酶分泌不足。因此,适当在饲料中添加产消化酶的益生菌可以弥补禽类内源酶的不足。枯草芽孢杆菌是一类可形成芽孢的好氧革兰氏阳性菌,被公认为是可在饲料中直接使用的微生物菌种(何明清,2004)。另外,芽孢杆菌进入动物肠道后,在肠道上部能迅速萌发并分泌活性很强的蛋白酶、脂肪酶、淀粉酶等,提高动物机体对饲料的消化率和养分的吸收利用率(潘康成,2009)。枯草芽孢杆菌EA-30-A是本实验室筛选到的一株高产脂肪酶的芽孢杆菌菌株,且经紫外诱变选育,性质稳定(郭晓军,2015)。本试验旨在研究不同水平产脂肪酶芽孢杆菌EA-30-A对仔鸡生长性能、肠道内脂肪酶活力及微生物菌群的影响,为其推广应用奠定理论基础。
1 材料与方法
1.1试验材料产脂肪酶芽孢杆菌:EA-30-A菌剂,有效活菌数5×108cfu/g,由河北众邦生物技术有限公司生产;全价饲粮:由河北大午农牧集团饲料有限公司提供;基础饲料:在全价饲料的基础上添加1%大豆油。
1.2试验动物与试验设计仔鸡,由保定市徐水县大午集团提供。选用同一批出雏的1日龄健康仔鸡900只,分为3组,每组3个重复,每个重复100只。对照组饲喂基础饲料;试验Ⅰ组和Ⅱ组分别在基础饲料的基础上添加0.5%和1%EA-30-A菌剂。
1.3试验饲粮与饲养管理本试验于河北农业大学种鸡试验场内进行,试验为期42 d。采用自由饮水,人工喂料(每天3次),按常规饲养管理进行免疫接种。两个饲养阶段日粮组成及营养水平见表1。

表1 日粮组成及营养水平
1.4测定指标与方法每周测定各组仔鸡的采食量、体增重,计算平均日增重(ADG)、平均采食量(ADFI)和料重比(F/G)。
于每周末早上从各组仔鸡十二指肠中取食糜测定其脂肪酶活力。脂肪酶活力测定方法参考橄榄油乳化法(Macrae,1985)。
试验第三周末取盲肠内容物,分离培养大肠杆菌、乳酸杆菌和双歧杆菌。伊红美兰(EMB)培养基用于培养大肠杆菌,MRS琼脂培养基用于培养乳酸杆菌,BBL琼脂培养基用于培养双歧杆菌。以10倍梯度将仔鸡盲肠内容物进行稀释,取1 mL稀释液分别涂布于培养基平板上,于37℃恒温培养24 h后,统计菌落数。
1.5数据处理试验数据采用SPSS 20.0进行单因素方差分析,Duncan’s法进行多重比较,试验结果用“平均值±标准差”表示。
2 结果与分析
2.1EA-30-A 菌剂对仔鸡生产性能的影响表2显示,从试验全期看,基础饲粮中添加0.5%和1%EA-30-A菌剂较对照组平均日增重提高9.20%、23.06%,差异均显著(P<0.05);1%剂量添加组较0.5%剂量组平均日增重提高12.69%(P<0.05)。基础饲粮中添加0.5%EA-30-A菌剂可提高仔鸡各期日采食量,但影响不显著(P>0.05);从试验全期看,添加1%EA-30-A菌剂仔鸡的平均日采食量较对照组提高了12.43%(P<0.05),与0.5%剂量组相比提高了8.63%(P<0.05)。基础饲粮中添加0.5%EA-30-A菌剂能降低仔鸡各期料重比,其中对前期(1~21 d)影响不显著(P>0.05),对后期(22~42 d)和全期影响显著,分别降低了2.51%(P<0.05)和5.00%(P<0.05);从试验全期看,添加1%EA-30-A菌剂降低了仔鸡料重比8.50%(P<0.05),与0.5%剂量组相比降低了3.68%(P<0.05)。
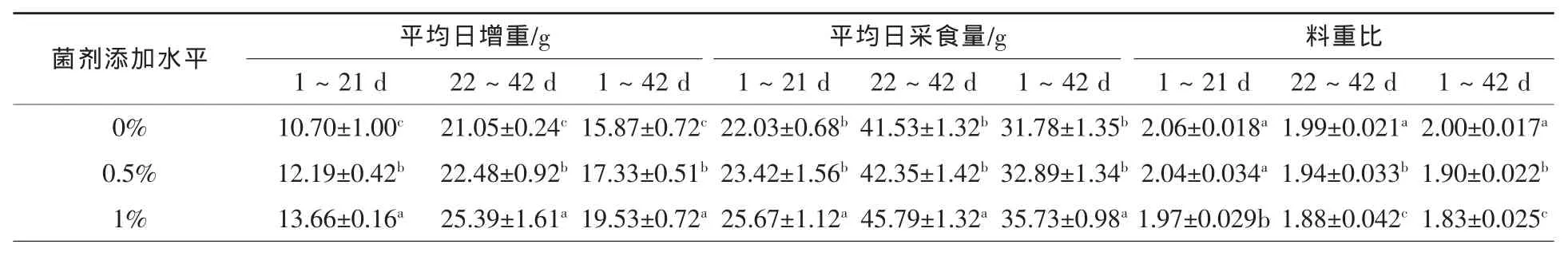
表2 EA-30-A菌剂对仔鸡生产性能的影响
2.2EA-30-A菌剂对仔鸡十二指肠脂肪酶活力的影响由表3可知,基础饲粮中添加0.5%EA-30-A菌剂在试验两周内对仔鸡十二指肠内脂肪酶活力无显著影响,在试验两周后显著提高了仔鸡十二指肠内脂肪酶活力;添加0.5%和1%EA-30-A菌剂与对照组相比,21日龄仔鸡肠道内脂肪酶活力分别提高了8.84%和25.31%(P<0.05)。

表3 EA-30-A菌剂对仔鸡十二指肠脂肪酶活力的影响U/mL
2.3EA-30-A菌剂对仔鸡盲肠中菌群的影响表4显示,与对照组相比,基础饲粮中添加0.5% EA-30-A菌剂,21日龄仔鸡盲肠内大肠杆菌数量降低了14.89%(P<0.05),1%剂量添加组大肠杆菌数量降低了33.93%(P<0.05)。基础饲粮添加1%EA-30-A菌剂,21日龄仔鸡盲肠内乳酸菌数量增加了73.78%(P<0.05),而添加0.5%剂量组对其影响不显著(P>0.10)。与对照组相比,基础饲粮添加0.5%EA-30-A菌剂对21日龄仔鸡盲肠内双歧杆菌数量影响不显著(P>0.05),1%剂量添加组双歧杆菌数量增加了28.82%(P<0.05)。
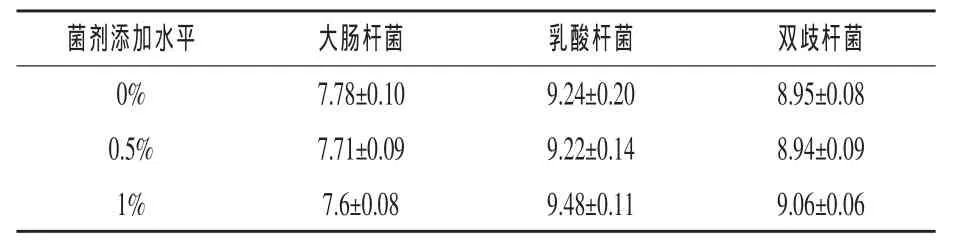
表4 EA-30-A菌剂对21日龄仔鸡盲肠内菌群数量的影响lg cfu/g
3 讨论
研究报道,芽孢杆菌能够提高仔鸡的平均日增重,改善饲料转化效率(Jiraohocakul,1990)。卢龙娣(2010)用芽孢杆菌制剂对AA白羽肉仔鸡进行饲喂试验,平均日增重约提高40%,不同阶段饲料转化率也有不同程度的提高。本试验也得到了相同的结果,基础饲粮中添加0.5%和1%EA-30-A菌剂均能显著提高仔鸡平均日增重,明显降低料重比。料重比显著降低,表明饲料转化率显著提高。从添加量来看,添加1%菌剂较添加0.5%菌剂效果好,说明芽孢杆菌要在动物体内发挥其益生作用还需要一定的有效活菌数。
芽孢杆菌促生长的机理可能是其进入动物体内后能产生多种酶类,如蛋白酶、脂肪酶、淀粉酶和半纤维素酶等,这些酶能促进肠道有机物的消化吸收(Haberer,2003),从而提高饲料的利用率。本试验将EA-30-A菌剂添加到基础饲粮中,仔鸡十二指肠内脂肪酶活力显著提高,说明EA-30-A菌剂进入仔鸡体内后,迅速生长繁殖,代谢产生了脂肪酶,弥补了仔鸡出壳初期内源性脂肪酶的不足,有效促进了脂肪的吸收利用,提高了料重比和饲料利用价值。
研究表明,动物长期持续饲喂芽孢杆菌可产生病原菌拮抗物质,拮抗肠道病原细菌,起到维持和调节肠道微生态平衡的作用(Guo,2006;Alexopoulos,2001;Jamamus,2001)。芽孢杆菌是好氧菌,抗逆性强,耐酸、碱、热,主要作用是消耗肠道中的氧气,给乳酸菌、双歧杆菌等厌氧益生菌营造厌氧的生长环境。王晓霞等(2006)在肉鸡饲粮中添加0.1%枯草芽孢杆菌,能减少肉鸡盲肠中的大肠杆菌和沙门氏菌等有害菌的数量,选择性增加乳酸杆菌等有益菌群的数量。Jin等(1998)发现,肉仔鸡在10、20日龄饲喂0.05%乳酸杆菌制剂后,盲肠内大肠杆菌数显著降低。本试验结果表明,饲粮中添加1%产脂肪酶芽孢杆菌显著降低了21日龄仔鸡盲肠中大肠杆菌数量,增加了乳酸杆菌和双歧杆菌数量,添加0.5%剂量对大肠杆菌生长量影响显著。虽然0.5%剂量添加组对21日龄仔鸡肠道内菌群影响没有达到显著水平,但仍显示了芽孢杆菌的有益作用。
4 结论
4.1基础饲粮中添加1%产脂肪酶芽孢杆菌能显著提高仔鸡平均日增重,改善料重比,效果优于0.5%剂量组。
4.2基础饲粮中添加产脂肪酶芽孢杆菌能提高仔鸡肠道内脂肪酶活力,促进脂肪的消化吸收,效果以添加1%最优。
4.3基础饲粮中添加1%产脂肪酶芽孢杆菌能显著降低盲肠内大肠杆菌数,增加乳酸杆菌和双歧杆菌数量。
[1]郭晓军,郭威,袁洪水,等.一株饲用产脂肪酶芽孢杆菌的筛选及紫外诱变[J].中国饲料,2015,7,10~12.
[2]何明清,程安春.动物微生态学[M].成都:四川科学技术出版社,2004,317~326.
[3]卢龙娣.鸡源性益生芽孢杆菌的筛选鉴定、固体发酵的优化及其应用效果的研究[D].福建师范大学,2010.
[4]潘康成.产酶芽孢杆菌的筛选、鉴定及对肉鸡的微生态效应研究[D].雅安:四川农业大学,2009.
[5]王恬,蒋正宇,周岩民,等.饲料外源酶与动物内源消化酶的互作效应及机制研究[J].饲料与畜牧,2006,12:5~8.
[6]王晓霞,易中华,计成,等.果寡糖和枯草芽孢杆菌对肉鸡肠道菌群数量、发酵粪中氨气和硫化氢散发量及营养素利用率的影响[J].畜牧兽医学报,2006,37(4):337~341.
[7]Alexopoulos C,Karaglannidis A,Kritas S K,et al.Field evaluation of a bioregulator containing live Bacillus cereus spores on health status and performance of sows and their litters[J].Journal of Veterinary Medicine Series A,2001,48(3):137~145.
[8]Guo X,Li D,Lu W,et al.Screening of bacillus strains as potential probiotics and subsequent confirmation of the in vivo effectiveness of Bacillus subtilisMA139 in pigs[J].Antonie Van Leeuwenhoek,2006,90(2):139~146.
[9]Haberer P,du Toit M,Dicks L M,et al.Effect of potentially probiotic lactobacilli on faecal enzyme activity in minipigs on a high-fat,high-cholesterol diet-a preliminary in vivo trial[J].Int J Food Microbiol,2003;87(3):287~291.
[10]Jadamus A,Vahien W,Simon O.Growth behavior of a spore forming probiotic strain in the gastrointestinal tract of broiler chicken and piglets[J].Arch Tierernahr,2001,54(1):1~17.
[11]Jin L Z,Ho Y W,Abdullah N,et al.Effects of adherent Lactobacillus cultures on growth,weight of organs and intestinal mieroflora and volatile fatty acids in broilers[J].Anim Feed Sci Technol,1998,70:197~209.
[12]Jiraphocakul S,Sullivan T W,Shahani K M.Influence of a dried Sporolactobacillus subtilis culture and antibiotics on performance and intestinal microflora in turkeys[J].Poultry Science,1990,69(11):1966~1973.
[13]Macrae A R,Hammond R C.Present and future applications of lipases[J]. Biotechnology&genetic engineering reviews,1985,3:193~217.■
This experiment was conducted to investigate the effects of dietary Bacillus producing lipase on performance,intestinal lipase activity and microflora of chicks.A total of 900 one-day-old chicks were randomly allocated to 3 groups with 3 replicates of 100 each.The chicks were randomly subjected to one of the following 3 treatments for 42 days:control group(fed a basal diet),and two treatments(fed the basal diet with 0.5%and 1%dietary Bacillus producing lipase,respectively).The result showed as follows:(1)Adding 1%Bacillus producing lipase decreased feed/gain by 8.50%at weeks 1 to 6(P<0.05),and adding 0.5%dose decreased by 5.00%(P<0.05).(2)After adding 0.5%and 1%Bacillus producing lipase,duodenal lipase activity of chicks on day 21 increased by 8.84%(P<0.05)and 25.31%(P<0.05),respectively.(3)The number of E.coli decreased by 33.93%and the number of Lactobacillus and Bifidobacterium in caecum of chicks on day 21 respectively increased by 73.78%(P<0.05)and 28.82%(P<0.05)by adding 1%Bacillus producing lipase,and the number of E.coli in caecum of chicks on day 21 decreased by 14.89%(P<0.05)after adding 0.5%Bacillus.In conclusion,adding 1%Bacillus producing lipase had significant influence on feed/gain,intestinal lipase activity and microflora of chicks at weeks 1 to 6(P<0.05).
lipase;Bacillus;growth performance;lipase activity;microflora
10.15906/j.cnki.cn11-2975/s.20161405
S816.7
A
1004-3314(2016)14-0019-03
国家星火计划项目[2010GA105010];河北省科技计划项目(12236606)

